FeOCl光芬顿催化剂的表征及其降解罗丹明B的效果
2023-12-28马金环魏智强赵继威路承功
马金环,魏智强,2,赵继威,路承功
(1.兰州理工大学 理学院,兰州 730050; 2.有色金属先进加工与回收国家重点实验室(兰州理工大学), 兰州 730050; 3.兰州理工大学 土木工程学院,兰州 730050)
随着社会的发展和工业生产的进步,许多国家已经认识到保护水资源的重要性[1-2]。生物的生存离不开水,水对地球上的生命至关重要[3]。然而,近几十年来,关于水资源短缺的报道越来越多,水资源短缺已成为人类迫切需要解决的重大资源问题[4]。因此许多国家将目光投向废水处理,希望以此解决水资源短缺的问题[5]。但废水的处理技术远远落后于污染水平[6]。寻找有效的污水处理技术成为关键。高级氧化工艺(AOP)是废水处理的一种有效方法,光芬顿反应是其中一个突出的代表[7-9]。光芬顿技术是基于Fe2+和H2O2的反应生成·OH来降解水中的污染物[10-11]。该方法因其所需的条件温和,效率高,并且操作简单,而被广泛应用。
FeOCl是一种功能材料,与其他铁基材料相比具有独特的结构和优异的芬顿性能[12-13]。FeOCl是通过层间范德华力形成的自堆叠晶体,因此,FeOCl结构松散,活性位点暴露多,并具有较大的比表面积[14-15]。另外,由于FeOCl具有强的Fe—O和Fe—Cl键,因此FeOCl具有优异的光电转换性能,这也加速了Fe3+/Fe2+的还原,并驱动H2O2生成更多的·OH[16-17]。此外,FeOCl的层状结构是良好的嵌入基材料,与其他半导体可以原位聚合[18]。如原位合成的FeOCl@MoS2石墨催化剂是一种很有前途的电芬顿材料[19]。
近年来,越来越多的研究表明,FeOCl是一种优良的类芬顿催化剂[20],其中在250 ℃下烧成的FeOCl的光芬顿性能最好[21]。通过部分热分解制备的FeOCl具有降解CBZ的3种可能途径,通过催化过碳酸钠(SPC),发现反应前后Fe离子的价态发生了变化[22-23]。然而,尚鲜有针对初始pH值、H2O2含量和催化剂用量对FeOCl催化剂在模拟太阳光下光芬顿降解RhB影响的研究报道。
本文通过简单的煅烧方法成功合成了3种不同形貌的FeOCl,以目标污染物为RhB,用于评估FeOCl的光芬顿性能和影响因素,找出最优的FeOCl降解RhB的降解条件。
1 实 验
1.1 试剂与制备方法
六水合氯化铁(FeCl3·6H2O,>98%)、盐酸(HCl,37%)、氢氧化钠(NaOH,≥98.0%). 所有试剂均由国药集团化学试剂有限公司提供。
FeOCl是通过图1中的简单煅烧方法制备。首先,称量一定量的FeCl3·6H2O,并将其置于研钵中研磨30 min。然后将其平放在坩埚底部,厚度约为0.3 cm,置于马弗炉中,以5 ℃/min的速度加热至250 ℃,保持1 h,再自然冷却至室温,然后用丙酮冲洗多次,以去除过量的FeCl3。最后,在60 ℃下干燥12 h得到红黑色粉末,称为FeOCl-1。同理,称取一定量的FeCl3·6H2O,加入5 mL去离子水,超声10 min,直至完全溶解,在60 ℃下干燥12 h,然后按照上述步骤煅烧,获得FeOCl-2。在这个过程中,减少了原材料的损失并产生大量的红黑色粉末。在上述两个步骤的基础上,将煅烧温度调整为230 ℃,得到的红黑色粉末为FeOCl-3。
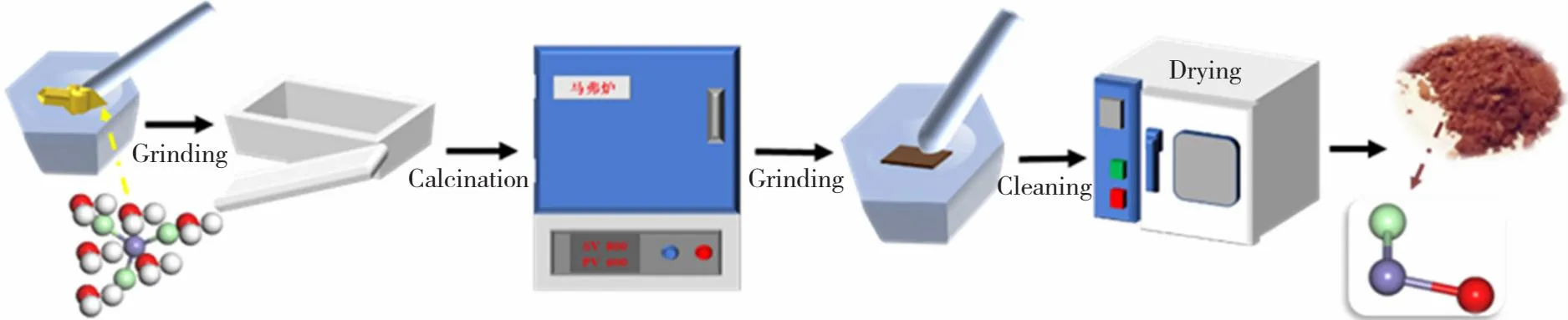
图1 FeOCl的实验制备流程图
1.2 材料表征
利用粉末X射线衍射仪(日本Rigaku,D/Max-2400)对样品的结晶相进行了研究,其角度范围为10°~80°,扫描速率0.2 (°)/s,步长0.02°。样品形貌通过场发射扫描电子显微镜(FESEM,Hitachi S4800)进行表征。X射线光电子能谱(XPS,PHI-5702)测量用于研究元素的化学状态。半导体的带隙可通过室温下的紫外-可见吸收光谱(UV-vis,TU-1901)得到,并结合莫特-肖特基(M-S)确定半导体的导带和价带的位置。通过红外光谱(FT-IR,Nexus 670),以KBr为背景,在400~4 000 cm-1范围内测试其官能团,探究材料的官能团。光致发光光谱(PL),用于确定电子空穴的复合效率。样品的光电化学测试是通过电化学工作站(CS350)得到,对电极和对参比电极使用的是铂片和饱和甘汞电极:将8 mg催化剂和1 mg乙炔黑研磨混合均匀,以1-甲基-2吡咯烷酮(NMP)为分散剂,聚偏二氟乙烯(PVDF)为粘合剂, 依次滴入并搅拌, 然后涂于导电玻璃表面,60 ℃下干燥得到工作电极,将工作电极置于0.1 mol/L Na2SO4溶液中, 测试M-S和瞬态光电流。
1.3 光芬顿性能测试
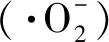
(Ct-C0)/C0×100%=(At-A0)/A0×100%
(1)
(2)
式中:C0(0时刻)和Ct(t时刻)分别代表初始和光照t时间溶液浓度;A0(0时刻)和At(t时刻)分别是初始和光照t时间溶液的相应吸光度;η是降解效率。
2 结果与讨论
2.1 结构和形貌表征
图2是3种形貌FeOCl的X射线衍射(XRD)谱图,可以看到:所有FeOCl谱线均出现了8个强峰,2θ=11.2°、26.1°、35.4°、37.9°、43.9°、48.1°、50.4°和61.1°,与正交晶系的FeOCl的标准卡片(PDF#72-0619)的(010)、(110)、(021)、(111)、(031)、(200)、(131)和(221)晶面相匹配;FeOCl-2和FeOCl-3的结晶度明显低于FeOCl-1。这可能是由于前期水解处理后晶体缺陷较多、比表面积较大和活性位点暴露较多所致[24]。然而,当温度变化时,特征峰强度明显减小。说明FeCl3的状态和烧制温度均影响材料的结晶度。图2的XRD结果表明,FeOCl纳米催化剂被成功制备。

图2 不同形貌FeOCl的XRD谱图
此外,根据正交晶系的晶体学公式,计算晶格常数a、b和c。
(3)
其中dhkl(hkl-待标晶面指数)为晶格间距,(hkl)为晶面指数,样品的粒度根据Scherrer公式计算
(4)
式中:Dhkl为垂直于晶体平面的方向上的晶粒尺寸;k为形状因子,通常取1;β为半峰宽度[25]。由表1结果可以看到,FeOCl-1、FeOCl-2和FeOCl-3的粒径分别为62.6、36.36和58.64 nm。研究发现,前驱体的水解处理和早期烧制温度的变化会影响样品的晶粒度,从而导致更宽的X射线光谱,这是(010)和(110)面峰值强度明显降低的原因。
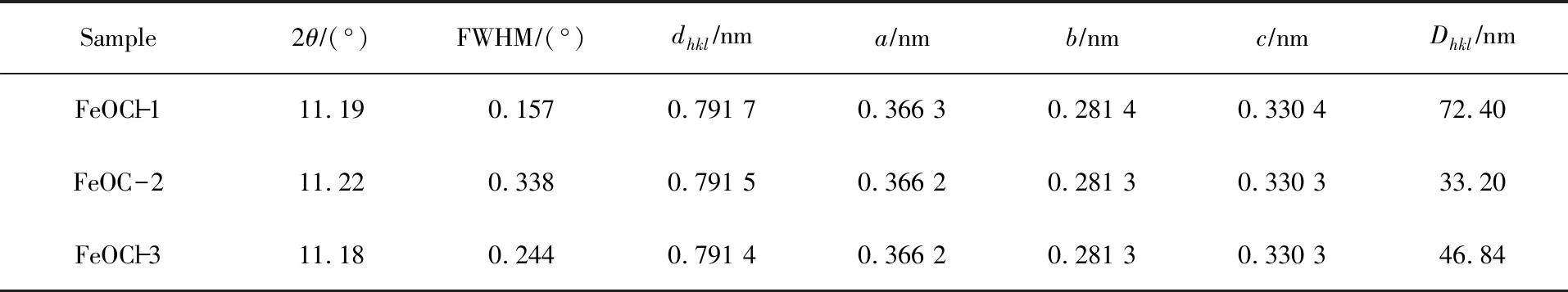
表1 不同形貌FeOCl的晶格参数
由图3中不同形貌FeOCl的SEM图像可以观察到,FeOCl-1由相对较厚的不规则矩形条状堆叠而成,FeOCl-2是由许多不规则的薄纳米片堆叠而成的花状结构,FeOCl-3的形状类似于腐朽的不均匀木材堆叠的层状结构。显然,本文合成的FeOCl在形貌上存在差异。

图3 FeOCl-1、FeOCl-2和FeOCl-3的SEM图像
2.2 元素组成分析
本文采用XPS光电子能谱表征花状FeOCl-2的元素组成,所有的测试数据均由标准C 1s(284.8 eV)峰校正。
由图4(a)FeOCl的XPS全谱图可以清楚地观察到,除卫星峰外,还有强度更大、对称性更好、狭缝宽度更小的明显特征峰,表明FeOCl材料中存在Fe、O和Cl元素。图4(b)显示,Fe 2p的结合能在711.3和725.4 eV,分别对应于Fe离子中的Fe 2p1/2和Fe 2p3/2[26]。711.3 eV的峰归因于Fe2+,而725.4 eV结合能处的峰对应于Fe3+,这表明FeOCl-2中存在Fe2+和Fe3+[27]。图4(c)中O 1s的结合能分别为531.3和520.4 eV,对应于吸附在催化剂表面的Fe—O键和H2O分子[28]。此外,在图4(d)中,Cl 2p的结合能位于199.7和198.4 eV,对应于Fe—Cl键[29]。
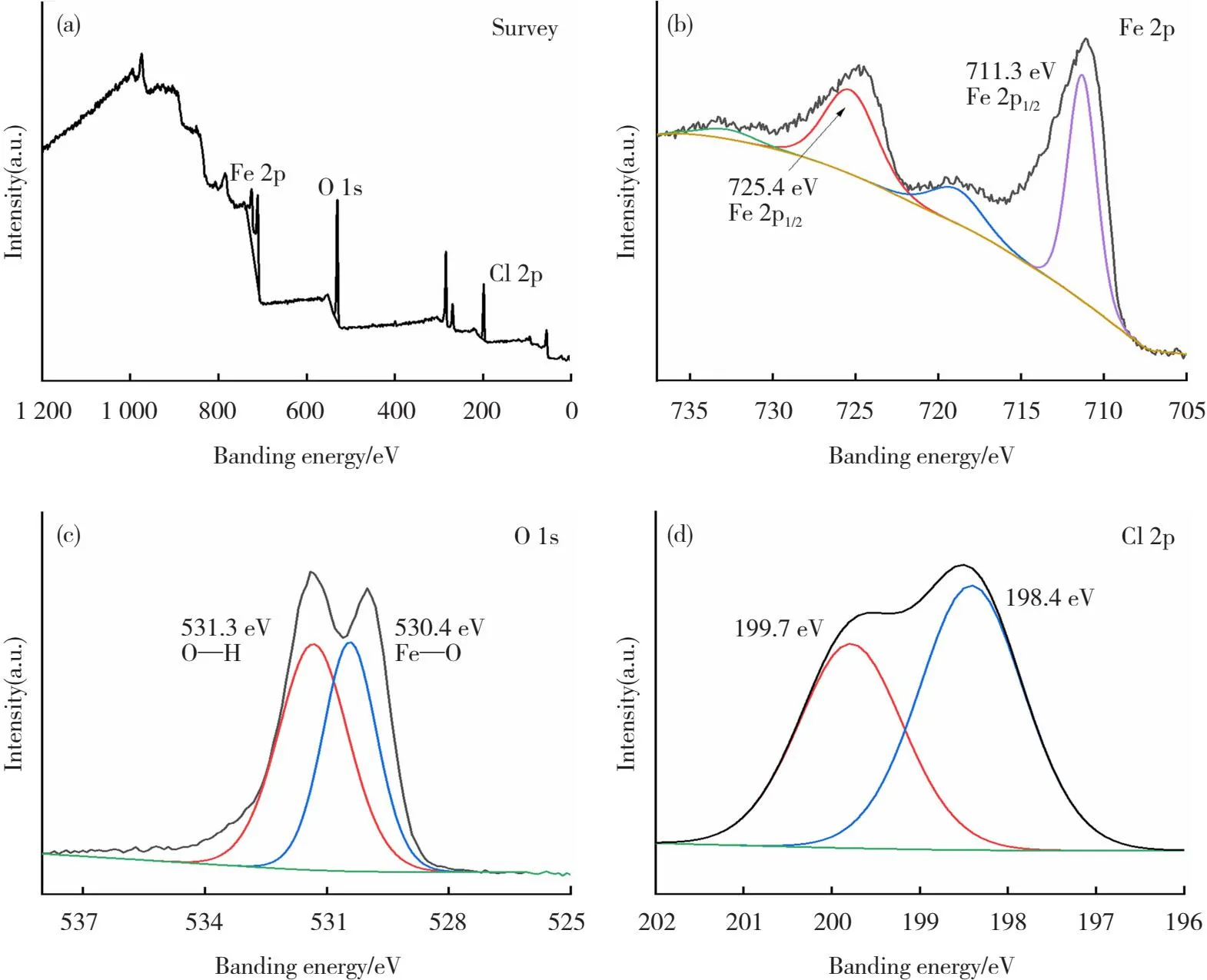
图4 FeOCl-2样品的 XPS 测试结果:(a) 全谱;(b) Fe 2p分谱;(c) O 1s分谱;(d) Cl 2p分谱
2.3 光电化学性能分析
2.3.1 UV-vis分析
材料的光吸收能力对催化剂的活性有着重要的影响。紫外可见光吸收光谱是表征材料对某一波段光的吸收能力的测试方法。如图5(a)是FeOCl的紫外可见吸收光谱。FeOCl-1,FeOCl-2,FeOCl-3的吸收边缘分别出现在725.1、688.5、708.6 nm处。在550~750 nm范围内FeOCl-2吸收强度较大,表明FeOCl-2的光响应能力相对较强。由图5(b)通过(αhv)1/2-hv曲线得到FeOCl-1、FeOCl-2、FeOCl-3的禁带宽度分别为1.71、1.80、1.75 eV。此方法是基于Tacu公式计算得到[30]
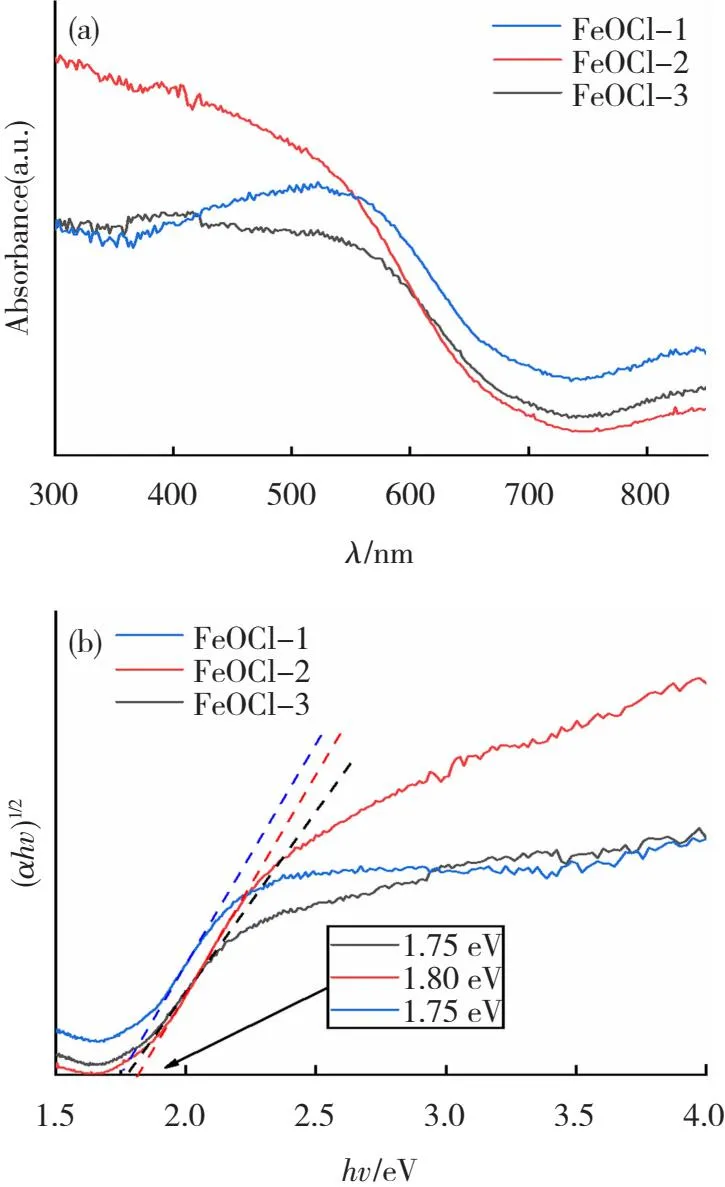
图5 不同形貌FeOCl的紫外可见吸收光谱(a)及(αhv)1/2-hv曲线(b)
(αhv)1/n=A(hv-Eg)
(5)
式中:α为吸收系数;hv为入射光子能量;A为常数,取值是A=4kπ/λ,k和λ分别为吸收常数和入射波长;FeOCl是间接带隙半导体,n取值2。
2.3.2 FT-IR分析
图6是FeOCl的FT-IR光谱,扫描范围是400~4 000 cm-1,在3 456 cm-1处存在一个很明显的宽吸收峰,这是由水分子的O—H键伸缩振动引起[31]。在1 611 cm-1左右的吸收峰可能是由水分子H—O—H弯曲振动所致。在800、670、493 cm-1左右的峰均是FeOCl的特征峰,都是由Fe—O的伸缩振动形成,其中493 cm-1左右的峰比较明显[32]。证明本文成功合成了FeOCl。
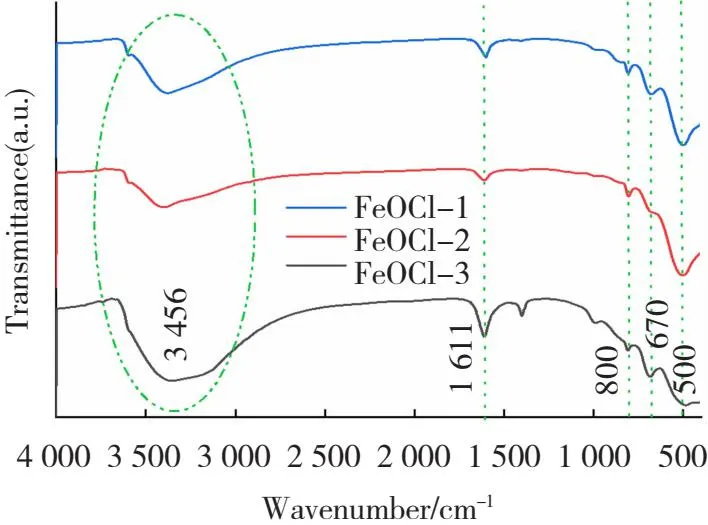
图6 不同形貌FeOCl的FT-IR谱图
2.3.3 PL分析
PL光谱是在室温下,氙灯激发波长325 nm下测试得到。PL光谱分析催化剂的光生电子和空穴的重组效率,特征峰强度越强,光生载流子的重组效率越高[33]。如图7所示,FeOCl-2和FeOCl-3的荧光强度远小于FeOCl-1,表明水解后高温烧制的FeOCl的光生电荷分离效率更高。
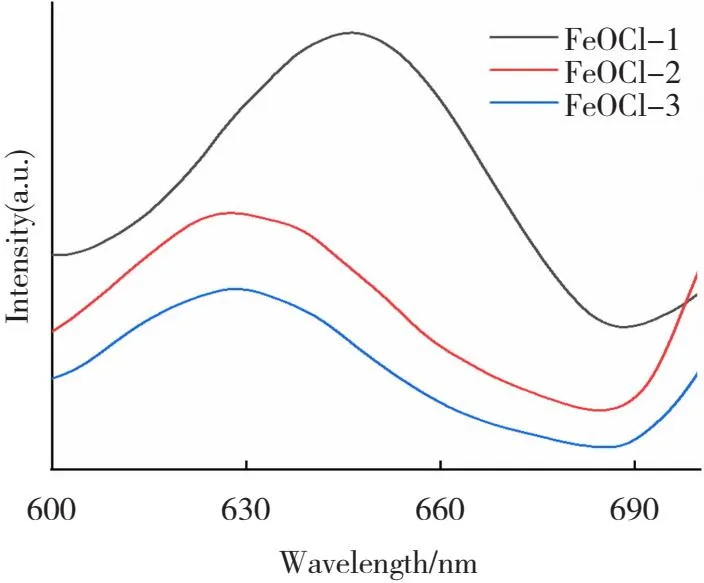
图7 不同形貌FeOCl的PL光谱
2.3.4 瞬态光电流响应分析
瞬态光电流是指当光照射到半导体电极上时,入射光的能量大于半导体的能带间隙,电子从价带向导带跃迁,产生光生电子空穴对,光生电子沿着外电路向另一电极迁移产生光电流[34]。如图8所示,FeOCl-2的光电流密度最大,是FeOCl-1的4倍,表明FeOCl-2具有优异的光响应能力。
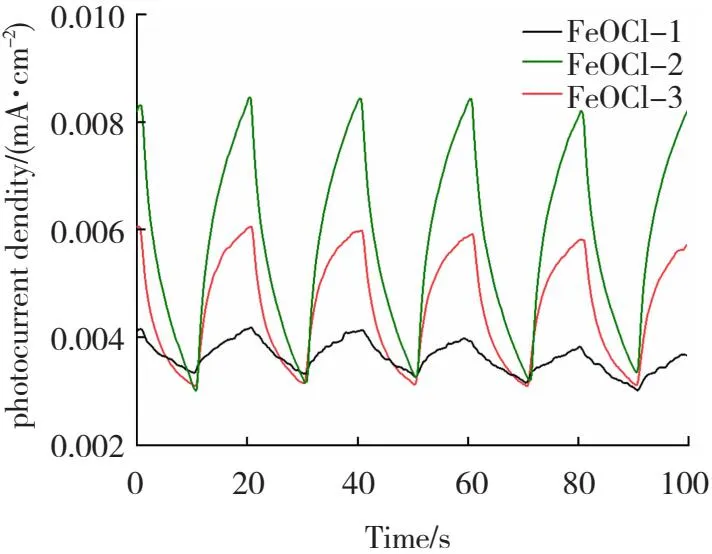
图8 不同形貌FeOCl的瞬态光电流响应
2.3.5 M-S分析
利用Mott-Schottky曲线测试可以确定半导体的类型、电流密度和平带电势[35]。图9中,由FeOCl-2的M-S曲线可以看到切线斜率为正,确认FeOCl-2为n型半导体。通过横坐标的截距得到平带电势VFB。假设n型半导体的导带电位近似为平带电位,根据式(6)[36]
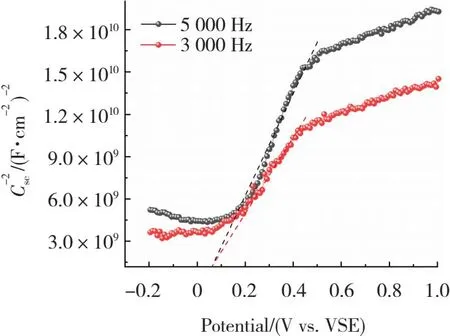
图9 FeOCl-2 的M-S图
V(NHE)=V(SCE)+0.059pH+0.242(pH=7)
(6)
将相对标准的甘汞电极(vs.SCE)电位转换为标准氢电极(vs.NHE)电位。结合UV-Vis测量的1.80 eV的带隙,根据式(7)[37]
EVB=ECB-Eg
(7)
计算出FeOCl-2的价带和导带电势分别为+0.672和+2.472 eV。
2.4 光芬顿性能分析及影响因素
2.4.1 光芬顿性能分析
首先,当初始溶液pH≈3时,在H2O2用量为0.04 mol/L,100mL 10 mg/L的RhB溶液和0.3 g/L FeOCl的条件下进行光芬顿测试。如图10(a)所示,在黑暗条件下搅拌30 min后,催化剂和RhB溶液达到吸附-解吸平衡,可以看到FeOCl-3的吸附性能优于其他两种,但在光照50 min后其光芬顿降解效率明显低于FeOCl-2。FeOCl-1、FeOCl-2和FeOCl-3体系的RhB去除率分别为96.8%、98.8%和26.5%。由图10(b)可以计算出FeOCl-2的一级动力学常数是FeOCl-1的14倍,且拟合度较好,相关性较高。表明FeOCl-2光芬顿降解效率最佳,这是因为纳米材料的粒径尺寸、微观形貌和结晶性之间的协同效应影响着材料的光芬顿性能。其中FeOCl-2大的表面暴露出更多的Fe活性位点,与H2O2结合产生了更多的活性自由基。
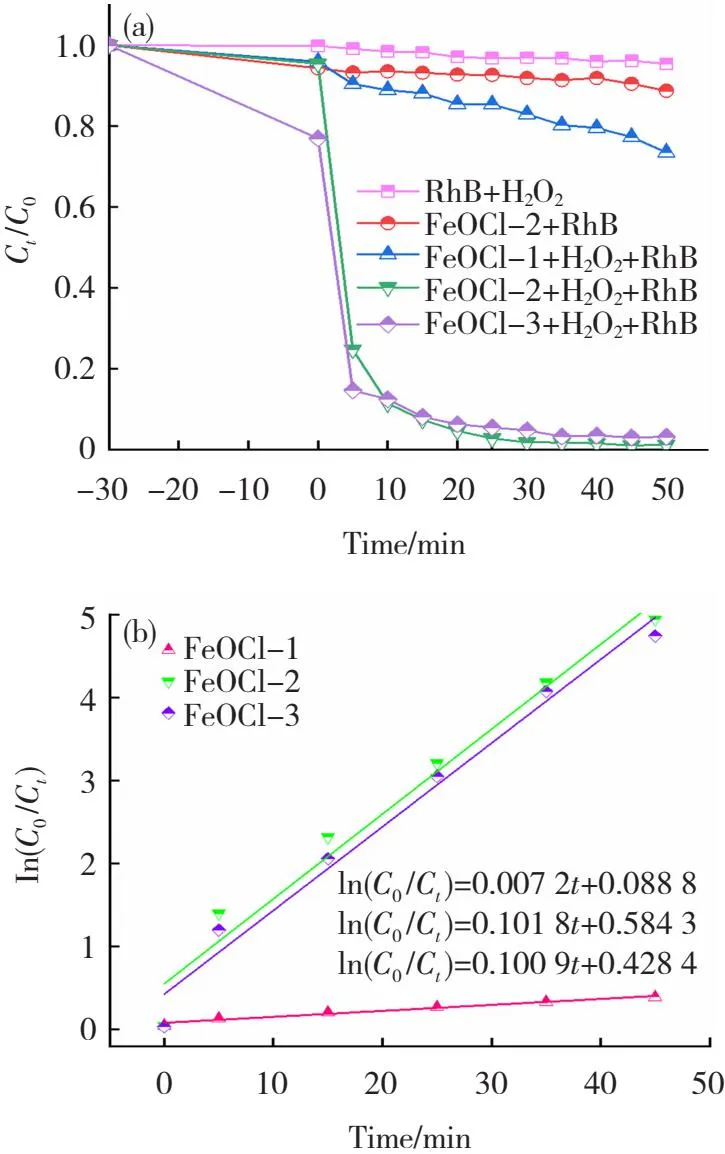
图10 不同形貌FeOCl降解RhB的光芬顿实验(a)和相应的一阶力学曲线(b)
2.4.2 初始pH 值影响
溶液初始pH值对光芬顿催化效果影响很大。本实验在不改变实验条件:RhB初始浓度为10 mg/L,FeOCl-2投加量为0.3 g/L,H2O2的投加量为0.04 mol/L,控制初始溶液的pH值为3、5、7、9、11,在室温下,黑暗中吸附30 min,在模拟太阳光下反应50 min,结果如图11所示,在pH=(3、5、7、9、11)±0.2时,RhB的去除率分别为98.9%、98.2%、97.1%、87.1%和72.4%。这可能是因为在碱性条件下,Fe3+和过量的OH-很容易沉淀生成氢氧化铁。这些结果证明了FeOCl-2样品对宽pH环境有较高的耐受性。
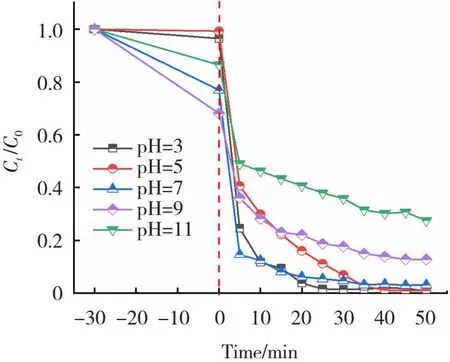
图11 溶液初始pH对光芬顿降解RhB的影响
2.4.3 H2O2含量影响
H2O2是光芬顿反应的重要的因素,实验条件:FeOCl的投加量为0.3 g/L,初始溶液pH≈3,染料仍为100 mL 10 mg/L的RhB溶液。如图12所示,当H2O2浓度分别取0、0.02、0.04、0.06、0.08和0.10 mol/L时RhB溶液的降解效率分别为11.2%、90.4%、99.1%、99.4%、97.3%和87.3%。图12结果表明,随着H2O2浓度的增加,RhB的降解效率先增加后减小,可能是由于H2O2过量,导致除产生·OH外还有氢氧化铁沉淀生成。因此,在节约原则下,又能够达到实验最佳效果,所有的光芬顿实验均取0.04 mol/L的H2O2溶液。
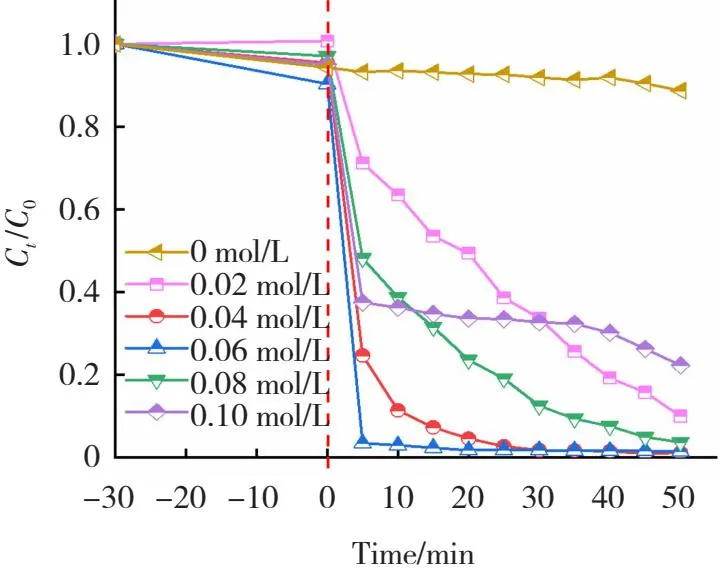
图12 H2O2含量对光芬顿降解RhB的影响
2.4.4 催化剂投加量影响
在初始溶液pH≈3,H2O2的投加量为0.04 mol/L,染料为100 mL 10 mg/L RhB溶液条件下研究了FeOCl的投加量对光芬顿实验的影响,结果如图13所示,可以看到FeOCl的投加量控制在0、0.1、0.3和0.5 g/L时RhB的去除率分别为6%、60%、98.6%和96.9%。催化剂的投加量影响RhB的去除率是由于FeOCl为氧化反应提供了活性位点,从而产生了更多的自由基。
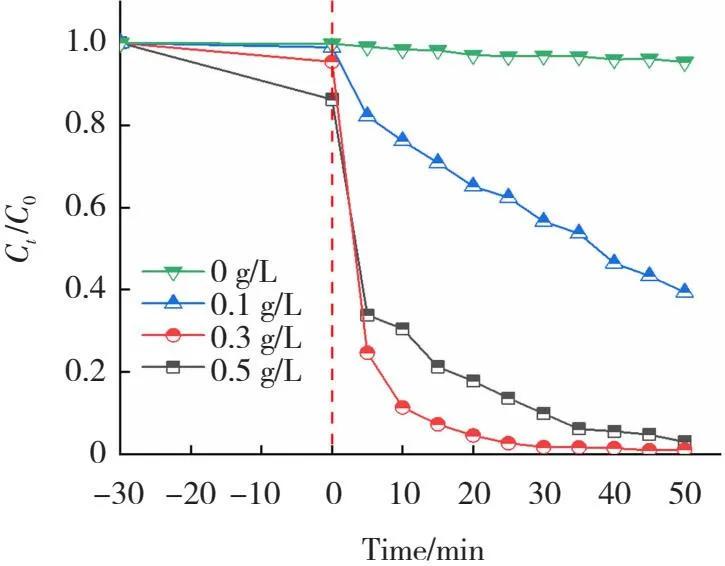
图13 FeOCl-2投加量对光芬顿降解RhB的影响
2.4.5 活性物种捕获实验
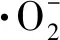
图14 FeOCl-2的自由基捕获实验
2.5 光芬顿降解机理
基于以上实验结果,本文推测出FeOCl-2可能的光芬顿机制,如图15所示。
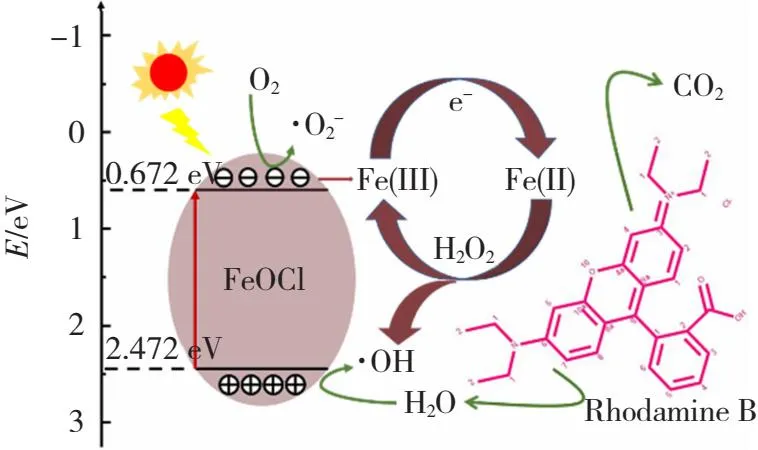
图15 FeOCl-2的光芬顿降解RhB的机制
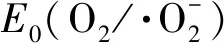
(8)
Fe3++e-→Fe2+
(9)
Fe2++H2O2→Fe3++·OH+OH-
(10)
H2O+h+→·OH+OH-
(11)
3 结 论
1)通过简单煅烧方法一步合成了不同形貌FeOCl,并通过多种表征测试方法对其形貌、结构、成分、光电化学性能进行测试,同时在模拟太阳光下研究了FeOCl降解RhB 的光芬顿性能和影响因素。
2)不规则纳米薄片堆叠的花状FeOCl-2具有较高的光芬顿活性。催化剂的投加量为0.3 g/L,0.04 mol/L H2O2、100 mL 10 mg/L的RhB溶液,在pH=3~7的范围内均具有良好的光芬顿性能,特别在pH≈3的酸性条件下,RhB的去除率达到98.8%。
3)基于花状FeOCl-2的自由基捕获实验,提出了光芬顿降解RhB的可能机制。研究发现,在光芬顿降解过程中,·OH是起主要作用的活性物种。
