电针次髎、耳甲调节大鼠胃内压和心率变异性效应方向一致性的实验研究*
2023-12-28潘彦宏姜劲峰
詹 铮,潘彦宏,姜劲峰
(南京中医药大学针药结合教育部重点实验室 南京 210023)
迷走/副交感神经支配范围广泛,亦参与调节人类记忆、认知、情感和情绪功能[1-4],其活性高低甚至可作为预测和评价人类生理和心理健康的重要指标[5-6],因此,调节迷走神经张力具有治疗疾病的潜力。迷走神经体表唯一分支(迷走神经耳支)支配的耳甲作为直接调节迷走神经的体表接口[7],其迷走神经调控效应已被用于癫痫[8]、抑郁症[9]、胃肠动力障碍[10]、脓毒血症[11]和糖尿病[12]等疾病的治疗。机体是否还存在调节迷走神经张力的其它腧穴(部位)?
自迷走神经参与电针足三里拮抗脓毒血症全身性炎症反应的机制[13]发现以来,足三里已被视为除耳甲外调节迷走神经的另一重要体表接口。最新研究显示,四肢腧穴(足三里和手三里)的迷走神经调节效应依赖于腧穴深部筋膜组织中PROKR2 神经元分布和电流刺激强度[14-15]。换言之,临床上能否准确地把握针刺(电针)足三里的深度、组织解剖层次和刺激强度,可能会影响其迷走神经调节效应的发挥,甚至可能因刺激强度的差异而产生效应方向迥异的交感神经调节效应。此外,在迷走神经调节效应(例如胃内压)的腧穴配伍研究[16]中,单独电针下肢腧穴上巨虚或上肢腧穴曲池均升高胃内压,但两者联合电针却并未出现1+1>1的协同增效作用。四肢腧穴在临床应用上是否均存在这些问题呢?
基于针灸临床观察,本团队于前期理论研究中提出“八髎与外耳均可作为刺激迷走神经的体表接口”的观点[17]。随后的实验研究亦表明,迷走神经参与了电针次髎拮抗内毒素血症的全身性炎症反应[18]。结合“骶神经传入-迷走神经传出”的神经通路介导骶神经刺激(SNS)显著改善溃疡性结肠炎症状[19]的研究前沿,以及电针中髎、会阳改善尿失禁[20]、慢性前列腺炎/盆腔疼痛综合征[21]等局部内脏功能的临床研究,提示以次髎为代表的八髎穴区域很可能是靶向迷走/副交感神经的另一重要体表部位,能否作为迷走神经调节效应腧穴配伍领域除四肢腧穴外新的腧穴配伍选择和补充呢?
基于此,本研究选取耳甲电针作为参照,以胃内压和心率变异性(Heart rate variability,HRV)作为指标,进一步明确电针次髎调控迷走神经的效应方向,并拟以两者联合电针是否具有协同增效作用来进一步阐述次髎调控迷走神经的效应方向,以期为临床迷走神经调控提供新的腧穴配伍选择。
1 材料与方法
1.1 动物与分组
选取健康成年雄性SD 大鼠24 只(体质量220-250 g),由浙江省医学科学院提供,动物生产许可证编号:SCXK(浙)2020-0002,饲养于南京中医药大学动物实验中心,保持室温25℃,相对湿度50%-70%,自由获取饲料和水。动物适应性饲养1 周后,将24 只雄性SD 大鼠按体质量由高到低依次编号1-24,再配以随机数字表,随机分为耳甲组、次髎组和“耳甲+次髎”组,每组8 只。实验过程严格遵循“3R”原则和科技部发布的《关于善待实验动物的指导性意见》规定。本实验通过了南京中医药大学动物伦理委员会的伦理审查(批号:012071001617)。具体实验流程见图1。

图1 实验流程示意图
1.2 主要试剂和仪器
乌拉坦(氨基甲酸乙酯,上海麦克林生化科技有限公司);韩氏电针仪(HANS-200A,南京济生医疗科技有限公司);多道生理信号采集系统(RM6240,成都仪器厂);压力换能器(YPJ01,成都仪器厂);恒温板(ST-1 型,成都仪器厂);生物信号采集分析系统(Microl401-3,CED,英国);无菌针灸针(0.35 mm×25 mm,北京中研太和医疗器械有限公司);自制胃内置球囊测压探头。
1.3 实验方法
实验前大鼠禁食12 h,允许自由饮水。腹腔注射20%乌拉坦(0.5 mL·100 g-1)麻醉后,剃净其上腹部毛并常规消毒,再将其仰卧位放于恒温板(37±1)℃上。
1.3.1 胃内压检测
采用囊内压实验法检测胃内压[22]:①于大鼠剑突下1 cm、腹部正中线左侧肋缘处,作长0.5 cm 左右的切口。用玻璃分针小心地挑起十二指肠,在其距幽门0.5-1 cm 处用手术剪刀对十二指肠作约0.2 cm 长的纵向切口;②把连接多道生理信号采集系统的压力换能器前端的球囊从切口处缓缓置入,并沿十二指肠向上轻推,直到球囊准确置入胃窦区,再缝合手术切口、固定导管,并用无菌纱布覆盖切口;③将约0.1 mL 的水注入球囊,缓慢调节囊内水容量使其基础压力保持在0.8 kPa 左右。当胃内压波形图维持稳定状态30 min以上时,记录囊内1 min 的压力值作为胃内压基线值。稳定状态下的胃内压波形图见图2。
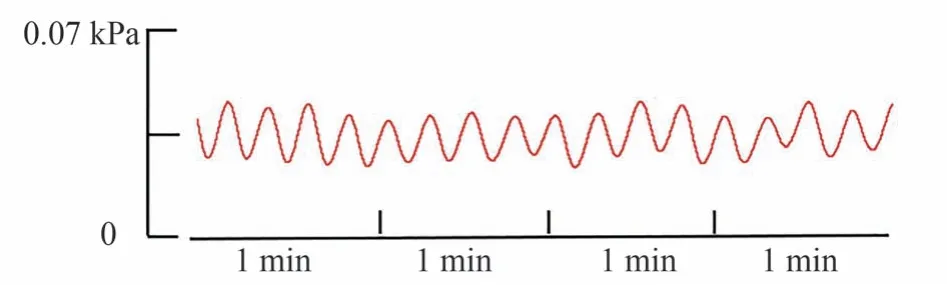
图2 正常大鼠稳定状态下的胃内压波形图
1.3.2 HRV检测
采用Ⅱ导联心电图模式检测HRV[23]:①无菌针灸针分别刺入大鼠的右上肢、右下肢和左下肢皮下,并依次连接NEG、EARTH 和POS 电极;②打开生物信号采集分析系统,在Lab Chart 计算机软件上输入参数[滤波:2 k·s-1,量程:5 mV,低通道:500 Hz;高频(HF):0.75-2.5 Hz,低频(LF):0.2-0.75 Hz,极低频(VLF):0-0.2 Hz],在记录胃内压的同时,同步记录HRV(HF、LF、VLF、LF/HF)。
1.4 干预方法
于大鼠左侧耳甲腔和耳甲艇的中心区域,针灸针分别沿皮刺入约6 mm[24];大鼠只有3对骶后孔,其次髎穴/中髎穴位于S2-S3 棘突间隙正中偏上旁开5-10 mm(第2 骶后孔)处,针灸针直刺约15-20 mm[25],左右各一针。因大鼠需在仰卧位行球囊置入术以检测胃内压,故预先将针灸针刺入次髎[26]。连接韩氏电针仪,30 Hz,2 mA,波宽0.2 ms±30%,连续波[23],电针2 min。具体电针操作见图3。
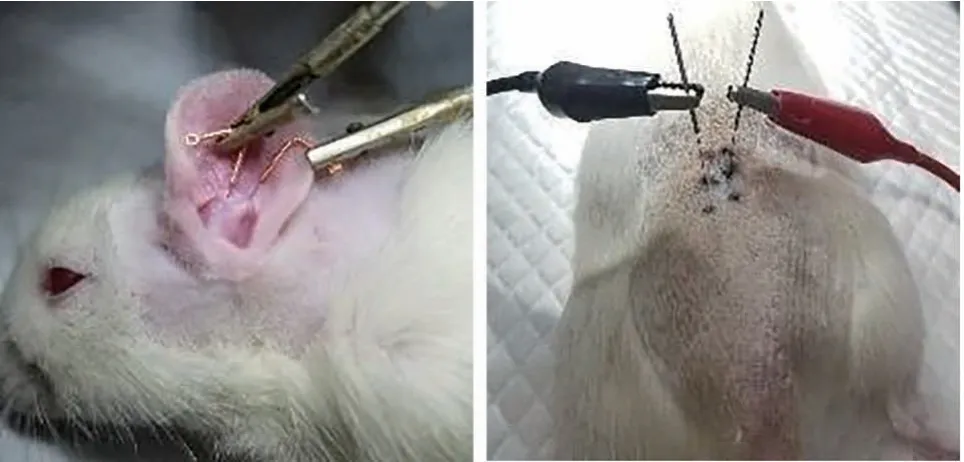
图3 耳甲、次髎定位及电针操作示意图
1.5 数据采集和分析
以30 s为一个观察单位导出数据并分析电针干预前和干预时胃内压和HRV 的变化,用变化倍率(变化倍率=电针干预时数值/干预前基线值×100%)分析不同干预方式效应的差异[27]。
1.6 统计与作图
采用SPSS 26.0 软件进行统计分析,采用GraphPad Prism 8 软件作图。计量资料以均数±标准误(xˉ±SEM)表示,数据均进行正态分布检验。组内数据统计分析,若服从正态分布,则采用配对t检验,否则采用非参数检验;组间数据统计分析,若服从正态分布且方差齐,则采用单因素方差分析,两两比较采用LSD 法,否则采用非参数检验。P≤0.05 时,认为差异有统计学意义。
2 结果
2.1 电针各穴位对大鼠胃内压的影响
与电针前相比,各组胃内压在电针干预期间均显著升高(见图4)。耳甲组:电针干预可显著升高胃内压,尤其在干预的30-60 s(P<0.05)、60-90 s 期间(P<0.05)(见图4A)。次髎组:电针干预可显著升高胃内压,尤其在干预的60-90 s 期间(P<0.05)(见图4A)。“耳甲+次髎”组:电针干预可显著升高胃内压,尤其在干预的60-90 s(P<0.01)、90-120 s 期间(P<0.05)(见图4A)。

图4 电针各穴位对大鼠胃内压的影响(xˉ±SEM,n=8)
胃内压变化倍率:“耳甲+次髎”组的胃内压变化倍率,在电针干预的30-60 s 期间开始高于同期耳甲组、次髎组,并在干预的60-90 s(P<0.01)、90-120 s 期间(P<0.01)显著高于同期耳甲组,在干预的60-90 s(P<0.05)、90-120 s 期间(P<0.05)显著高于同期次髎组。耳甲电针干预升高胃内压起效更快,但在电针后期,“耳甲+次髎”电针干预的胃内压比耳甲电针、次髎电针的胃内压更高,且“耳甲+次髎”电针干预的胃内压增幅更高、增加更快(见图4A、4C)。
2.2 电针各穴位对大鼠HRV的影响
耳甲组:与电针前相比,耳甲电针干预的HF 在干预全程均显著升高(P<0.01,P<0.05,P<0.01,P<0.05)、LF 在干预全程均显著升高(P<0.01,P<0.01,P<0.05,P<0.05)、VLF 在干预全程均显著升高(P<0.05,P<0.05,P<0.05,P<0.05)。耳甲电针干预可显著降低LF/HF,尤其在干预的0-30 s(P<0.01)、30-60 s(P<0.05)、60-90 s期间(P<0.05)(见图5A、5B、5C、5D)。
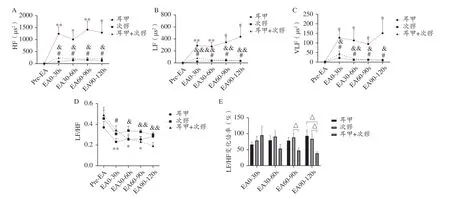
图5 电针各穴位对大鼠HRV的影响(xˉ±SEM,n=8)
次髎组:与电针前相比,次髎电针干预的HF 在干预全程均显著升高(P<0.05,P<0.05,P<0.05,P<0.05)、LF 在干预全程均显著升高(P<0.05,P<0.05,P<0.05,P<0.05)、VLF 在干预全程均显著升高(P<0.05,P<0.05,P<0.05,P<0.05)。次髎电针干预可显著降低LF/HF,尤其在干预的0-30 s 期间(P<0.05)(见图5A、5B、5C、5D)。
“耳甲+次髎”组:与电针前相比,“耳甲+次髎”电针干预的HF在干预全程均显著升高(P<0.05,P<0.05,P<0.05,P<0.05)、LF 在干预全程均显著升高(P<0.001,P<0.05,P<0.01,P<0.01)、VLF 在干预全程均显著升高(P<0.05,P<0.01,P<0.05,P<0.05)。“耳甲+次髎”电针干预可显著降低LF/HF,尤其在干预的30-60 s(P<0.05)、60-90 s(P<0.01)、90-120 s 期间(P<0.01)(见图5A、5B、5C、5D)。
LF/HF变化倍率:“耳甲+次髎”组的LF/HF变化倍率,在电针干预的30-60 s 期间开始低于同期耳甲组、次髎组,并在干预的90-120 s 期间(P<0.05)显著低于同期耳甲组,在干预的60-90 s(P<0.05)、90-120 s 期间(P<0.05)显著低于同期次髎组。在电针后期,耳甲组、次髎组的LF/HF 略有升高,但仍明显低于电针干预前,而“耳甲+次髎”组的LF/HF 则持续降低,且降幅更高、降低更快(见图5D、5E)。
3 讨论
自主神经系统(Autonomic nervous system,ANS)在针刺(电针)调节机体功能稳态中发挥关键作用[28]。研究表明,特异性地调节迷走神经,能获得对神经-内分泌-免疫网络可靠而又稳定的调节能力[29]。目前,侵入式迷走神经刺激术(VNS)因存在创伤和副作用以及高成本等弊端,导致其在临床广泛开展受到限制。针刺(电针)作为一种操作简便且安全的ANS 调节手段[30],可轻易避免VNS 的诸多弊端,具有天然优势。由于针刺(电针)调节ANS 的效应方向与其所刺激的腧穴密切相关,即存在迷走效应和交感效应两种效应方向。因此,明确腧穴的具体效应方向显得尤为重要。
HRV 常用于定量评估人和动物的ANS 功能,其中,HF 反映迷走神经张力,LF 和VLF 代表交感神经活性,LF/HF 则反映交感-迷走神经平衡移动[31-32]。鉴于迷走神经分支在胃部分布丰富且胃运动由其主导[33-34],胃内压的增减可具体量化和反映迷走神经调节效应的强弱,故选择胃内压和HRV作为评估迷走神经调控效应的指标。
本研究中,电针次髎或耳甲,HF 升高,提示迷走神经张力增加。由于胃运动主要由迷走神经支配,因此,胃内压的升高亦印证了迷走神经张力增加的结果。这表明,次髎和耳甲均可作为激活迷走神经(副交感神经)的体表接口。此外,与部分研究[10]未将交感神经活性纳入针刺(电针)对ANS 影响的观察指标不同,本研究中LF 和VLF 升高,提示电针次髎或耳甲亦提高了交感神经活性。然而,LF/HF比值却降低,表明交感-迷走神经平衡向迷走神经方向移动,提示电针次髎或耳甲对ANS 的调节是以大幅度地提高迷走神经张力、同时小幅度地提高交感神经活性的方式进行。换言之,电针次髎或耳甲以迷走神经作为调控ANS 的入口,通过上调调定点(Set point)水平来重建交感-迷走神经平衡,而非通过单纯地削弱一方或增强一方来实现,表明该调控效应是一种基于整体调节的优势迷走神经调控效应。
迷走效应主要由耳甲(迷走神经耳支)和以足三里(坐骨神经)为代表的下肢腧穴先将感觉信息上传至中枢NTS 整合,再由迷走神经背核(DMV)下行传递调节信息,最后由增强的传出迷走神经末梢释放神经递质(乙酰胆碱,Ach)作用于相应靶器官(胃肠等)而触发(胆碱能抗炎通路或胃肠动力调节效应)[35]。解剖学研究表明,骶内脏神经、骶前神经和盆内脏神经共同构成盆丛[36-37]。其中,由S2-S4副交感纤维在骶孔构成的盆内脏神经具有副交感属性;由于部分S2-S3 躯体纤维常伴行盆内脏神经,因此,骶丛神经的传出属性尚存在争议[38-39],但后续一系列研究仍倾向于骶丛具有副交感属性[40]。从八髎穴的临床应用来看,针刺(电针)八髎穴常用于包括溃疡性结肠炎[41-42]、盆腔炎[43-44]等多种炎症性疾病以及女性围绝经期潮热、汗出[17]等疾病的治疗,提示临近骶丛的八髎穴区可能具有副交感属性。离断迷走神经,电针次髎拮抗内毒素血症的抗炎效应明显减弱,全身炎症因子水平显著上升,说明迷走神经参与了电针次髎的全身性抗炎效应[18];另一项研究显示,SNS 导致溃疡性结肠炎大鼠NTS中c-fos表达增加,并显著降低了全身炎症因子水平,但离断迷走神经后,SNS 抗炎效应消失[19]。故与VNS 作用途径相似,电针次髎可能亦通过“脊髓上行传入——中枢整合——迷走神经传出——增强的迷走效应输出”途径,产生全身性迷走神经调控效应[18-19]。本研究中,由于骶神经并不支配上消化道[45],但迷走神经张力(HF)增加,而胃运动由迷走神经主导,故胃内压增高可能是通过脊髓上中枢通路激动迷走神经导致,这也是对上述次髎的全身性迷走神经调控效应实验的进一步补充。不过,电针次髎在升高胃内压的时效性上要迟于电针耳甲,即次髎电针60 s 后胃内压才明显升高。其原因可能是:电针次髎需通过脊髓上中枢才可以激活迷走神经,而电针耳甲具有直接作用于脊髓上中枢的“捷径”优势[17]。
此外,本研究显示,在联合电针的后期,与单独电针次髎或耳甲相比:胃内压变化倍率增加,提示胃内压持续增高且增幅更大;LF/HF 变化倍率降低,提示LF/HF持续降低且降幅更大。这表明在迷走神经调控方面,次髎与耳甲联合电针具有显著的协同增效作用,即1+1>1。两穴同用的协同增效作用,也从侧面进一步验证了次髎与耳甲调节迷走神经(副交感神经)效应方向基本一致的结论。
迷走神经张力降低、交感神经活性增加所致的ANS 失衡是众多疾病的核心病理环节[46],明确腧穴调节ANS 的具体效应方向对于疾病的治疗显得格外重要。目前,重建ANS 平衡取穴多以腹部腧穴、耳甲和四肢腧穴为主。腹部腧穴以天枢穴为代表,只能激活交感效应,且只有高强度而非低强度电针才能将其激活,体现出一定的强度依赖性[15]。耳甲迷走神经调节效应虽显著,但其效应可能受到迷走神经耳支分布区域狭小的限制。四肢腧穴中,触发交感效应,腧穴取穴上肢多于下肢,以内关穴(正中神经)为代表,可抑制交感神经异常放电;触发迷走效应,腧穴取穴下肢多于上肢,以足三里(坐骨神经)为代表[35]。最新研究显示,足三里的迷走效应受到腧穴深层筋膜组织中PROKR2 神经元分布的影响,亦具有明显的刺激强度依赖性,即不同电流强度分别激活交感、迷走神经环路,这对针刺(电针)的深度、组织解剖层次和刺激强度提出了较高的要求[14-15]。
八髎穴受解剖位置影响,其主治病种多集中于泌尿生殖系统和肛肠系统疾病[47]。本研究通过进一步明确次髎的全身性迷走神经调控效应,为八髎穴广泛地用于特异性迷走神经调控提供了新的实验证据,从而在一定程度上拓宽了八髎穴的适用病种。此外,在迷走神经调节效应的腧穴配伍研究[16]中,上肢腧穴(曲池)与下肢腧穴(上巨虚)配伍,在升高胃内压方面并未出现1+1>1 的协同增效作用。而次髎和耳甲联合电针产生1+1>1 的协同增效作用,为针刺(电针)介入相关疾病提供了除四肢腧穴外新的腧穴配伍选择。
本研究亦有不足之处,比如只研究了单一电流强度下电针次髎对ANS 的影响,那么其是否也存在强度依赖性呢?此外,本研究于生理状态下的大鼠身上进行,其调控效应能否适用于病理状态下的大鼠呢?都需要进一步探索和明确。
