基于网络药理学和实验验证探讨淫羊藿苷联合泼尼松治疗激素抵抗性肾病综合征大鼠的作用机制*
2023-12-28戴恩来张云霞白俊嫄蒲晓薇
吕 娟,戴恩来,张云霞,白俊嫄,蒲晓薇
(1. 甘肃中医药大学中西医结合学院 兰州 730000;2. 甘肃省中医院 兰州 730050)
SRNS 定义为肾病综合征采用1 mg·kg-1·d-1剂量的泼尼松龙治疗8 周后仍未缓解,其在肾病综合征病例中所占比例较小(8%-15%)。但SRNS 患者已被证明更难治疗,可导致急性肾功能衰竭、继发严重感染等急性并发症,若未得到有效控制,继而向肾功能慢性化发展,造成了严重的社会和经济负担[1-3]。泼尼松作为糖皮质激素的代表药物,是治疗原发性肾病综合征最重要和首选的药物,除了具有一般的免疫抑制和抗炎作用外,还对足细胞有直接作用,增加肌动蛋白丝的稳定性[4],对激素抵抗型肾病综合征患者治疗后未达到缓解,常与免疫抑制剂联合使用,但临床效果依旧欠佳,而且毒副作用大。中西医结合治疗SRNS,在减轻症状、缩短病程、改善预后等方面具有一定的优势。
戴恩来教授经过多年的临床经验认为,SRNS 的中医病因病机主要是肾阳虚,阳不化阴,故而水湿痰浊血瘀有形之邪为患。研究证实补肾温阳可以增加SRNS的治疗效果,增加激素的敏感性[5]。
淫羊藿作为温阳药的代表药物,主要功效为温阳利水。淫羊藿苷是淫羊藿的主要提取成分之一。研究表明,淫羊藿苷具有抑制肾纤维化、保护肾脏的功能[6],对肾阳虚大鼠具有保护作用[7],在糖尿病肾病中降低了足细胞凋亡、维持线粒体膜的完整性[8]。淫羊藿苷可以通过上调雄激素受体、下调磷酸化雄激素受体及磷酸化AKT,抑制肾阳亏虚以及双酚A 染毒引起的雄激素受体和AKT 磷酸化,为此可减少睾丸组织细胞的凋亡,进一步改善结构[9]。本研究在网络药理学研究的基础上将淫羊藿苷与核心靶点的分子,以及与核心靶点相关的蛋白进行对接分析,并通过动物实验验证,进一步揭示淫羊藿苷治疗SRNS 的分子机制,为临床治疗SRNS提供依据。
1 材料与方法
1.1 网络药理学分析使用的数据库和软件
中药系统药理学数据库与分析平台:TCMSP(https://tcmspw.com/tcmsp.php);化学专业数据库:GeneCards(https://www. genecards. org);CTD(http://ctdbase.org);Uniprot(https://www.uniprot.org/);OMIM(http://www. omim. org);DRUGBANK(https://www.drugbank.ca);Venn2.1.0(https://bioinfogp.cnb.csic.es/tools/venny/);String(https://string-db.org/);DAVID6.8(https://david.ncifcrf.gov/);RCSB PDB(https://www.rcsb.org/);软件:AutoDockTools 1.5.6;PyMOL。
1.2 材料、仪器及设备
实验动物:从甘肃中医药大学实验动物中心购买7-8周龄雄性Wistar大鼠50只,体质量(210±10)g。动物合格证号:6200100000025,动物使用许可证号:SCXK(甘)2015-0002。阿霉素(Adriamycin,ADR)北京索莱宝科技有限公司;醋酸泼尼松片(Prednisone Acetate Tablets,PAT)浙江仙琚制药股份有限公司;淫羊藿苷(Icariin,ICA)陕西博林生物技术有限公司;山羊抗兔IgG、Ant-LC3-Ⅱ、Ant-PI3k、Ant-Akt、Ant-GAPDH 均购自美国Abcam 公司;RIPA 裂解液购自北京索莱宝科技有限公司。尿白蛋白检测试剂盒购自Roche Diagnostics GmbH 公司,HE 染色试剂盒购自碧云天生物技术公司。切片机、荧光显微镜购自Leica公司,电子天平购自赛多利斯科学仪器公司,全自动生化仪购自上海科华卓越生物工程股份有限公司,转膜仪、电泳仪、Western blot 电源购自北京六一生物科技公司。
1.3 方法
1.3.1 淫羊藿苷作用靶点的筛选
通过TCMSP 数据平台,GeneCards 数据库及CTD数据库将“淫羊藿苷”作为检索对象,获取药物淫羊藿苷作用靶点,去重并整合。
1.3.2 SRNS相关靶蛋白预测
挖掘GeneCards 数据库、OMIM 数据库、CTD 数据库中“steroid resistant nephrotic syndrome(SRNS)”的潜在靶点,查询西医临床治疗SRNS 的一线用药,进入DRUGBANK 数据库获得该药对应作用靶点,进一步完善补充。Genecards数据库中,疾病与靶点的联系是否密切,取决于Score 值的大小。根据经验,若靶点过多则设定Score 大于中位数的目标靶点为SRNS 的潜在靶点,合并4个疾病数据库靶点后,删除重复值得到SRNS靶点。
1.3.3 药物靶点-基因靶点的构建
将淫羊藿苷活性成分对应的靶点基因与SRNS 靶点基因进行相互映射,绘制Venn图,获取交集基因,并以此作为后续分析基础。
1.3.4 蛋白-蛋白相互作用(PPI)网络的构建
为研究靶点蛋白的相互作用,将交集基因上传至STRING 数据库,选择Multiple proteins,物种限定为“Homo sapiens”,借助Cyscape(3.7.2)绘制淫羊藿苷靶蛋白-SRNS 靶蛋白PPI(Protein-protein interactions)网络互作图并依据Degree值获取关键基因。
1.3.5 GO功能富集分析和KEGG富集通路分析
将1.3.3 获得的共有基因上传至DAVID v6.8 数据库,将输出数据进行GO(Gene ontology)富集分析和KEGG(Kyoto encyclopedia of gene and genomes)通路分析,取P<0.05,探究淫羊藿苷治疗SRNS 的相关作用机制。
1.3.6 药物成分-核心靶点分子对接验证
为进一步验证核心活性成分潜在治疗作用的可靠性,将从“药物-成分-靶点-疾病”网络中筛选出的核心活性成分与PPI网络中确定的关键靶蛋白进行分子对接。本课题还选择了与关键靶蛋白相关的蛋白进行了分子对接,以明确其潜在治疗作用。
首先在TCMS 平台中下载淫羊藿苷的结构文件。在RCSB PDB 数据库下载获取靶蛋白的晶体结构:磷脂酰肌醇3-激酶(PI3K)的蛋白结构(PDB ID:1E8X)、蛋白激酶B(Akt)的蛋白结构(PDB ID:3QKL)、微管相关蛋白1 轻链3(LC3)水解酶的蛋白结构(PDB ID:5GMV)。用AutoDockTools 1.5.6 软件将淫羊藿苷与3 个蛋白进行半柔性对接,结合能最低的结合模式被认为是最优结合模式,因此选择对接结合能最低的最优构象,然后用PyMOL 软件对结合能最低的成分-靶蛋白结合模式进行可视化处理。通过微生信在线工具将分子对接结果绘制成热图。对接评分为评价对接的匹配情况的依据。
1.3.7 动物造模、分组及给药
购买的实验大鼠在SPF 级实验室适应性喂养7 天,按照随机数字化表随机分为5 组:空白组、模型组、泼尼松组、淫羊藿苷组、泼尼松+淫羊藿苷组,每组10只。根据课题组前期造模方法,采用一次性尾静脉注射剂量为6 mg·kg-1的阿霉素建立SRNS 模型[10]。验证模型成功后,分别给药连续处理42 天,泼尼松组按6.3 mg·kg-1·d-1泼尼松配制溶液灌胃,淫羊藿苷组按50 mg·kg-1·d-1淫羊藿苷配制溶液灌胃,泼尼松+淫羊藿苷组按上述剂量泼尼松加淫羊藿苷配制溶液灌胃[10-11],对照组和模型组给予等体积饮用水灌胃。
1.3.8 大鼠体质量的测量
分别于造模前、造模后2 周末和联合给药42 天后对各组大鼠称量体质量并记录。
1.3.9 尿蛋白定量的测定
采用金属笼子收集24 h 大鼠尿液,每只笼子放置1 只大鼠,收集各组大鼠造模前、造模后第2 周末及联合给药42 天后大鼠24 h 总尿液。每次收集尿液后离心15 min,收集上清,-20℃保存,避免反复冻融。全自动生化分析仪用免疫比浊法检测各组大鼠造模前、造模后第2周末及联合给药42天后的24 h尿蛋白总量。
1.3.10 HE染色观察各大鼠肾组织病理形态
按照上述实验分组,大鼠给药处理42 天后,切除大鼠左侧肾脏,切片加4%的戊二醛溶液固定24 h,全自动脱水机脱水后浸蜡处理,切超薄片,用二甲苯进行脱蜡,梯度酒精洗脱二甲苯,进行苏木精染色,将玻片在盐酸乙醇溶液中提插数下,自来水中浸泡15 min,之后伊红水溶液染色,75%、85%、95%乙醇依次脱水,最后无水乙醇脱水,中性树脂封片光学显微镜下观察肾组织病理形态。
1.3.11 Western Blot 检测SRNS 大鼠肾组织LC3-II 及PI3K、Akt的表达水平
将各组大鼠颈椎脱臼处死,分离肾组织,添加RIPA裂解液提取蛋白,BCA法检测蛋白浓度。之后进行SDS-PAGE 电泳,将胶块上的蛋白转移至PVDF 膜上,5%脱脂奶室温封闭1 h,将封闭好的PVDF 膜置于LC3-II、PI3K、Akt 和GAPDH 一抗溶液中4℃孵育过夜孵,漂洗3 次后将PVDF 膜置于二抗溶液中,室温孵育1.5 h,添加超敏发光液于PVDF 膜上,置于化学发光成像仪分析。
1.3.12 统计方法
所有数据均采用SPSS 21.0统计分析软件处理,数据采用均值±标准差(±s)表示。组间比较,符合正态性要求,采用单因素方差分析组间差异;两组间比较,方差齐时,采用LSD法,除有特殊说明,数据统计中P<0.05 为差异有统计学意义。采用Image J 进行灰度检测分析。
2 结果
2.1 淫羊藿苷活性成分对应靶点的筛选
分别在TCMSP,GeneCards 及CTD 数据库中对淫羊藿苷靶点进行检索,并进行整合、删除重复值,最终得到淫羊藿苷活性成分对应的靶点蛋白共计139个。
2.2 激素抵抗性肾病综合征靶点预测
利用Pubmed 中“ 医学主题词表”(Medical subjectheadings,MeSH)功能,确定SRNS的主题词。将从Pubmed 查询到的SRNS 的主题词作为关键词,使用GeneCards、OMIM、CTD数据库筛选出与SRNS相关的靶点。并与DRUGBANK 数据库寻找SRNS治疗药物的作用靶点进行合并,去重并整合,从而得到与SRNS相关的所有疾病靶点共计1476 个。图1 中粉色代表来源于GeneCards 中SRNS 疾病靶点,蓝色代表来源于CTD 中SRNS 疾病靶点,紫色代表来源于DRUGBANK 中SRNS疾病靶点,绿色代表来源于OMIM中SRNS疾病靶点。

图1 SRNS疾病靶点交集图
2.3 药物靶点-基因靶点的构建
将淫羊藿苷活性成分对应的139个靶蛋白基因与SRNS 的1476 个靶点基因进行匹配,绘制Venn 图获取共有基因58个(见图2)。图中蓝色代表中药单体淫羊藿苷成分靶点,红色代表SRNS 疾病靶点,紫色代表淫羊藿苷-SRNS共有靶点,共58个。
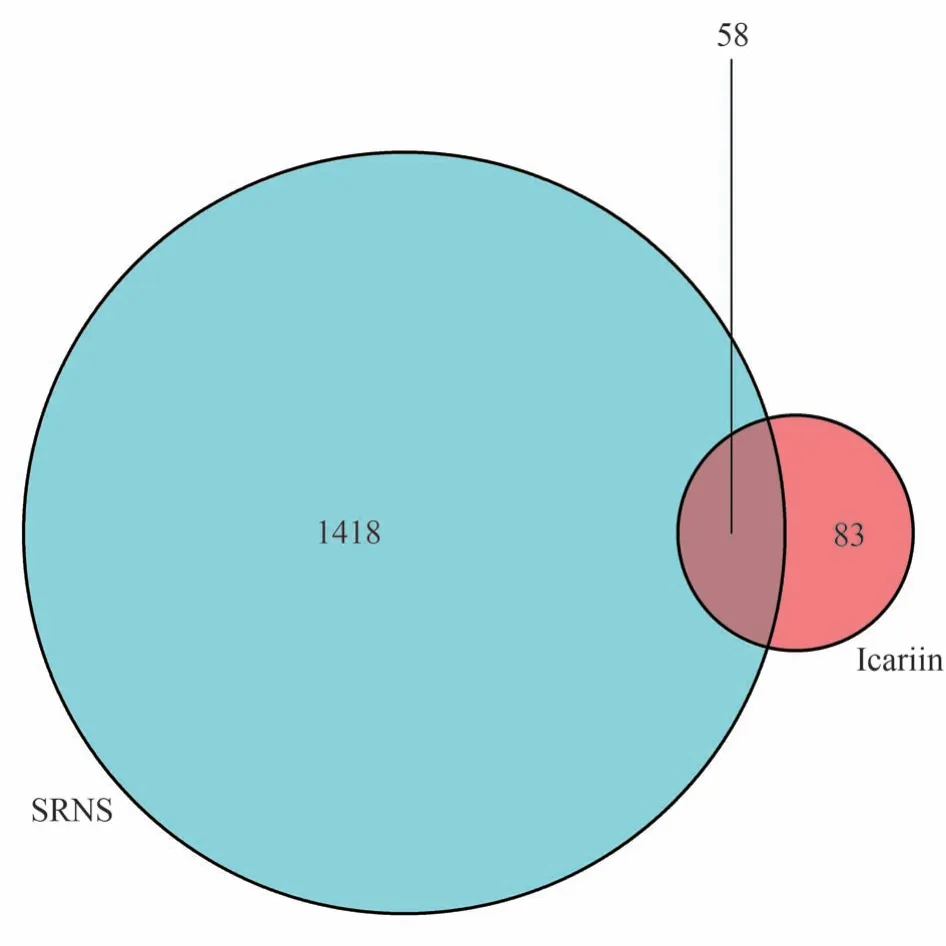
图2 淫羊藿苷活性成分-SRNS靶点交集图
2.4 淫羊藿活性成分靶蛋白-SRNS 靶蛋白相互作用(PPI)网络
将58 个共有基因导入STRING 中,获得淫羊藿苷治疗SRNS 的靶蛋白PPI 网络互作图(见图3)。该网络包括57 个节点,658 条边。借助于Cytoscape 软件作图并依据插件CytoNCA 计算度中心性(Degree),以Degree 值大小对各靶点进行排序,其中字体大小与Degree 值成正相关,取排名前10 的靶点为核心靶点(见图3)。其中,RAC-α 丝氨酸/苏氨酸蛋白激酶(AKT1)(degree=50)、1 号染色体基因(JUN)(degree=45)、白介素-6(IL6)(degree=44)等可视为核心靶点。表明上述靶点在淫羊藿苷治疗SRNS 中的重要性,可作为研究淫羊藿苷治疗SRNS的关键靶点。

图3 淫羊藿苷活性成分靶蛋白-SRNS靶蛋白相互作用网络图
2.5 GO和KEGG功能富集分析
2.5.1 GO功能富集分析
使用DAVID v6.8 数据库对58 个共有基因进行分析,设定P<0.05,共富集到58 个生物过程及功能。根据P值大小排序后,筛选出前20 个核心功能绘制柱状图(见图4)。说明淫羊藿苷治疗SRNS 可能与以下生物学机制有关。

图4 淫羊藿苷治疗SRNS的GO功能柱状图
2.5.2 KEGG功能富集分析
利用DAVID 数据库进行通路富集分析,共富集到144条与淫羊藿苷治疗SRNS相关的通路,根据P<0.05筛选出与淫羊藿苷治疗SRNS 相关的通路。根据P值将筛选到排名前30 条KEGG 代谢通路,根据P值绘制气泡图,气泡的大小代表富集到相应通路上的基因数目的多少,颜色的深浅代表显著性,可直观地观察到显著性富集信息(见图5)。从图中可以发现淫羊藿苷主要通过调控PI3K/AKT 通路发挥对SRNS 的治疗作用。

图5 淫羊藿苷治疗SRNS的KEGG功能柱状图
2.6 药物成分-核心靶点分子对接验证
用AutoDockTools 1.5.6 软件将淫羊藿苷与PI3K、Akt、LC3 进行半柔性对接,选择对接结合能最低的最优构象,用PyMOL软件进行可视化。对接评分为评价对接的匹配情况的依据,结果见表1。
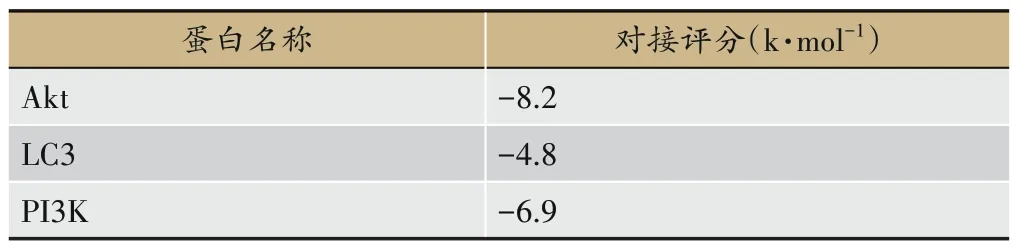
表1 分子对接结果表
分子对接的对接结合能负值代表化合物易与靶蛋白结合,正值则表明二者不易结合。对于负值来说,负值的绝对值越大,则认为化合物与靶点有较强的亲和力,构象越稳定。当对接结合能的绝对值大于4.25 k·mol-1时,表示具有一定的结合活性;大于5.0 k·mol-1为具有较好的结合活性;大于7.0 k·mol-1为具有强烈的结合活性。由结果可知,Akt 和PI3K 与淫羊藿苷有较好的结合活性,LC3 与淫羊藿苷亦有一定的结合活性(图6-8)。
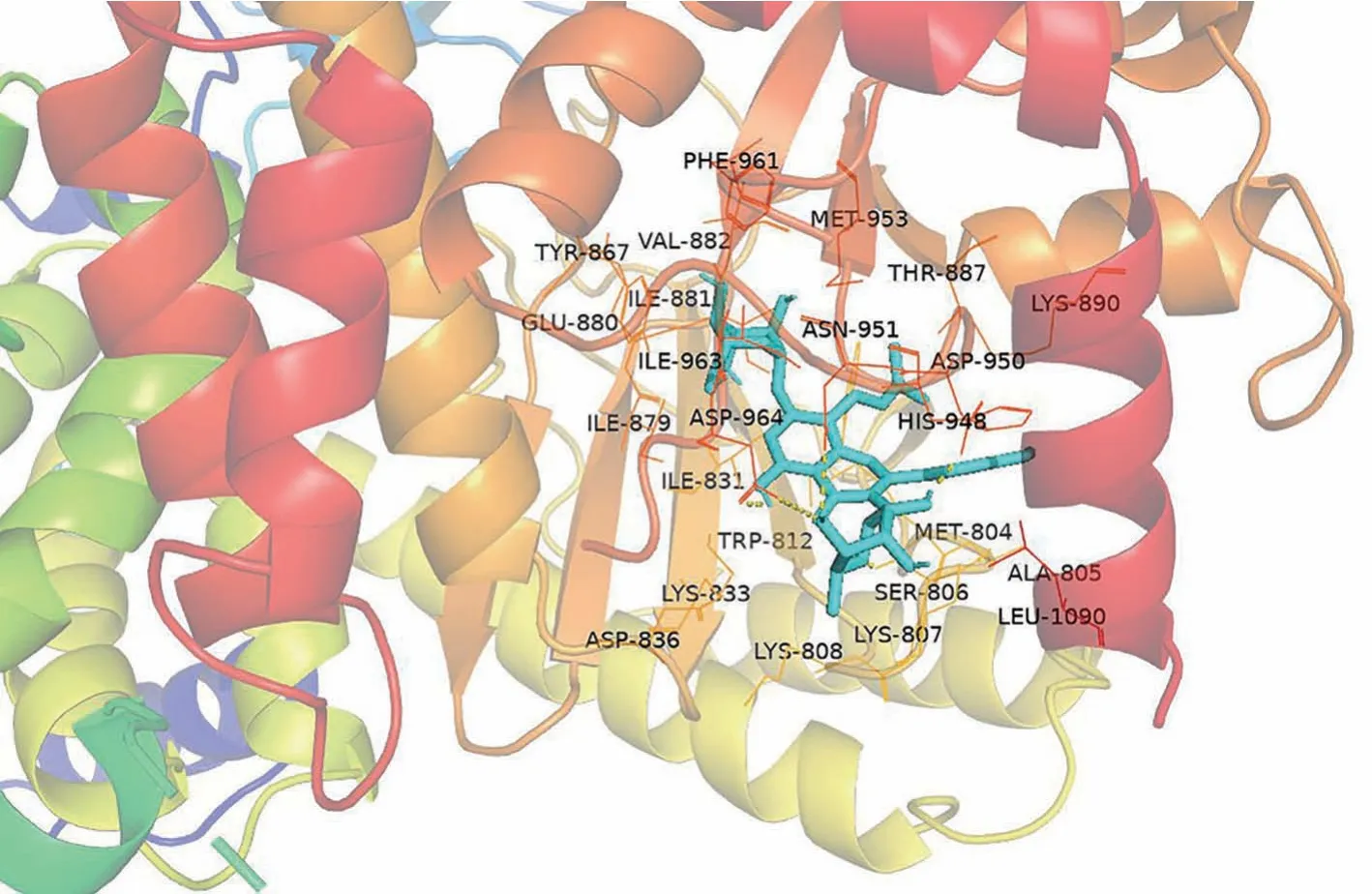
图6 PI3K与淫羊藿苷对接模式图

图7 Akt与淫羊藿苷对接模式图

图8 LC3与淫羊藿苷对接模式图
2.7 各组大鼠体质量的变化
如表2 和图9 所示:造模前各组大鼠体质量基本控制在200~220 g,比较无统计学意义。与空白组相比,模型组大鼠体质量明显减少,具有统计学意义(P<0.05)。与模型组相比,给药治疗42 天后泼尼松组淫以及羊藿苷组大鼠体质量变化无统计学意义,淫羊藿联合泼尼松组大鼠体质量显著增加,具有统计学意义(P<0.05)。说明淫羊藿苷联合泼尼松治疗阿霉素大鼠,能改善模型组大鼠体质量。
表2 各组大鼠体质量变化(g)(±s,n=3,g)
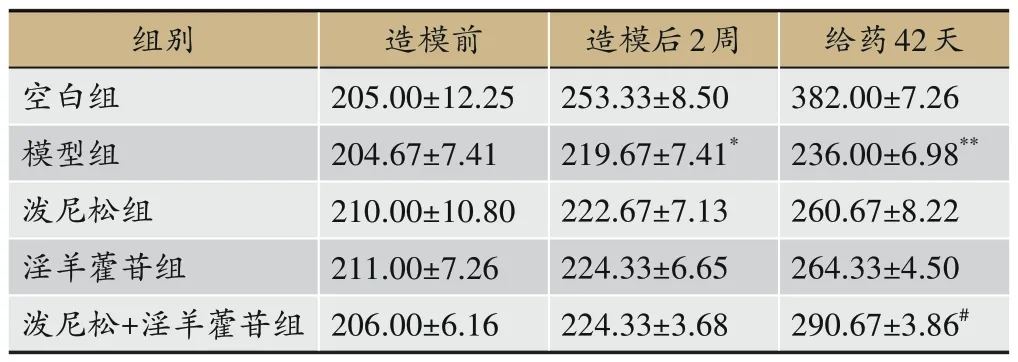
表2 各组大鼠体质量变化(g)(±s,n=3,g)
注:与空白组相比,*P<0.05,**P<0.01;与模型组相比,#P<0.01。
给药42天382.00±7.26 236.00±6.98**260.67±8.22 264.33±4.50 290.67±3.86#组别空白组模型组泼尼松组淫羊藿苷组泼尼松+淫羊藿苷组造模前205.00±12.25 204.67±7.41 210.00±10.80 211.00±7.26 206.00±6.16造模后2周253.33±8.50 219.67±7.41*222.67±7.13 224.33±6.65 224.33±3.68
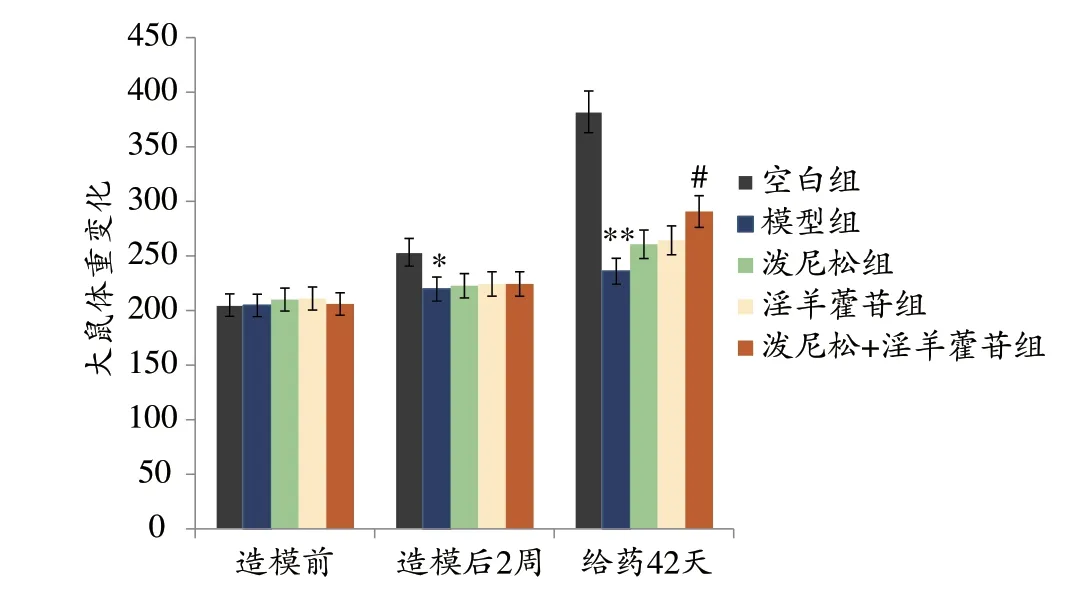
图9 各组大鼠体质量变化
2.8 各组大鼠24 h尿蛋白定量的变化
如表3 和图10 所示:空白组大鼠在实验过程中尿蛋白含量正常,无统计学意义。与空白组相比,模型组大鼠尿液中24 h 蛋白总量明显增多,具有统计学意义(P<0.01)。与模型组相比,泼尼松组大鼠经泼尼松治疗42 天后,24 h 尿蛋白总量未缓解,提示模型大鼠对泼尼松具有抵抗性。与模型组相比,淫羊藿苷组24 h尿蛋白总量变化也无统计学意义。淫羊藿联合泼尼松治疗阿霉素大鼠42天后,24 h 尿液中总蛋白含量显著减少,具有统计学意义(P<0.01)。提示SRNS 大鼠模型成功,淫羊藿苷联合泼尼松治疗阿霉素大鼠,有效的降低了尿液中蛋白含量,具有治疗作用。
表3 24 h尿蛋白定量(mg·24 h-1)(±s,n=3)

表3 24 h尿蛋白定量(mg·24 h-1)(±s,n=3)
注:与空白组相比,**P<0.01;与模型组相比,#P<0.01。
给药42天4.80±0.82 174.65±2.83**166.09±1.57 163.94±4.79 90.72±2.59##组别空白组模型组泼尼松组淫羊藿苷组泼尼松+淫羊藿苷组造模前4.65±0.57 4.91±0.78 4.93±0.17 4.66±0.07 4.99±0.72造模后2周4.69±0.55 119.38±2.93**119.42±0.85 118.86±1.36 119.23±1.07

图10 SRNS大鼠尿液中24小时尿蛋白定量的变化
2.9 各组大鼠肾组织病理形态的变化
如图11 所示:空白组大鼠肾组织形态正常,肾小球结构完整,轮廓清晰,球内血管分布均匀,排列整齐。与空白组相比,模型组大鼠肾组织结构紊乱,肾小球变形,部分萎缩,球内毛细血管成团分布,肾小囊轮廓不清晰,滤过膜结构模糊,肾小管部分萎缩、部分扩张,结构不一,排列紊乱,可见局灶性炎性细胞浸润。与模型组相比,泼尼松+淫羊藿苷组大鼠经淫羊藿苷协同泼尼松治疗后,肾组织结构形态改善明显,肾小球结构较清晰,轮廓清除,球内毛细血管分布均匀,肾小管分布均匀,排列整齐,无萎缩或扩张现象。单纯的泼尼松组和淫羊藿苷组大鼠肾组织结构形态较模型组无明显改变。提示淫羊藿苷联合泼尼松治疗改善了阿霉素大鼠肾小球的形态学变化。

图11 各组大鼠肾组织病理形态的变化
2.10 Western blot检测LC3-II、PI3K、Akt的表达
如表4和图12所示:与空白组相比,模型组LC3-Ⅱ的表达减少、PI3K、Akt的表达增加(P<0.01),泼尼松组和淫羊藿苷组与模型组相比LC3-Ⅱ、PI3K、Akt的表达无明显变化。与模型组相比,泼尼松+淫羊藿苷组LC3-Ⅱ的表达增加、PI3K、Akt的表达明显减少(P<0.01)。
表4 淫羊藿苷联合泼尼松对SRNS大鼠肾组织LC3-II、PI3K、Akt的表达水平(±s,n=3)

表4 淫羊藿苷联合泼尼松对SRNS大鼠肾组织LC3-II、PI3K、Akt的表达水平(±s,n=3)
注:与空白组相比,##P<0.01;与模型组相比,**P<0.01。
分组空白组模型组泼尼松组淫羊藿苷组泼尼松+淫羊藿苷组LC3-II 1.00±0.04 0.71±0.03##0.74±0.06 0.94±0.04 0.83±0.13**PI3K 1.00±0.04 1.61±0.07##1.53±0.05 1.59±0.05 1.39±0.05**Akt 1.00±0.07 1.41±0.06##1.39±0.06 1.40±0.05 1.16±0.06**

图12 淫羊藿苷联合泼尼松对SRNS大鼠肾组织自噬蛋白LC3-II、PI3K/Akt表达的影响
3 讨论
SRNS 对药物治疗反应差,肾损害进行性加重,在临床上,FSGS 是导致SRNS 这一事件发生最常见的因素,其特点是在5-10年的诊断期内迅速发展为终末期肾病[12-14]。西医治疗以环孢素、他克莫司等免疫抑制剂为主,但在用药之前,首先要排除患者是否有肿瘤病史及感染指征,而且临床效果不佳,不良反应重,临床治疗出现部分缓解也是令人满意的[15]。中西医结合治疗SRNS 有一定的疗效和前景,中医药对激素可以起到减毒增效的作用。表明中西医结合干预靶点的治疗,有助于提高SRNS 疗效、减少药物不良反应及改善预后[16]。循证医学研究结果表明,温阳法结合西医常规治疗SRNS 在提高临床综合疗效及安全性方面显著优于单纯的西医治疗方案[17]。网络药理学打破了传统单向路径式的研究理念,成为中医药现代化的有力工具[18]。它结合基因组学、蛋白质组学和中药化学物质,通过先进的计算算法和网络模型,连接疾病、治疗、中药配药,并分析活性成分,将一个靶点、一种药物的范式转变为网络靶点、多成分疗法,在研究靶点、药物、疾病和途径之间复杂多样的关系有独特的优势[19-20]。本研究利用网络药理学的方法,从分子生物学角度更深层次地揭示淫羊藿苷干预SRNS 大鼠的作用机制。
淫羊藿苷治疗SRNS 的网络药理学分析结果为:淫羊藿苷活性成分对应的139 个靶蛋白基因与SRNS的1476 个靶点基因进行匹配药物靶点-基因靶点,得出交集基因共58 个。淫羊藿苷治疗SRNS 排在前3 位的标靶蛋白是:RAC-α 丝氨酸/苏氨酸蛋白激酶(AKT1)(degree=50)、1 号染色体基因(JUN)(degree=45)、白介素-6(IL6)(degree=44),可作为研究淫羊藿苷治疗SRNS的关键靶点。KEGG富集分析结果提示,淫羊藿苷主要通过调控PI3K/AKT 信号通路发挥对SRNS 的治疗作用。而PI3K/AKT 信号通路与肿瘤生长、血管生成、患者预后及治疗密切相关[21],PI3K/Akt级联通路在控制足细胞肌动蛋白细胞骨架重塑具有重要作用,肌动蛋白细胞骨架在足细胞损伤中的解体与PI3K 相关[22]。在糖尿病肾病的发生发展过程中,通过调控PI3K-Akt 信号通路,恢复自噬,可以缓解肾脏纤维化[23]。研究表明活化的PI3K/Akt通路可损伤足细胞参与蛋白尿形成[24]。Akt 蛋白位于信号通路mTOR上游、PI3K 下游,在外界环境刺激下,活化的PI3K 进一步激活Akt,导致Akt 磷酸化,磷酸化的Akt 可以直接激活mTOR,从而抑制自噬,说明活化的PI3K/AKT信号通路可负向调控自噬水平[25]。自噬在细胞内稳态中起重要的生理作用,自噬的失调可能参与各种疾病状态,如炎症、衰老、代谢性疾病、神经退行性疾病、癌症及肾脏疾病[26-27]。文献表明,自噬与肾小球足细胞的稳态有关[28]。Hartleben 等[29]发现足细胞在基础条件下具有高水平的自噬,且足细胞自噬体形成能力的丧失导致了小鼠足细胞功能受损和肾小球疾病的发生。
基于以上网络药理学研究结果,本研究选取KEGG 富集到的主要信号通路PI3K/AKT 蛋白进行分子对接验证。以上文献研究表明,可以通过调控PI3K/AKT信号通路调节细胞自噬水平,达到保护肾脏的目的。本实验选择能够反应细胞自噬水平的相关蛋白LC3 进行分子对接验证,进一步从自噬角度阐明淫羊藿苷治疗SRNS 的机制。结果表明,Akt 和PI3K与淫羊藿苷有较好的结合活性,LC3 与淫羊藿苷亦有一定的结合活性,进一步提示淫羊藿苷可能通过Akt、PI3K和LC3-II蛋白靶点起关键作用。
动物实验中可以看到,淫羊藿苷联合泼尼松可以明显增加SRNS 大鼠体质量,减少24 h 尿蛋白定量,改善肾小球的形态学变化。上调了大鼠肾组织中自噬相关蛋白LC3-II 的表达,抑制了自噬信号通路蛋白PI3K、Akt 的表达。说明淫羊藿苷联合泼尼松治疗SRNS 大鼠,可以保护肾组织,延缓疾病进展,其作用可能与抑制PI3K/Akt/信号通路和激活肾脏自噬有关。
参照《网络药理学评价方法指南》[30-31],本研究中淫羊藿苷活性成分靶点、SRNS相关靶点均通过网络药理学研究的权威数据库筛选获得,网络药理学分析所使用的软件及方法为网络药理学研究广泛使用。并进一步通过动物体内研究对结果进行验证,实验设计合理,结果具有可重复性。本研究对淫羊藿苷治疗SRNS 大鼠的可能作用机制进行整体地预测和分析,发现淫羊藿苷治疗SRNS 大鼠是通过多靶点和多通路的共同协调来实现的。体内动物实验进一步证实了淫羊藿苷对SRNS 大鼠的治疗具有一定的改善作用。本研究为后续淫羊藿苷治疗SRNS 的相关研究提供一定的线索和提示,为临床治疗SRNS提供理论基础。但本研究仅基于目前现有数据库与已有数据进行建模,预测结果可能存在偏差,中药成分组成复杂,目前获取的药物活性成分和作用靶点有限,不能完全揭示其作用机制,且需要更多的动物实验给予验证其真实性。
