绿色高效铁阴极Fenton体系氧化降解对硝基苯酚的应用研究
2023-12-28徐灿程赵泽坤葛保鑫齐元峰
徐灿程,赵泽坤,徐 畅,曹 琦,葛保鑫,齐元峰,江 波,*
(1.青岛理工大学 环境与市政工程学院,青岛 266525;2.江苏艾特克环境工程有限公司,宜兴 214214)
在过去的几十年中,高级氧化工艺 (AOPs) 在废水处理领域引起了越来越多的关注,其核心是原位产生高度活性的羟基自由基(·OH,E0=2.80 V(vs SHE)),无选择性地与大多数有机物反应,动力学常数值高达108~1010L/(mol ·s)[1-3]。在各种高级氧化工艺中,传统的 Fenton反应工艺因其反应速度快、操作条件温和、控制简单等优点而被广泛应用于废水处理。Fenton反应主要通过两个步骤进行,第一阶段为Fe2+和H2O2之间的均相反应快速形成·OH(式(1)),大部分污染物降解在这一阶段完成[4];第二阶段主要为Fe3+和H2O2之间的缓慢反应,用于再生Fe2+(式(2)),生成的·HO2同样可以降解污染物,同时维持Fenton反应的连续性[5]。
Fe2++ H2O2→ Fe3++ OH-+·OH ,k1=63~76 L/(mol·s)
(1)
Fe3++ H2O2→ Fe2++ ·HO2+ H+,k2=0.001~0.01 L/(mol·s)
(2)
然而,Fenton工艺存在一些缺陷,极大地阻碍了其工业应用。由于反应的最佳pH值为3,在这种酸性pH值下工作需要添加大量浓酸试剂,反应后溶液的中和也需要消耗大量的碱性试剂。浓酸试剂为危险化学品,在实际应用中会受到限制,此外,酸碱试剂和铁盐的使用不可避免地会引入杂质离子,增加水体的盐度,而水体盐含量的大幅增加可能使废水不能被自然环境所接受,或者对后续的反渗透装置造成很大的压力[6]。
近几十年来,研究界越来越关注解决传统Fenton工艺的上述局限性,异相Fenton体系的发展已被证明是避免铁盐类试剂添加的可行策略,其中氧化铁和其他金属氧化物通常用作异相催化剂[7-8]。异相Fenton无需添加铁盐,在中性条件下即可进行,很大程度上解决了传统Fenton的一些局限性[9]。尽管如此,大多数非均相Fenton体系仍然在pH 3~5降解效果最佳,催化性能在近中性水体中大大降低[3, 10-11]。此外,异相Fenton反应动力学缓慢,对有机物的降解效果明显弱于均相Fenton[12]。
在典型的电解系统中,OH-和H+分别在阴极和阳极产生[13],受此特性启发,分离式电解槽可用作Fenton反应系统前后的pH调节单元,无需化学添加即可自动酸化和中和废水。此外,在酸性溶液中,金属铁的酸性溶解可以将铁离子释放到溶液中,而在阴极的极化作用下,释放的铁离子量可以得到很好的控制,同时,Fe3+也可以在铁阴极处还原为Fe2+(式(3))[14],加速体系的铁循环。
Fe3++ e-→ Fe2+
(3)
本研究开发了一种绿色高效的铁阴极Fenton体系,用于对硝基苯酚(PNP)的降解。在以PTFE膜作为分离材料的pH调节电解池中,通过H2O在阳极和阴极分别分解为H+和OH-,可以获得Fenton反应适宜的pH值。在外加H2O2的铁阴极Fenton工艺中,金属铁片和DSA电极分别作为阴极和阳极,金属铁电极的阴极极化作用可以有效减少铁离子的释放,减少铁泥的产生。这些优势消除了传统Fenton工艺的局限性,提高了其对污染物的处理效率。
1 实验材料和方法
1.1 实验材料
50 mm×50 mm 的铁板(Fe,> 99%)购自腾峰金属材料有限公司(河北);对硝基苯酚(PNP, C6H5NO3, 99%)由上海亿恩化工科技有限公司提供;1,10-邻菲咯啉(C12H8N2·H2O, 99%)、冰醋酸(C2H4O2, 99%)、乙酸钠(CH3COONa, 99%)、硫酸亚铁 (FeSO4·7H2O, 99%)、盐酸羟胺 (HONH3Cl, 98.5%)、硫酸钠 (Na2SO4, 99%)、过氧化氢 (H2O2, 30%)、草酸钛钾 (K2TiO(C2O4)2, 98%)、六水硫酸亚铁铵 (Fe(NH4)2·(SO4)2·6H2O, 99%)、高锰酸钾 (KMnO4, 99%)、硫酸 (H2SO4, 98%)、氢氧化钠 (NaOH, 98%) 由中国国药化学试剂有限公司提供。 所有化学品均为分析级,无需进一步纯化即可使用。所有实验均使用超纯水(18.2 MΩ·cm)制备反应溶液。
1.2 实验方法

图1 体系的pH调节分隔式电解槽
铁阴极Fenton体系主要包括四个步骤。步骤一中,在分隔式电解槽中进行pH调节,阴极和阳极室由PTFE微滤膜隔开,电解装置如图1所示。阳极为50 mm×80 mm 的硼掺杂金刚石 (BDD) 电极,阴极为相同尺寸的钛网,电极间距为25 mm,PTFE膜位于阳极和阴极之间,PNP溶液同时进入阴极和阳极室,停留时间约为1 min;步骤二中,电解槽的阳极室出水进入Fenton反应池,该部分采用三电极体系控制阴极电位,反应液的体积为500 mL,工作电极为50 mm×50 mm的铁板,对电极为50 mm×50 mm DSA (Ti-RuO2-IrO2) 电极,在15 min内连续加入200 mg/L H2O2,在恒定的酸性pH下发生Fenton反应降解有机物;步骤三中,Fenton反应后的溶液进入电解装置的阴极室中以增加pH;步骤四中,溶液通过过滤装置去除铁泥等固体杂质,装置填充物为粒径80~120 mm的石英砂。每间隔一定时间取一次水样,用于PNP、COD、铁离子和H2O2浓度的检测,每组实验重复进行2次,最后的实验结果取平均值。PNP,COD 或 TOC的去除率η通过式(4)计算:
(4)
式中:C0为初始时刻PNP,COD或TOC的浓度;Ct为t时刻PNP,COD或TOC的浓度。
2 结果与讨论
2.1 电解池中的pH调节
本研究开发了一种使用亲水性PTFE微滤膜作为分离材料的隔离式电解槽,其主要成分为聚四氟乙烯,具有良好的耐酸耐碱性能,且使用寿命高,价格低廉。在该系统中,H2O在阳极和阴极的电解反应可分别产生H+和OH-(式(5)(6)),隔膜减缓了阳极室的H+向阴极室的扩散速率,可以调控阴阳极室的出水pH。电流密度是影响电化学反应速率的重要因素,如图2(a)所示,当含有100 mg/L PNP和3 g/L Na2SO4电解质的中性溶液通过蠕动泵以20 mL/min的流速泵入电解装置时,随着电流密度的增加,阳极室出水的pH值不断下降。当电流密度从0.5 mA/cm2增加到6 mA/cm2,阳极室出水的pH值从4.2下降到2.7,而阴极室出水的pH值从9.9增加到11.5;当施加的电流密度为2 mA/cm2时,阳极室出水的pH稳定在3.0~3.2。之前的研究已经证明,Fenton反应最适宜的pH值为3,因此,为了达到最有利的Fenton反应条件,本研究采用2 mA/cm2的电流密度来调节溶液的pH值。
2H2O+2e-→2OH-+H2
(5)
2H2O-4e-→4H++O2↑
(6)
由图2(b)可以看出,随着电流密度最初从0增加到1 mA/cm2,PNP降解效率增加,但当电流密度升高到1 mA/cm2以上时,它变得几乎恒定。具体来说,随着电流密度从0.5 mA/cm2增加到1 mA/cm2,PNP去除效率从5%增加到10%,COD去除率从2% 增加到5%。然而,将电流密度进一步提高到6 mA/cm2,PNP的去除率没有增加,且COD浓度比初始轻微提高。BDD电极由于具有较高的析氧电位,更易产生·OH,当污染物通过阳极室时,·OH会部分氧化污染物。而当电流密度逐渐升高,阳极的析氧反应加剧,使得BDD电极的阳极氧化效果减弱,且PNP降解的中间产物可能会影响COD浓度的测定。由于停留时间太短,BDD阳极对该系统中污染物的降解作用不大。
2.2 不通电情况下铁板浸在酸性溶液中的铁析出量
如图3所示,当溶液的pH值降低到接近3.0时,铁板在没有通电的情况下浸入水中30 min内产生的Fe(tot)(总铁)浓度为20 mg/L,其中89%为Fe2+。在这个过程中,铁板在酸性条件下会被H+溶解生

图2 电流密度对阴阳极室出水pH和PNP浓度的影响

图3 不同条件下铁离子浓度的变化情况
成Fe2+(式(7)),溶液pH值从3.0略微升高到3.2。30 min内,Fe(tot)和Fe2+的平均产率分别为 0.33和0.3 mg/min,表明铁板在酸性溶液下稳定释放Fe2+。相同条件下,当15 min内连续向溶液中加入200 mg/L H2O2后,Fe(tot)浓度显著增加至52 mg/L,这可以用酸性条件下Fe0和H2O2的反应来解释(式(8))[15]。Fe(tot)的平均产率在20 min内稳定(约1.1 mg/min),是不添加H2O2时的3倍,但在 20~30 min的反应时间内,平均产率下降至0.41 mg/min,和不添加H2O2的条件相似,这可能是由于大部分H2O2在20 min内被消耗。至于Fe2+浓度,它在10 min内持续增加,产率约为1.13 mg/min,并在10~20 min从23 mg/L下降到11 mg/L,这可以用Fenton反应过程中Fe2+的消耗来解释。20 min后Fe2+浓度不断增加,最终在30 min时达到18 mg/L,占Fe(tot)的35%。在20~30 min内,Fe(tot) 浓度增加了8 mg/L,接近Fe2+浓度增加值(7 mg/L),这也可以解释为20 min后剩余的H2O2很少,并且Fe(tot) 浓度的增加主要是由于Fe2+的生成。上述结果表明,H2O2的存在可以促进酸性溶液中Fe0向铁离子的转化。
Fe+2H+→Fe2++H2
(7)
Fe+H2O2+2H+→Fe2++2H2O
(8)
2.3 阴极Fenton体系中不同电势的影响
为了减小通入H2O2条件下酸性溶液中铁板溶出亚铁离子的速率并提高Fe3+对Fe2+的再生能力,本研究开发了一种新型铁阴极Fenton系统,通过在铁板上施加一个阴极电势来精确调控铁离子的释放量。图4(a)显示了不同阴极电位下Fe(tot) 的浓度变化,随着施加的阴极电势增加,产生的Fe(tot) 浓度不断减少。在-1.0和-1.2 V (vs SCE)阴极电位下,30 min内产生的Fe(tot) 浓度分别为30和21 mg/L,与不通电相比 (52 mg/L),分别降低了42%和61%。进一步增加阴极电位到 -1.4 V (vs SCE),Fe(tot) 浓度略微下降到18 mg/L。在 -1.2 V (vs SCE)阴极电位下,最初20 min内Fe(tot)的产率 (0.43 mg/min)明显高于-1.4 V (vs SCE) (0.29 mg/min),但数值在20~30 min内明显下降 (0.17 mg/min),而-1.4 V (vs SCE)的Fe(tot)产率速率基本保持不变(0.33 mg/L)。这可能是由于过高的电势抑制,-1.4 V (vs SCE) 条件下释放的铁离子浓度过低,从而使得20 min内H2O2的消耗量远小于-1.2 V (vs SCE)。图 4(b)显示了在不同的阴极电位下30 min产生的Fe2+和Fe(tot)浓度, 随着阴极电位从 -1.0 V (vs SCE) 降低到 -1.4 V (vs SCE),Fe2+与Fe(tot)的浓度比从0.39显著提高到0.77,这表明施加的阴极电势越高,Fe3+向Fe2+的还原反应越强烈。
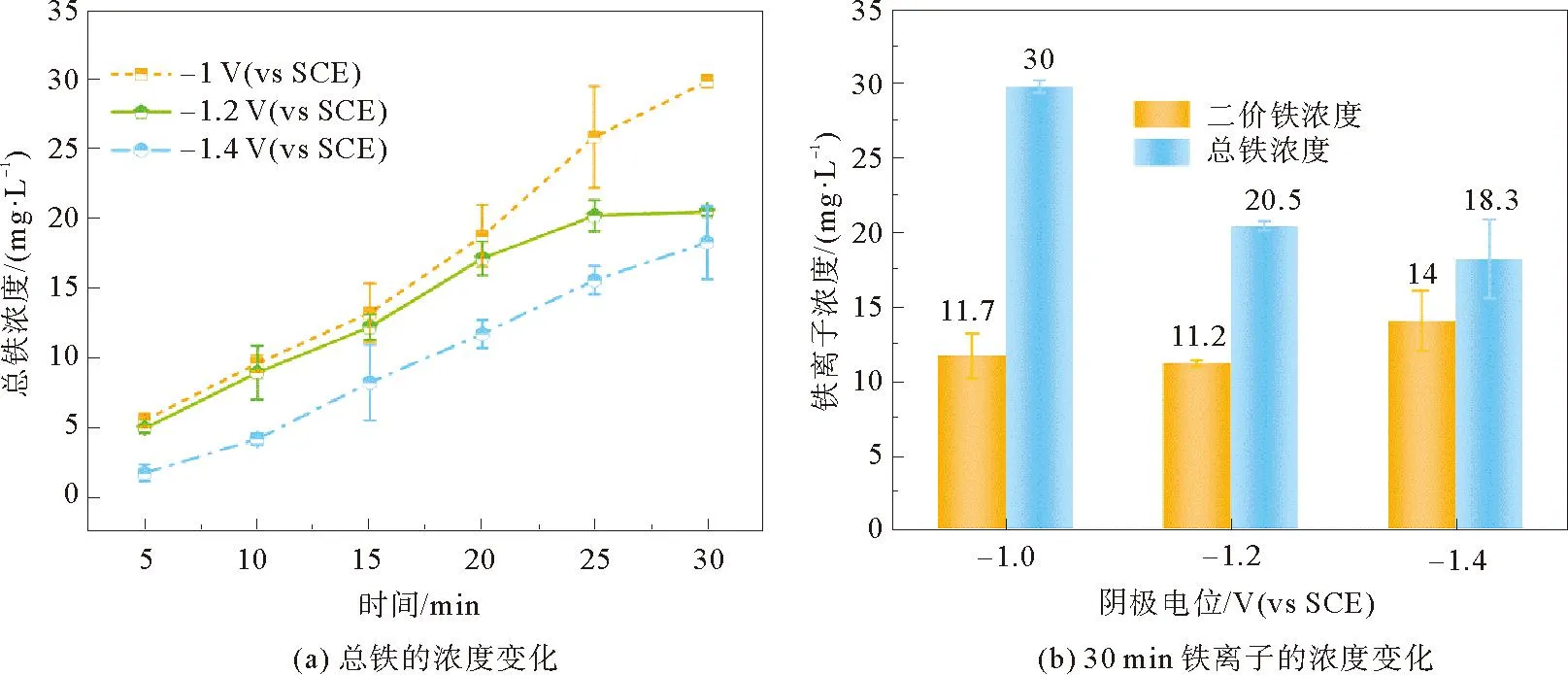
图4 不同阴极电位下总铁的浓度变化和30 min铁离子的浓度变化
PNP浓度随时间的变化趋势如图5(a)所示,在不通电的情况下,铁板浸入酸性溶液并外加200 mg/L H2O2时(WE Fenton工艺),30 min内仅降解75%的PNP。当阴极电位为 -1.0,-1.2 和 -1.4 V (vs SCE) 时,PNP 去除效率分别提高到87%,91% 和 90%。如图 5(b)所示,WE Fenton工艺的COD去除率为 67%,在阴极电位为 -1.0和 -1.2 V (vs SCE) 时分别提高到76% 和75%,残留COD浓度均低于50 mg/L。然而,当阴极电位降低到 -1.4 V (vs SCE) 时,COD 浓度在30 min内仅仅从154 mg/L降低到73 mg/L,这可归因于过大的抑制导致用于Fenton反应的Fe(tot)产量过低。根据上述结果,选择-1.2 V (vs SCE)作为最佳阴极电位,与WE Fenton工艺相比,释放的Fe(tot)浓度降低了约61%,COD出水浓度进一步从52 mg/L降低到40 mg/L。在传统的 Fenton系统中,溶液的pH用1 mol/L 硫酸调至3.0,20 mg/L Fe2+(硫酸亚铁)和200 mg/L H2O2一次性加入溶液,结果表明PNP分子在5 min内被快速破坏。然而,铁阴极Fenton体系在30 min的COD去除率高于传统Fenton,这可能是由于体系中的Fenton试剂缓慢生成,更好地避免了羟基自由基的猝灭反应。H2O2浓度的变化如图5(c)所示,当在铁板上施加阴极电位时,H2O2浓度在15 min内增加,然后在反应后期下降。与WE Fenton反应体系相比,

图5 不同条件下PNP,COD和H2O2浓度随时间的变化
25 min内施加阴极电位的H2O2浓度明显高于前者,这是由于释放到溶液的铁离子浓度降低,从而对H2O2的消耗减少,且随着施加的阴极电位从 -1.0 V (vs SCE) 增至-1.4 V (vs SCE),整个反应期间H2O2的消耗速率减慢。在传统Fenton反应过程中,H2O2的浓度在5 min内从200 mg/L显著下降到126 mg/L,这是由于一次性加入的Fe2+和H2O2之间快速剧烈反应,30 min时剩余的H2O2浓度为13 mg/L。
2.4 pH调节电解池与铁阴极Fenton系统组合
根据上述实验结果,分别得到了溶液pH调节电解池的最佳电流密度和铁阴极Fenton反应的最佳阴极电位,现在在各自最优条件下将体系联合。PNP和COD浓度随时间的变化结果如图6(a)所示,在pH调节过程中,由于BDD电极的阳极氧化,出水的PNP浓度从100 mg/L略微降到91 mg/L,而COD去除效率仅为 5%。在铁阴极Fenton氧化过程中,PNP和COD的去除率在30 min内分别达到93%和72%,而过滤之后的出水PNP和COD浓度从6,43 mg/L进一步降低到2 和34 mg/L。图6(b) 显示了传统Fenton和铁阴极Fenton的TOC去除效率,传统Fenton在5 min内去除效率为42%,但在剩余时间内保持相对稳定,最终达到48%。在组合系统中,电解装置出水TOC浓度小幅升高,Fenton反应过程中TOC去除率为51%,过滤之后去除效率达到了60%,远高于传统Fenton,这可能归因于三价铁离子沉淀发生了絮凝反应,进一步降解污染物。PNP (98%),COD (79%) 和TOC (60%) 的高去除率表明联合系统比传统Fenton反应能更有效地降解矿化污染物。
对于传统的Fenton,使用1 mol/L的H2SO4和NaOH溶液将pH值调节至所需值,同时使用硫酸亚铁作为铁盐。如图7所示,传统Fenton酸化后电导率从4.35 mS/cm提高到4.68 mS/cm,Fenton 反应后电导率继续提高到4.95 mS/cm,而pH值从3.07略微下降到2.73,这是因为PNP在降解过程中产生了大量的有机酸。反应后的pH值被中和到大约9.0,使得三价铁离子沉淀完全,此时电导率降低到4.76 mS/cm,这可能是由酸碱中和引起的。对于联合工艺,在最佳的电流密度(2 mA/cm2)下,阳极室出水的电导率增加到 4.55 mS/cm,伴随着pH从7.0降低到3.1。铁阴极Fenton反应后,在相同的电流密度下,溶液通过电解装置的阴极,出水pH值仅从 2.95 增加到 3.75,这可能是由于有机酸对pH起到了缓冲作用。在中和过程中,通过NaOH溶液进一步将pH值调节至中性(~9.0),保证Fe(OH)3的完全沉淀。通过过滤装置后,溶液电导率进一步降低至 4.37 mS/cm。总的来说,传统Fenton的电导率比初始溶液增加9%,而目前的联合工艺反应前后电导率基本保持不变,避免了传统Fenton大量添加化学试剂造成的水盐度明显增加。
2.5 环境应用
在目前的联合系统中,电力成本在整个过程的运行成本中起着重要的作用。显然,总能耗是pH调节单元和铁阴极Fenton单元的总和,废水的能耗根据式(9)计算[16]。
(9)
式中:E为能耗;U为反应期间测量的电压,V;I为施加的电流,A;T为电解时间,h;V为反应溶液的体积,m3。
如图8(a)所示,在pH调节过程中,电流密度对能耗有显著影响,而随着电流密度从0.5 mA/cm2增加到6 mA/cm2,能耗从0.075 kWh/m3增加到2.385 kWh/m3。在2 mA/cm2的最佳电流密度下,能耗为0.435 kWh/m3。图8(b)显示,铁阴极Fenton过程的能耗随着阴极电位的降低而增加,当阴极电位为 -1.0,-1.2和 -1.4 V (vs SCE) 时,体系的能耗分别为0.115,0.17和0.235 kWh/m3。在联合系统中,pH调节单元占据了大部分电力消耗(72%),整个系统废水的电力消耗为0.605 kWh/m3,根据我国的平均工业电价(0.5 元/kWh),该系统的电力成本约为 0.3 元/m3。其他成本方面,铁板非常便宜且可重复使用(10元),可以忽略成本。H2O2的单价为 1.8 元/ L,本研究的联合体系每吨水消耗0.6 L H2O2,成本约为 1.08 元。此外,体系外部添加的过氧化氢可以通过电化学原位生成来代替,消除化学成本。

图8 不同电流密度和阴极电位对能耗的影响
3 结论
开发了一种绿色高效铁阴极Fenton体系,用于PNP的降解。在该系统中,100 mg/L PNP不仅在30 min内有效降解(97%),而且COD 和 TOC的去除率分别为 79% 和 60%,表明了良好的污染物矿化效果。在 -1.2 V (vs SCE)的最佳阴极电位下,Fe(tot) 的浓度从52 mg/L显著降到21 mg/L,最大限度地减少了铁泥的产生。反应后体系的电导率从4.35 mS/cm微升至4.37 mS/cm,表明目前的联合工艺对废水含盐量的影响可以忽略不计。该系统成本低,能耗仅为0.605 kWh/m3,展现了极大的工业应用前景。
