樱桃小果病毒1号胶体金免疫层析试纸的研发与应用
2023-12-28郭静静田利光陈呈涛赵怡琳迟胜起原雪峰曹欣然
郭静静 田利光 陈呈涛 赵怡琳 迟胜起 原雪峰 曹欣然



关键词:樱桃小果病毒1号;病毒检测;胶体金免疫层析试纸;外壳蛋白
近年来对樱桃主产区病虫害情况调查发现,病毒病是危害樱桃的主要病害,并且对樱桃生产的影响逐年加重,目前国内报道了12种能够侵染甜樱桃的病毒,其中樱桃小果病毒1号(little cher-ry virus 1,LChV-1)、2号(LChV-2)和3号(LChV-3)是樱桃小果病(little cherry disease,LCD)的主要病原,侵染后导致樱桃果实缩小,严重影响甜樱桃的产量,甚至彻底丧失经济价值。LChV-1田间检出率较高。该病毒属于长线形病毒科长线病毒属Closterio‘-oirus[13]。多数品种对LChV-1敏感,因此在田间生产中对该病毒的检测尤为重要。
病毒检测常用的方法有血清学检测(蛋白水平)和PCR/qPCR/RT-PCR/法(核酸水平)等。在病毒进入植物体的过程中,高度保守的含有多个抗原决定簇的CP蛋白起重要作用,决定着病毒的抗原性,因此对LChV-1的CP蛋白免疫获得抗体后可以对病毒进行特异性检测。常规的Westernblot和PCR等方法均需在实验室完成,不能满足田间快速检测的需求。目前,环介导等温扩增(loop-me-diated isothermal amplification,LAMP)技术、胶体金免疫层析(colloidal gold immunochromatographyassay,GICA)技术和重组酶聚合酶扩增(recombi-nase polymerase amplification,RPA)技术可以满足田间检测。其中胶体金免疫层析技术是以血清学检测法为原理建立的一种检测方法,是将胶体金作为示踪标志物应用于抗原抗体反应的一种新型的免疫标记技术。该方法只要根据条带指示即可判断病毒的有无,不需要专用仪器和专业技术人员操作,能够满足田间快速检测的需求。
LChV-1存在潜伏侵染现象,在苗期获得无毒种苗是预防樱桃病毒病的有效措施,所以,早期的田间检测至关重要。目前的检测技术无法满足田间快速检测的需求。本研究采用胶体金免疫层析试纸的方法,可以用较短时间呈现检测结果,旨在为樱桃小果病的综合防控提供了有效监测和检测手段。
1材料与方法
1.1构建含有LChV-1 CP编码序列的原核表达载体
对NCBI上已经报道的樱桃小果病毒1号分离物序列(GenBank序列登录号分别为KU715989、KR080325、JX669615、NC001836和KR736335)进行比对分析,设计带有BarnH工和Not工酶切位点的引物LChV-1-CP-BamHI-12061-F(5'-AAGGATCCAT-GGCGAATTTAGCTTTCACGAAA-3),LChV-1-CP-Notl-13275-R(5'-TTGCGGCCGCTTAATTT-CTTCTACCGCGACGTGG-3)。使用RNAprepPure多糖多酚植物总RNA提取试剂盒[天根生化科技(北京)有限公司]提取植物总RNA,反转录为cDNA,以cDNA为模板进行PCR扩增。PCR反应体系(25uL):10×PCR缓冲液(Mg2+ plus)2.5uL,10mmoL/L dNTPs
1uL,LChV-1-CP-BamHI-12061-F和LChV-1-CP-Notl-13275-R各1uL,cD-NA 1uL,5U/uL Taq DNA聚合酶1uL,ddH20補足至25uL。PCR反应程序:94℃预变性5min;94℃变性40s,50℃退火40s,72℃延伸2min,共30个循环;72℃10min,
将PCR产物连接到表达载体pESC-HIS上,经双酶切鉴定和测序得到酶切位点和序列信息正确的重组表达载体pESC-HIS-LChV-1-CP。
1.2LChV-1CP蛋白的原核表达及蛋白纯化
将pESC-HIS-LChV-1-CP原核表达质粒转化到大肠杆菌Rosetta感受态细胞中。挑取含重组质粒的Rosetta菌株于LB培养基中活化8h,然后扩大培养至OD600达0.5左右,在LB培养基中加入0.5mmol/L的IPTG继续振荡培养4h,进行目的蛋白的诱导表达。收集少量菌体加入2×SDS蛋白上样缓冲液[20 mmoL/L Tris-HCl(pH 7.4)、0.2moL/L NaCI、1mmoL/L EDTA]沸水浴8min,采用SDS-PAGE电泳检测诱导表达的蛋白质。成功表达后,将获得的菌体超声波破碎,分别检测上清液和沉淀物中蛋白质含量,确定表达蛋白的可溶性。
大量诱导表达LChV-1的CP蛋白并超声破碎。上清液用0.22um的水系滤膜过滤至50mL离心管中,过Ni柱纯化(整个层析过程在4℃环境中进行)。装柱:根据待纯化的蛋白量,将2 ml。介质加入层析柱;平衡:用5~10倍柱体积平衡缓冲液平衡层析柱;上样:将蛋白加入层析柱中,收集流出液;洗涤:用洗涤缓冲液(19.6mL 1×Buffer B,400uL1mol/L咪唑)分两次洗脱杂蛋白,每次1mL,再用洗脱缓冲液(8.5mL1×Buffer C,1.5mL 1mol/L咪唑)洗脱目的蛋白,收集5管流出液(每管500uL)。SDS-PAGE电泳检测,-80℃保存。
1.3LChV-1 CP抗血清制备、特异性检测及效价分析
将纯化后的LChV-1 CP蛋白送北京华大基因科技有限公司进行抗血清制备。采用Western blot检测抗血清的特异性。获得的一抗的多抗血清终浓度为1:5000,加入二抗终浓度为1:20000。使用间接ELISA方法分析抗血清效价,多抗血清用TBS从200倍开始2倍梯度稀释,终浓度分别为200、400、800、1600、3200、6400、12800倍和25600倍,反应终止后在波长405nm下测定吸光度,以OD值大于0.1标准判断为阳性。
1.4胶体金免疫层析试纸的研发
1.4.1确定最佳抗体标记浓度
将制备好的胶体金溶液pH调节至7.08。取不同浓度的抗血清30uL加入离心管中,加入胶体金125uL,5min后,加入10% NaCI,1h后观察颜色变化,颜色不变的最低浓度即为最佳抗体标记浓度。
1.4.2制备金标抗体
取1mL胶体金,用0.2mol/L碳酸钾调节pH至7.08。将最佳抗体标记浓度(0.24mg/mL)的抗血清加入到1mL胶体金中,迅速振荡5min,室温静置1h;加入137.8uLBSA至终浓度为1%;振荡5min后静置1h;13000r/min4℃离心25min,弃上清,加入1mL含0.01mol/L硼砂的2%BSA重悬沉淀;重复步骤上一步;13000r/min 4℃离心25min,加入200uL TBS重悬沉淀。
1.4.3胶体金免疫层析试纸的检测原理
试验采用竞争法。在试纸条的结合垫上固定金标抗体,NC膜的T線和C线上分别固定待测抗原和能与金标抗体特异性结合的二抗。当待测样品液体滴加到试纸条上后,通过层析作用,液体依次会流过结合垫、T线、C线。当样品中含有目的抗原时,移动至结合垫时待测抗原与结合垫上的金标抗体结合,移动至T线时,由于金标抗体已经与样品中的待测抗原结合,故无法被T线上的抗原捕获,胶体金不会发生聚集,T线不会显色,移动至C线时,游离的金标抗体被二抗捕获,胶体金聚集并显色,结果呈现为一条线;当样品中不含有目的抗原时,液体移动至结合垫,结合垫上的金标抗体上的抗原结合位点未被占据,液体移动至T线,金标抗体被T线上的抗原捕获,胶体金聚集并显色,液体运动至C线,游离的金标抗体被二抗捕获,胶体金聚集并显色,结果呈现为两条线。
1.5田间样品检测
采用胶体金免疫层析试纸条及常规RT-PCR对田间甜樱桃样品进行检测。田间甜樱桃上常发生的病毒有樱桃小果病毒1号、樱桃小果病毒2号(littlecherry virus 2,LChV-2)、樱桃病毒A(cherry virus A,CVA)、樱桃绿斑驳病毒、李矮缩病毒(prune dwarf virus,PDV)、黄瓜花叶病毒(cucumber mosaic virus,CMV)、李树皮坏死与茎痘伴随病毒(plum bark necrosis stem pitting-asso-ciated virus,PBNSPaV)、李属坏死环斑病毒(prunus nec-rotic ring spot virus,PNRSV)和柑橘叶斑驳病毒(citrusleaf blotch virus,CLBV)。这些病毒的RT-PCR检测所用的特异性引物参考专利ZL201811480617.2。
田间甜樱桃样本于2021年7月采集于烟台栖霞,品种为‘辉煌’‘玲珑脆’‘橹樱三’‘瑞德’‘五月红’。采用TransZoI Plant试剂盒提取植物叶片总RNA,利用RT-PCR检测病毒。反转录反应体系(25uL,试剂购自TaKaRa公司):植物总RNA 20~50ng,100mmol/L反向引物 5.0uL,10mmol/LdNTPs 4.0uL,ddH25.0uL。80℃ 3 min然后冰上5min,加入5×Reverse Transcriptase M-MLVbuffer 5.0uL,反转录酶(M-MLV)0.5uL,Recom-binant RNase Inhibitor 0.5uL,于42℃反应90min。PCR反应体系(20.0uL):cDNA 2.0uL,100mmol/L上、下游引物各0.5uL,2×Taq Master Mix(康为世纪生物科技有限公司)10uL,超纯水7.0uL。反应条件:94℃5min;94℃40s,50~54℃40s,72℃20~35s,30个循环;72℃10min。
将樱桃叶片用缓冲液(20mmol/L Tris-HCI,150mmol/L NaCI,0.05% Tween-20,pH 7.5)研磨后,滴加于胶体金免疫层析试纸上。10min后待条带清晰稳定后,通过观察检测线和质检线的显色情况进行判定。检测线没有红色条带,质检线出现红色条带,判定为阳性,说明所检测植物样本中有LChV-1;检测线和质检线两条线都显现红色条带,判定为阴性,即所检测样品中不含有LChV-1;只有检测线有条带,或检测线质检线均没有条带,表明该试纸条检测结果不可信。
2结果与分析
2.1LChV-1 CP蛋白的原核表达及可溶性
SDS-PAGE电泳发现不同浓度IPTG诱导表达出的目的蛋白量差异不明显。选取0.5mmol/L浓度的IPTG进行目的蛋白的诱导表达,表达的蛋白分子量在43~55kD之间,与LChV-1-CP蛋白的分子量(45kD)相符(图2)。可溶性检测结果显示,目的蛋白在上清和沉淀中均存在(图2)。上清中的目的蛋白可用于Ni柱纯化。
2.2抗血清的特异性及效价
以实验室保存的健康烟草叶片、重组的LChV-1CP蛋白、带有LChV-1的田间樱桃叶片为材料,对制备好的抗血清进行特异性检测。结果(图3)显示,重组的LChV-1CP蛋白和田间样本在45kD处有明显特异性条带。表明该抗体可用于LChV-1的检测。间接ELISA进行抗血清的效价分析显示,抗血清在稀释12800倍时,仍然可以检测出阳性样本。
2.3胶体金免疫层析试纸检测体系的优化
2.3.1最佳抗体标记浓度
胶体金结合垫上含有抗体标记胶体金颗粒,该抗体为本实验所获得的特异性良好的LChV-1CP的抗血清。为确定结合垫上最佳抗体标记浓度,将终浓度分别为0,0. 12,0.24,0.48mg/mL和0. 72mg/mL用作抗体标记浓度,以不变颜色的最低浓度为金标抗体的最佳浓度。结果显示,最佳标记浓度为0.24mg/mL(图4)。
2.3.2最佳检测线浓度
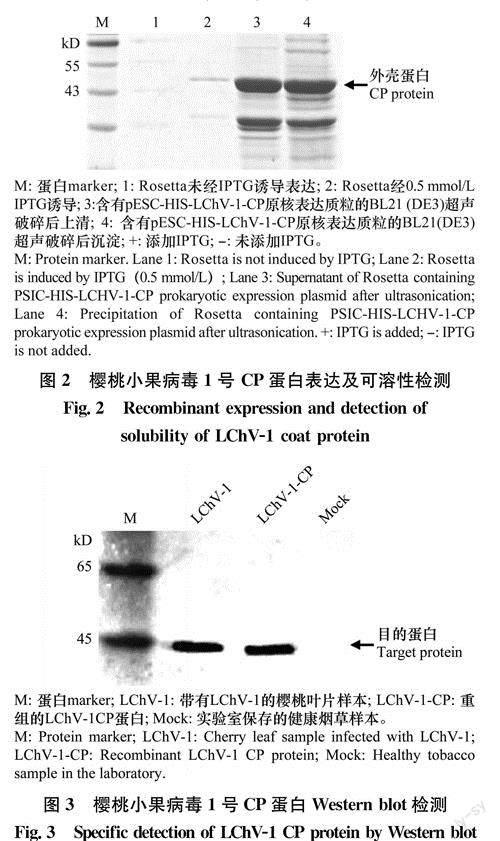
检测线包被抗原,该抗原为本实验所获得的可溶性良好的LChV-1CP的重组蛋白。为确定最佳检测线浓度,将不同抗体终浓度(0.0625,0.125,0.25,0.5,1mg/mL)重组蛋白点涂于硝酸纤维素膜上,作为检测线。如图5所示,肉眼可识别的最低浓度即为最佳检测线浓度,最终确定最佳检测线浓度为0.25mg/ml.。
2.3.3最佳质检线浓度
确定检测线浓度后进行质检线浓度的确定,将不同终浓度(0.1,0.08,0.06,0.04,0.02mg/mL)羊抗兔IgG抗体点涂于硝酸纤维素膜上,作为质检线,肉眼可识别的最低浓度即为最佳质检线浓度,最终確定最佳质检线浓度为0.04mg/mL(图6)。
2.3.4胶体金免疫层析试纸的特异性
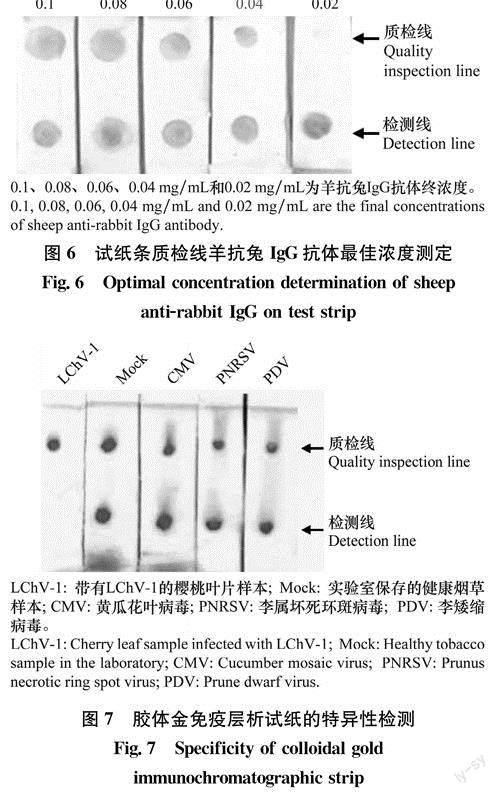
用实验室保存的分别单独被黄瓜花叶病毒(cu-cumber mosaic vlrus,CMV),李属坏死环斑病毒(prunus necrotic ring spot vlrus,PNRSV),李矮缩病毒(prune dwarf virus,PDV)侵染的植物样品进行检测。结果(图7)显示,LChV-1中检测线不显色,其余3种样品中检测线显色,说明该试纸条可以特异性检测LChV-1。质检线显色,说明该试纸条可正常使用。该试纸条可以特异性检测出含有LChV-1病毒的植物样本。
2.3.5胶体金免疫层析试纸的田间应用
试纸条结果(图8a)显示,样本1中检测线不显色,质检线显色,表明样本含有LChV-1,样本2~样本9检测线和质检线均显色,表明样本不含有LChV-1;将所有样本提取RNA进行RT-PCR检测,结果与试纸条结果一致(图8b)。因此,在田间样品的检测中,制备的胶体金免疫层析试纸可以成功检测出LChV-1,具有良好的田间应用效果。
3结论与讨论
胶体金免疫层析技术是一种将胶体金标记技术、免疫检测技术、层析分析技术和单克隆(多克隆)抗体多种方法相结合的一种固相标记检测技术。该技术作为一种新型的免疫标记示踪技术,比传统酶联免疫标记(enzyme linked immunosorbent assay,ELISA)、聚合酶链式反应(polymerase chain reac-tion,PCR)等方法更快速简便、不需要特殊设备和试剂、结果判断直观等优点,成为当前检测领域的热点。其检测原理分为竞争法与双抗夹心法,竞争抗体法适用于含有单一抗原表位的小分子抗原,双抗夹心法适用于含有多个抗原表位的大分子抗原,本试验选用竞争法。前期试验中也采用过结果更容易判读的双抗夹心法,但并未成功,推测原因可能由于LChV-1CP蛋白表位比较单一,后改为竞争法。
试纸样品垫的作用是迅速吸收待测样品,储存样品并迅速释放待测样品,试验前期采用磷酸缓冲液(phosphate buffered solution,PBS)加吐温-20对样品垫进行预处理,发现层析过程中样品垫与结合垫连接处可见胶体金残留堵膜,推测可能由于PBST盐浓度较高容易引起沉淀,后调整为Tris缓冲液(Tris buffered solution,TBS)加吐温-20,再添加活性剂,这样可以使样品垫缓冲液分布均匀,释放样品速率加快,膜上背景干净,胶体金释放完全。胶体金免疫层析试纸中的核心组件是硝酸纤维素膜(NC),是免疫反应的主要载体,其质量主要由两方面决定,一是结合大分子物质的能力,二是膜的孔径。膜的孔径是影响层析速度的关键因素。孔径越小,层析速度越慢,抗原抗体结合时间越长,反应越充分,但发生非特异性结合的可能性也相应提高,所以需要根据抗原(抗体)蛋白分子大小、检测原理和厂家等多种因素进行摸索。
在我们前期工作中发现,甜樱桃在田间复合侵染现象非常普遍。由于樱桃小果病毒1号造成危害较为严重,故本试验选择该病毒进行胶体金免疫层析试纸的研发,旨在为LChV-1的早期诊断和综合防治提供监测和检测手段。后期可根据甜樱桃复合侵染特点,针对两种或更多种病毒研发两重或多重GICA试纸,满足田间的检测需求。
