大麦条纹病菌基因Pgr03902致病功能研究
2023-12-28祁天涛司二静郭铭孟亚雄姚立蓉汪军成马小乐李葆春杨轲尚勋武王化俊
祁天涛 司二静 郭铭 孟亚雄 姚立蓉 汪军成 马小乐 李葆春 杨轲 尚勋武 王化俊

关键词:大麦条纹病菌;RNA干扰;遗传转化;致病性
大麦病害种类多样,其中由真菌麦类核腔菌Pyrenophora grarnznea侵染导致的条纹病(barleyleaf stripe)是大麦的主要病害之一,严重影响大麦的产量和品质。病原菌侵染后,大麦叶片上产生和叶脉平行的条纹状病斑并不断延展,最终引发叶片枯死,穗部发生畸变不结实或种子带菌。发病严重年份可造成70%以上的产量损失。目前,大麦条纹病的主要防治措施为建立无病种子田、化学药剂防治、栽培管理防治及选育推广抗条纹病品种。无论是非生物防治措施还是生物防治措施,其前提是要充分了解大麦条纹病菌的致病机理。
病原菌侵染植物的过程中会分泌一些效应蛋白,这些蛋白可通过多种方式抑制植物产生免疫反应,从而促进病原菌侵染,最终导致植物品种的抗病性丧失。同时,植物病原微生物在与寄主植物互作过程中会促使致病相关基因过量表达,其编码的蛋白在被植物抗病基因编码的蛋白识别后可引起植物的免疫反应,在不被植物识别的情况下则表现为毒性功能。到目前为止,研究人员已对不同病原菌效应蛋白的功能进行了研究,如Joe等发现基因RXLR编码的蛋白AVR3a与信号肽和半胱氨酸的分泌有关;张茜茜等发现稻瘟病菌Pyriculariaorzae效应蛋白MoIEEP1分泌到胞外引起寄主细胞死亡,并证明了该蛋白通过与寄主植物线粒体或过氧化物酶体上的蛋白受体互作表现出致病性;Liu等和Singh等分别构建了产黄青霉Penicilliumchrysogenum、长孢轮枝菌Verticilliurn longispo-rum等真菌致病基因的RNA干扰(RNA interfer-ence,RNAi)载体,用于研究致病相关基因的功能;郭铭运用RNAi技术研究大麦条纹病菌效应子基因Pgr07060的功能,结果表明该基因与大麦条纹病菌的致病性密切相关,Pgr07060下调表达后,干扰菌株的生长速率和致病力均显著降低。
目前,大麦条纹病菌基因组测序已完成,加速了其致病相关基因的功能研究进程。本课题组前期通过大麦条纹病菌与大麦互作的转录组分析筛选出在侵染早期高效表达的效应蛋白编码基因pgFr03902,本研究通过生物学信息分析、表达模式分析、亚细胞定位和RNAi菌株在生长速率、菌丝形态和致病性差异上的研究,初步解析大麦条纹病菌基因Pgr03902的功能,为进一步研究大麦条纹病菌致病机制及防治奠定基础。
1材料与方法
1.1试验材料
植物材料包括大麦‘Alexis’和本氏烟Nicoti-ana bentharniana。供试大麦条纹病菌为野生型菌株QWC。用于遗传转化的菌株包括农杆菌Agrobacteriurn turn.efaciens GV3101和大肠杆菌E.schrichia coli DH5a。pSilent-l干扰载体由河北农业大学曹志艳教授惠赠;亚细胞定位载体PCAM-BIA1300-35S-EGFP及pMD-19 simple vector T载体由本實验室保存。用于大麦条纹病菌菌株QWC生长的LB(Luria-Bertani)培养基、马铃薯葡萄糖(potato dextrose,PD)培养基、马铃薯葡萄糖再生(potato dextrose regeneration,rPD)培养基及原生质体转化所使用的试剂配方均参考文献的方法。
1.2生物信息学分析
测序得到的序列利用NCBI ORF finder寻找基因Pgr03902开放阅读框(ORF,https:∥WWW.nc-bi.nlm. nih. gov/orffinder/)并进行序列翻译。分别登录ProtParam(https://web. expasy. org/prot-param/)、SOPMA( https:∥npsa-prabi. ibcp. fr/cgi-bin/npsa_automat. pl?
page-npsa_sopma. html)、ProtScale( https:∥web. expasy. org/protparam/)、SignaIP-5.0(http:∥www. detaibio. com/tools/in-dex. php?r=signal-peptide% 2Findex)和Gen-Script(https:∥www. genscript. com/tools/psort),预测该基因编码蛋白的理化性质、二级结构、亲疏水性、信号肽和亚细胞定位。
1.3基因Pgr03902在大麦条纹病菌与大麦互作时的表达量分析
将大麦条纹病菌菌株QWC接种于PDA培养基中,于(25±1)℃的真菌培养箱里培养7d,备用;同时,选取粒大饱满的大麦品种‘Aleixs’种子90粒,用70%乙醇和5%次氯酸钠分别处理30s、5min,然后用灭菌超纯水冲洗多次后,将种子彻底晾干,备用。采用“三明治法”用培养7d的QWC菌饼处理‘Aleixs’种子,分别在处理后第0、7、14、18天收集种胚,设置3次重复。收集的样品在广州基迪奥生物科技有限公司进行转录组学分析,获得Pgr03902基因表达情况。
1.4Pgr03902基因亚细胞定位载体的构建及遗传转化
1.4.1Pgr03902基因的PCR扩增
根据亚细胞定位载体PCAIVIBIA1300-35S-EGFP质粒上的多克隆位点及Pgr03902基因中CDS序列设计亚细胞定位引物EGFP-Pgr03902-F和EG-FP-Pgr03902-R(表1),以菌株QWC的cDNA为模板扩增Pgr03902全长序列。PCR反应体系与程序参照2×TransTaq HiFi PCR SuperMixⅡ聚合酶说明书(天根生化科技有限公司)。扩增产物用1%琼脂糖凝胶电泳检测,符合预期产物大小的条带用DNA胶回收试剂盒(天根生化科技有限公司)回收,与pMD19-T载体连接并转化大肠杆菌DH5a感受态细胞,筛选的阳性克隆由北京擎科生物科技有限公司完成测序,测序结果正确的菌液提取质粒备用。
1.4.2Pgr03902基因亚细胞定位载体的构建
大麦条纹病菌基因Pgr03902和PCAM-BIA1300-35S-EGFP载体质粒分别用Kpn1和Xba1双酶切并回收酶切产物,16℃恒温水浴过夜连接酶切产物。反应体系:Pgr03902 4uL,PCAM-BIA1300-35S-EGFP 1uL,Solution5uL。连接液转化大肠杆菌DH5a感受态细胞,通过亚细胞定位引物M13-R和Primer4(表1)对菌液进行PCR扩增,提取阳性质粒并保存菌液,获得亚细胞定位载体PCAMBIA1300-35S-EGFP-Pgr03902.
1.4.3Pgr03902基因的遗传转化
采用热激法将亚细胞定位载体PCAM-BIA1300-35S-EGFP-Pgr03902導入到农杆菌GV3101中,取处于生长期的本氏烟叶片,利用注射法转染烟草,通过激光共聚焦显微镜观察荧光信号检测Pgr03902在细胞内的表达位置。
1.5Pgr03902基因干扰载体的构建及遗传转化
1.5.1Pgr03902基因干扰片段的PCR扩增
根据载体质粒上的多克隆位点及Pgr03902基因中CDS全长序列设计Pgyr03902的干扰片段引物Pgr03902-Xho1-F/Pgr03902-HindⅢ-R和Pgr03902-Kpn1-F/Pgr03902-Bg/Ⅱ-R(表1),以菌株QWC的cDNA为模板扩增干扰片段Pgr03902-1和Pgr03902-2。PCR反应体系与程序以及载体构建方法同1.4.1。
1.5.2Pgr03902基因干扰载体的构建
取干扰片段Pgr03902-1和含载体pSilent-1的质粒,分别进行Kpn1和BglⅡ双酶切(10×MBuffer),琼脂糖凝胶电泳检测双酶切产物,符合预期产物大小的条带切胶纯化后与载体过夜连接,用Pgr03902-1的引物,对筛选出的pSilent-1-Pgr03902-1进行菌液PCR和双酶切验证;再取干扰片段Pgr03902-2和构建的pSilent-1- Pgr03902-1载体进行双酶切,方法同上,最终获得pSilent-1-Pgr03902干扰载体。
1.5.3Pgr03902基因干扰片段的遗传转化
使用酶解液(10mg/ml。溶壁酶+20mg/ml。纤维素酶R-10)裂解大麦条纹病菌菌株QWC菌丝细胞壁,制备新鲜的原生质体,再取pSilent-1-Pgr03902干扰载体质粒(1~5mg)与原生质体混合,室温孵育20min后逐滴加入PTC溶液(60%PEG4000,10mmol/L CaCl,10mmol/L Tris-HC1,pH7.5)胁迫,之后将该混合物倒入含潮霉素B(hy-gromycin B.Hyg B)的PDA培养基中培养,对菌落进行3代抗性筛选,至筛选出Pgr03902干扰菌株Pgr03902。
1.6干扰菌株的Hyg B鉴定及RT-qPCR检测
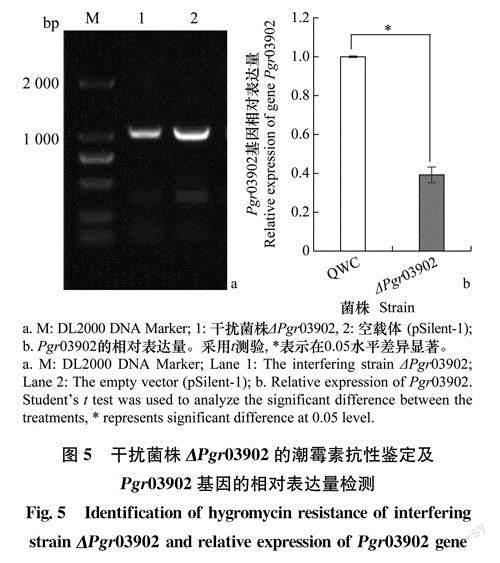
采用特异性引物Hyg B-F、Hyg B-R(表1)对干扰菌株△Pgr03902的Hyg B抗性基因进行PCR检测,对鉴定正确的干扰菌株提取RNA合成cD-NA,对干扰菌株进行实时荧光定量PCR分析(引物见表1)。获得干扰菌株Pgr03902基因的循环阈值(Ct),以大麦条纹病菌的Actin为内参基因,将野生菌株QWC的Pgr03902基因表达量设为1,计算得出各干扰菌株的基因相对表达量,干扰率=100%一表达量%,试验设置3次重复。
1.7基因功能初步分析
1.7.1营养生长分析
使用打孔器在野生型菌株QWC和干扰菌株菌落边缘各打取5 mm菌饼,分别接种于PDA培养基上,并置于22℃黑暗环境下培养,试验设置3次重复。在第7天时测量菌落直径并观察菌落形态,拍照。
1.7.2致病性测定
采用“三明治法”进行人工接种试验。将灭菌处理后的‘Aleixs’种子摆放在长满菌丝的PDA培养基上,用另一长满菌丝的PDA培养基的皿覆盖在种子上,密封后置于6℃黑暗条件下侵染种子21d。分别用野生型菌株QWC和干扰菌株△Pgr03902进行接种,以空白PDA培养基为对照,设置3次重复。然后将种子种植于长×宽×高=10cm×10cm×10cm的小花盆中,于人工气候室中光暗各12h交替(黑暗温度12℃和光照温度20℃)生长。参照刘海颖等的研究方法,于大麦三叶期对条纹病原菌处理后的大麦统计病情指数。
病情指数(DI)=∑(各级病株数×发病级值)/(最高病级值×调查总株数)×100。
利用Excel 2016对试验数据进行汇总和处理,通过单因素方差分析(One-way ANOVA)比较大麦植株接种野生型菌株QWC和干扰菌株APgr03902的差异,结果用Excel 2016作图。
2结果分析
2.1Pgr03902基因编码产物的生物信息学分析
Pgr03902基因全长348 bp,编码116个氨基酸,对该基因编码蛋白的理化性质的预测结果表明:该蛋白是酸性蛋白,等电点约为6.53,分子量29.25kD,组成氨基酸中甘氨酸(Gly)占比最多,为14.3%。Pgr03902编码蛋白的二级结构中无规则卷曲占比最多,为39.66%,其次是延伸链和a螺旋,占比分别为27.59%和23.28%,转角最少,为9.48%。该基因编码蛋白脂溶系数为26.15,分子式是C553 H862 N148 0165,S5,不稳定性指数为41.95,并且亲疏水性评分峰值主要在0以上,因此预测该蛋白为不稳定的疏水性蛋白。软件预测该蛋白无可识别的信号肽区域。亚细胞定位预测该蛋白存在于细胞膜。
2.2大麦条纹病菌效应蛋白编码基因Pgr03902表达特性分析
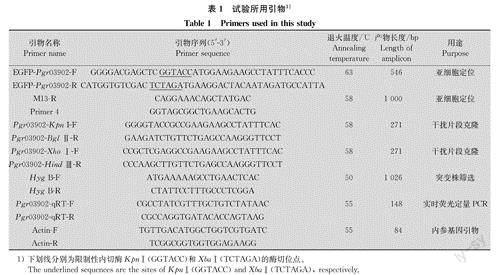
通过转录组学分析大麦条纹病菌侵染种子过程中Pgr03902的表达特性,结果表明,Pgr03902在接种后第0、7、14、18天时的基因表达量分别为113. 46、610. 59、715. 10、1193. 95 FPKM,较对照分别增加了5. 38、6.30、10. 52倍,随着侵染时间的延长,Pgr03902的表达量显著上调(图1),说明其可能在大麦条纹病菌侵染大麦及在大麦体内生长繁殖过程中发挥重要作用。
2.3Pgr03902基因亚细胞定位载体的构建与农杆菌转化
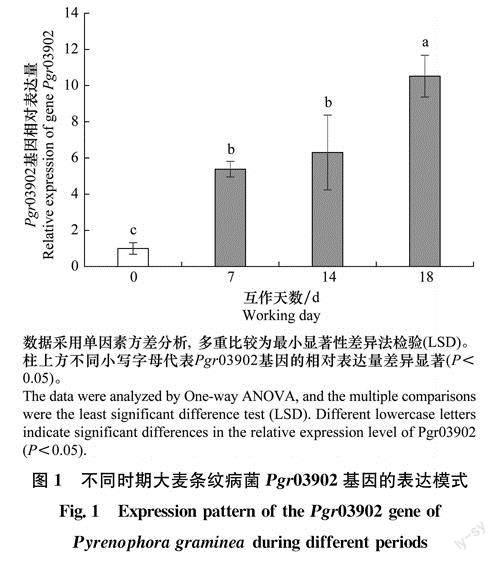
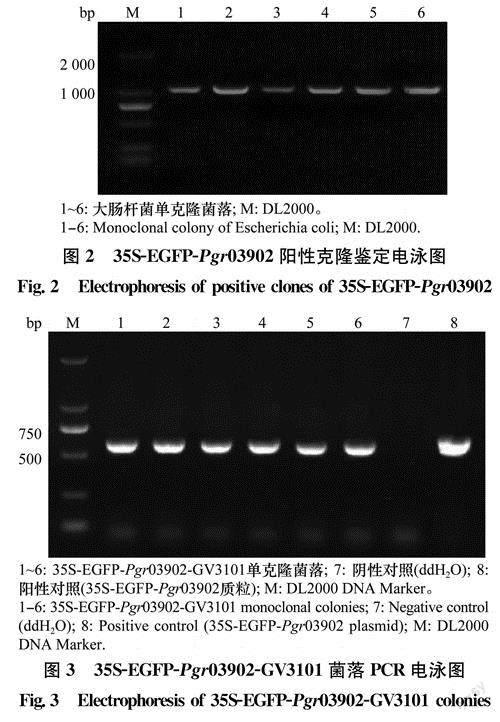
由Pgr03902基因亚细胞定位引物M13-R和Primer 4对大肠杆菌转化子进行Pgr03902基因的菌落PCR,发现部分转化子的扩增产物为1000bp(图2),表明成功构建Pgr03902基因的亞细胞定位载体EGFP-Pgr03902。最后,利用目的基因扩增引物EGFP-Pgr03902-F和EGFP-Pgr03902-R,对农杆菌转化子再进行Pgr03902基因PCR扩增验证,扩增片段大小为546bp(图3),进一步对转化子进行测序验证,结果表明Pgr03902基因已成功转化到农杆菌中。
2.4Pgr03902基因在本氏烟中的亚细胞定位
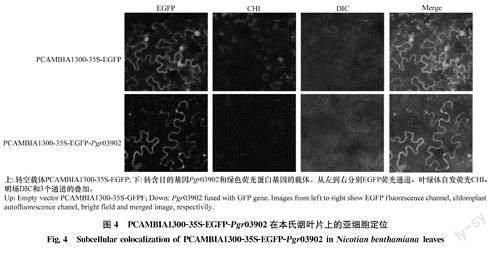
用含PCAMBIA1300-35S-EGFP-Pgr03902和空载体PCAMBIA1300-35S-EGFP的质粒分别转染烟草,荧光显微镜下均能观察到绿色荧光,亚细胞定位结果显示,Pgr03902在细胞核和细胞膜中均有表达(图4)。
2.5Pgr03902基因干扰菌株的筛选与验证
采用PCR从干扰菌株中获得Pgr03902基因的干扰片段长度为271bp,对干扰载体进行双酶切,得到的条带大小与Pgr03902干扰片段和pSilent-1载体一致,表明成功构建Pgr03902基因的干扰载体pSilent-1-Pgr03902。
本试验共筛选出1个干扰菌株,通过Hyg B的特异性引物进行PCR验证,获得1026bp的HygB基因(图5a)。RT-qPCR结果表明,与大麦条纹病菌野生型菌株QWC相比,干扰菌株△Pgr03902的Pgr03902基因相对表达量显著降低了60.79%(P<0.05)(图5b)。
2.6突变菌株的营养生长分析
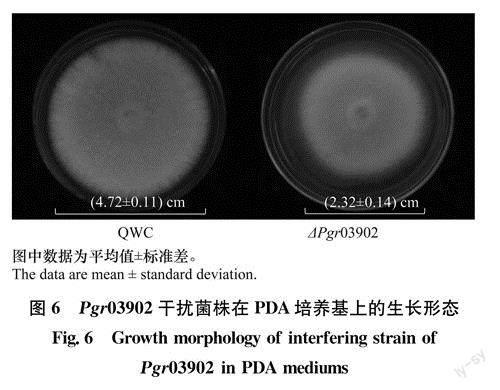
分别于PDA平板上接种野生型菌株QWC和干扰菌株△Pgr03902(图6),发现它们的菌落均为白色,平坦,边缘有微小的锯齿,但干扰菌株菌丝较野生型菌株稀疏。于接种第7天测量各菌株的菌落直径,干扰菌株的菌落直径为(2. 32±0.14)cm,小于野生型菌株[(4.72±0.11)cm],表明干扰菌株生长减缓。
2.7干扰菌株的致病性分析
分别用野生型菌株QWC和干扰菌株△Pgr03902浸染大麦‘Alexis7的种子,于大麦三叶期观察发病症状(图7a)并统计病情指数(图7b),结果显示,QWC和干扰菌株APgr03902浸染引起的病情指数分别为(51.53±4.23)和(37.86±3.36),APgr03902侵染后病情指数显著低于QWC,说明APgr03902的致病性明显减弱,Pgr03902基因可能参与调控大麦条纹病菌的致病性。
3结论与讨论
病原菌基因功能的研究结果有助于阐明其致病机理的遗传背景,也可以为防控植物病害提供新的策略和抗性育种信息。大量研究表明,病原菌致病相关基因在侵染寄主时表达量较高。本研究通过转录组学分析了Pgr03902基因在大麦条纹病菌与大麦互作时的表达量,发现Pgr03902基因的表达量在侵染过程中随侵染时间延长而升高,表明Pgr03902基因可能在大麦条纹病菌对大麦的致病过程中起到关键作用。研究表明,丝状真菌入侵寄主日寸,疏水蛋白参与了这一复杂的过程。疏水蛋白可以在亲水一疏水界面自我组装成膜,形成较稳定的多聚体膜,使丝状真菌菌丝避开水环境,诱导某些特化结构及毒素产生等。本研究通过生物信息学分析预测该基因编码的蛋白为不稳定的疏水性蛋白,说明该基因可能参与调控病原菌致病性。细胞核作为植物和动物细胞中的最重要的细胞器之一,在寄主的免疫反应过程中起着非常重要的作用,生物信息学预测该基因只位于细胞膜部位,但采用农杆菌介导的瞬时表达对基因Pgr03902进行亚细胞定位分析显示,其在细胞核和细胞膜上均有表达,两者结果不一致,有待进一步验证。
病原菌与寄主间能否建立亲和互作关系,往往是由于病原菌中能够干扰寄主正常生理代谢功能的致病基因发挥重要的作用,该基因会调控病原菌对寄主的吸附、感染、定殖等过程;有些致病基因的表达产物具有双重作用,一方面可以致毒,另一方面也可以充当激发子。目前,RNAi技术已经在多数真核生物病原菌基因功能验证方面有大量应用,利用RNAi技术能够有效地抑制基因表达,对基因的功能研究具有重要意义。夏杨等对胶孢炭疽菌Colletotrichum. gZoeosporioides
CgCDC2基因沉默突变株的PG、PL基因的表达进行分析,结果显示,突变体菌株的PG、PL基因表达量均显著下调,并且与蛋白定量分析结果一致,说明CgCDC2参与调控PG、PL基因的表达;苏初连等通过PEG介导法成功获得胶孢炭疽菌泛素结合酶基因CgUBC2的RNAi沉默突变体,研究结果显示该基因参与调控胶孢炭疽菌的致病过程;侯静静通过营养生长、毒素试验及致病性试验研究大麦条纹病菌致病性候选基因Pgrnior的功能,发现干扰菌株生长速度和致病力均明显低于野生型菌株,说明该基因参与调控大麦条纹病菌的致病性。在本研究中,基因Pgr03902的干扰突变显著影响了大麦条纹病菌的营养生长,并且干扰菌株侵染大麦后引起的发病率较QWC菌株降低,表明Pgr03902基因参与调控大麦条纹病菌致病性。
