壳聚糖/羧甲基纤维素/聚丙烯酸凝胶对含铅废水的吸附研究
2023-12-27胡泽康张惠灵梁俊杰叶子嫣
胡泽康,张惠灵,梁俊杰,叶子嫣
(武汉科技大学资源与环境工程学院,冶金矿产资源高效利用与造块湖北重点实验室,湖北武汉 430081)
近年来,随着现代工业技术的迅速发展,环境污染问题日益严重。大量工业废水排放至自然水体中,重金属污染正严重威胁着水资源的安全使用和人类健康,重金属污染问题已成为当今社会亟待解决的污染问题之一〔1-3〕。目前,污水中重金属离子的常见去除方法有化学沉淀法、离子交换法、膜分离法、氧化还原法、电化学法和吸附法等〔4-6〕。其中,化学沉淀法工艺简单,但该方法适用于高浓度废水,并且伴随着大量污泥产生,这些污泥会对环境造成二次污染;离子交换法适用于处理低浓度废水,该方法具有设备简单、离子交换树脂可再生等优势,但该方法无法一次性处理大量的废水,同时树脂材料重复利用工序非常繁琐;膜分离法在处理溶液中的重金属离子时具有较高的效率,但该方法所需成本较高,同时处理工艺流程繁琐;电化学法的优势在于可以针对某些特定的重金属离子定向地将其从污水中去除,但在处理过程中通常伴随着大量能耗,同时,电极使用寿命较短也是值得关注的问题〔3〕。与其他方法相比,吸附法由于其工作效率高、操作简便并且成本低等特点,成为去除水中污染物广泛使用的方法之一。水凝胶吸附剂亲水性良好,原料成本低,贴合工业、农业实际的生产环境,作为一种环境友好型吸附材料,水凝胶为解决水体中重金属污染提供了一种新思路。
近些年来,天然吸附剂广泛应用于重金属离子的去除,常见材料包括纤维素、壳聚糖、海藻酸钠等。这些材料普遍都具有来源丰富、简单易得、价格低廉、无毒无害、可降解等优点。但由以上材料合成的传统水凝胶具有溶胀性差、机械强度低、化学稳定性差、吸附能力较差的缺点。针对以上问题,应用自由基聚合法,将具有良好生物相容性与可降解性的壳聚糖(CTS)与羧甲基纤维素钠(CMC-Na)复合,同时用N,N’-亚甲基双丙烯酰胺进行交联,采用丙烯酸(AA)作为功能单体改性引入亲水基团以提高亲水性,得到壳聚糖/羧甲基纤维素钠/聚丙烯酸凝胶(CTS/CMC/PAA)。该复合凝胶中含有大量的羧基、羟基、氨基,具有良好的溶胀性、亲水性,在对重金属污染物的去除中具有优异的表现。
1 实验部分
1.1 仪器与试剂
实验仪器:分析天平BSA224S 型;集热式恒温加热搅拌器DF-101S 型;SHA-BA 水浴恒温振荡器;超纯水机PGD-10-AS 型;ZKF 系列电热真空干燥箱ZKF030 型;火焰原子吸收分光光度计NOVAA-350型,德国耶拿分析仪器;Sartorius 普及型pH 计PB-10型;场发射电子扫描显微镜JSM-7610F 型,日本电子;傅立叶红外光谱仪VERTEX70 型,德国布鲁克;X 射线粉末衍射仪Shimazu XRD-700 型,岛津。
实验试剂:丙烯酸(AA)、壳聚糖(CTS)、羧甲基纤维素钠(CMC-Na)、过硫酸钾、N,N’-亚甲基双丙烯酰胺(C7H10N2O2)、氢氧化钠、无水乙醇、Pb(NO3)2·2H2O,以上试剂均为分析纯,购自国药集团化学试剂有限公司。
1.2 CTS/CMC/PAA 水凝胶的合成
通过自由基聚合法制备双网络型CTS/CMC/PAA 水凝胶〔7〕。
1)将CTS、CMC-Na 分别溶解于质量分数1%的醋酸溶液和质量分数40%的乙醇水溶液中。完全溶解后,将两溶液混合于100 mL 容量瓶中,去离子水定容。将溶液转移至烧杯,用磁力搅拌器搅拌至澄清。
2)依次加入功能单体AA,交联剂N,N’-亚甲基双丙烯酰胺,在室温(25 ℃)环境下搅拌30 min,混合均匀后加入引发剂过硫酸钾,密封。在60 ℃恒温水浴中反应3 h。
3)将反应得到的产物依次置于无水乙醇、0.1 mol/L 的氢氧化钠溶液中清洗,重复3 次。最后用去离子水浸泡2 h,去除未形成水凝胶的游离单体和低聚物。放入60 ℃的烘箱中干燥直至恒重,密封保存备用。
1.3 CTS/CMC/PAA 水凝胶的吸附实验
分别将重金属离子初始质量浓度、吸附时间、pH 作为变量,其他条件保持一致,考察不同因素条件对水凝胶吸附重金属离子的影响。
将75 mL 一定质量浓度的Pb2+溶液和0.050 g 水凝胶粉末依次加入250 mL 锥形瓶中,设置转速为180 r/min,温度为25 ℃,使其在水浴恒温振荡器中反应若干小时后,吸取锥形瓶中上清液,测量上清液中Pb2+质量浓度〔8〕,根据式(1)和式(2)分别计算水凝胶对Pb2+的吸附效率及吸附容量〔9〕。
式中:η——水凝胶对Pb2+的吸附率;
c0、ce——吸附反应前、后溶液中Pb2+的质量浓度,mg/L;
V——Pb2+溶液的体积,L;
qe——吸附平衡时水凝胶对Pb2+的吸附容量,mg/g;
m0——水凝胶粉末质量,g。
1.4 CTS/CMC/PAA 水凝胶的重复利用性实验
精准称取0.050 g 干燥水凝胶粉末放入250 mL锥形瓶,加入75 mL 质量浓度为100 mg/L 的Pb2+溶液,在25 ℃、180 r/min 下恒温震荡1 h,吸取上清液测定上清液中Pb2+的质量浓度。过滤烧杯中残留物,收集水凝胶,将过滤好的水凝胶放入0.1、0.2、0.3 mol/L 的盐酸溶液中,在25 ℃、100 r/min 下恒温振荡进行60 min 解吸附,测定上清液中Pb2+的质量浓度。解吸后的水凝胶再重新进行吸附实验。重复上述过程5 次,进行3 次平行实验,测定水凝胶对Pb2+的吸附效率和吸附容量,评价其再生性能。
1.5 CTS/CMC/PAA 水凝胶的动态连续流实验
称取一定量的干凝胶粉末与石英砂作为填充材料,以石英砂—凝胶粉末—石英砂的填充方式填充处理柱。在25 ℃下,使用蠕动泵将20~100 mg/L 的Pb2+溶液自下而上地注入处理柱。每隔15 min 吸取上层清液,测定上层清液中Pb2+质量浓度。
1.6 测试与表征
1.6.1 CTS/CMC/PAA 水凝胶溶胀率的测试
质量法分析CTS/CMC/PAA 水凝胶在室温下的溶胀率。称取一定质量的干凝胶浸泡于100 mL 去离子水中溶胀,每隔15 min 取出溶胀的凝胶放于滤纸上去除凝胶表面多余水分,准确称量其质量,重复至其达到溶胀平衡即质量稳定;按照式(3)计算水凝胶的溶胀率。
式中:W——水凝胶溶胀率;
m——t时刻时,室温下凝胶吸水溶胀后的质量,g。
1.6.2 CTS/CMC/PAA 水凝胶吸附机理研究
吸附动力学研究。取5 个250 mL 锥形瓶,准确称取0.050 g 过200 目筛干燥水凝胶粉末放入锥形瓶,分别在5 个锥形瓶中加入75 mL 质量浓度为100 mg/L 的Pb2+溶液,25 ℃、180 r/min 恒温振荡反应。不同吸附时间下,吸取上清液测定溶液中Pb2+质量浓度。分别用准一级动力学模型〔式(3)〕、准二级动力学模型〔式(4)〕和颗粒扩散模型〔式(5)〕〔10〕进行动力学拟合。
式中:qt——吸附时间为t时水凝胶对Pb2+的吸附容量,mg/g;
t——吸附时间,min;
k1——准一级动力学模型的吸附速率常数,min-1;
k2——准二级动力学模型的吸附速率常数,g/(mg·min);
k3——内部扩散速率常数,mg/(g·min0.5);
C——与边界层厚度有关的参数,mg/g。
吸附热力学研究。精准称取15 份0.050 g 干燥水凝胶粉末,分3 组置于250 mL 的不同锥形瓶中,在每组5 个锥形瓶中分别加入75 mL 质量浓度在20~100 mg/L 的Pb2+溶液,以180 r/min 的速度分别在15、25、35 ℃下恒温振荡反应45 min。提取上层清液后测定Pb2+质量浓度。按照式(7)、式(8)〔11〕拟合Langmuir 模型和Freundlich 模型以研究CTS/CMC/PAA 水凝胶对Pb2+的吸附等温线。
式中:qmax——水凝胶对Pb2+的最大吸附容量,mg/g;
KL、KF——Langmuir 及Freundlich 吸附平衡常数;
nF——Freundlich 吸附指数,与吸附容量有关。
1.6.3 表征
将样品进行48 h 冷冻干燥处理后,磨碎,过筛。喷金处理后,以JSM-7610F 型场发射电子扫描显微镜观测样品表面形貌;以VERTEX70 型傅里叶红外光谱仪进行测试,扫描波数范围为4 000~500 cm-1;以Shimazu XRD-700 型X 射线粉末衍射仪进行XRD测试,扫描速率为5 (°)/min,衍射角(2θ)为10°~90°;以Malvern Nano ZS90 型纳米粒度电位仪对材料表面电位进行测试。
2 结果与讨论
2.1 CTS/CMC/PAA 水凝胶的性能表征
2.1.1 SEM 分析
CTS/CMC/PAA 水凝胶溶胀前后的SEM 如图1所示。
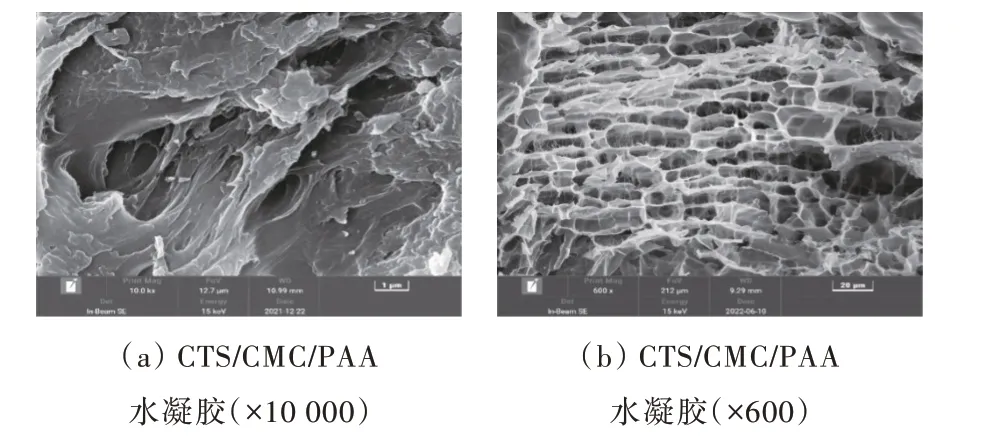
图1 CTS/CMC/PAA 水凝胶的SEMFig.1 SEM of CTS/CMC/PAA hydrogel
可以清楚地观察到图1(a)中,干凝胶内部呈现出明显的层状结构,交错纵横。图1(b)为干凝胶经过溶胀、冷冻干燥后600 倍的SEM,可以观察到出现了大量疏松大孔网络结构,内部具有不规则的洞通道,水凝胶的孔径尺寸范围在5~25 µm 之间,这种多孔结构有利于溶液中重金属离子的扩散,从而在短时间内与水凝胶的吸附位点相结合,实现水凝胶对重金属离子吸附能力的显著提升。
2.1.2 FT-IR 分析
图2 为CTS/CMC 水凝胶与CTS/CMC/PAA 水凝胶的FT-IR 光谱。

图2 CTS/CMC/PAA 和CTS/CMC 的FT-IR Fig.2 FT-IR of CTS/CMC/PAA and CTS/CMC
在CTS/CMC 水凝胶图谱(图2)中,3 416.99 cm-1处的强吸收峰为CTS 上N—H 伸缩振动与CTS、CMC-Na分子间的O—H 伸缩振动峰叠加所致〔12〕。C—H 和CTS上羧基的O—H 伸缩振动产生了2 925.84 cm-1处的特征峰〔13〕。CMC-Na 羧基的C= = O 伸缩振动产生两处特征峰,分别为1 644.04 cm-1和1 701.94 cm-1处的吸收峰。CMC-Na 的C—O—C 在1 158.87 cm-1处存在反对称峰。
在CTS/CMC/PAA 水凝胶图谱(图2)中,CTS/CMC/PAA水凝胶除了保留了CTS/CMC水凝胶上述位置的特征峰外,还出现了新的特征峰。其中3 474.90 cm-1及3 548.77 cm-1处出现的中强特征峰为O—H伸缩振动与N—H 伸缩振动在接枝反应后得到增强所致。同时,在CTS/CMC/PAA水凝胶的红外光谱中,1 626.07 cm-1处的羧基C= = O 伸缩振动峰与酰胺Ⅰ带重叠,这说明了AA与CTS 发生了接枝反应。在1 718.35 cm-1处的新特征峰为羰基伸缩振动峰,这说明AA 与CMC-Na 发生了接枝反应。
2.1.3 XRD 分析
CTS/CMC/PAA 水凝胶吸附Pb2+前后的XRD 如图3 所示。
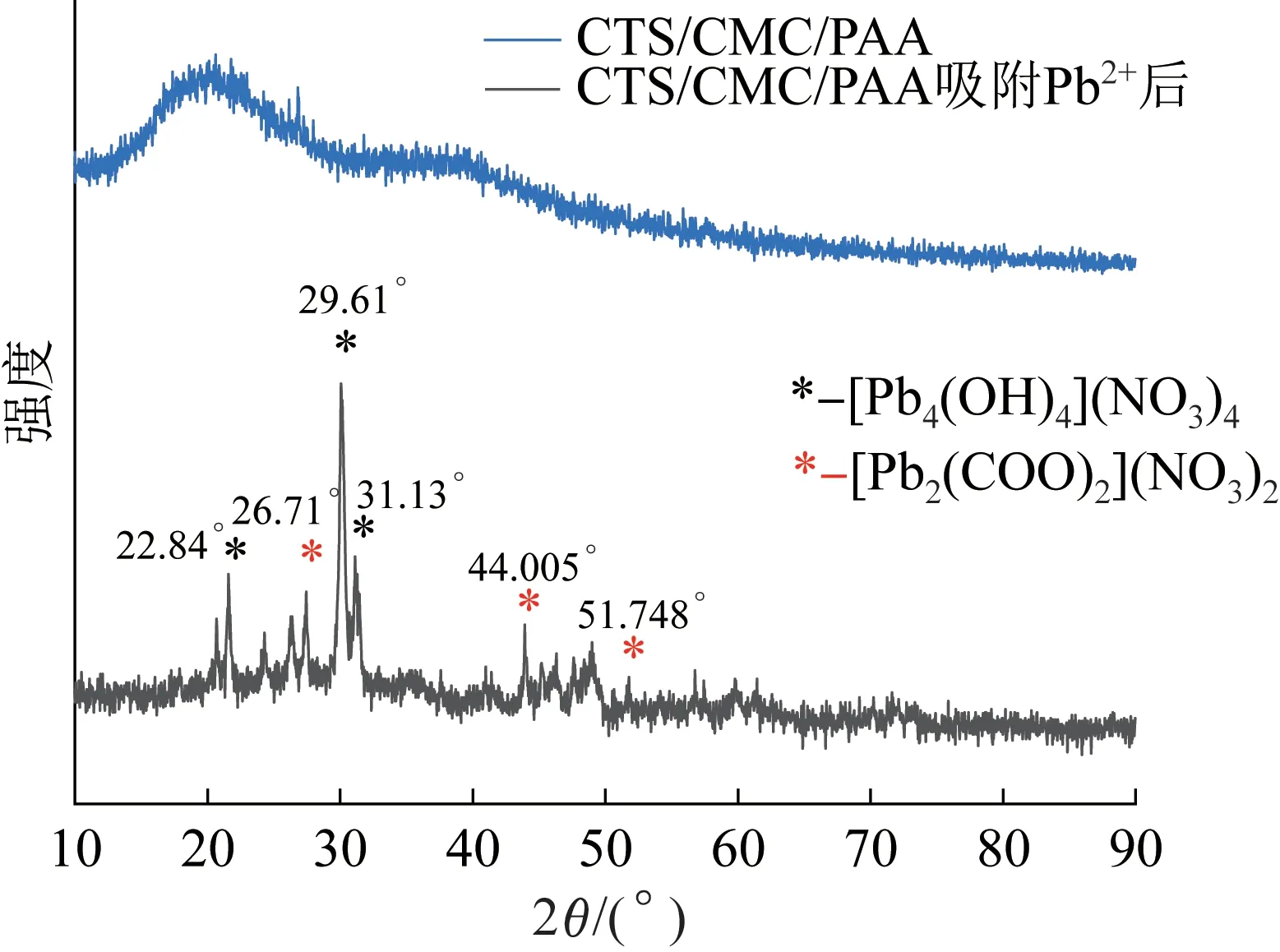
图3 CTS/CMC/PAA 吸附Pb2+前后XRDFig.3 XRD before and after adsorption of Pb2 + by CTS/CMC/PAA
由图3 可见,CTS/CMC/PAA 水凝胶吸附Pb2+前XRD 无明显的尖峰,这是因为CTS、CMC-Na 为合成水凝胶主要成分,无明显的晶体结构。吸附前,在22°位置出现了微弱的衍射峰,这是由于CMC 的半结晶性质所致〔13〕。CTS/CMC/PAA 水凝胶吸附Pb2+后,XRD 出现了明显的衍射峰,其中,在22.84°、29.61°、31.13°处出现的衍射峰分别对应(130)、(32-5)、(35-6)晶面,属于[Pb4(OH)4](NO3)4·2H2O 晶体。在26.71°、44.005°、51.748°处出现的衍射峰分别对应(300)、(500)、(511)晶面,属于[Pb2(COO)2](NO3)2晶体。这说明了CTS/CMC/PAA 水凝胶在吸附Pb2+的过程中,内部的活性基团—OH、—COO-与Pb2+发生了螯合作用,同时也说明了CTS/CMC/PAA 水凝胶吸附Pb2+的过程包含化学吸附。
2.1.4 Zeta 电位分析
所制备CTS/CMC/PAA 水凝胶的表面电位分析见图4。

图4 CTS/CMC/PAA 的Zeta 电位Fig.4 Zeta potential of CTS/CMC/PAA
如图4 所示,Zeta 电位为0 时对应的pH 为3.86,即当溶液pH<3.86 时,水凝胶表面官能团质子化,凝胶表面呈正电性,与带正电的Pb2+之间存在静电斥力,不利于凝胶对Pb2+的吸附。当溶液pH>3.86 时,水凝胶表面官能团去质子化,凝胶表面呈负电性,与Pb2+之间存在静电引力,随着pH 的增大,凝胶表面负电性增强,对Pb2+的去除率增强,这与下文中溶液pH 对凝胶吸附Pb2+性能结果一致。
2.1.5 溶胀性能分析
CTS/CMC/PAA 水凝胶随溶胀时间延长溶胀率变化情况见图5。

图5 CTS/CMC/PAA 的溶胀率Fig.5 Swelling rate of CTS/CMC/PAA
由图5知,CTS/CMC/PAA水凝胶的溶胀率在15 min内快速提高至46.34%,30 min 时提高至78.36%,45 min后逐渐达到饱和,此时CTS/CMC/PAA 水凝胶的溶胀率约为102.46%,说明其具有良好的亲水性能。这主要是因为CTS/CMC/PAA 水凝胶含有丰富的羧基、氨基和羟基亲水基团,使得其更容易吸引水分子与水亲和,同时,CTS/CMC/PAA 水凝胶具有疏松多孔的结构使得水分子在水凝胶内表面的扩散速率较快。
2.1.6 CTS/CMC/PAA 水凝胶吸附过程中TOC 的释放
吸附过程中,溶液中TOC 含量随吸附时间变化如图6 所示。

图6 吸附过程溶液中TOC 变化Fig.6 Change of TOC in solution during adsorption
由图6 知,随着吸附时间的增加,溶液中TOC 呈先增大后趋于平稳的趋势。当吸附时间为60 min时,溶液中TOC 质量浓度达到0.86 mg/L,而后趋于平稳,变化量较小。溶液中TOC 来源可能包括合成过程中未形成凝胶的游离单体和低聚物。随着吸附时间的增加,水凝胶不断溶胀,水凝胶中包含的游离单体和低聚物不断释放,直至溶液中TOC 达到最大值后趋于平稳。
2.2 CTS/CMC/PAA 水凝胶吸附Pb2+的研究
2.2.1 吸附时间对CTS/CMC/PAA 水凝胶吸附性能的影响
考察了不同吸附时间下,CTS/CMC/PAA 水凝胶在pH 为5 的溶液中对Pb2+的吸附率,见图7。

图7 吸附时间对CTS/CMC/PAA 吸附性能的影响Fig.7 Effect of adsorption time on adsorption performance of CTS/CMC/PAA
如图7 所示,随着吸附时间的增加,CTS/CMC/PAA 水凝胶对Pb2+吸附率先快速增大后趋于平稳。当吸附时间为45 min 时,CTS/CMC/PAA 水凝胶对Pb2+吸附率达到95.22%,45 min 后吸附率基本维持不变。这是因为吸附开始进行时,水凝胶迅速溶胀,且水凝胶表面存在大量吸附位点,重金属离子扩散至水凝胶表面后吸附阻力较小,随着吸附的进行,吸附位点逐渐被占据,吸附速率逐渐降低〔14〕。吸附进行到一定时间,重金属离子占据了水凝胶绝大部分的吸附位点,此时吸附率增长缓慢,表示到达了吸附平衡的临界点。
2.2.2 初始Pb2+质量浓度对CTS/CMC/PAA 水凝胶吸附性能的影响
考察了初始Pb2+质量浓度为20~120 mg/L 时,CTS/CMC/PAA 水凝胶对Pb2+吸附量和吸附率,见图8。
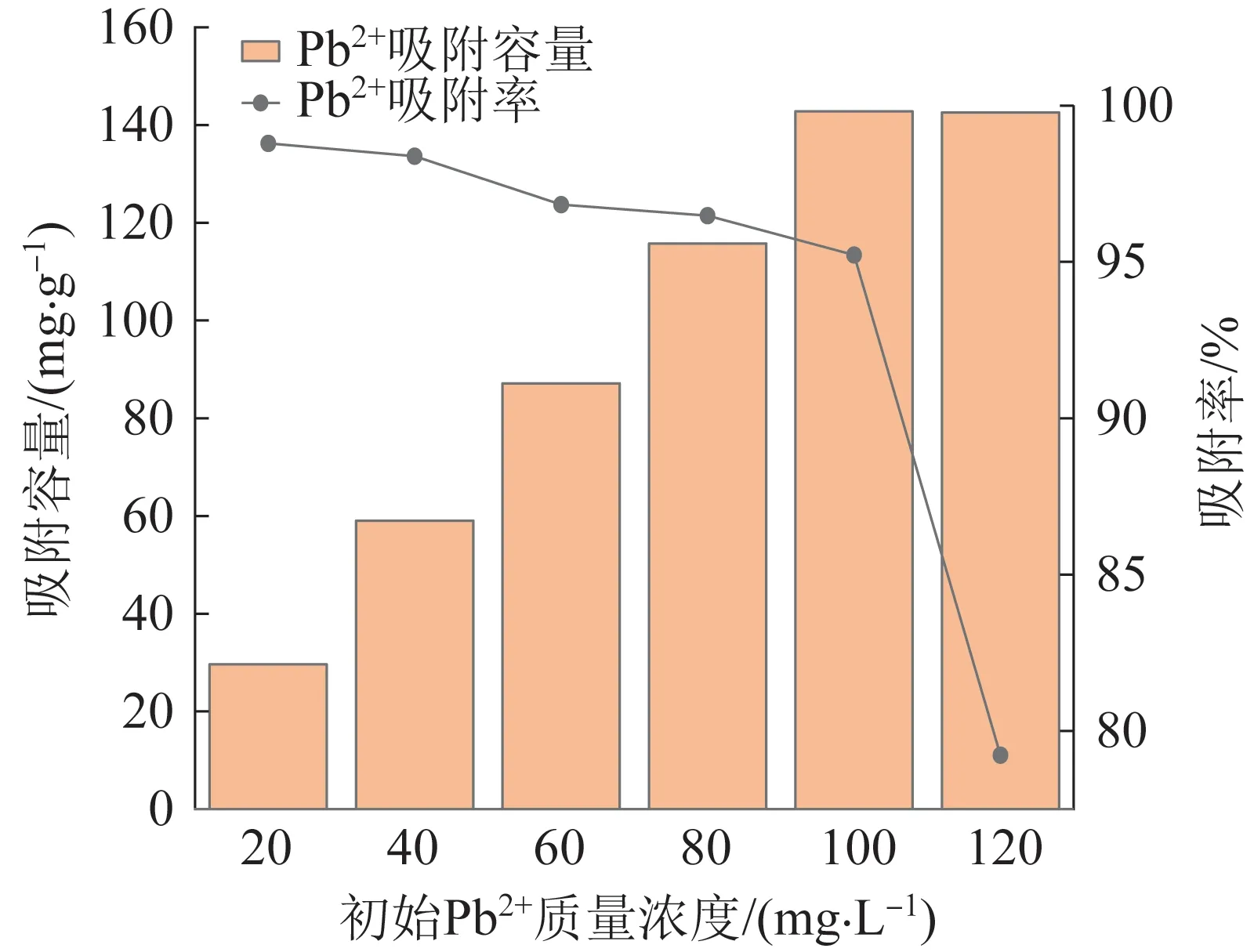
图8 初始Pb2+质量浓度对CTS/CMC/PAA 吸附性能的影响Fig.8 Effect of initial mass concentration of Pb2+ in solution on adsorption performance of CTS/CMC/PAA
如图8 所示,随着溶液中初始Pb2+质量浓度逐渐升高,CTS/CMC/PAA 水凝胶对Pb2+吸附量由最初的快速增加到最后吸附平衡时基本保持不变,而其对应的吸附率逐渐降低。当溶液初始Pb2+质量浓度为100 mg/L 时,凝胶对Pb2+吸附率和吸附容量分别达到95.22% 和142.83 mg/g。M. N. SAHMOUNE 等〔15〕研究表明,在一定浓度范围内,溶液中重金属离子的初始质量浓度增加对水凝胶的吸附存在促进作用,有利于重金属离子从溶液扩散至水凝胶的活性表面进行吸附。当水凝胶对Pb2+的吸附达到饱和时,凝胶对Pb2+吸附容量不再增加,致使吸附率降低。
2.2.3 溶液pH 对CTS/CMC/PAA 水凝胶吸附性能的影响
溶液的pH 影响着CTS/CMC/PAA 水凝胶的表面电性,因此很大程度上影响了水凝胶对Pb2+的吸附,初始Pb2+质量浓度为100 mg/L、吸附时间为45 min时,不同pH 下水凝胶对Pb2+的吸附率见图9。
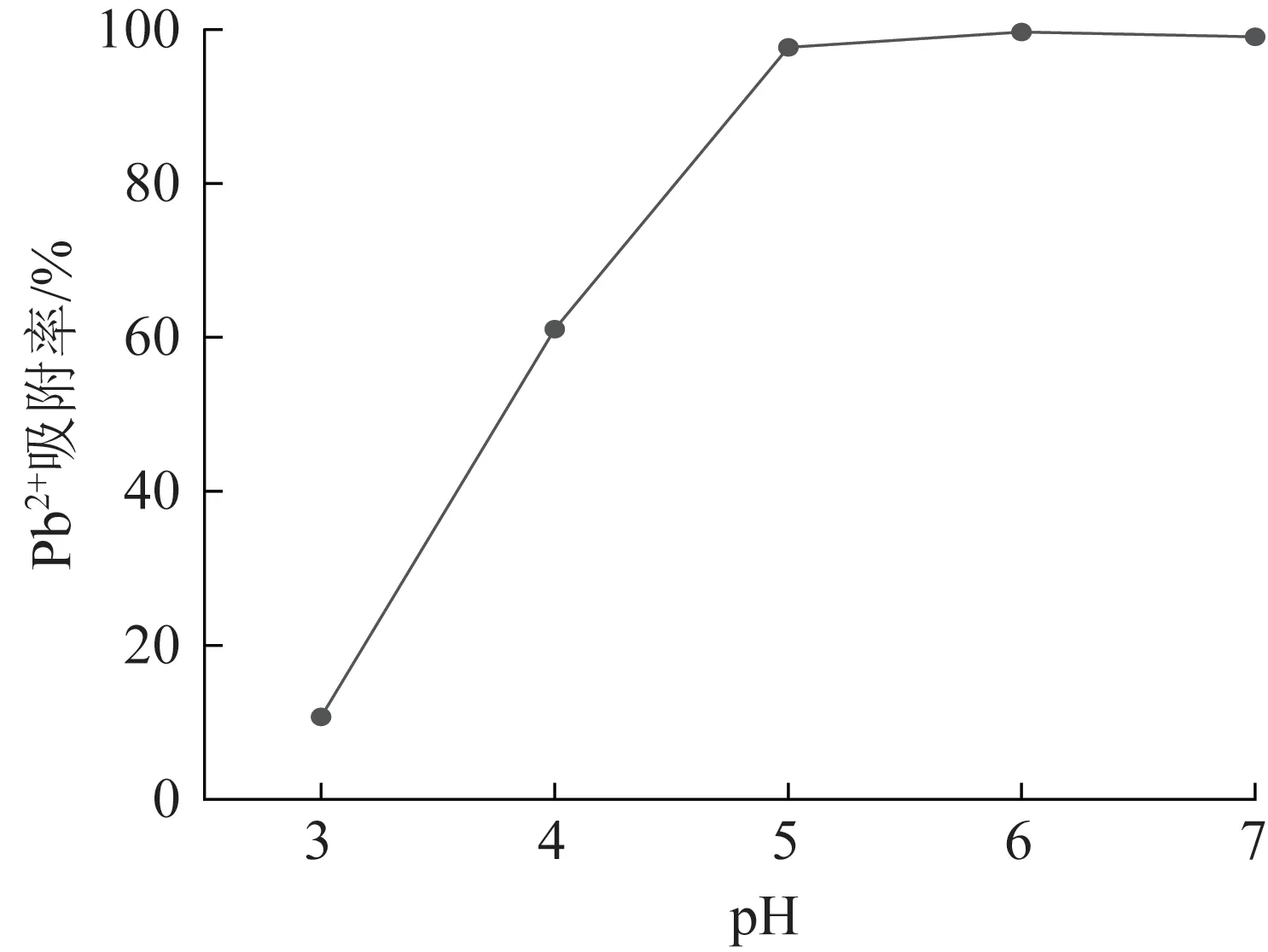
图9 pH 对CTS/CMC/PAA 吸附性能的影响Fig.9 Effect of pH on adsorption performance of CTS/CMC/PAA
如图9 所示,随着pH 逐渐升高,水凝胶对Pb2+的吸附率呈先快速上升后趋于平稳的趋势。当pH为5 时,水凝胶对Pb2+的吸附率达到95.22%。而当pH≥6 时,水凝胶对Pb2+的吸附率几乎达到100%。这是因为pH 较低时,溶液中的H+与CTS/CMC/PAA水凝胶所含的部分官能团质子化,导致螯合能力较强的氨基和羧基转变为—NH3+和—COOH,从而不利于水凝胶对Pb2+的吸附。此外,部分H+同样会占据于吸附位点上,导致Pb+的可吸附位点数量骤减。相反的,当溶液的pH 逐渐增大时,CTS/CMC/PAA 水凝胶中因H+质子化产生的NH3+和—COOH 等将去质子化转变成—NH2和—COO-,去质子化会显著增强水凝胶对重金属离子的螯合作用,从而促进水凝胶对Pb2+吸附率的增加〔16〕。
2.2.4 CTS/CMC/PAA 水凝胶对Pb2+的选择吸附性
控制pH、温度、离子强度等外界因素相同时,研究CTS/CMC/PAA 水凝胶对Cu2+、Pb2+、Cd2+的选择吸附性能,结果如图10 所示。

图10 CTS/CMC/PAA 水凝胶的选择吸附性Fig.10 Selective adsorption of CTS/CMC/PAA hydrogel
从图10 可以看出,对单独重金属离子溶液来说,CTS/CMC/PAA 水凝胶的吸附能力为Pb2+>Cu2+>Cd2+。对混合重金属离子溶液来说,CTS/CMC/PAA水凝胶的吸附能力为Pb2+>Cu2+>Cd2+。在上述实验条件下,影响凝胶吸附重金属离子的主要因素为金属离子自身的电负性。水凝胶对重金属吸附亲和力大小随重金属离子电负性增大而增大〔17〕。其中3 种重金属离子电负性大小为Pb2+(2.23)>Cu2+(1.9)>Cd2+(1.69)。电负性的不同影响了CTS/CMC/PAA 水凝胶对不同重金属离子的吸附能力,使得该水凝胶对Pb2+具有特殊选择性。
2.3 CTS/CMC/PAA 水凝胶吸附机理的研究
2.3.1 CTS/CMC/PAA 水凝胶对Pb2+的吸附动力学
分别利用准一级、准二级动力学扩散模型以及颗粒扩散模型对CTS/CMC/PAA 水凝胶吸附Pb2+的过程进行拟合,3 种模型的拟合结果详见图11,相关拟合参数见表1。

表1 准一级动力学模型、准二级动力学模型和颗粒扩散模型对Pb2+吸附的拟合参数Table 1 Fitting parameters of quasi first order kinetic model,quasi second order kinetic model and particle diffusion model for Pb2+adsorption

图11 CTS/CMC/PAA 水凝胶对Pb2+的吸附动力学模型Fig.11 Adsorption kinetics model of CTS/CMC/PAA hydrogel for Pb2 +
由图11 和表1 可以看到,准一级动力学模型、准二级动力学模型和颗粒扩散模型对Pb2+吸附的动力学相关系数R2分别为0.999 4、0.959 8、0.678 6。可见,CTS/CMC/PAA 水凝胶对Pb2+溶液的吸附过程能很好地拟合准一级吸附动力学模型,能较好地拟合准二级吸附动力学模型,不属于颗粒扩散模型。结合上文中Zeta 电位分析结果,当溶液pH>3.86 时,水凝胶对Pb2+存在静电引力作用。这说明CTS/CMC/PAA 水凝胶吸附Pb2+为表面的物理吸附和化学吸附共同作用,而颗粒内扩散不是控制吸附过程的主要步骤〔18〕。
2.3.2 CTS/CMC/PAA 水凝胶对Pb2+的吸附热力学
分别利用Langmuir 模型和Freundlich 模型对CTS/CMC/PAA 水凝胶吸附Pb2+的过程进行拟合并绘制吸附曲线,模型的拟合结果详见图12,相关拟合参数见表2。

表2 Freundlich 和Langmuir 模型对吸附Pb2+的拟合参数Table 2 Fitting parameters of Freundlich and Langmuir models for adsorption of Pb2+

图12 CTS/CMC/PAA 水凝胶吸附Pb2+的等温吸附模型Fig.12 Isothermal adsorption models of Pb2+ adsorption by CTS/CMC/PAA hydrogel
由图12 可以看出,Langmuir 模型和Freundlich模型均可较好拟合CTS/CMC/PAA 水凝胶吸附Pb2+的过程,Langmuir 吸附等温式的拟合结果更优。但两种模型拟合方程的相关系数R2均大于0.95,这说明CTS/CMC/PAA 水凝胶对Pb2+的吸附过程并不局限于均匀的单分子层吸附,可能存在不均匀的多分子层吸附。
由表2 可见,Langmuir 模型拟合得出在25 ℃时CTS/CMC/PAA 水凝胶对Pb2+最大吸附量(141.206 mg/g)与实验所得最大吸附量(142.83 mg/g)相近。
与其他文献中所研究吸附剂相比,CTS/CMC/PAA 水凝胶对Pb2+具有较好的吸附能力,见表3。

表3 不同吸附剂对Pb2+吸附能力对比Table 3 Comparison of adsorption capacity of different adsorbents for Pb2+
2.4 水凝胶再生实验
对CTS/CMC/PAA 水凝胶重复利用性能进行了分析,结果见图13。
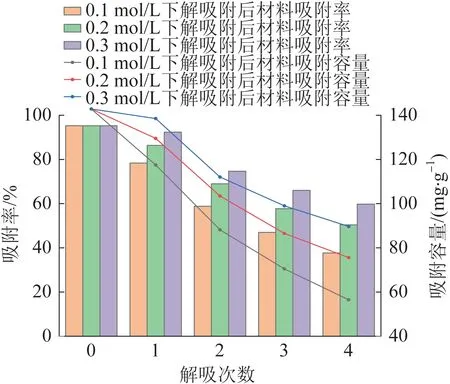
图13 CTS/CMC/PAA 水凝胶重复利用性能Fig.13 Reuse performance of CTS/CMC/PAA hydrogel
由图13 可知,随着解吸次数的增加,水凝胶对Pb2+吸附容量不断降低,但仍有一定程度的吸附性能。这是因为稀盐酸可通过离子交换作用将金属离子从吸附剂表面活性位点释放〔23〕。结果表明,通过投加一定浓度稀盐酸,可有效提升水凝胶再生性能,增加重复利用次数。改变解吸溶液浓度,对CTS/CMC/PAA 水凝胶重复利用性能有一定影响。在25 ℃下,随着盐酸浓度提升,再生水凝胶对Pb2+吸附量逐渐升高。与盐酸浓度为0.1 mol/L 相比,盐酸浓度为0.3 mol/L 时,水凝胶再生3 次后,水凝胶对Pb2+吸附率由46.98%提升至65.99%,并且对Pb2+的吸附量为98.98 mg/g。这是因为水溶液中大多数重金属离子以阳离子形式存在,因此吸附剂对金属离子的吸附过程属于阳离子吸附。在解吸过程中,加入盐酸并引入氢离子,从而与金属阳离子产生竞争。随着盐酸浓度的增加,吸附剂表面基团被氢离子或水合氢离子所占据,导致吸附剂表面的金属离子发生脱附,重新以阳离子的形式回到水溶液中。
2.5 CTS/CMC/PAA 水凝胶的连续流运行实验
进一步考察了CTS/CMC/PAA 水凝胶对Pb2+溶液的续流运行效果,结果见图14。
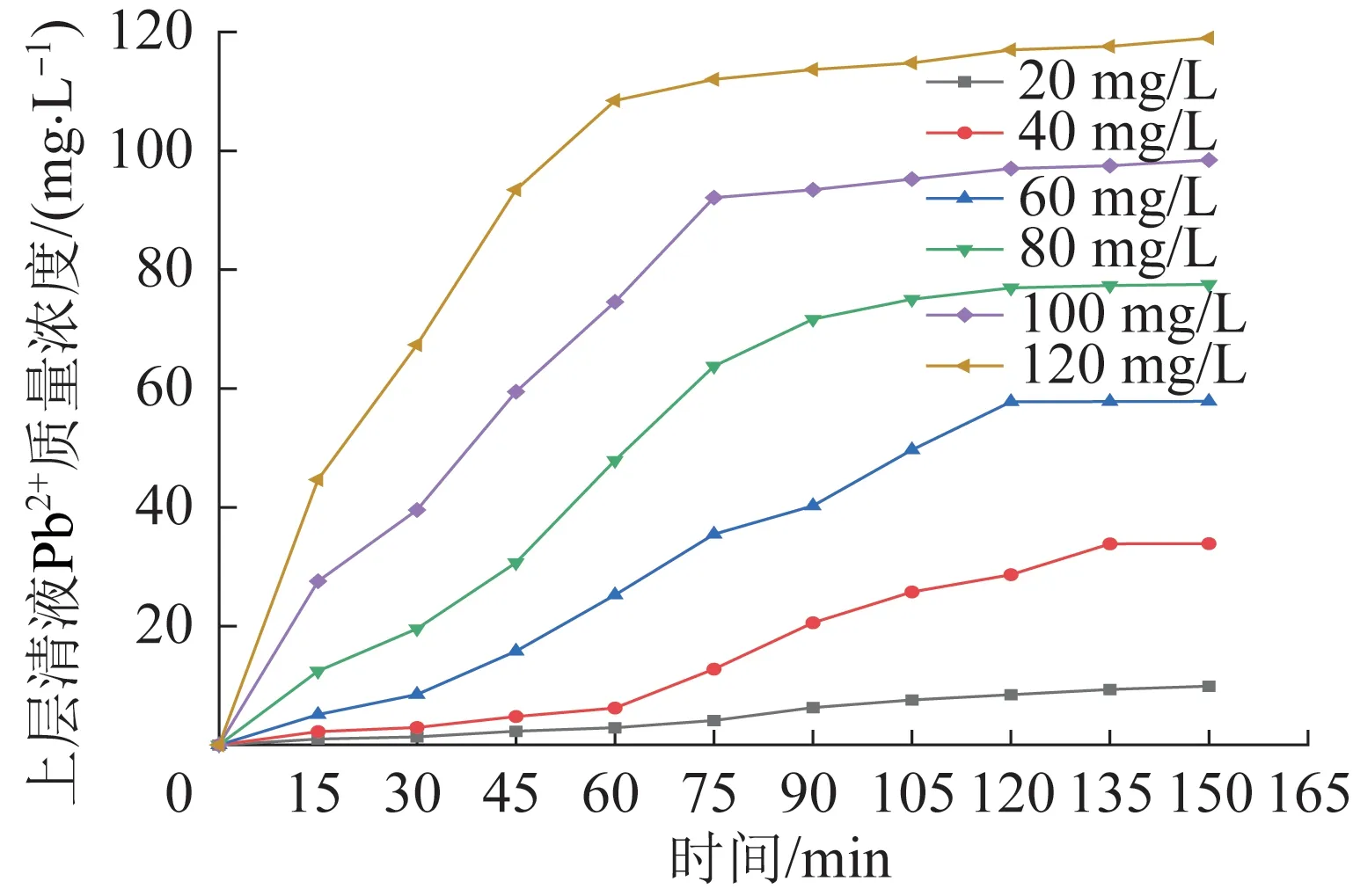
图14 初始Pb2+质量浓度的影响Fig.14 Effect of initial Pb2+ mass concentration
如图14 所示,随着Pb2+初始质量浓度逐渐升高,溶液中剩余Pb2+的质量浓度呈增加且表现类似的剩余趋势。此外,可以看到随着吸附时间的增加,上层清液中Pb2+质量浓度稳定点随着初始Pb2+质量浓度增加而向左偏移。Pb2+的去除速率表现为20 mg/L<40 mg/L<60 mg/L<80 mg/L<100 mg/L<120 mg/L。这是因为对Pb2+的去除需要水凝胶表面的活性位点参与,随着Pb2+质量浓度与吸附时间不断增加,凝胶表面活性位点逐渐被占据,导致吸附能力逐渐减弱。
3 结论
1)在常温条件下,以CTS 和CMC 作为接枝底物,在N,N’-亚甲基双丙烯酰胺交联作用和过硫酸钾引发剂作用下,选择AA 作为功能单体成功制备了CTS/CMC/PAA 水凝胶。
2)通过SEM、XRD 分析发现水凝胶具有丰富的三维网状结构,对Pb2+有良好的吸附性能。制备得到的CTS/CMC/PAA 水凝胶具有良好的溶胀性和再生性,吸附平衡时的溶胀率为102.46%,解吸3 次后,水凝胶对Pb2+吸附容量仍有98.98 mg/g。在连续流吸附中有较好的表现,对含Pb2+废水有较好的处理效果。
3)在室温25 ℃、pH=5、初始Pb+质量浓度为100 mg/L 条件下,CTS/CMC/PAA 水凝胶在吸附45 min 后对溶液中Pb2+吸附率和吸附容量分别达到95.22%和142.83 mg/g。
4)CTS/CMC/PAA 水凝胶吸附Pb2+的过程符合准一级动力学和准二级动力学模型,吸附等温线符合Langmuir 和Freundlich 等温线模型。拟合结果表明,CTS/CMC/PAA 水凝胶对Pb2+的吸附过程为多层物理、多层化学的混合过程。
