超声辅助酶解提取水蜜桃果核多酚工艺优化及抗氧化性研究
2023-12-27郭明遗王天鑫曾传涛吴华昌
郭明遗 邓 艳 王天鑫 曾传涛 吴华昌
(1. 四川旅游学院食品学院,四川 成都 610100;2. 四川旅游学院烹饪科学四川省高等学校重点实验室,四川 成都 610100)
水蜜桃(PrunuspersicaL.)为蔷薇科桃属植物,肉多汁甜,营养丰富,深受消费者喜爱[1]。中国桃子品类丰富,其果肉中含有丰富的抗氧化物如维生素、类胡萝卜素和酚类化合物[2],果核中富含具有抗炎、抗过敏以及抗菌等多种生物活性的木质素[3]、苦杏仁苷[4-5]、多酚及苦杏仁酶[6]等物质。研究表明,当人体受到外源性物质刺激时,细胞内会产生大量的活性氧簇(ROS),大量ROS积累与细胞内的有机物质发生链式反应[7],氧化损伤DNA和细胞组织[8],诱发基因突变、细胞凋亡等,调节代谢功能失调,继而引发多种相关疾病,如心血管疾病、慢性阻塞性肺疾病、慢性肾脏疾病、神经退行性疾病、癌症、中风、糖尿病等[9-11]。
植物多酚具有多种特殊的生理活性,作为天然植物源性抗氧化剂的多酚物质被广泛应用于预防和治疗老年性退行性神经疾病[12]、高血压[13]、心脏代谢紊乱[14-15]、免疫系统促进[16]、抗炎抑菌[17]、皮肤保护[18]等方面,被称为“第七类营养素”。采用超声协同纤维素酶提取法,能够加速细胞壁破碎速度[19],增加提取剂渗透作用,其优势在于提取温度低、提取时间短、得率高、耗能低[20],能够最大限度保留其生物活性[21]。而有关水蜜桃果核的研究相对较少,主要为果核木质化形成机理[22]、果肉粘核表型分析[23]以及裂核发病机制[24-26]研究,鲜有针对果核有益成分进行的特定提取开发研究。研究拟对超声辅助酶解提取水蜜桃果核多酚工艺进行优化,并分析其抗氧化性能,以期推动水蜜桃果核多酚在护肤品和保健品等具有高附加值产品中的应用,为其深度开发利用提供依据,助力特色产区的水蜜桃产业的升级发展。
1 材料和方法
1.1 材料与试剂
水蜜桃:产自四川省成都市龙泉驿区;
食品级纤维素酶:10万U/g,山东隆科特酶制剂有限公司;
七水合硫酸亚铁、过二硫酸钾(过硫酸钾)、三羟甲基氨基甲烷(Tris缓血酸胺)、焦性没食子酸、水杨酸、抗坏血酸:分析纯,成都金山化学试剂有限公司;
没食子酸标准品:≥99%,上海麦克林生化科技有限公司;
福林酚试剂、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)(≥95%)、1,1-二苯基-2-三硝基苯肼(DPPH)标准品(≥99%):福州飞净生物科技有限公司。
1.2 仪器与设备
电动粉碎机:FW177型,天津市泰斯特仪器有限公司;
紫外可见分光光度计:UA Blue Star A型,北京莱伯泰科仪器有限公司;
电热恒温水浴锅:DK-98-Ⅱ型,天津市泰斯特仪器有限公司;
恒温鼓风干燥箱:DHG-9240A型,上海恒一科学仪器有限公司;
超声波仪:SG9200T型,上海冠特超声仪器有限公司;
电子天平:LS220ASCS型,上海天美天平仪器有限公司。
1.3 试验方法
1.3.1 水蜜桃核多酚的提取 将水蜜桃果肉、果核分离,果核用20 000 r/min破壁机粉碎3 min,过40目筛,冷冻备用。准确称量0.5 g水蜜桃果核粉,按料液比(m果核粉∶V乙醇)1∶30 (g/mL)加入乙醇、纤维素酶,于超声波清洗机中进行超声辅助提取。
1.3.2 没食子酸标准曲线绘制 参照GB/T 8313—2018绘制标准曲线,得标准曲线方程为y=0.011 5x+0.021 2,R2=0.999 6。
1.3.3 提取液多酚含量测定 吸取1 mL提取液,用乙醇定容至10 mL,吸取1 mL定容后的溶液于比色管中,加入5 mL 10%福林酚试剂,摇匀,反应1 h,测定765 nm处吸光度,以没食子酸当量干重(mg/g)表示多酚含量,平行3次,按式(1)计算多酚提取量。
(1)
式中:
R——多酚提取量,mg/g;
C——没食子酸质量浓度,μg/mL;
V——提取液体积,mL;
N——稀释倍数;
m——取样量,g。
1.3.4 单因素试验 根据预试验结果,以超声功率240 W,乙醇体积分数60%,超声时间30 min,超声温度60 ℃,纤维素酶添加量5%为基础提取条件,分别考察超声功率(120,240,360,480,600 W)、乙醇体积分数(20%,40%,60%,80%,100%)、超声时间(10,20,30,40,50 min)、超声温度(40,50,60,70,80 ℃)、酶添加量(1%,3%,5%,7%,9%)对水蜜桃果核多酚提取量的影响。
1.3.5 响应面试验 通过单因素试验,根据响应面Box-Behnken设计,选择酶添加量、超声温度、乙醇体积分数和超声时间为自变量,水蜜桃果核多酚提取量为响应值,进行四因素三水平的响应面试验分析以确定多酚提取的最佳工艺条件。
1.3.6 抗氧化性分析
(1) ABTS自由基、DPPH自由基清除能力:参照GB/T 39100—2020。
(2) 羟自由基清除能力:参照石秀梅等[27]的方法。
(3) 超氧阴离子自由基清除能力:参照Wang等[28]的方法。
1.4 数据分析
通过Origin 2021软件进行数据处理;运用Design-Expert 11软件进行响应面试验分析和设计。每组试验平行3次,结果以平均值±标准差表示。
2 结果与分析
2.1 单因素试验
2.1.1 酶添加量对水蜜桃多酚提取量的影响 由图1可知,当酶添加量为1%~5%时,多酚提取量随酶添加量的增大而升高,当酶添加量为5%时达最大,原因是一定量的纤维素酶的破壁作用使细胞中的多酚溶出增大,而当酶添加量>5%时,多酚提取量开始下降,可能是因为过多的酶聚集阻塞了细胞壁作用通孔,使多酚溶出有所减少。综合考虑,选择酶添加量为3%,5%,7%进行响应面试验。
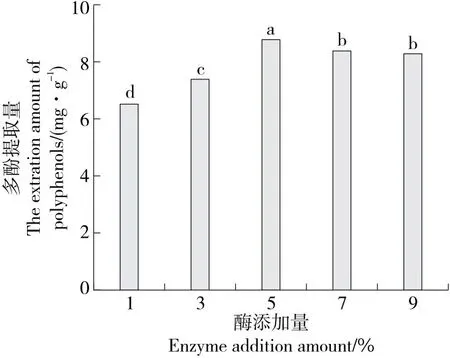
字母不同表示差异显著(P<0.05)
2.1.2 超声功率对水蜜桃多酚提取量的影响 由图2可知,当超声功率为120~240 W时,多酚提取量随超声功率的增大而增多,超声功率的增大,加大了水蜜桃细胞中振动的幅度,有利于多酚的溶出;而当超声功率>240 W时,多酚提取量开始下降,可能是过大的超声功率会在水中产生空化气泡,使超声波在水中传递作用减弱,多酚物质的溶出效率降低。综合考虑,选择超声功率为240 W。
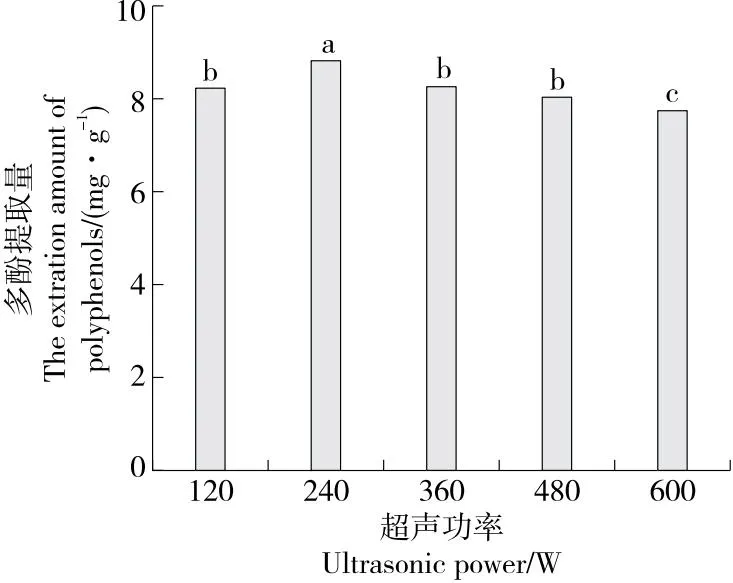
字母不同表示差异显著(P<0.05)
2.1.3 乙醇体积分数对水蜜桃多酚提取量的影响 由图3可知,当乙醇体积分数为20%,100%时,不利于多酚的提取;当乙醇体积分数为20%~40%时,果核多酚提取量明显增大,当乙醇体积分数为60%时,果核多酚提取量达最大,当乙醇体积分数>60%时,多酚提取量开始减少,可能是因为乙醇体积分数过大,其他易溶于高浓度乙醇的物质溶出,多酚溶出通道被占,使多酚溶出相对减少,影响了多酚物质的溶出。故选择乙醇体积分数为40%,60%,80%进行响应面试验。
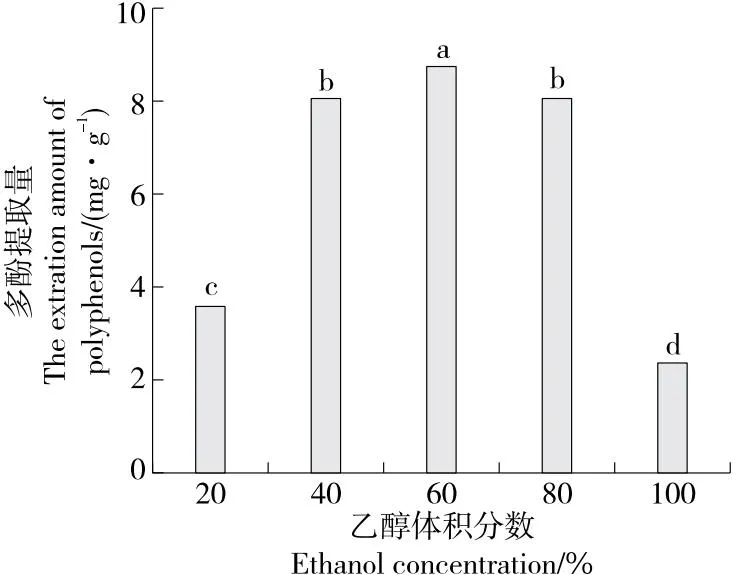
字母不同表示差异显著(P<0.05)
2.1.4 超声时间对水蜜桃多酚提取量的影响 由图4可知,当超声时间为10~30 min时,多酚提取量逐渐增加,当超声时间为30 min时多酚提取量达到峰值,随后开始缓慢下降,可能是因为随着超声时间的延长,细胞中液体黏度增大,多酚溶出阻力增大,超声波的空化作用可能使部分多酚分解。综合考察,选择超声时间为20,30,40 min进行后续试验。
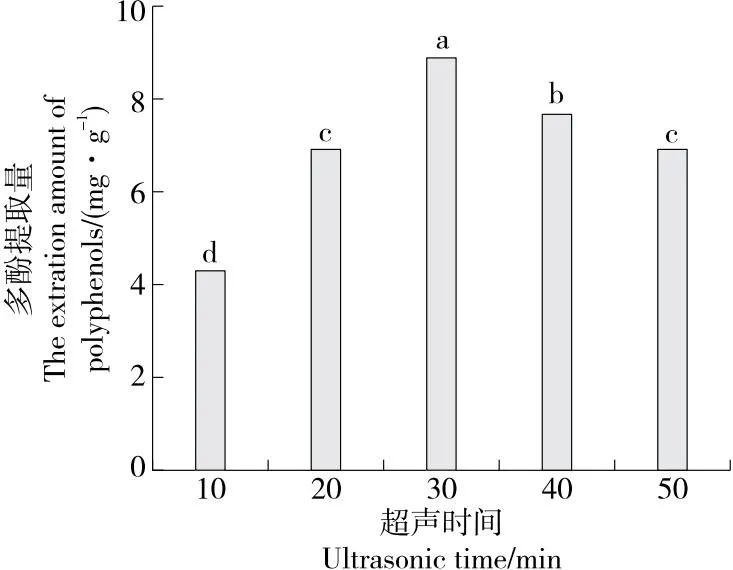
字母不同表示差异显著(P<0.05)
2.1.5 超声温度对水蜜桃多酚提取量的影响 由图5可知,当超声温度为40~60 ℃时,多酚提取量增加,是因为随着超声温度的升高,纤维素酶开始活化,使提取达到较好的效果;当超声温度为60 ℃时,多酚提取量达到最大,超过60 ℃后提取量开始下降,是因为酶在高温下会失活。综合考虑,选择超声温度为50,60,70 ℃进行响应面试验。
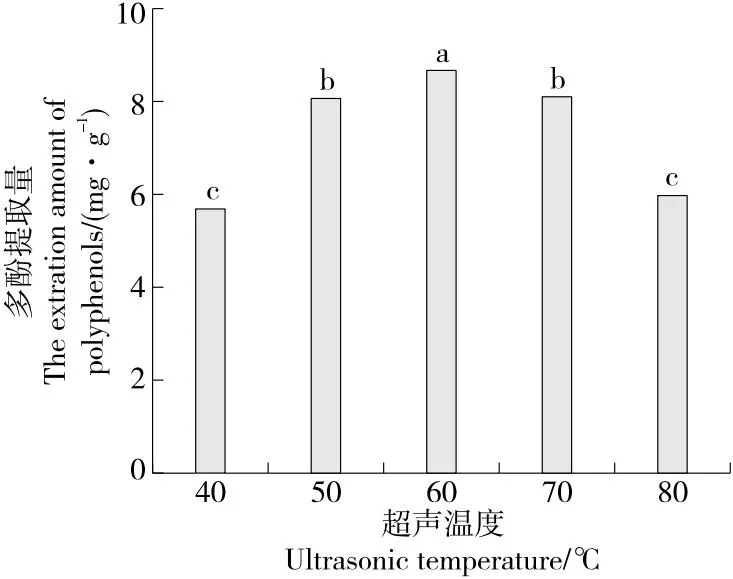
字母不同表示差异显著(P<0.05)
2.2 响应面试验
在单因素试验基础上,选择酶添加量、超声温度、乙醇体积分数和超声时间为自变量,以多酚提取率为响应值,利用Design-Expert 11软件进行响应面优化水蜜桃提取多酚工艺,各因素水平见表1,试验设计及结果见表2。
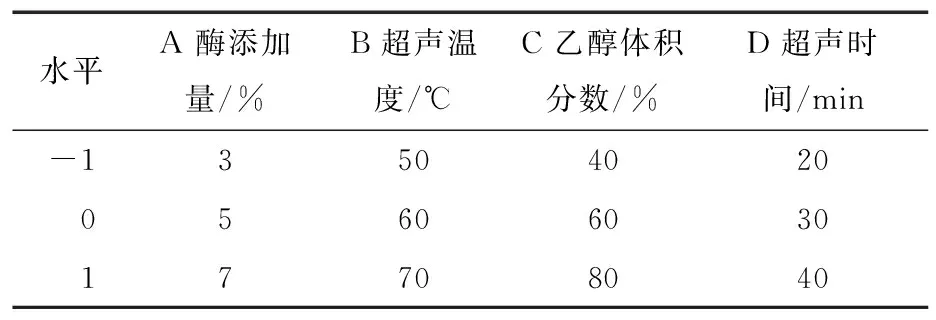
表1 响应面试验因素与水平
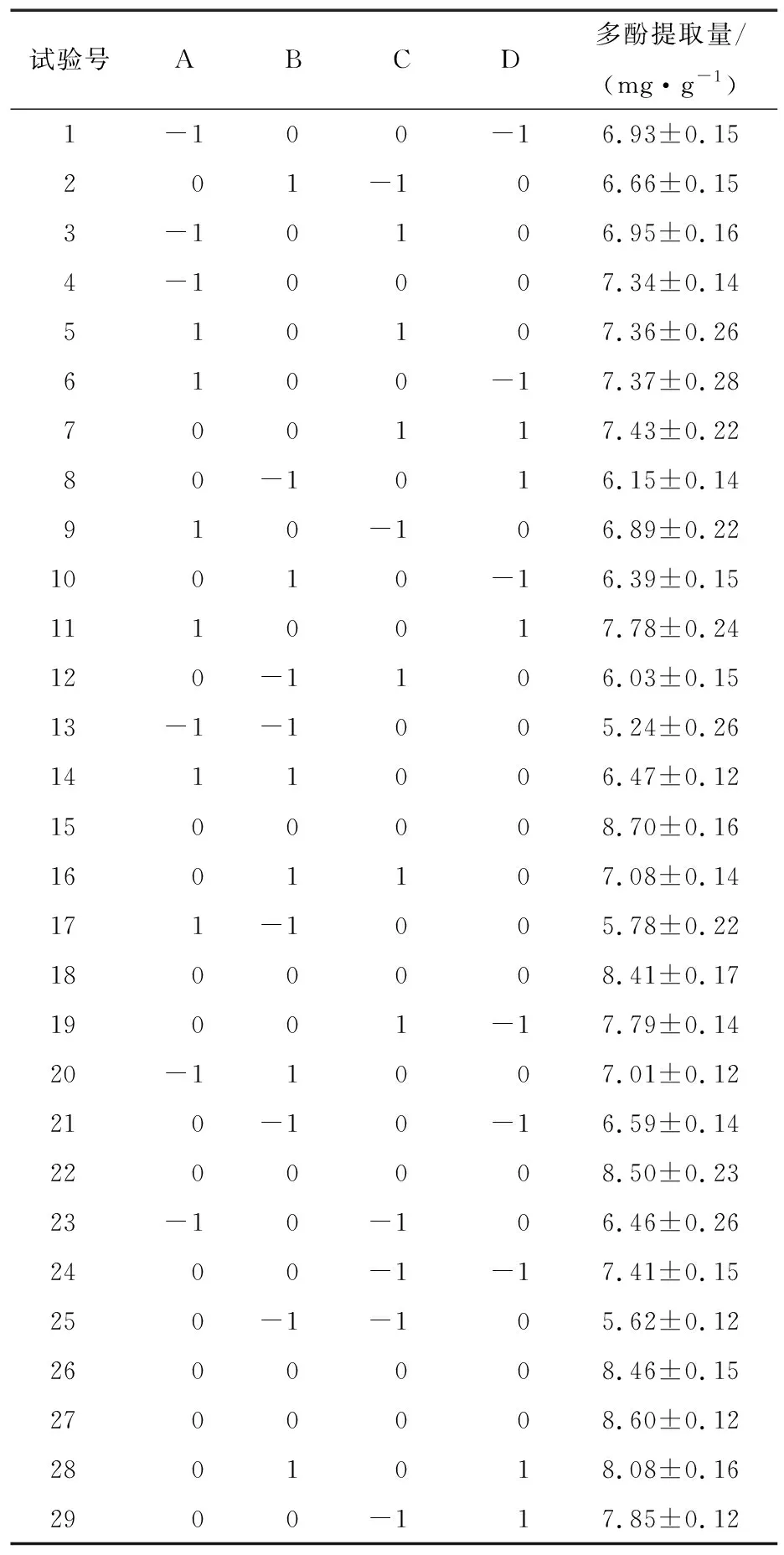
表2 响应面试验设计及结果
对试验数据进行回归方程拟合,得到多酚提取率的二次多项式回归模型方程为:
Y=8.54+0.14A+0.52B+0.14C+0.18D-0.27AB-5.33×10-3AC-7.05×10-4AD-3.00×10-5BC+0.53BD-0.20CD-0.93A2-1.49B2-0.69C2-0.24D2。
(2)
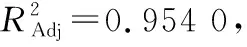
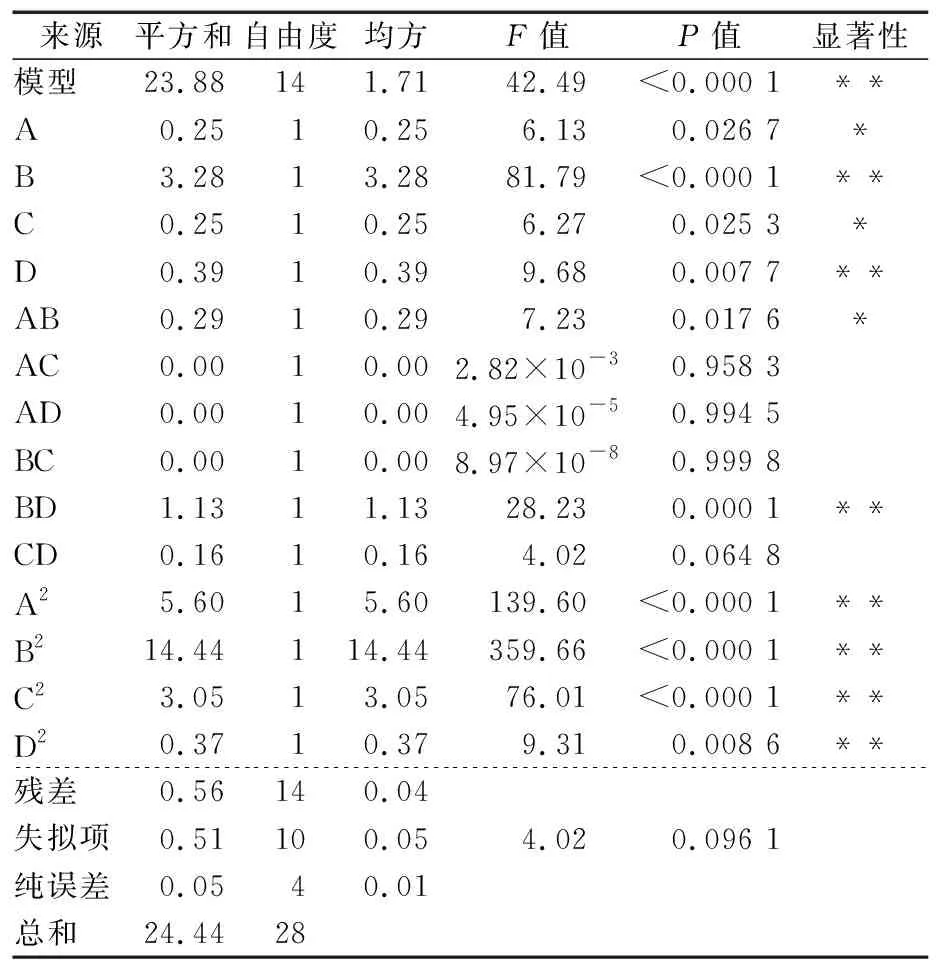
表3 方差分析†
由图6可知,酶添加量与超声温度、超声温度与超声时间的响应面图曲面陡峭,交互作用对多酚提取量结果影响显著,存在显著协同作用。
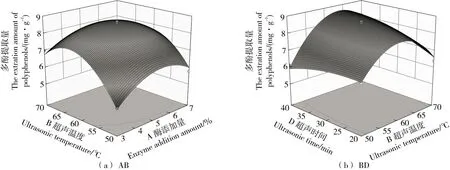
图6 因素交互作用对水蜜桃果核多酚提取量的影响
2.3 最佳工艺验证性试验
根据Design-Expert软件分析结果,果核多酚的最优工艺条件为酶添加量5.22%、超声温度62.98 ℃、乙醇体积分数60.04%、超声时间37.03 min,多酚提取量预测值为8.68 mg/g。考虑实际操作将提取参数优化为酶添加量5.2%、超声温度63 ℃、乙醇体积分数60%、超声时间37 min,此条件下果核多酚提取量为8.63 mg/g,与预测结果非常接近,可以认为该响应面法得到的预期优化提取条件具有较大的参考价值。
2.4 抗氧化活性分析
由图7~图10可知,在供试浓度范围内,水蜜桃果核多酚提取物对4种自由基清除率均在趋于平缓前逐渐升高,当质量浓度为0.25 mg/mL时,多酚提取物对ABTS自由基、DPPH自由基、羟自由基、超氧阴离子自由基清除率分别为75.22%,85.91%,44.72%,45.76%。根据拟合方程求出,果核多酚提取物对ABTS自由基、DPPH自由基、羟自由基、超氧阴离子自由基的半抑制浓度(IC50)分别为0.099,0.098,0.332,0.320 mg/mL。综上,果核多酚提取物对DPPH自由基、ABTS自由基均表现出相对较好的抗氧化活性,且在一定适用范围内对各自由基的清除率随提取物质量浓度的升高而升高。
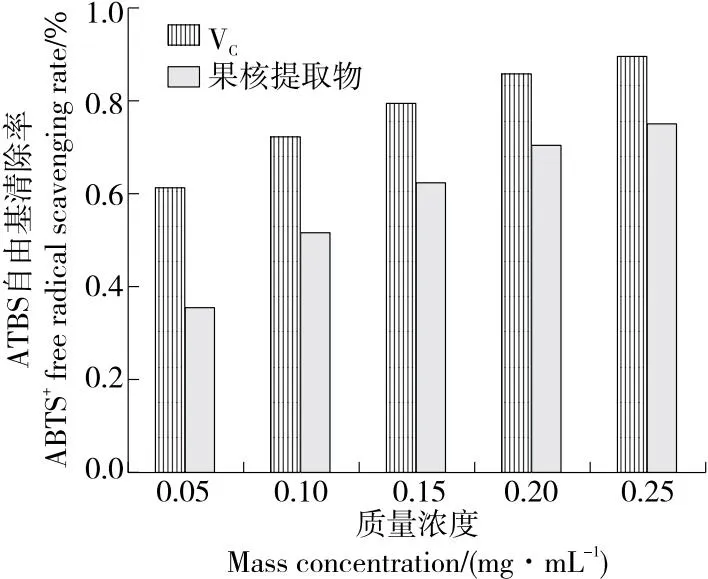
图7 水蜜桃果核多酚提取物ABTS自由基的清除作用
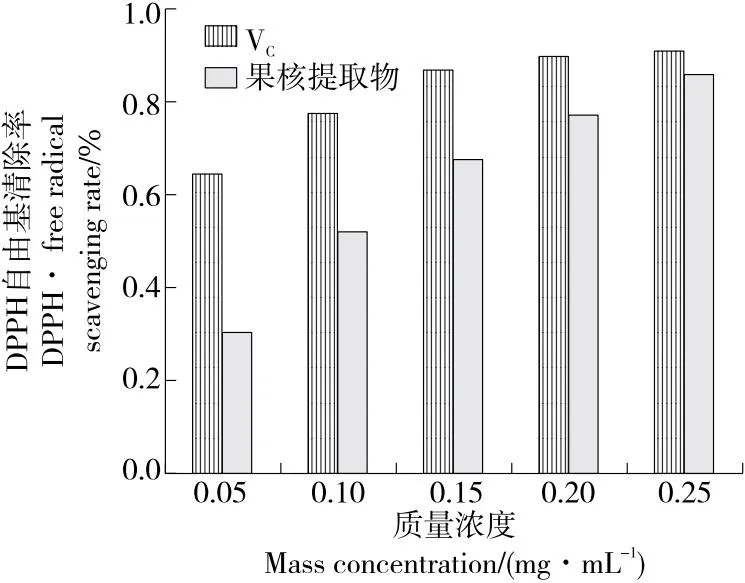
图8 水蜜桃果核多酚提取物DPPH自由基的清除作用
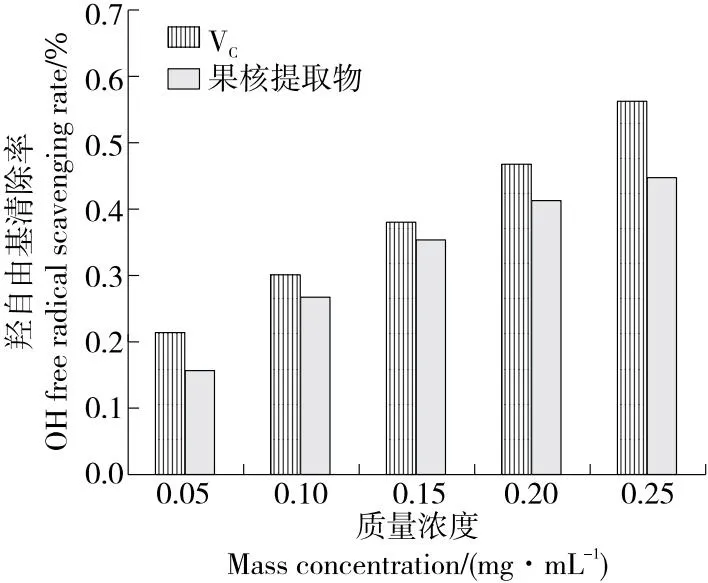
图9 水蜜桃果核多酚提取物羟自由基的清除作用
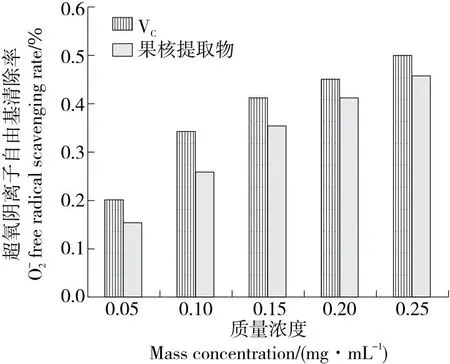
图10 水蜜桃果核多酚提取物超氧阴离子自由基的清除作用
3 结论
通过响应面法确定了超声辅助酶解提取水蜜桃果核多酚的最佳工艺参数为酶添加量5.2%,超声温度63 ℃,乙醇体积分数60%,超声时间37 min,此条件下水蜜桃果核多酚提取量可达8.63 mg/g。该果核多酚提取物对DPPH自由基、ABTS自由基均表现出相对较好的抗氧化活性,且半抑制质量浓度(IC50)分别可达到0.098,0.099 mg/mL,说明果核作为特色食品加工废弃物具备工业化机械生产循环利用的潜在路径及附加产值。后续将在更丰富化其生理活性和产品化制剂的制备以及产品性能的测试评估上进行深入研究。
