电针调控背根神经节巨噬细胞浸润改善紫杉醇诱导神经病理痛的机制研究
2023-12-27向宏春张虹李静龙漫蔡国伟
向宏春,张虹,李静,龙漫,李 熳,蔡国伟*
1 华中科技大学同济医学院附属协和医院,湖北 武汉 430022;2 湖北科技学院,湖北 咸宁 437100;3 华中科技大学同济医学院基础医学院,湖北 武汉 430030
化疗所致的周围神经病变(chemotherapy induced peripheral neuropathy,CIPN)是由于化疗药物[如紫杉醇(paclitaxel)和奥沙利铂等]产生的神经毒性引起的周围神经病变[1]。紫杉醇是治疗癌症(如乳腺癌、肺癌和卵巢癌等)的有效化疗药物,但是会导致CIPN,介导疼痛性神经病变,导致患者临床用药剂量减少,甚至停药[2-3]。目前已知的紫杉醇作用机制是稳定微管、阻断有丝分裂并促进细胞死亡[4]。有研究表明,紫杉醇可诱导背根神经节(dorsal root ganglion,DRG)单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)的表达增加,使巨噬细胞募集到DRG,巨噬细胞释放炎症因子[如白细胞介素-1β(interleukin-1β,IL-1β)等]介导紫杉醇诱导和维持外周痛觉超敏反应[5]。虽然紫杉醇对周围神经系统的毒性严重影响患者生活质量,但在临床上紫杉醇仍然是常用的化疗药物[6]。因此,改善使用紫杉醇患者的生活质量具有重要的意义。
有研究采用紫杉醇诱导的神经病理痛模型,电针双侧足三里可促进脾脏、脊髓背角α7烟碱型乙酰胆碱受体(α7 nicotinic acetylcholine receptor,α 7nAChR)表达,降低脾脏、脊髓背角肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)释放,从而改善模型小鼠的机械痛觉过敏[7]。本研究以紫杉醇诱导疼痛模型小鼠为研究对象,观察电针对小鼠DRG组织中MCP-1、IL-1β、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)表达和巨噬细胞浸润的影响,探讨电针对紫杉醇诱导周围神经病理痛的调控机制。
1 材料与方法
1.1 实验动物分组
选择健康雄性SPF级成年C57小鼠30只,体质量20~25 g,购自北京维通利华实验动物技术有限公司,实验动物生产许可证号:SCXK(京)2021-0006,合格证号:1100112211044731865。饲养条件为白光(8:00—20:00)和暗光(20:00—8:00)交替,室温(23±2)℃,湿度50%左右,普通小鼠饲料,自由饮水进食。采用随机数字表法将小鼠分为对照组、模型组、电针组,每组10只。本研究实验方案经华中科技大学实验动物伦理委员会批准[审批号:〔2019〕伦审字(S1866号)]。
1.2 主要试剂与仪器
紫杉醇(美国MedChemExpress公司);1∶1 000小鼠源IL-1β抗体(美国R&D Systems公司,生产批号:MAB5011);1∶1 000兔源iNOS抗体(英国Abcam公司,生产批号:178945),1∶10 000小鼠源β-actin抗体(美国Santa Cruz Biotechnology公司,产品批号:sc-47778);1∶200小鼠源CD68抗体(英国Abcam公司,生产批号:ab955);兔源MCP-1抗体(美国Proteintech公司,产品批号:26161-1-AP);Von Frey纤维丝测痛仪(美国IITC Life Science公司);18 mm×0.15 mm一次性无菌针灸针(苏州华佗医疗器械有限公司);冰冻切片机(德国徕卡公司);正置荧光显微镜(日本奥林巴斯公司);PVDF膜(美国Millipore公司),电泳仪、电泳槽、转膜槽(北京六一仪器厂);ECL显色液(上海雅酶生物医药科技有限公司,型号:Omni-ECL™)。
1.3 实验方法
1.3.1 造模方法 紫杉醇溶液按照说明书由5%二甲基亚砜(dimethyl sulfoxide,DMSO)、40%聚乙二醇300(polyethylene glycol 300,PEG300)、5% Tween 80和无菌0.9% NaCl溶液配制而成,注射用紫杉醇浓度为0.5 mg/mL。在第1、3、5、7天分别通过腹腔注射2 mg/kg紫杉醇进行造模,最终总注射剂量为8 mg/kg;对照组注射相同体积的溶媒。
1.3.2 治疗方法 电针治疗使用电针仪(华佗牌),取双侧足三里(ST 36),在4次紫杉醇腹腔注射结束后(第9天)开始电针治疗,频率15 Hz,强度1 mA,30 min/次,1次/d,共治疗7 d。电针组治疗时采用自制的固定装置束缚小鼠后再进行电针治疗,保证小鼠无痛苦挣扎。对照组、模型组和电针组采用同样的束缚固定方法。
1.3.3 观察指标
1.3.3.1 机械痛觉阈值 采用“up and down”法测定足底机械阈值(paw withdrawal mechanical threshold,PWMT)[8]。检测前,所有小鼠在痛行为学测试前适应测试环境30 min,然后测试基线机械痛觉阈值。具体如下:将Von Frey纤维丝垂直抵在小鼠后爪足底,使纤维弯曲5 s,小鼠后爪快速缩回或小鼠舔爪,即痛觉阳性行为。当观察到阳性反应行为时,使用下1个较低阈值的Von Frey纤维丝,当没有出现阳性反应时,使用前1个较高阈值的Von Frey纤维丝,反复进行5次测试并记录。5 min后再重复上述测试并记录,取2轮测试平均值为足底机械阈值。在造模第0天(即基线)、第8天造模结束后以及第11、13、15天电针治疗后3 h进行检测。
1.3.3.2 DRG组织病理学特征观察 采用苏木精和伊红(hematoxylin-eosin,HE)染色观察各组DRG组织的病理特征。具体如下:行为学检测完成后,通过腹腔注射2%戊巴比妥钠(0.3 mL/100 g)深度麻醉后进行取材。取3只麻醉后的小鼠,切开胸腔暴露心脏,经左心室灌注37 ℃生理盐水、4%多聚甲醛进行组织固定,冰上快速完整剥离腰段双侧DRG组织,一侧用于冰冻切片的免疫荧光染色,一侧用于石蜡切片的HE染色。把DRG组织放在10%福尔马林缓冲液中固定48 h,再进行常规石蜡包埋。石蜡包埋的组织切片厚度约为5 μm,HE染色,用显微镜在400倍视野下拍照并获取图片。
1.3.3.3 DRG组织CD68和MCP-1免疫阳性面积百分比检测 ① 采用4%多聚甲醛溶液固定腰段DRG组织8 h,分别用20%和30%蔗糖溶液在4 ℃冰箱梯度沉底。② 用OCT包埋DRG组织进行冰冻切片,厚度20 μm。③ 用0.01 mol/L磷酸盐缓冲液(phosphate-buffered saline,PBS)(pH 7.4)洗涤玻片3次,用驴血清配制的封闭液(10%)室温封闭1 h,然后用0.01 mol/L PBS洗涤3次,滴加抗体CD68(1∶200)和MCP-1(1∶200)后,在湿盒4 ℃孵育过夜。④ 用0.01 mol/L PBS洗涤玻片3次,滴加相应的荧光二抗,室温避光孵育1 h。⑤ 结束后滴加0.01 mol/L PBS(pH 7.4)冲洗,再滴加4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole dihydrochloride,DAPI)避光孵育5 min。⑥ 用0.01 mol/L PBS洗涤3次,滴加适量的抗荧光淬灭封裱剂,加上盖玻片封片。⑦ 荧光显微镜下用200倍视野观察和拍照获取图片。⑧ 采用ImageJ软件打开免疫荧光染色图片,以DAPI染色为参考,圈取DRG组织的轮廓,根据CD68和MCP-1免疫阳性信号,获得CD68和MCP-1免疫阳性面积百分比。
1.3.3.4 DRG组织CD68、MCP-1、iNOS和IL-1β蛋白表达水平检测 每组随机选取4只小鼠,深度麻醉后,完整分离腰段双侧第3~5节段DRG组织,分别用液氮冻存备用。① 各组取小鼠DRG组织,用RIPA强裂解液充分匀浆裂解后高速离心(12 000 r/min)取上清液。② BCA试剂盒测上清液浓度。③ 加入蛋白上样缓冲液,加热到95 ℃使蛋白变性。④ 对蛋白样品进行电泳分离,用300 mA恒流将蛋白转到PVDF膜。⑤ 室温条件下用5%脱脂牛奶封闭60 min,分别加入CD68、MCP-1、IL-1β、iNOS和β-actin一抗(1∶1 000)在4 ℃冰箱孵育过夜。⑥ 第2天用0.01 mol/L TBST洗涤5 min,共5次。加入辣根过氧化物酶(horseradish peroxidase,HRP)标记的二抗(1∶3 000)孵育1 h,0.01 M TBST洗涤5 min,共5次。⑦ 用增强型化学发光液(enhanced chemi-luminescence,ECL)对蛋白条带显色,暗室曝光成像。⑧ 采用ImageJ软件对蛋白条带进行灰度分析,以β-actin为内参蛋白,目的蛋白与内参蛋白的比值(%)即为目的蛋白表达水平。
1.3.3.5 DRG组织巨噬细胞超微结构观察 每组随机选取3只小鼠,深度麻醉后,经心脏灌注生理盐水,于冰上快速断头处死小鼠,完整分离腰段双侧第3~5节段DRG组织,立即放入电镜固定液(2.5%戊二醛)中室温固定2 h,在4 ℃冰箱保存。① 用0.1 mol/L PBS(pH 7.4)漂洗3次(每次15 min),0.1 mol/L PBS配制1%锇酸在室温(20 ℃)固定2 h,0.1 mol/L PBS漂洗3次,乙醇梯度脱水。② 脱水后的组织依次放入丙酮∶环氧树脂(2∶1)、丙酮∶环氧树脂(1∶1)和环氧树脂3种渗透剂,共渗透3次,在37 ℃温箱渗透,12 h/次。③ 加入包埋剂环氧树脂,在60 ℃恒温箱聚合48 h。④ 切片使用超薄切片机(德国徕卡公司,型号:UC7)进行切片,切片厚度为60~80 nm。⑤ 铀铅染色液双染色,室温染色约15 min,室温干燥过夜。⑥ 采用透射电子显微镜(日本日立公司,型号:HT7800)观察,在1 000或1 500倍视野下进行拍照并获取图片。
1.4 统计学方法
采用SPSS 26.0统计软件进行数据分析。计量资料服从正态分布以()表示,组内多时间点比较采用重复测量方差分析;组间比较采用单因素方差分析,两两比较采用Bonferroni检验。P<0.05为差异具有统计学意义。
2 结 果
2.1 3组治疗前后PWMT比较
与对照组同一时间点比较,模型组第8、11、13、15天机械痛觉阈值明显降低(P<0.05)。与模型组同一时间点比较,电针组第11、13、15天机械痛觉阈值明显升高,差异具有统计学意义(P<0.05)。见表1。
表1 3组治疗前后PWMT比较() gTable 1 Comparison of PWMT in three groups before and after treatment () g
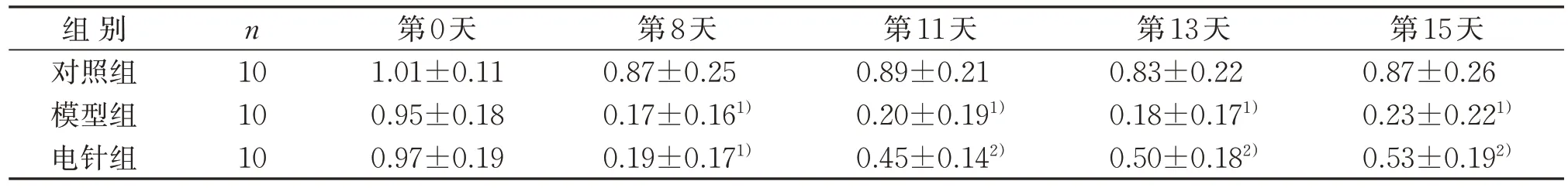
表1 3组治疗前后PWMT比较() gTable 1 Comparison of PWMT in three groups before and after treatment () g
注:与对照组同一时间点比较,1) P<0.05;与模型组同一时间点比较,2) P<0.05。Note: Compared with the control group at the same time, 1) P<0.05; compared with the model group at the same time, 2) P<0.05.
第15天0.87±0.26 0.23±0.221)0.53±0.192)组 别对照组模型组电针组n 10 10 10第0天1.01±0.11 0.95±0.18 0.97±0.19第8天0.87±0.25 0.17±0.161)0.19±0.171)第11天0.89±0.21 0.20±0.191)0.45±0.142)第13天0.83±0.22 0.18±0.171)0.50±0.182)
2.2 3组小鼠DRG组织病理学特征
HE染色图显示,对照组有少量的炎症细胞,形态为近圆形、颜色为蓝紫色;模型组炎症细胞数量增加,呈浸润聚集状态,形态为近圆形、颜色为蓝紫色;电针组聚集浸润状态的炎症细胞数量较少,形态为近圆形、颜色为蓝紫色。见图1。
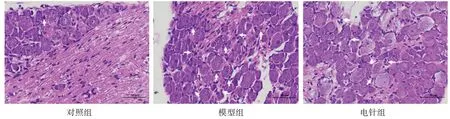
图1 3组DRG组织HE染色图(×400)Figure 1 HE staining of DRG tissue in three groups (×400)
2.3 3组DRG组织MCP-1、CD68免疫阳性面积百分比比较
与对照组比较,模型组DRG组织MCP-1、CD68免疫阳性面积百分比明显升高,差异具有统计学意义(P<0.05);与模型组比较,电针组DRG组织MCP-1、CD68免疫阳性面积百分比明显降低,差异具有统计学意义(P<0.05)。见图2、图3和表2。
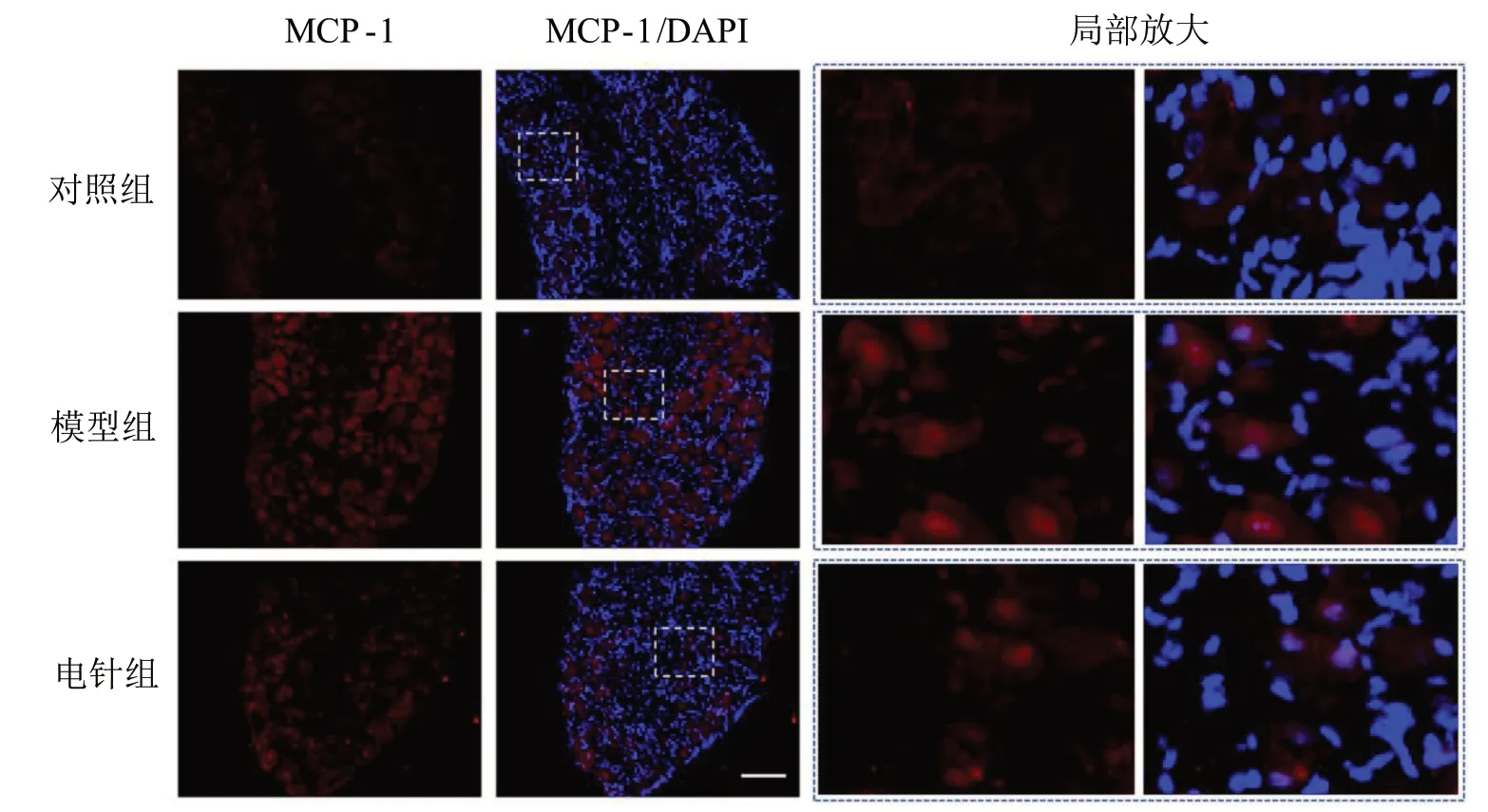
图2 3组DRG组织MCP-1免疫荧光染色图(×200)Figure 2 Immunofluorescence staining of MCP-1 in DRG tissues in three groups (×200)
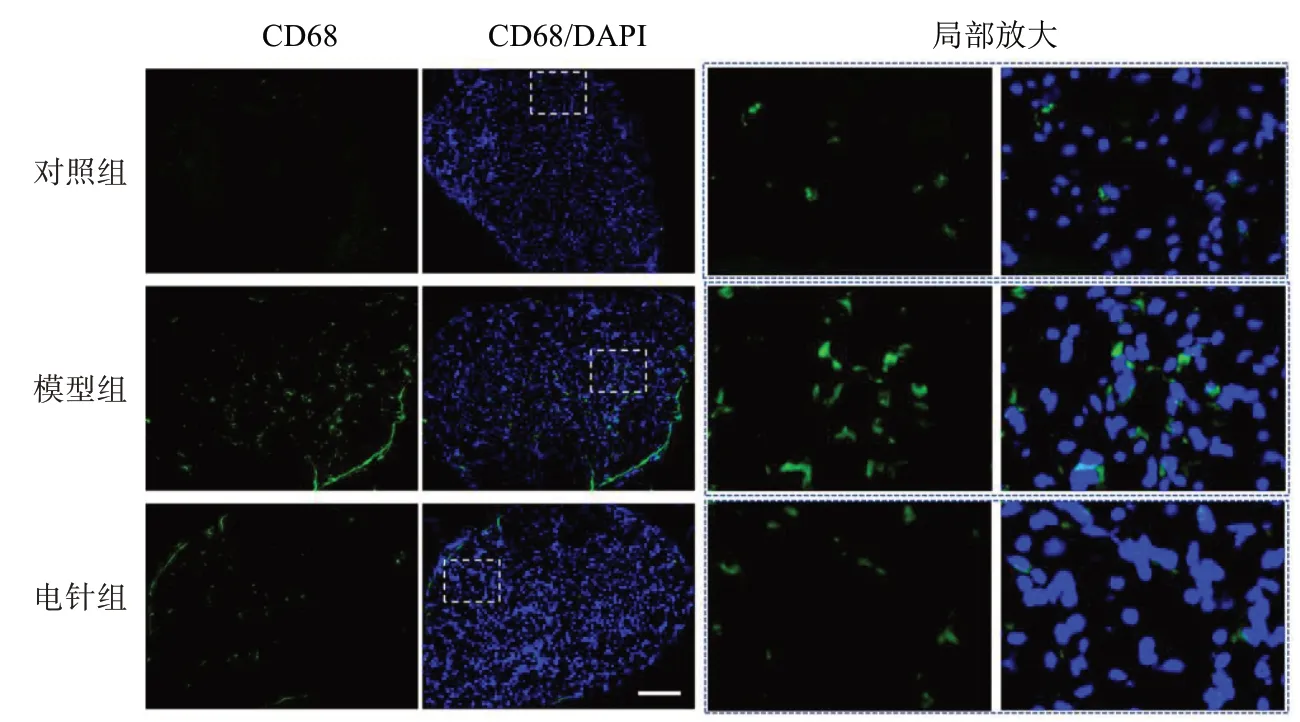
图3 3组DRG组织CD68免疫荧光染色图(×200)Figure 3 Immunofluorescence staining of CD68 in DRG tissues in three groups (×200)
表2 3组DRG组织MCP-1、CD68免疫阳性面积百分比比较() %Table 2 Comparison of MCP-1 and CD68 immunopositive areas of DRG tissues in three groups () %
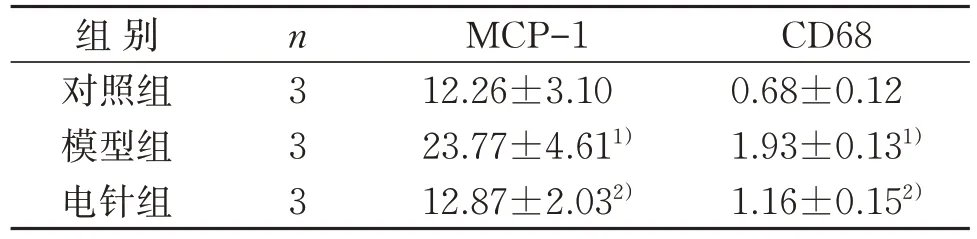
表2 3组DRG组织MCP-1、CD68免疫阳性面积百分比比较() %Table 2 Comparison of MCP-1 and CD68 immunopositive areas of DRG tissues in three groups () %
注:与对照组比较,1) P<0.05;与模型组比较,2) P<0.05。Note: Compared with the control group, 1) P<0.05; compared with the model group, 2) P<0.05.
CD68 0.68±0.12 1.93±0.131)1.16±0.152)组 别对照组模型组电针组n3 3 3 MCP-1 12.26±3.10 23.77±4.611)12.87±2.032)
2.4 3组DRG组织MCP-1、CD68、IL-1β和iNOS蛋白表达水平比较
与对照组比较,模型组DRG组织MCP-1、CD68、IL-1β和iNOS蛋白表达水平明显升高,差异具有统计学意义(P<0.05);与模型组比较,电针组DRG组织MCP-1、CD68、IL-1β和iNOS蛋白表达水平明显下降,差异具有统计学意义(P<0.05)。见图4和表3。
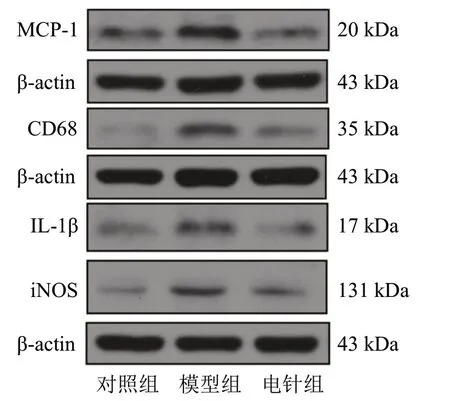
图4 3组DRG组织MCP-1、CD68、IL-1β和iNOS蛋白条带图Figure 4 Protein band figure of MCP-1, CD68, IL-1β and iNOS in DRG tissues in three groups
表3 3组DRG组织MCP-1、CD68、IL-1β和iNOS蛋白表达水平比较()Table 3 Comparison of protein expression level of MCP-1, CD68,IL-1β and iNOS of DRG tissues in three groups ()

表3 3组DRG组织MCP-1、CD68、IL-1β和iNOS蛋白表达水平比较()Table 3 Comparison of protein expression level of MCP-1, CD68,IL-1β and iNOS of DRG tissues in three groups ()
注:与对照组比较,1) P<0.05;与模型组比较,2) P<0.05。Note: Compared with the control group, 1) P<0.05; compared with the model group, 2) P<0.05.
iNOS 104.34±18.61 201.63±13.851)141.76±8.222)组 别对照组模型组电针组n4 4 4 MCP-1 101.54±2.81 189.76±23.621)80.61.15±20.872)CD68 101.67±19.35 234.98±48.751)119.15±4.792)IL-1β 103.18±13.28 183.41±23.391)94.37±13.762)
2.5 3组DRG组织巨噬细胞超微结构
透射电镜观察结果显示,对照组DRG组织巨噬细胞形态呈近圆形,有圆钝形突起;模型组DRG组织巨噬细胞形态呈扁平状,有伪足,胞体比对照组大;电针组DRG组织巨噬细胞的形态呈近圆形,胞体比对照组大。见图5。
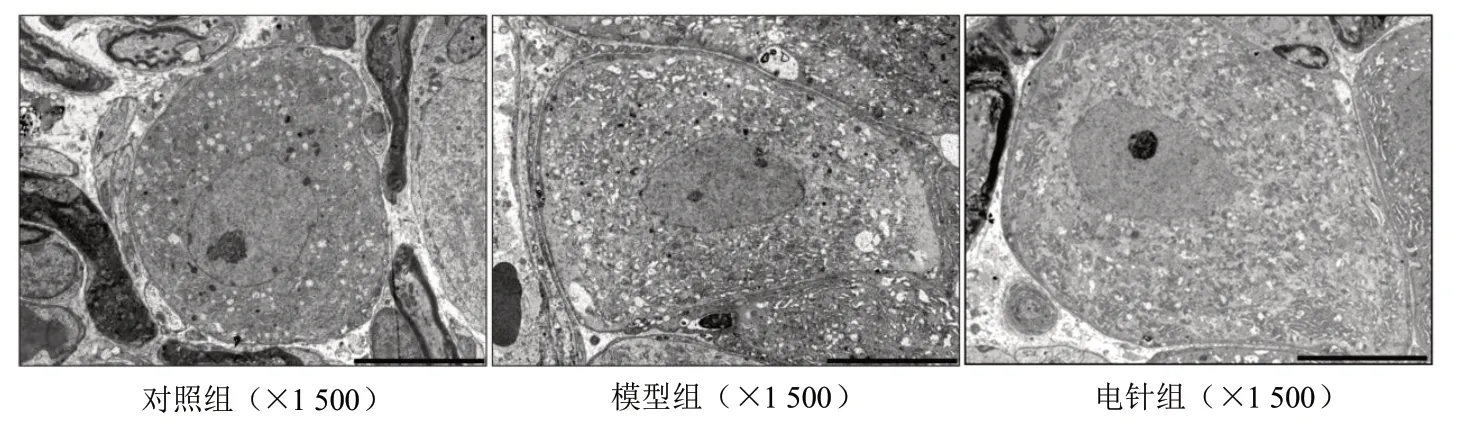
图5 3组DRG组织巨噬细胞超微结构比较Figure 5 Ultrastructure images of macrophages in DRG tissues in three groups
3 讨 论
3.1 电针“足三里”可改善紫杉醇诱导神经病理痛模型小鼠疼痛程度
化疗诱发的周围神经病变是化疗药常见的毒副作用[9]。本研究采用反复紫杉醇腹腔注射模型研究化疗药所致周围神经病变的机制,通过疼痛行为学观察模型动物的伤害性痛觉敏化现象。造模结束后(即第8天)的行为学结果显示,与对照组比较,模型组小鼠机械痛觉阈值明显下降,表明紫杉醇可诱导小鼠的伤害性痛觉敏化。本研究结果显示,与模型组同一时间点比较,电针组第11、13、15天机械痛觉阈值明显升高,提示电针足三里可改善紫杉醇诱导神经病理痛模型小鼠的疼痛行为。这可能与以下原因有关:中医学认为化疗药物所致疼痛病机主要为“不通则痛”。化疗药物虽可杀死部分肿瘤细胞,但也会影响正常机体气机运行,使邪留局部脏腑经络,引起局部疼痛。足三里穴为扶正祛邪之要穴,针刺足三里可以疏通经络,调理脏腑,理气行滞,调节机体回归阴阳平衡状态,从而减轻疼痛程度。
3.2 电针改善紫杉醇诱导的周围神经病理痛可能与调控DRG巨噬细胞浸润和炎症因子表达有关
本研究结果显示,在紫杉醇诱导的神经病理痛小鼠模型中DRG组织有大量巨噬细胞浸润,MCP-1、CD68、IL-1β和iNOS蛋白相对表达量明显升高;与模型组比较,电针组DRG组织巨噬细胞浸润明显减少,MCP-1、CD68、IL-1β和iNOS蛋白表达水平明显下降,提示电针改善紫杉醇诱导的周围神经病理痛可能与调控DRG巨噬细胞浸润和炎症因子表达有关。疼痛的发生与神经元的活动、炎症反应等诸多方面密切相关,巨噬细胞是神经病理痛反应的重要靶点,在紫杉醇诱导的神经病理痛模型中,巨噬细胞浸润DRG组织且释放大量炎症因子[10],导致周围传入感觉神经致敏,参与介导疼痛的发生和疼痛持续状态[11]。电针双侧足三里穴可抑制巨噬细胞在DRG组织浸润,抑制MCP-1、CD68、IL-1β和iNOS蛋白表达,从而改善模型小鼠的疼痛程度。这与ZHAO等[12]研究结果一致。此外,紫杉醇可使大量巨噬细胞浸润DRG,DRG中炎症因子IL-1β和TNF-α表达水平明显增加,通过RIP3/MLKL途径启动神经元坏死性凋亡,介导神经性疼痛[10]。MCP-1是一种趋化因子,在炎症条件下调控单核细胞/巨噬细胞的迁移和浸润,在神经性疼痛中起重要作用[13];炎症因子(如IL-1β、iNOS和IL-6)可介导伤害性神经元的兴奋性,参与疼痛的发生和维持[14]。电针足三里穴可抑制IL-1β、iNOS和IL-6等炎症因子的表达,使DRG组织交感神经-感觉神经耦合作用减弱,从而发挥抗炎镇痛作用[15]。这与本研究发现针刺足三里穴可通过抑制巨噬细胞浸润以及炎症因子表达,改善紫杉醇诱导神经病理痛的观点相似。
4 小 结
电针足三里穴治疗可有效改善紫杉醇诱导的疼痛小鼠模型的疼痛程度,其效应机制可能是通过抑制DRG中MCP-1表达,下调巨噬细胞浸润,减少IL-1β、iNOS和CD68等促炎因子分泌,从而发挥镇痛效应,但是作用机制仍需要进一步研究。
