牛磺胆酸钠诱导的急性坏死性胰腺炎小鼠肠屏障功能的变化
2023-12-27陈逸飞孙思慎张尧周春华邹多武
陈逸飞 孙思慎 张尧 周春华 邹多武
上海交通大学医学院附属瑞金医院消化内科,上海 200025
SAP是一种伴有胰腺或胰周组织坏死及多器官功能衰竭的疾病,常合并肠屏障功能损伤,从而导致疾病加重,死亡率升高[1]。动物模型是研究SAP病理生理机制及治疗靶点的重要工具,其中胰胆管逆行注射牛磺胆酸钠是建立急性坏死性胰腺炎(acute necrotizing pancreatitis, ANP)动物模型的方法之一,该方法模拟了临床上胆源性胰腺炎的发病过程,具有建模方便、成功率高且模型稳定性好的特点[2]。但该方法所用动物多为Sprague-Dawley大鼠[3-6],而大鼠在饲养条件、生长发育及基因编辑方面劣于小鼠[7],有一定的局限性。小鼠由于体积小、胰胆管细,手术逆行插入操作难度大,造模技术要求高,目前研究中缺乏小鼠ANP模型的肠屏障功能损伤病理变化的描述。本研究使用C57BL/6小鼠进行胰胆管逆行注射牛磺胆酸钠建立ANP模型,选取造模后24 h及48 h两个ANP发展的关键时间节点,观察ANP相关肠屏障功能损伤的动态变化,为利用该动物模型研究ANP合并肠屏障功能障碍的病理生理机制及治疗方法奠定基础。
材料和方法
一、实验动物与分组
18只SPF级雄性8~12周龄、体重22~27 g的C57BL/6小鼠购于上海南方模式生物科技股份有限公司。给小鼠喂食标准饮食,并在无病原体的条件下饲养,昼夜循环12 h。实验操作前禁食12 h,自由饮水。按数字表法将小鼠随机分为假手术组和ANP组,其中ANP组根据造模时间进一步分为造模后ANP 24 h组和ANP 48 h组,每组6只。ANP造模按照Perides等[8]报道的方法进行:三溴乙醇腹腔注射麻醉小鼠后,行剖腹手术暴露胰胆管,胆总管上段使用血管夹夹闭,将导管穿入十二指肠后再经十二指肠乳头逆行插入小鼠胰胆管,在3 min内匀速泵入5%牛磺胆酸钠(2 μl/g)诱导ANP,药物成功泵入后将胰胆管、十二指肠归位,关腹。假手术组仅行手术操作,穿刺胰胆管,未注射药物。手术完成后,记录术后48 h小鼠的存活情况并进行生存率分析。分别在造模后24、48 h使用三溴乙醇注射麻醉小鼠,眼球取血后颈椎脱臼法处死,剖腹取胰腺、小肠、结肠组织,将小肠从中间横切分为上下段再分别纵向对半分开。将血清、对半的小肠上下段组织-80℃冻存;将胰腺组织、另一半小肠上下段组织及结肠置4%多聚甲醛溶液中固定。
二、观察指标
1.胰腺和肠道组织病理学检查:取多聚甲醛溶液固定的胰腺、肠道组织标本,常规石蜡包埋、切片,苏木精-伊红(HE)染色,光学显微镜下观察组织病理学改变。胰腺组织按照改良Schmidt评分标准[9]对胰腺水肿、炎症细胞浸润、出血和腺泡细胞坏死进行评分。小肠组织按照Chiu等[10]提出的病理分级进行评分:0分,正常肠黏膜;1分,绒毛顶部出现上皮下间隙;2分,上皮下间隙继续扩展;3分,上皮层大块分离伴部分绒毛顶部缺失;4分,绒毛消失伴固有层、扩张的毛细血管裸露;5分,固有层溃疡、解体。结肠组织学评分参照文献[11]。所有数据均由随机选择各组小鼠6张切片,每张切片随机选择3个视野观察、计算得到。
2.血清淀粉酶和脂肪酶检测:应用全自动生化仪(Chemray 240,深圳雷杜生命科技公司)测定小鼠血清淀粉酶和脂肪酶的活性。
3.血清D-乳酸检测:使用ELISA试剂盒(美国AAT Bioquest公司)测定血清D-乳酸水平,严格按说明书操作。使用Synergy LX酶标仪检测575 nm和605 nm处吸光度比值,绘制D-乳酸标准曲线,计算得到血清D-乳酸浓度。
4.小肠组织肠道紧密连接蛋白检测:取冻存的各组小鼠小肠上段组织,裂解后取上清,采用蛋白质免疫印迹法检测肠道紧密连接蛋白ZO-1、occludin表达,以GAPDH为内参对照。抗ZO-1、occludin抗体购自武汉塞维尔生物科技有限公司,工作浓度分别为1∶1 500、1∶1 000。抗GAPDH抗体、HRP标记山羊抗兔IgG二抗购自美国Cell Signaling Technology公司,工作浓度分别为1∶2 000、1∶3 000。ECL(美国Millipore公司)发光,X片曝光、显影、定影,用Image J 软件扫描条带灰度值,以目标条带与内参条带的灰度值比表示目的蛋白表达量。
三、统计学处理
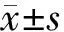
结 果
一、各组小鼠造模后生存率、胰腺病理学及血生物化学指标变化
术后观察各组小鼠生存情况,假手术组48 h总生存率为100%,造模组小鼠术后出现萎靡、嗜睡、体温降低,并在术后6 h开始出现死亡,24、48 h两个时间节点总生存率分别为36.4%、25.0%,提示造模后24 h内为ANP小鼠的死亡高峰期。
胰腺组织HE染色结果显示,假手术组小鼠胰腺组织结构完整,腺泡排列紧密;ANP 24 h组、48 h组胰腺组织均出现了水肿、出血、炎症细胞浸润、腺泡细胞坏死(图1)。假手术组、ANP 24 h组、ANP 48 h组胰腺Schmidt病理评分分别为(0.67±0.82)、(10.58±0.64)、(8.81±1.55)分,ANP 24 h组和ANP 48 h组均较假手术组显著升高,差异均有统计学意义(t值分别为23.43、11.36,P值均<0.05)。
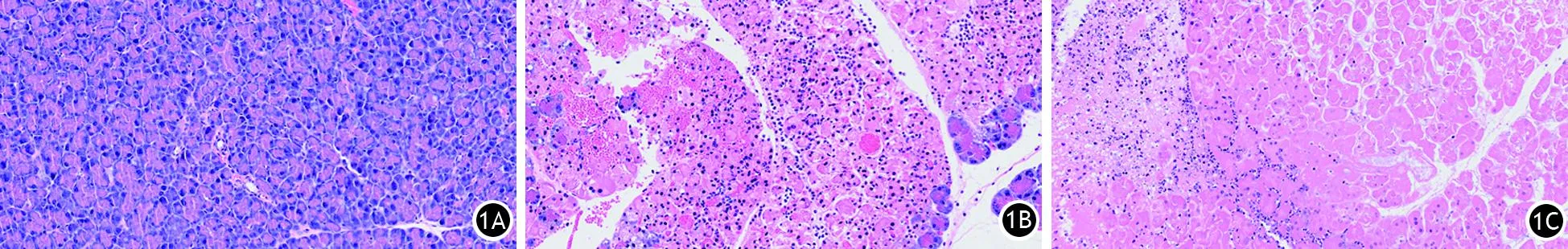
图1 假手术组(1A)、ANP 24 h组(1B)、ANP 48 h组(1C)小鼠胰腺组织病理学变化(苏木精-伊红染色, ×200)
假手术组、ANP 24 h组、ANP 48 h组血清淀粉酶水平分别为(479.14±86.42)、(5998.72±2096.31)、(3055.43±2336.5)U/L,脂肪酶水平分别为(18.56±3.84)、(558.20±559.65)、(112.58±94.91)U/L,ANP组血清淀粉酶、脂肪酶水平均高于假手术组,其中ANP 24 h组较假手术组升高显著,差异有统计学意义(t值分别为6.44、2.36,P值均<0.05)。
以上结果表明成功建立ANP小鼠模型。
二、牛磺胆酸钠诱导的ANP小鼠肠道病理改变
HE染色结果显示,假手术组小肠组织排列紧密、结构完整。ANP 24 h组小肠组织出现上皮细胞部分脱落,绒毛排列紊乱、大片倒伏,顶端上皮下间隙扩大,并有肿胀坏死脱落;ANP 48 h组小肠绒毛完整性部分恢复,绒毛排列稍紊乱,肿胀坏死程度减轻(图2)。假手术组、ANP 24 h组、ANP 48 h组小肠上段Chiu肠黏膜损伤病理评分分别为(0.17±0.41)、(2.11±1.41)、(1.61±0.80)分,小肠下段Chiu病理评分分别为(0.17±0.41)、(1.00±0.76)、(1.06±0.25)分,ANP 24 h、48 h组小肠病理评分均高于假手术组,其中小肠上段病理损伤更加明显,差异有统计学意义(t值分别为3.25、3.94,P值均<0.05)。假手术组、ANP 24 h组和ANP 48 h组结肠结构完整,无明显损伤(图2),病理评分分别为(0.33±0.52)、(0.67±0.82)、(0.67±0.52)分,3组间差异无统计学意义。提示牛磺胆酸钠诱导的ANP相关肠道病理损伤主要发生在小肠上段。

图2 假手术组(2A~2C)、ANP 24 h组(2D~2F)、ANP 48 h(2G~2I)组小鼠小肠上段(左)、小肠下段(中)、结肠(右)组织病理学变化(苏木精-伊红染色, ×200)
三、牛磺胆酸钠诱导的ANP小鼠肠屏障功能变化
假手术组、ANP 24 h组和ANP 48 h组血清D-乳酸水平分别为(337.76±125.90)、(1690.52±1072.13)、(288.36±134.86)μmol/L,ANP 24 h组血清D-乳酸水平较假手术组显著增加,差异有统计学意义(t=3.07,P<0.05),ANP 48 h组和假手术组血清D-乳酸水平大致相当,差异无统计学意义。蛋白质免疫印迹结果显示,假手术组、ANP 24 h组、ANP 48 h组小肠上段组织ZO-1表达量分别为0.87±0.08、0.19±0.18、0.50±0.19,occludin表达量分别为0.98±0.04、0.13±0.08、0.69±0.04,ANP 24、48 h组ZO-1、occludin表达量较假手术组均显著降低,差异有统计学意义(t值分别为5.93、3.19,16.43、8.90,P值均<0.05,图3)。其中ANP 48 h组ZO-1表达量较ANP 24 h组升高,但差异无统计学差异,occludin表达量较ANP 24 h组显著升高,差异有统计学意义(t=10.64,P值<0.05)。提示ANP小鼠肠屏障功能在早期严重受损,随后可逐渐自我恢复。
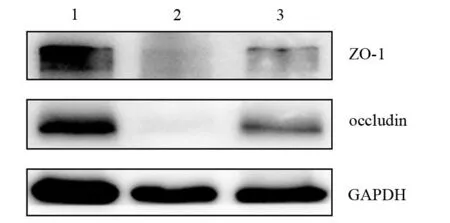
图3 假手术组(1)、ANP 24 h组(2)、ANP 48 h组(3)小鼠小肠上段紧密连接蛋白ZO-1、occludin的表达(免疫印迹法)
讨 论
动物ANP模型能够一定程度上模拟人类SAP的病程,有助于该疾病的病理生理机制研究以及药物治疗探索[12]。近年来ANP动物模型被广泛使用以探究ANP的发病机制,而小鼠因其成本低、可进行基因敲除等优势逐渐成为研究AP最常用的实验动物。目前AP小鼠模型常用的方式为腹腔注射雨蛙素刺激胰腺分泌造成AP,但雨蛙素诱导的AP多为轻症,病理上主要表现为胰腺水肿、腺泡细胞空泡形成,难以模拟人类SAP的病理表现[2]。本研究通过十二指肠插入胰胆管逆行注射5%牛磺胆酸钠诱导ANP小鼠模型,与假手术组相比,造模组死亡率为60%~70%,与文献报道的ANP模型死亡率大致相当[3,13];在病理学上可见到胰腺水肿出血、炎症细胞浸润及腺泡细胞坏死,提示胰腺病理损伤严重;血清淀粉酶、脂肪酶升高,提示小鼠ANP模型制备成功。
肠道是SAP期间容易受损的靶器官之一,一项荟萃分析显示60%的SAP患者存在肠屏障功能障碍[14]。肠屏障由机械、生物、化学屏障组成,其中肠道紧密连接蛋白在维持肠道屏障完整性方面发挥了重要作用[15]。此外,D-乳酸作为肠道细菌代谢产物,当肠屏障受到破坏时,D-乳酸可入血,因此血清D-乳酸水平可反映肠道黏膜通透性的变化[16]。近年来研究发现,肠道不仅是SAP的“受害者”,反过来也能够成为“加害者”,促进全身炎症反应综合征和感染性胰腺坏死的发生[17]。SAP合并肠屏障功能障碍主要以肠道上皮细胞和肠道紧密连接受损为特征,导致肠道通透性增加,菌群和肠道有毒产物的移位加重了SAP并发症的发生,增加死亡风险。Van den Berg等[18]研究发现引起坏死性胰腺炎继发感染的微生物来源于胃肠道。ANP发病后肠道通透性增加与肠道微生物群改变及感染性并发症密切相关,在ANP小鼠上进行粪便微生物群移植会增加细菌移位和死亡率。相反,补充丁酸盐可明显增强肠黏膜屏障功能,减轻小鼠的疾病进展。Li等[19]发现AP的严重程度受肠屏障、肠道菌群、NLRP3炎症小体互相作用的影响。可见肠道屏障功能已成为当前研究SAP病理生理机制及治疗靶点的热点。
胰胆管逆行注射牛磺胆酸钠诱导的ANP小鼠模型相对稳定,可重复性好,适用于研究ANP的局部和全身并发症,且可用于治疗相关研究。牛磺胆酸钠溶液可诱发急性出血性胰腺炎,死亡率在24%~100%之间[20],且可表现出肠屏障功能障碍的特征,但目前对该小鼠模型中肠道的病理学动态变化、肠屏障功能的损伤仍缺乏系统性评价与监测。本研究选取ANP造模后24、48 h两个时间节点,对肠屏障结构及功能进行动态观察与检测,通过肠道组织病理变化、肠道紧密连接蛋白表达、血清D-乳酸水平等指标发现ANP相关肠道病理损伤主要位于小肠部位,尤其是小肠上段,且同胰腺损伤一样呈现出自我恢复的趋势,24 h内肠屏障障碍逐渐加重,形成一个死亡高峰,而48 h后肠屏障功能逐渐恢复。
综上所述,本研究利用C57BL/6小鼠逆行胰胆管注射5%牛磺胆酸钠建立ANP模型,并初步探究了ANP肠屏障的动态变化,为后续深入研究ANP肠屏障功能障碍机制及治疗药物的开发提供有效的模型。
利益冲突所有作者声明无利益冲突
作者贡献声明陈逸飞:实验操作、数据分析、论文撰写;孙思慎:数据整理、统计学分析;张尧:研究设计、研究指导、论文修改;周春华:研究设计、研究指导、论文修改、工作支持;邹多武:研究指导、论文修改、经费支持
