基于FAERS 数据库的塞利尼索不良事件信号挖掘与分析
2023-12-27何晓东刘慧敏柯昌虎李华谢波李鹏李志浩
何晓东,刘慧敏,柯昌虎,李华,谢波,李鹏,李志浩
湖北医药学院附属国药东风总医院 药学部,湖北 十堰 442000
多发性骨髓瘤是仅次于非霍奇金淋巴瘤的第2大常见血液学恶性肿瘤,约占血液系统恶性肿瘤的10%。最新数据显示,多发性骨髓瘤的年发病率约为5/100 000,2020 年全球新发多发性骨髓瘤病例为176 404 例,死亡病例为117 077 例[1-2]。目前治疗多发性骨髓瘤的新型药物主要为蛋白酶体抑制剂、免疫调节剂和单克隆抗体,尽管上述药物治疗效果较好,但是仍难以避免在疾病进展过程中复发。人类核输出蛋白XPO-1 是细胞中关键的核质转运蛋白,负责将蛋白质运输出细胞核。肿瘤抑制蛋白的核输出是肿瘤细胞逃避凋亡的重要机制,XPO-1 可作为多发性骨髓瘤治疗的靶点[3]。塞利尼索是全球首个强效核输出蛋白抑制剂,具有全新的作用机制,能影响多条信号通路,协同增强其他抗肿瘤药物活性。国内外临床研究证实以塞利尼索为基础的联合方案治疗复发难治性多发性骨髓瘤,可获得较高缓解率[4-6]。2019 年7 月美国食品药品监督管理局(FDA)批准塞利尼索用于治疗复发难治性多发性骨髓瘤,2021 年塞利尼索进入中国市场,获批与地塞米松联用,适用于既往接受过治疗且对至少1 种蛋白酶体抑制剂,1 种免疫调节剂以及1 种CD38 单抗的复发难治性多发性骨髓瘤患者。随着塞利尼索在国内外广泛使用,其不良事件(adverse drug event,ADE)报告也逐渐增多,但基于真实世界的不良反应数据分析尚未见报道。本研究拟通过美国FDA 药品不良事件报告系统(FDA adverse event reporting systerm,FAERS)数据库,利用数据挖掘技术分析真实世界中的塞利尼索不良事件信号,为临床安全用药提供参考。
1 资料与方法
1.1 数据来源
本研究数据来源于美国FAERS 数据库,结合塞利尼索上市时间,下载2019 年第3 季度—2023年第3 季度的美国信息互换标准代码(American standard code for information interchange,ASCII)数据包,每个数据包包含DEMO(人口学信息)、DRUG(药品)、INDI(适应证)、REAC(不良事件)、OUTC(结局)、THER(治疗过程)、RPSR(来源)7 个数据表。将下载的15 个季度数据包导入MySQL8.0 数据库,通过关键字段primaryid 在7 个数据表之间建立映射关系。使用SQL 命令删除所有deleted 病例和重复报告,通过数据库管理工具Navicat 在DRUG 数据表中drugname 和prod_ai 字段以通用名“SELINEXOR”和商品名“XPOVIO”为关键词,筛选出所有以塞利尼索为首要怀疑药物(prime suspected drug,PS)的相关ADE 报告。由于FAERS数据库中的各术语均是按照《监管活动医学词典》(Medical Dictionary for Regulatory Activities,MedDRA)进行编码,本研究亦采用MedDRA 25.1中的首选系统器官分类(system organ class,SOC)和首选术语(preferre term,PT)对检索出的ADE信号进行归类分析。
1.2 ADE 信号挖掘
比值失衡法常用于药品风险信号检测和实际药物ADE 的检测,其原理是比较目标药物–事件的出现频率与背景频率的差异,当目标药物–事件组合的出现频率明显高于整个数据库的背景频率并且达到了设定的阈值,就认为产生了1 个信号[7]。本研究采用比值失衡法中的报告比值比(report odds ratio,ROR)法和比例报告比值(porportional reporting ratio,PRR)法分别计算ROR 值和PRR值,筛选药物潜在ADE 信号。由于ROR 法和PRR法灵敏度较高,容易出现假阳性信号,故同时采用上述2 种方法进行ADE 信号检测,筛选重合的信号,ROR 法和PRR 法计算公式及阈值见表1、2。

表1 比例失衡法四格表Table 1 Fourfold table of disproportionality
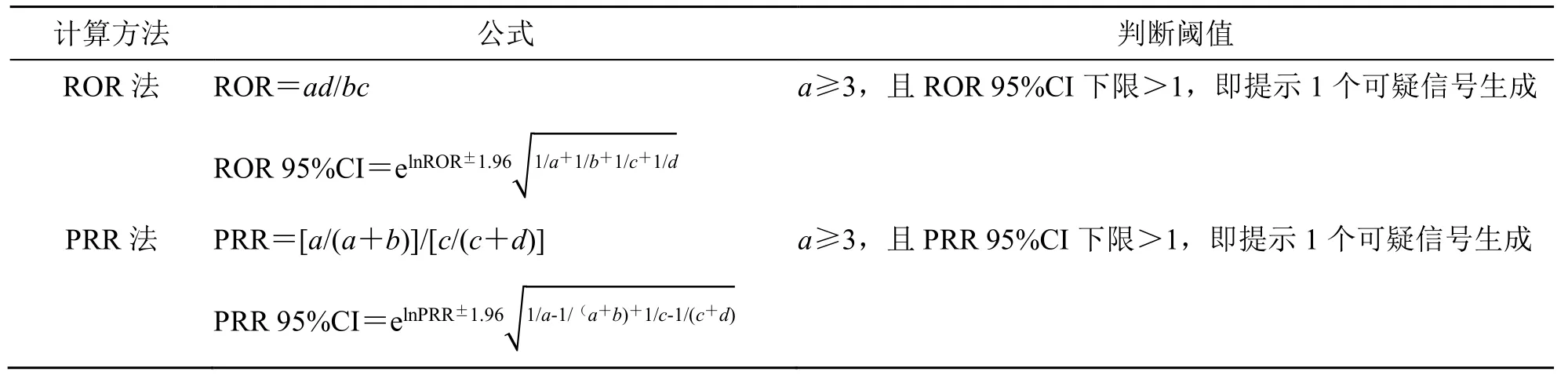
表2 ROR 法和PRR 法计算公式及阈值Table 2 Formula and threshold value of ROR and PRR
2 结果
2.1 ADE 报告基本情况
经过数据清洗,从2019 年7 月1 日—2023 年9 月30 日,FAERS 共收到6 470 498 例ADE 报告,其中以塞利尼索为首要怀疑药物的ADE 报告4 991例,涉及19 868 个PT。在已知性别的ADE 报告中男性患者略多(897 例,占55.27%),患者年龄中位数为65 岁,平均年龄为63.63 岁。ADE 报告者职业主要为消费者(2 828 例,占56.66%),上报国家前3 位分别为美国(3 305 例,占66.22%)、中国(316 例,占4.33%)和澳大利亚(154 例,占3.09%)。严重ADE 报告共有2 262 例,前3 位分别是住院(1 245 例,占55.04%)、死亡(814 例,占35.99%)和其他严重ADE(203 例,占8.97%),具体报告基本信息见表3。

表3 塞利尼索相关ADE 报告基本信息Table 3 Basic information on ADE reports related to selinexor
2.2 ADE 信号检测结果
对以塞利尼索为首要怀疑药物的ADE 信号进行检测,ROR 法和PRR 法计算结果高度重合,共得到塞利尼索ADE 信号281 个。经过多重筛选,删除产品本身问题、用药错误、各类操作以及与原发疾病相关等干扰因素所致ADE 信号163 个,最终获得118 个有效信号,涉及16 个SOC。研究结果显示,按各SOC 累计报告数排序,前5 位的分别是胃肠系统疾病(3 479 例,占26.60%)、全身性疾病及给药部位各种反应(2 418 例,占18.49%)、各类检查(1 491 例,占11.40%)、代谢及营养类疾病(1 390 例,占10.63%)、血液及淋巴系统疾病(1 209例,占9.24%)。其中胃肠系统疾病信号最多,共涉及13 个PT 信号,主要为恶心(1 541 例,占45.13%)、腹泻(752 例,占21.73%)、呕吐(595 例,占17.25%)、便秘(265 例,占7.41%)等。与目前国内已上市的塞利尼索药品说明书进行对比,有53 个PT 信号在说明书中未被提及。未被提及的信号主要集中于胃肠系统疾病、呼吸系统、胸及纵隔疾病和各类检查,如死亡、便秘、跌倒等,见表4、图1。
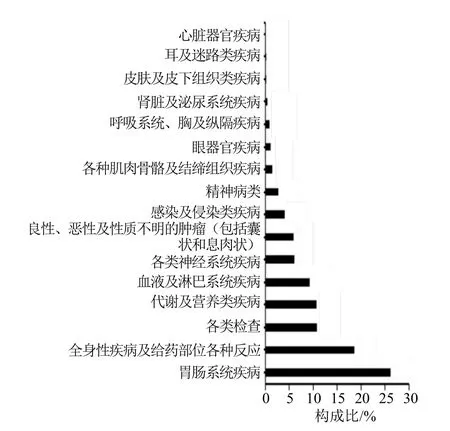
图1 塞利尼索累计系统ADE 构成比Fig.1 Constituent ratio of selinexor involving systemic ADE

表4 塞利尼索累及系统信号数与ADE 构成比Table 4 ADE signal and SOC of selinexor
2.3 PT 信号分析
对塞利尼索信号发生频次进行分析,排名前20位的PT 信号主要集中在全身性疾病及给药部位各种反应、胃肠系统疾病、代谢及营养类疾病等,前5 位PT 信号分别为恶心、疲劳、血小板减少、食欲减退和腹泻。有3 种PT 在说明书中未被提及,分别是死亡、便秘和跌倒。以ROR 法对塞利尼索PT信号强度进行分析,信号强度排名前20 位的PT 信号主要集中在良恶性及性质不明的肿瘤、胃肠系统疾病、代谢及营养类疾病等。前5 位PT 信号分别为神经纤维肉瘤、睑板腺功能障碍、胶质母细胞瘤、高肌酐血症和肾功能检查异常,有7 个PT 在说明书种未被提及。该结果为进一步更新塞利尼索说明书中的ADE 提供参考,见表5。
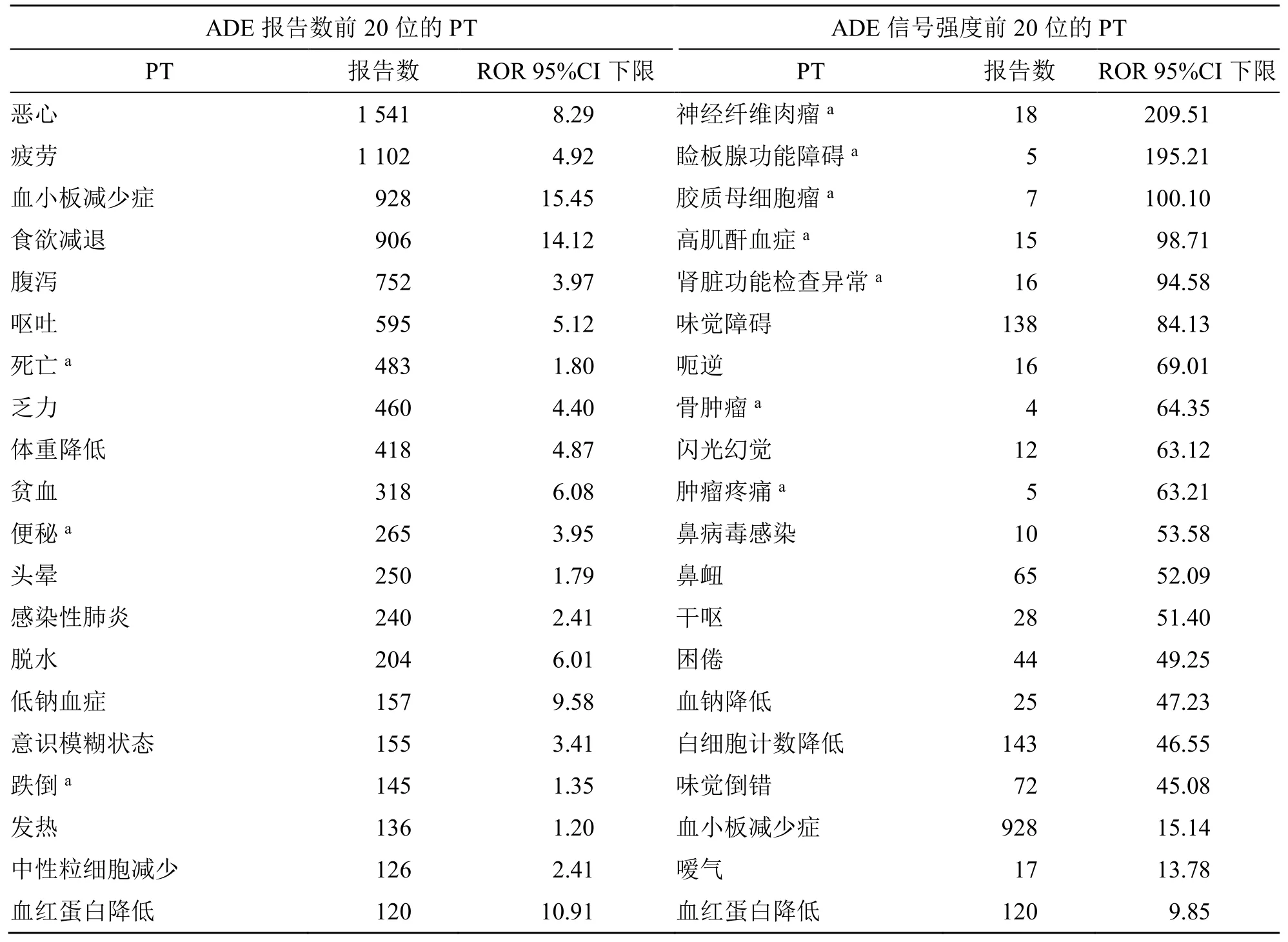
表5 塞利尼索ADE 发生频数和信号强度排名前20 位PTTable 5 Top 20 PT of selinexor ADE frequency and signal strength
2.4 严重ADE 信号分析
在4 991 例塞利尼索ADE 报告中,导致严重后果的有2 262 例(占45.32%),排前3 位的分别是延长住院时间(占55.04)、死亡(35.99%)和其他严重ADE(占8.97%)。经过风险信号挖掘,导致严重ADE 的前5 位PT 分别是恶心(9.23%)、死亡(7.82%)、食欲减退(5.71%)、腹泻(4.32%)和血小板减少症(4.31%)。在已知年龄的严重ADE 报告中,患者年龄中位数为65 岁,65 岁以上患者有527 例(占55.28%)。上述结果提示在老年患者中应及时采取有效预防措施,防止因恶心、食欲减退、腹泻或血小板减少等导致严重ADE。
3 讨论
3.1 塞利尼索ADE 人口学特征
本研究共检索出4 991 份以塞利尼索为首要怀疑药物的ADE 报告,虽然在已知性别的ADE 报告中,男性患者使用塞利尼索ADE 发生比例略高于女性(55.27%vs44.73%),但流行病学资料显示[8],多发性骨髓瘤男性发病率高于女性,该结果不能说明性别与ADE 发生之间的联系,尚需设计严谨的临床研究证实。在已知年龄信息的ADE 报告中,患者中位年龄为65 岁,平均年龄为63.63 岁,65 岁以上的患者占比51.37%,该结果提示老年患者使用塞利尼索的ADE 发生率可能较青壮年高,应重点关注老年人群用药安全。在ADE 上报国家中,上报例数最多的是美国(66.22%),这与该药首先在美国上市有关。来自中国的ADE 报告仅占4.33%,鉴于塞利尼索在国内上市不久,中国人群用药后数据较为缺失,提示对我国人群用药安全性分析时应充分评估潜在风险。
3.2 常见ADE 信号分析
STORM 和MATCH 研究结果显示[9-10],塞利尼索常见ADE 为血小板减少、贫血、恶心呕吐和腹泻,其他ADE 包括体质量下降、厌食、低钠血症和乏力。在本次研究中,共挖掘出118个塞利尼索ADE信号,发生频率高的ADE 有恶心、疲劳、腹泻、食欲减退、腹泻和血小板减少等。ADE 主要集中在胃肠系统疾病、代谢及营养类疾病和各类检查,与塞利尼索药品说明书和既往文献报道基本一致,说明本研究结果比较可靠。血小板减少、中性粒细胞减少和乏力是导致塞利尼索治疗中断的最常见的ADE[11],尤其是与其他有骨髓抑制的药物联合使用时更应注意。血小板减少是塞利尼索的主要血液学毒性,其通过抑制巨核细胞成熟阶段的血小板生成素(TPO)信号传导而抑制血小板的生成,对于本身血小板较低的人群使用塞利尼索更容易导致严重的出血事件,如颅内出血、胃肠道出血等[12]。塞利尼索介导的血小板减少是可逆的,可通过TPO 激动剂艾曲泊帕或罗米司亭纠正血小板减少,在BOSTON 试验中[13],18%的血小板减少症患者使用了TPO 药物,显著降低了因血小板减少而导致剂量调整或治疗中断的发生率。塞利尼索诱导的血小板减少存在剂量相关性,1 项观察性研究结果表明,高剂量组(>100 mg/2 周)29 d 内血小板降低发生率显著高于低剂量组(50~70 mg/2 周)[14]。塞利尼索上述典型ADE 多是可预见的,一般多出现于前2 个治疗周期内,随着后续治疗时间的延长,患者的耐受性也会逐步提高。塞利尼索另一常见ADE为胃肠道毒性,如恶心、呕吐、腹泻、厌食和食欲减退。胃肠道ADE 一般是通过中枢介导的,虽然很少导致严重ADE,但会限制塞利尼索的耐受性,预防性使用止吐药有助于提高患者耐受性[15]。有文献报道[16-17],89%~100%接受塞利尼索治疗的患者会使用止吐药,许多患者可能会需要2种(14%~33%)甚至3 种(5%)止吐药。对于恶心呕吐等胃肠道反应,可在首剂前使用8 mg 昂丹司琼或其他等效止吐药。在BOSTON 研究中[13],33%的患者在第1 个周期内发生恶心呕吐,但在后续治疗中恶心呕吐发生率降低50%,完成前2 个治疗周期后,恶心呕吐发生率低于10%。因此,在塞利尼索前2 个治疗周期内应加强患者的药学监护,建议每周监测血常规、血生化(电解质)、体质量等,严重情况下每周监测2 次,避免因严重ADE 而中断治疗[18]。使用塞利尼索的患者出现厌食、食欲减退、体质量下降和乏力等症状可能是多种因素引起的,除药物本身的影响,放化疗和恶心肿瘤本身也可能导致上述症
状的发生。
3.3 说明书未提及ADE 信号分析
本次研究共检测出了53 个药品说明书未收录的ADE 信号,如神经纤维肉瘤、胶质母细胞瘤、骨肿瘤等良恶性肿瘤。查阅相关资料,目前尚无使用塞利尼索增加相关肿瘤风险的报道,关于塞利尼索与增加肿瘤风险的联系尚需进一步临床研究。本研究还发现了高肌酐血症、肾功能损伤等说明书未收录的ADE 信号,在塞利尼索上市前临床研究中就观察到其可能导致肾损伤和电解质紊乱[9-10,13],塞利尼索导致肾损伤的机制目前尚不清楚,可能与患者本身恶性肿瘤有关,多发性骨髓瘤治疗复杂,使用药物众多,肾功能异常究竟由药物引起抑或是由恶性肿瘤进展导致尚无法确定。塞利尼索相关肾损伤一般是轻微的,很少导致严重后果,迄今为止只有1 例不可逆肾功能衰竭导致治疗中断的报道[9]。一般根据肾损伤严重程度进行门诊液体复苏或住院治疗,临床在使用塞利尼索过程中仍应注意肾功能和电解质的监测。本次研究还发现了跌倒、嗜睡、便秘等说明书未提及的信号。据文献报道,经塞利尼索片治疗的患者30%曾出现神经系统毒性,包括晕厥、眩晕、精神状态改变等,神经毒性首次发病的中位时间为15 d[19-20]。塞利尼索相关神经系统毒性可能与低钠血症、低血红蛋白水平有关,建议及时调整水化状态,监控血红蛋白水平,配合药物治疗,避免加剧眩晕或精神状态的变化。目前尚未见塞利尼索致便秘的相关文献报道,塞利尼索最常见ADE 为胃肠道毒性,一般导致呕吐、腹泻等,推测塞利尼索相关便秘可能是严重胃肠道功能紊乱所致,但尚需临床研究进一步证实。
3.4 本研究局限性
本研究通过FAERS 数据库进行真实世界下的用药安全性分析,能有效解决临床试验样本量小,观察时间短等问题,但仍存在一定的局限性。首先,FAERS 数据量巨大,覆盖范围广,但是数据完整性差,存在部分数据漏报现象。由于无法获得使用塞利尼索但未发生ADE 的患者数量,因此无法计算药物整体ADE 发生率。其次,ROR 法和PRR 法作为计算工具,只能说明药物与ADE 之间的联系强度,无法直接表明两者之间的因果关系,具体情况还需要结合既往文献和临床使用加以佐证。最后,FAERS 数据库报告基本来自欧美国家,因地域、种族与亚洲人群存在差异,故本研究结果不能完全正确反映中国人群用药后的ADE 发生情况,应尽快建立科学规范化的基于中国人群的ADE 数据库,为正确评估中国药品上市后药品不良反应,做好药物安全警戒,促进合理用药,提供真实世界的数据。
利益冲突所有作者均声明不存在利益冲突
