黄土高原水蚀风蚀交错区固氮微生物群落多样性在生物结皮中的演变规律
2023-12-26焦冰洁李香真张丙昌
焦冰洁,徐 琳,李香真,张丙昌,*
1 山西师范大学地理科学学院, 太原 030031
2 山西师范大学黄河中游生态环境研究中心, 太原 030031
3 中国科学院成都生物研究所, 成都 610041
4 四川农业大学生态林业研究所, 成都 611100
黄土高原水蚀风蚀交错区属于黄土高原向荒漠过渡、森林草原向典型干旱草原过渡的地带,是黄河流域的重要生态屏障[1—2],该区域水土流失和干旱缺水两大问题并存,加之人类活动的影响,是典型的生态脆弱区。黄土高原退耕还林还草工程实施后,生物结皮广泛发育,并逐渐成为恢复生态系统的重要组成部分。生物土壤结皮(简称生物结皮,BSCs)是由细菌、蓝藻、真核藻类、真菌、地衣和苔藓与土壤颗粒胶结而成的有机复合体[3]。根据生物结皮的优势物种,可将生物结皮分为藻结皮、地衣结皮和藓结皮,这种不同类型的生物结皮反映了其演替趋势[4—6]。
黄土高原水蚀风蚀交错区极不均匀的降水分布以及单次暴雨的强度导致该地区严重水土流失[7],造成大量有效养分损失,尤其是氮素[8—9]。氮素是调节陆地生态系统结构和功能的关键元素,也是植物净生产力和土壤生态系统生产力的主要限制性元素[10]。生物结皮对干旱半干旱区土壤氮素的提高有着重要贡献,在世界不同地区,多数研究表明,生物结皮是干旱半干旱区除大气氮沉降和豆科植物固氮外土壤氮素输入的重要贡献者[11—13]。据报道,生物结皮在全球干旱半干旱区年固氮量高达49 Tg,约占全球陆地生态系统生物总固氮量的1/4[14]。在温带荒漠藻类生物结皮的固氮酶活性可高达133 μmol m-2h-1[11];Xu等在古尔班通古特沙漠中的研究表明,演替后期的生物结皮有更高的固氮酶活性[15]。
固氮微生物是固氮过程的关键功能群,在土壤氮素输入中发挥着重要作用[10, 16]。研究表明,在门水平,多数研究区生物结皮的固氮类群主要是蓝藻门和变形菌门[17—19],在古尔班通古特沙漠沙漠生物结皮固氮蓝藻的研究中发现,念珠藻(Nostoc)和伪枝藻(Scytonema)是生物结皮固氮微生物的核心物种[15]。在内蒙古浑善达克沙地和戈壁荒漠生物结皮中的固氮微生物优势菌是蓝藻门和变形菌门,优势纲为α-变形菌和β-变形菌,在戈壁石下生物结皮中α-变形菌是稳定固氮微生物群落的关键类群,可能是主要固氮者;在属水平,伪枝藻、念珠藻和斯克尔曼氏菌(Skermanella)在生物结皮中占明显优势[20—21]。Wang等在对青藏高原高寒草甸土壤非共生固氮菌的研究中发现,中慢生根瘤菌(Mesorhizobium)、固氮螺菌属(Azospirillum)、慢生根瘤菌(Bradyrhizobium)和是已知固氮微生物中的优势物种[22]。土壤理化因子对不同生态系统或不同生境的固氮微生物具有明显的调控作用,多数研究认为,土壤有机碳、全氮、有效氮和pH是影响固氮微生物群落的主要因子[19—20],如古尔班通古特沙漠生物结皮演替过程中,研究发现土壤总有机碳与总氮之比(TOC/TN)和pH是影响固氮微生物群落的关键环境因素,在青藏高原高寒草甸中,研究也发现以pH为主导的确定性过程在土壤非共生固氮菌的群落构建中发挥着主要作用,除pH外,慢生根瘤菌和中慢生根瘤菌的丰度还与年平均温度、年平均降雨量以及沙粒、粉粒和粘粒的比例显著相关[15, 22]。
黄土高原水蚀风蚀交错区的固氮研究多集中在土壤氮素的积累或循环[23—24]、固氮酶活性及其影响因子[25]等方面。然而,该区域生物结皮演替过程中固氮微生物群落多样性及其关键驱动因子尚不清楚。本研究以黄土高原水蚀风蚀交错区生物结皮为对象,研究了黄土高原水蚀风蚀交错区生物结皮演替过程的固氮潜力、固氮微生物群落多样性及其关键环境影响因子,以期为该区域生态修复提供科学数据和理论支撑。
1 研究区概况
研究区位于陕西省神木县六道沟小流域(38°46′—48°51′N,110°21′—110°23′E),海拔1081—1274 m,流域面积6.89 km2,属于典型的水蚀风蚀交错带。该区主体地貌由风沙地貌和黄土丘陵共同构成,土壤质地为砂质土壤,属中温带半干旱气候;年均降水量408.5 mm,且80%以上集中在7—9月,多以暴雨形式出现,气候变化剧烈,平均水蚀模数15000 t km-2a-1,平均风蚀模数3200 t km-2a-1,是典型的水蚀风蚀生态脆弱区。流域为典型的盖沙黄土丘陵地貌,分为东西两半、西部多为固定沙丘,以风沙土为主,占流域总面积的13.5%;东部则大部分为黄绵土为主,占流域总面积的86.5%[26]。流域内植被盖度60%以上,现以人工植被和退耕荒坡地演替植被为主,主要是苜蓿(Medicagosativa)、长芒草(Stipabungeana)、柠条(Caraganakorshinskii)等;生物结皮的盖度30%—40%。
2 研究方法
2.1 样品采集
2021年7月,在神木六道沟封禁良好的小流域典型坡面上,设置5条20 m×20 m的样带(样带间距大于30 m),坡度为15—25°,各样带区域大小相同,坡向相同。在每条样带随机选择不同的生物结皮类型:浅色藻结皮(LAC)、深色藻结皮(DAC)、地衣结皮(LC)、藓结皮(MC),其盖度和主要物种组成见表1。将裸地(BS)作为研究对照,每种类型设置3个1 m×1 m的样方,沿样方对角线采用自然剥离法收集土壤样品,分为结皮层和结皮下层(0—5 cm)2个土壤层次。为减少空间异质性,每条样带收集同种类型的3个土壤样品均匀混合后作为一个样品,共获得60份土壤样品。用无菌采样铲收集样品后装入无菌封口袋,并尽快运回实验室。每个样品分为两份:一部分土壤自然风干,用于测定理化性质及固氮酶活性,另一份土壤于-20℃冰箱保存,用于分子分析。

表1 生物结皮不同类型的关键物种组成
2.2 固氮酶活性与环境变量测定

2.3 样品DNA提取、聚合酶链式反应(PCR)扩增测序及荧光定量PCR
采用PowerSoil®DNA提取试剂盒(Qiagen,德国希尔登)并按照说明从(0.6±0.1)g土壤样品中提取DNA,利用Nanodrop2000对DNA浓度和质量进行检测(OD A260/A280比值在1.8—2.0之间)。
以nifH1(5′-GCC ATC ATY TCN CC-3′)和nifH2(5′-TGY GAY CCN AAR GCN GA-3′)为引物,对nifH基因进行PCR扩增(反应条件:95℃预变性3 min;94℃变性1 min,50℃退火1 min,72℃延伸1 min,35个循环;72℃延伸10 min),通过Illumina HiSeq平台对扩增产物进行测序,测序长度2×250 bp。
分别针对nifH基因(引物:nifH1;nifH2)、16S rRNA基因(引物 515F:5′-GTGYCAGCMGCCGCGGTA-3′;909R:5′-CCCCGYCAATTCMTTTRAGT-3′)、ITS基因(引物 ITS4:5′-TCCTCCGCTTATTGATATGC-3′;gITS7:5′-GTGARTCATCGARTCTTTG-3′)采用荧光定量PCR的方法定量检测固氮微生物、细菌和真菌的绝对丰度,ITS与16S rRNA基因丰度之比定义为真菌与细菌之比(F/B)[19]。
2.4 生物信息学分析
使用QIIME2将下机的原始序列利用FLASH进行双端测序数据拼接,根据样品标签信息对序列进行分类,并进行质控及优化[28]。Usearch8对序列进行嵌合体检测[29],使用Framebot去除移码突变[30],UCLSUT以96%序列相似性基于基本操作单元(OTU)进行聚类分析,去除<10的聚类簇[31],将各样品序列抽平到同一深度,共得到每个样品5548条序列;使用晶体结构可视化软件(Diomand)构建对比数据库对OTU进行分类信息注释,注释阈值选用80%。固氮酶活性与nifH基因丰度采用单因子方差分析(ANOVA)检验在不同生物结皮演替阶段的差异显著性,并使用Origin 2021绘图;其余数据统计分析与绘图使用R4.2.0软件加载Microeco包进行[32]:计算固氮微生物群落的α及β-多样性;分别在门、目和属分类水平上统计各样品的群落组成;采用单因子ANOVA检验和多重比较(LSD)检验固氮微生物α-多样性、物种组成在不同生物结皮演替阶段间的显著性差异;通过主成分分析(PCoA)确定群落结构差异,并采用置换多元方差分析(PERMANOVA)对Bray-Curtis距离检验群落差异显著性;通过冗余分析(RDA)和Mantel检验固氮微生物群落与环境因子的显著性。
3 研究结果
3.1 固氮酶活性与nifH基因丰度
生物结皮层的固氮酶活性随结皮演替呈显著增加趋势(图1),其中藓结皮层的固氮酶活性最高,可达(4.78±0.66) μmol C2H4m-2h-1,高于地衣结皮、浅色和深色藻结皮,显著高于裸地(P<0.05);生物结皮层的固氮酶活性均显著高于结皮下层土壤(图1)。nifH基因丰度的变化趋势也与其相似(图1),nifH基因绝对丰度在结皮层与结皮下层中均表现为随演替呈现增加趋势;除裸地外,其余四种结皮的nifH基因绝对丰度均显著高于结皮下层(图1)。

图1 不同演替阶段生物结皮层与结皮下层土壤的固氮酶活性及nifH基因丰度
3.2 固氮微生物群落α-多样性的变化规律
在生物结皮不同演替阶段中,Shannon指数、谱系多样性(PD)与固氮酶活性变化规律类似,均表现为藓结皮最高,显著高于裸地、藻结皮和地衣结皮阶段,而裸地、藻结皮和地衣结皮Chao1指数、Shannon指数无显著差异(图2),表明生物结皮的演替显著提高了固氮微生物多样性。生物结皮层的Shannon、PD指数显著高于结皮下层(图2);而结皮层的chao1指数高于结皮下层但不显著(图2)。

图2. 生物结皮不同演替阶段及生物结皮层与结皮下层土壤固氮微生物群落α-多样性指数
3.3 固氮微生物群落组成
在门水平上,蓝藻门(Cyanobacteria)、变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、广古菌门(Euryarchaeota)的相对丰度占固氮微生物总丰度的98%以上。在裸地中,变形菌门的相对丰度高达63.1%,主要包含红螺菌目(Rhodospirillales)、酸硫杆菌目(Acidithiobacillales)和根瘤菌目(Rhizobiales),其次是蓝藻门的念珠藻目(Nostocales)和厚壁菌门的梭菌目(Clostridiales);浅色和深色藻结皮、地衣结皮中蓝藻门的念珠藻目占绝对优势(相对丰度在84.72%—88.53%之间),而蓝藻门的颤藻目(Oscillatoriales)、色球藻目(Chroococcales)和聚球藻目(Synechococcales)的丰度只占很小比例,变形菌门与厚壁菌门的相对丰度也显著低于裸地;而在藓结皮阶段,仍以蓝藻门的念珠藻目占优势,其次是变形菌门的红螺菌目、酸硫杆菌目和根瘤菌目(图3)。

图3 生物结皮不同演替阶段及生物结皮层与结皮下层土壤固氮微生物在目水平上的群落组成
在属水平上,裸地中的优势物种主要是斯克尔曼氏菌属(Skermanella)、瘤胃梭菌属(Ruminclostridium),其次为嗜酸硫杆菌属(Acidithiobacillus)和Trichomus;但Trichomus在浅色和深色藻结皮、地衣结皮、藓结皮中均占绝对优势,且在藻结皮和地衣结皮的相对丰度显著高于藓结皮和裸地(P<0.05);除此之外,念珠藻属(Nostoc)、蓝杆藻属(Cyanothece)、鱼腥藻属(Anabaena)、斯克尔曼氏菌、瘤胃梭菌属在藻结皮、地衣结皮、藓结皮均占明显优势。在OTUs水平上,发现有多个OTUs属于同一物种,如Trichormusvariabilis和Skermanellaaerolata分别有130和98个OTUs,另外Nostocpunctiforme、念珠藻(Nostocsp. PCC7120)、鱼腥藻(Anabaenasp. L31)等均有多个OTUs,这表明生物结皮中的固氮微生物具有丰富的多样性。
在物种组成上,结皮层和结皮下层具有明显的差别,如在门水平上,蓝藻门是结皮层的优势类群,而结皮下层则是变形菌门占优势;除蓝藻纲外,α-变形菌纲(Alphaproteobacteria)、梭菌纲(Clostridia)和Acidithiobacillia在结皮下层占明显优势,其相对丰度均显著高于结皮层;在目水平上,结皮层以念珠藻目占绝对优势,其相对丰度为81.74%±2.24%,显著高于结皮下层(34.60%)(P<0.01);在属水平上,结皮下层的固氮微生物优势物种是斯克尔曼氏菌、Trichormus、瘤胃梭菌属、念珠藻属、酸硫杆状菌属,与裸地接近。
3.4 固氮微生物群落结构与关键环境因子的关系
基于Bray-Curtis距离的主成分分析(PCoA)表明,第一、二排序轴分别解释累积变量的29.2%和12.3%(图4);浅色藻结皮、深色藻结皮和地衣结皮的固氮微生物群落重合度高,表明这三个演替阶段的固氮微生物群落结构具有明显相似性;而裸地和藓结皮的固氮微生物群落与这三个演替阶段彼此分离,且PERMANOVA显著性检验表明裸地与其它所有结皮类型之间的固氮微生物群落差异为极显著(P<0.01);藓结皮与裸地、浅色和深色藻结皮、地衣结皮之间的固氮微生物群落差异也为极显著水平(P<0.01),说明生物结皮演替对固氮微生物群落结构具有显著影响。生物结皮层与结皮下层土壤的固氮微生物群落有明显的分离(图4),PERMANOVA分析亦表明它们之间差异极显著(P<0.01),进一步说明生物结皮对固氮微生物群落结构具有显著影响。
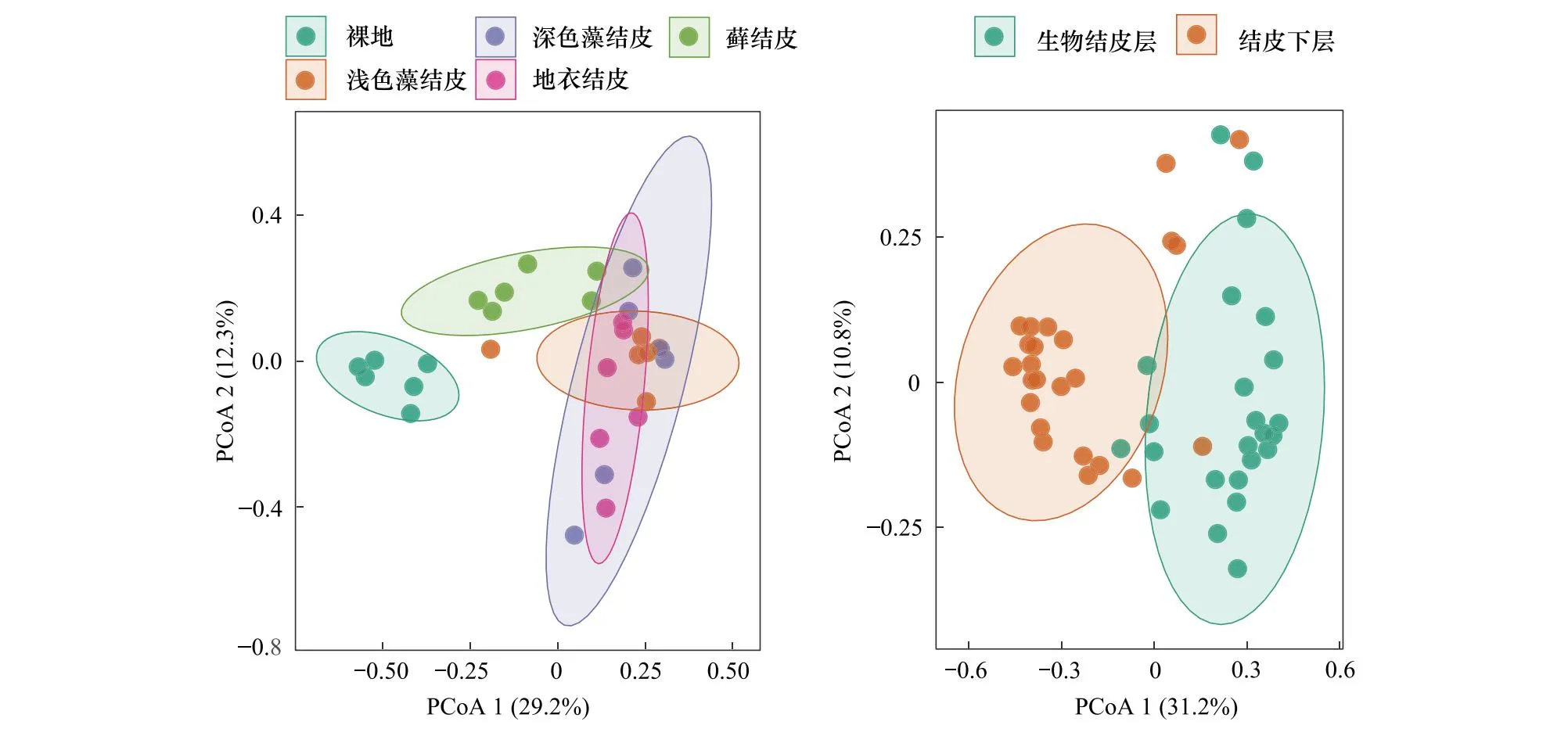
图4 生物结皮不同演替阶段及生物结皮层与结皮下层土壤固氮微生物群落组成的主坐标分析
土壤有机质(SOM)、土壤含水量(SWC)、全氮(TN)与Chao1显著或极显著正相关(P<0.05或P<0.01),表明多因子共同调控固氮微生物多样性,导致固氮能力的提升;土壤碳氮比(C/N)与Shannon指数呈显著负相关关系(P<0.05),也说明生物结皮固氮微生物对土壤氮素积累的贡献;真菌与细菌之比(F/B)与Shannon指数也呈显著的负相关关系,表明固氮微生物以细菌为主(表2)。通过测试进一步分析环境因子与固氮微生物群落的关系,结果表明,土壤pH值、TN与固氮微生物群落呈极显著正相关(P<0.01)(表3);pH值与念珠藻目、念珠藻科(Nostocaceae)以及其中的Trichormus属均呈显著或极显著正相关的关系(P<0.05或P<0.01),而与变形菌门中的红螺菌目及其中的红螺菌科(Rhodospirillaceae)、斯克尔曼氏菌属呈极显著负相关关系(P<0.01);土壤TN与念珠藻属呈显著正相关(P<0.01),这表明pH与TN是影响黄土高原生物结皮固氮微生物的关键环境因子。

表2 土壤环境因子与固氮微生物群落α-多样性的相关性分析
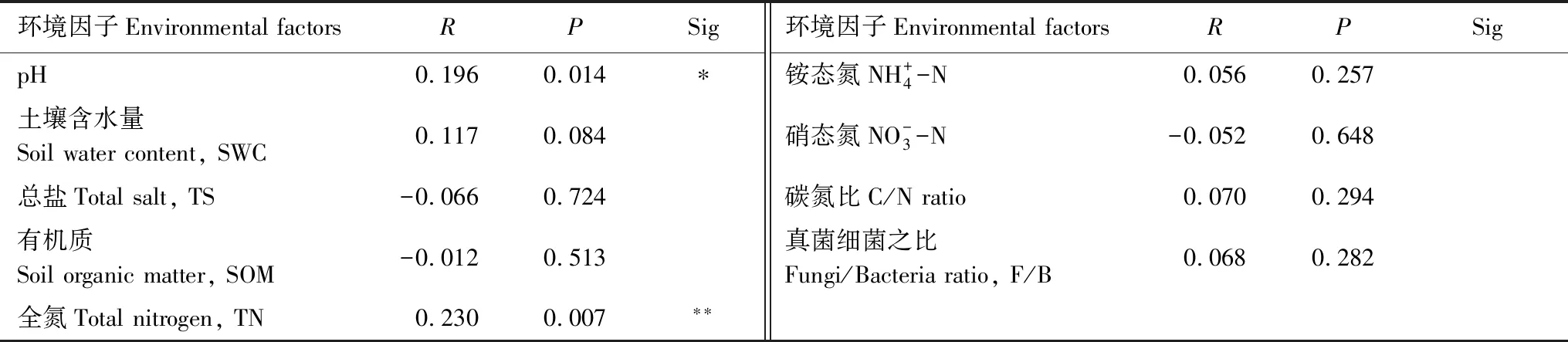
表3 土壤环境因子与固氮微生物群落的相关性分析
3.5 影响固氮潜力的关键微生物
相关性分析表明,固氮酶活性与固氮基因丰度(nifH)之间呈显著的正相关关系(R2=0.27,P=0.000),固氮酶活性(NAc)、nifH基因丰度与蓝藻中的念珠藻目均为极显著的正相关关系,而与红螺菌目、酸硫杆菌目、梭菌目、根瘤菌目呈显著负相关(图5);表明隶属蓝藻门的念珠藻目可能是固氮微生物的关键物种,在生物结皮的固氮功能中发挥着关键作用;而红螺菌目、酸硫杆菌目、梭菌目、根瘤菌目只在裸地表现出较高的丰度,但在生物结皮的固氮基因丰度和固氮酶活性中均贡献微弱。

图5 生物结皮关键固氮物种与环境因子的相关性
4 讨论
4.1 念珠藻目是黄土高原水蚀风蚀交错区生物结皮固氮微生物的优势类群
本研究中发现,黄土高原水蚀风蚀交错区固氮微生物类群中念珠藻目为主要优势类群。念珠藻目的物种,其丝状体均存在数量不等的异形胞,而异形胞是一种特有的能固氮的细胞,内含有固氮酶,可将大气中的氮分子固定为氮素化合物[33]。本文发现黄土高原水蚀风蚀交错区藻结皮(浅色和深色)、地衣结皮和藓结皮阶段的固氮微生物以蓝藻门的念珠藻目占绝对优势,其中的Trichormus和念珠藻(Nostocsp.)为主要优势种;其次是变形菌门的红螺菌目、酸硫杆菌目和根瘤菌目以及厚壁菌门的梭菌目。Trichormus是从鱼腥藻属分离出来的新属,其包含的Trichormusvariabilis则是念珠藻科鱼腥藻属的多变鱼腥藻(Anabeanavariabilis)[34]。在荒漠区域的多数研究也发现固氮蓝藻是生物结皮固氮的关键类群,如在科罗拉多高原、奇瓦瓦(Chihuahuan)沙漠中深色藻结皮的固氮蓝藻主要来自念珠藻目的念珠藻(Nostocspp.)、伪枝藻(Scytonemaspp.)、单岐藻(Tolypothrixspp.)、鱼腥藻(Anabeanaspp.)、眉藻(Calothrixspp.)[35—36]。在古尔班通古特沙漠中,生物结皮固氮微生物的关键物种是念珠藻和伪枝藻[19]。念珠藻目物种一方面可以固氮,另一方面还可以通过光合作用进行固碳,增加土壤中的C和N[5, 37]。在毛乌素沙地,化能合成固氮微生物共有4455个OUTs,96.57%属于变形菌门,其中固氮螺菌属(Azospirillum)、慢生根瘤菌属(Bradyrhizobium)、中生根瘤菌属(Mesorhizobium)是该区域的核心固氮物种[38]。在荒漠区,变形菌门的异养固氮细菌与厚壁菌门的梭菌科是早期生物结皮的重要固氮类群[17, 19, 35—36],本研究发现裸地中的固氮微生物则以变形菌门的红螺菌目、酸硫杆菌目和根瘤菌目为主,同时裸地中的nifH基因丰度最低,这说明变形菌门的物种适于在养分贫瘠的环境中生长。
通过nifH基因测序发现固氮微生物具有高度多样性[34]。有研究表明,Trichormus和鱼腥藻属是多系的,可能包含几个属[30]。本研究发现黄土高原水蚀风蚀交错区生物结皮固氮微生物具有丰富的多样性,如在OTU水平上,Trichormusvariabilis和Skermanellaaerolata分别有130和98个OTUs,另外点状念珠藻(Nostocpunctiforme)、念珠藻(Nostocsp. PCC7120)、鱼腥藻(Anabaenasp. L31)等均有多个OTUs,表明生物结皮中孕育着丰富的固氮微生物物种资源。因此,在黄土高原固氮微生物的研究中,为了挖掘物种资源及应用,需重视固氮微生物的分离、纯化及规模化培养。
4.2 pH为主导的多因子共同调控固氮微生物群落
在黄土高原水蚀风蚀交错区,自然和人工生物结皮的发育对土壤有机碳、总氮和速效氮、总磷和有效磷、速效钾等均有显著贡献,藓结皮的C、N、P含量较藻结皮分别增加了161%、127%和9%[6,39]。同时,生物结皮的演替有利于降低土壤pH、增加土壤水分、促进土壤团聚体的形成[40]。在全球尺度上,土壤pH是影响细菌群落结构和谱系多样性的关键环境因子,土壤pH通过改变酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes)的相对丰度影响细菌群落结构[41—42]。在高寒草甸土壤中发现pH是影响固氮群落的关键环境因子,与低pH(pH 5.02—7.00)土壤相比,高pH(pH 7.00—8.00)土壤的固氮微生物群落多样性更高,群落聚集性更强[43]。在古尔班通古特沙漠生物结皮中,固氮微生物的核心物种是与念珠藻和伪枝藻相关的OTUs,pH与固氮微生物群落谱系多样性指数βNTI呈显著正相关[19]。本研究发现,pH值与固氮微生物群落和关键固氮类群念珠藻目及其主要物种之间存在显著或极显著正相关关系,表明在固氮过程中起关键作用的念珠藻目相关物种更适于在中性到碱性土壤环境生长。一些研究证实,蓝藻更适合在碱性土壤中生长,碱性土壤易形成蓝藻占优势的生物结皮[44];Li等在沙坡头固沙植被区的研究表明,生物结皮群落中蓝藻物种丰富度和多样性随沙面土壤pH和总盐的增加而增加[45]。在实验室培养条件下,发现念珠藻和鱼腥藻在高pH(pH>8)的培养基中具更高的生物量[46],预示着高pH的碱性环境可能更利于念珠藻目的物种生长。本研究中,藻结皮和地衣结皮的pH分别为8.53—8.56和8.47,明显高于裸地(8.36)和藓结皮(8.32),高pH土壤对蓝藻中的念珠藻目种类提供了适宜的微环境,对固氮微生物起到筛选作用,导致念珠藻目物种在藻结皮和地衣结皮中占有更高的相对丰度。
本研究中,还发现土壤SOM、C/N对微生物多样性起着调控作用。在生物结皮的演替过程中,藻结皮主要以丝状蓝藻为主,当发育到地衣结皮时,除地衣植物外,还有大量的藻类植物[47—48],固氮微生物中念珠藻目占优势;当进一步演替至藓结皮,藻类种类和生物量下降,逐渐被藓类植物取代,显著增加了土壤中有机碳的含量,为异养微生物提供了丰富的能源物质,致使细菌和真菌生物量随生物结皮的演替显著升高[5,15],在藓结皮中,异养固氮微生物(如红螺菌目、酸硫杆菌目和根瘤菌目)可能获取更多的碳源,致使其生物量的增加,加之念珠藻目的物种,最终导致藓结皮的固氮微生物多样性和生物量显著高于其它阶段,固氮微生物群落结构也有了明显区别。
除土壤pH、SOM外,TN含量、土壤含水量与固氮微生物群落多样性亦有明显的相关性,说明多因子共同调控固氮微生物群落。这表明生物结皮的演替可能改变土壤理化性质导致生态位的变化,进而影响其中的固氮微生物群落组成,这在一定程度上也验证了在小尺度上确定性过程在固氮微生物群落构建中发挥着关键作用。
4.3 黄土高原水蚀风蚀交错区固氮微生物的固氮潜力
在草原土壤中,研究证明固氮微生物β-多样性与固氮酶活性具显著相关性[46]。在黄土高原水蚀风蚀交错区,本研究表明固氮酶活性、nifH基因丰度、固氮微生物α-多样性均随生物结皮的演替呈显著升高,而生物结皮中TN与固氮微生物多样性、固氮群落以及关键物种均存在显著正相关关系,说明生物结皮中固氮微生物多样性和数量的增加,其固氮能力明显提升,导致土壤氮素含量的升高。在黄土高原水蚀风蚀交错区,生物结皮中的念珠藻目以及Trichormusvariabilis的丰度与固氮酶活性、固氮微生物nifH基因丰度呈显著正相关关系,这表明与念珠藻目的Trichormusvariabilis相关的OTUs在黄土高原生物结皮氮输入过程中发挥着重要作用。黄土高原水蚀风蚀交错区土壤氮素含量随水土流失损失严重[9],但在生物结皮形成后,土壤TN随生物结皮演替而呈显著上升趋势[40, 49],说明黄土高原生物结皮中的固氮微生物对土壤氮积累具有重要贡献。
5 结论
在黄土高原水蚀风蚀交错区,生物结皮演替显著影响固氮酶活性、nifH基因丰度和固氮微生物α-多样性,各参数表现为藓结皮显著高于其它演替阶段,且生物结皮层高于结皮下层土壤。生物结皮演替对固氮微生物群落组成与结构具有明显影响;在裸地,固氮微生物以变形菌门的红螺菌目、酸硫杆菌目和根瘤菌目为主,而在藻结皮、地衣结皮和藓结皮均表现为蓝藻门的念珠藻目占绝对优势,是固氮微生物的关键类群。念珠藻目以及Trichormusvariabilis的丰度与固氮酶活性、固氮微生物nifH基因丰度呈显著正相关关系,Trichormus相关的类群在黄土高原生物结皮固氮过程中发挥着重要作用。生物结皮演替引起的土壤pH、SOM、TN、土壤含水量等理化性质的变化改变了微生境,进而影响固氮微生物群落结构与多样性,其中pH发挥着关键作用。
