Биоуголь в сочетании с арбускулярными микоризными грибами (АМГ) способствует росту и фотосинтетической способности проростков сои
2023-12-26УЯньлин,ВаньЮйцян,ПолянкоАлисаЮрьевна,СунГэ,КураковАлександрВасильевич,СунФунцян
У Яньлин,Вань Юйцян,Полянко Алиса Юрьевна,Сун Гэ,Кураков Александр Васильевич,Сун Фунцян
(1.Центр инженерных исследований сельскохозяйственных микробологических технологий,Ключевая лаборатория экологического восстановления и использования ресурсов холодных районов в провинции Хэйлунцзян,Ключевая микробиологическая лаборатория в провинции Хэйлунцзян,Биологический интситут,Хэйлунцзянский университет,Харбин 150080,Китай;2.Кафедра микологии и альгологии,биологический факультет,Московский государственный университет имени М.В.Ломоносова,Москва 119992,Россия)
0 Введение
Соя является важной зерновой и масличной культурой в Китае. Из-за несбалансированного питания почвы и отсталой технологии посева урожайность сои снизилась. Китаю приходится в значительной степени полагаться на иностранный импорт для удовлетворения внутреннего спроса на сою[1]. Так что использование устойчивой биотехнологии для улучшения условий роста и постоянного повышения урожайности сои имеет большое стратегическое значение для поддержания устойчивого развития сельского хозяйства и обеспечения национальной продовольственной безопасности. Арбускулярные микоризные грибы (АМГ) могут образовывать микоризно-растительные симбионты с 80% наземных растений[2]. Арбускулярные микоризные грибы могут повышать активность почвенных ферментов и эффективность высвобождения питательных веществ из почвы,тем самым увеличивая биомассу растений-хозяев[3-4]. Кроме того,результаты многочисленных исследований показали,что инокуляция АМГ может значительно повысить чистую скорость фотосинтеза,скорость транспирации и устьичную проводимость листьев растений,одновременно снижая концентрацию межклеточного углекислого газа[5]. Таким образом,инокуляция АМГ в сельскохозяйственном производстве может улучшить фотосинтез растений,тем самым способствуя их росту и развитию.
Биоуголь представляет собой богатый углеродом побочный продукт,получаемый в результате пиролиза биомассы в анаэробных условиях и играющий важную роль в сельскохозяйственном производстве и смягчении последствий изменения климата[6]. Применение биоугля может стимулировать рост растений,повышать эффективность поглощения питательных веществ растениями и улучшать фотосинтетическую активность растений[7-12]. Кроме того,долгосрочные эксперименты по позиционированию доказали,что применение биоугля может значительно увеличить общее содержание хлорофилла,чистую скорость фотосинтеза и устьичную проводимость листьев картофеля,а также значительно снизить скорость транспирации картофеля[13],тем самым косвенно влияя на процесс роста и развития растений.
В настоящее время многие исследования доказали,что биоуголь и АМГ могут стимулировать рост растений[14-16]. Тем не менее,исследования по совместному применению по-прежнему невелики,в частности,влияние на рост проростков растений после введения биоугля и АМГ в разных концентрациях остается неясным. Поэтому в этом исследовании был разработан эксперимент выращивания сои в горшках для изучения влияния взаимодействия биоугля и АМГ в различных концентрациях на рост проростков сои,чтобы заложить теоретическую основу для эффективной выращивания сои.
1 Материалы и методы
1.1 Материалы испытаний
В этом исследовании использовалась соя Хэйнун № 84 в качестве тест-растений,чьи семена были получены из Хэйлунцзянской академии сельскохозяйственных наук. Тест- АМГ былRhizophagusIntraceradices(RI). Содержание спор составляло около 25 ш/г инокулятов.RhizophagusIntraceradicesбыл размножен и сохранен Ключевой лабораторией экологического восстановления холодных районов Хэйлунцзянского университета. Инокуляты состояли из спор,мицелий и фрагментов микоризы. В качестве биоугля использовался биоуголь из кукурузной соломы (температура карбонизации при термическом пиролизе 500 ℃),предоставленный Ляонинской компанией сельскохозяйственной науки и техники Цзиньхэфу.
Тест-почва была собрана в кампусе Хулань при Хэйлунцзянском университете. Поверхностная почва (0~20 см) была собрана,примеси с поверхности были удалены,почва была пропущена через сито 2 мм,а затем подвергнута стерилизации под высоким давлением (2 часа,121 ℃),сушили естественным путем на воздухе и сохраняли для дальнейшего использования. pH почвы составляет 6.56,доступный фосфор -59.60 мг/кг,доступный калий -121.70 мг/кг,общее содержание азота -8.35 г/кг.
1.2 Экспериментальный проект
Этот эксперимент проводился в световой комнате культуры биологического института Хэйлунцзянского университета. Эксперимент выращивания сои в горшках начался 16 ноября 2022 года и включал в общей сложности 6 обработок:(1) без применения биоугля,без инокуляции АМГ(CK);(2) отдельная инокуляция АМГ (RI);(3) количество вносимого биоугля составляет 2% (2%C,массовое соотношение,то же,что указано ниже);(4)АМГ инокулируется и 2% биоугля (RI+2%C);(5)количество вносимого биоугля составляет 5% (5%C);(6) AMF инокулируется и 5% биоугля (RI+5%C). Каждую обработку повторяли с 6 горшками,в общей сложности 36 горшков.
обработка АМГ и биоугля:Общий вес каждого горшка составлял 3 500 г. В отношении обработок с инокуляциями АМГ (т.е. RI,RI+2%C,RI+5%C)инокулировали 5% инокулянта в каждом горшке в зависимости от массы. В отношении обработок без инокуляций АМГ(т.е. CK,2%C,5%C)добавляли в каждый горшок равную массу стерилизующего инокулянта и 10 мл микоризного фильтрата[17]. Для обработок с применением биоугля (т. е. RI+2%C,2%C,RI+5%C,5%C)добавляли 2% или 5% биоугля соответственно в соответствии с массовым соотношением,а затем добавляли соответствующее количество почвенной матрицы,чтобы обеспечить вес каждого горшка 3 500 г.
В качестве экспериментального контейнера для культивирования был выбран пластиковый горшок прямоугольной формы (верхний диаметр 33 см × 16 см,нижний диаметр 25 см × 10 см,высота 12 см),в каждый горшок равномерно высевали по 12 семян сои и прореживали всходы через 15 дней,оставляя в каждом горшке по пять проростков растений с одинаковым потенциалом для роста,помещали совершенно случайным образом все обработки. Каждые три дня горшки менялись местами,чтобы сохранить одиноковые факторы окружающей среды.
1.3 Определение показателей испытаний
1.3.1 Определение уровня инфицирования сои АМГ
Корни сои брали примерно через 30 дней после появления всходов и определяли уровень микоризной инфекции с помощью окрашивания трипановым синим[18]. Случайным образом выбирали от 50 до 100 сегментов корней сои (длиной около 1 см),промывали их,затем проводили прозрачность,подкисление,окрашивание,обесцвечивание,таблетирование и микроскопическое наблюдение,в конечном итоге рассчитывали степень инфицирования АМГ по следующей формуле.
Уровень микоризного инфекции = (количество сегментов корней,инфицированных АМГ / общее количество наблюденных сегментов корней)× 100%
1.3.2 Определение показателей роста проростков сои
Сои собирали примерно через 30 дней после роста. Были взяты основные стебли проростков сои в каждой обработке,была измерена высота растений и толщина стеблей проростков сои,было взято среднее значение трех измерений.
Собранные проростки сои ополаскивали деионизированной водой,затем растения разделяли ножницами на надземную и подземную части и оставляли сушиться на воздухе в течение 72 часов. Затем помещали проростки в термостат для высушивания до постоянного веса,взвешивали и записывали сухую массу надземных и подземных проростков растений.
1.3.3 Определение параметров фотосинтетического газообмена,параметров флуоресценции хлорофилла и кривой светочувствительности проростков сои
Портативная фотосинтетически-флуоресцентная система измерения GFS-3000 (Heinz Walz GmbH,Германия)использовалась для измерения параметров фотосинтетического газообмена,параметров флуоресценции хлорофилла и кривой светочувствительности проростков сои. С 9:00 до 11:00 16 декабря 2022 года для измерения соответствующих показателей отбирали растения c одинаковым потенциалом для роста,и каждую обработку повторяли три раза. При измерении параметров фотосинтетического газообмена выбранными источниками света являлись красный и синий свет,интенсивность света составляла 1 000 мкмоль/(м2·с),концентрация CO2в баллоне контролировалась на уровне 420 мкмоль/с,температура листовой камеры составляла 26 ℃±1 ℃. Показатели измерения включали чистую скорость фотосинтеза (Pn),устьичную проводимость (Rs),межклеточную концентрацию CO2(Ci)и скорость транспирации (Tr).
После обработки листьев проростков сои в темноте в течение 30 минут измеряли параметры флуоресценции хлорофилла. Показателями для измерения параметров флуоресценции хлорофилла являлись максимальная эффективность флуоресценции (Fv/Fm),эффективность PSⅡ (выход),кажущаяся скорость фотосинтетического переноса электронов (ETR),коэффициент фотохимического тушения (qP)и коэффициент нефотохимического тушения (qN).
Перед измерением кривой светочувствительности необходимо провести световую индукцию в течение 30 минут при интенсивности света 1 400 мкмоль/(м2·с),чтобы гарантировать полное отражение фотосинтетической способности растения. Интенсивность света (PAR)была установлена на уровне 1 800,1 400,1 000,800,600,400,200,100,50,0 мкмоль/(м2·с)соответственно (10 градиентов). Для максимальной чистой скорости фотосинтеза (Amax),точки световой компенсации (Lcp),точки светового насыщения (Lsp)и кажущейся квантовой эффективности (AQY)были проведены расчеты в соответствии с использованием модели непрямоугольной гиперболической коррекции[19].
1.4 Анализ данных
Данные были обработаны с помощью программного обеспечения Excel и SPSS и рисунки были нарисованы с использованием программного обеспечения Prism9 и SigmaPlot14.0. Однофакторный дисперсионный анализ SPSS использовался для сравнения значительных различий между методами обработки,а тест множественного диапазона Дункана использовался для проверки значимости различий (P<0.05). Двухфакторный дисперсионный анализ использовался для анализа значительных эффектов отдельной инокуляции АМГ,применения биоугля и взаимодействия между ними.
2 Результаты
2.1 Уровень микоризной инфекции
Гифы и везикулярные структуры появлялись в корнях проростков сои после инокуляции RI,причем интенсивность инфекций при обработке RI+2%C была самой высокой,составляя 76.67%,по сравнению с отдельной инокуляции RI значительно больше на 17.65% (P<0.05). По мере увеличения количества применения биоугля уровень микоризной инфекции имел тенденцию сначала возрастать,а затем снижаться,и разница была чрезвычайно значительной (P<0.001)(рис. 1).
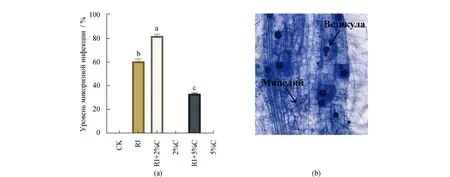
Рисунок 1 Уровень микоризной инфекции в корневой системе проростков сои при разными обработкамиВ результате получается среднее значение ± стандартное отклонение от троекратного повторения,а различные буквы указывают на статистическую разницу между различными обработками (P<0.05). (a)Уровень микоризной инфекции при разными обработками;(b)Колонизация AMГ в корневой системе проросков сои под оптическим микроскопом (в 400 раз)по отношению к обработке RI + 2% C
2.2 Влияние биоугля в сочетании с RI на биомассу проростков сои
По сравнению с CK отдельная обработка RI значительно увеличила биомассу проростков сои(рис. 2). Существенно возросли наземная,подземная и общая биомасса соответственно на 80.77%,52.94% и 80.00% (P<0.05). Обработка RI + 2%C значительно увеличила надземную,подземную и общую биомассу по сравнению с другими обработками (P<0.05). По сравнению с CK,только лишь 2% биоугля смогло значительно увеличить наземную биомассу проростков сои (P<0.05),в то время как 5% C не повлияло на биомассу проростков сои.
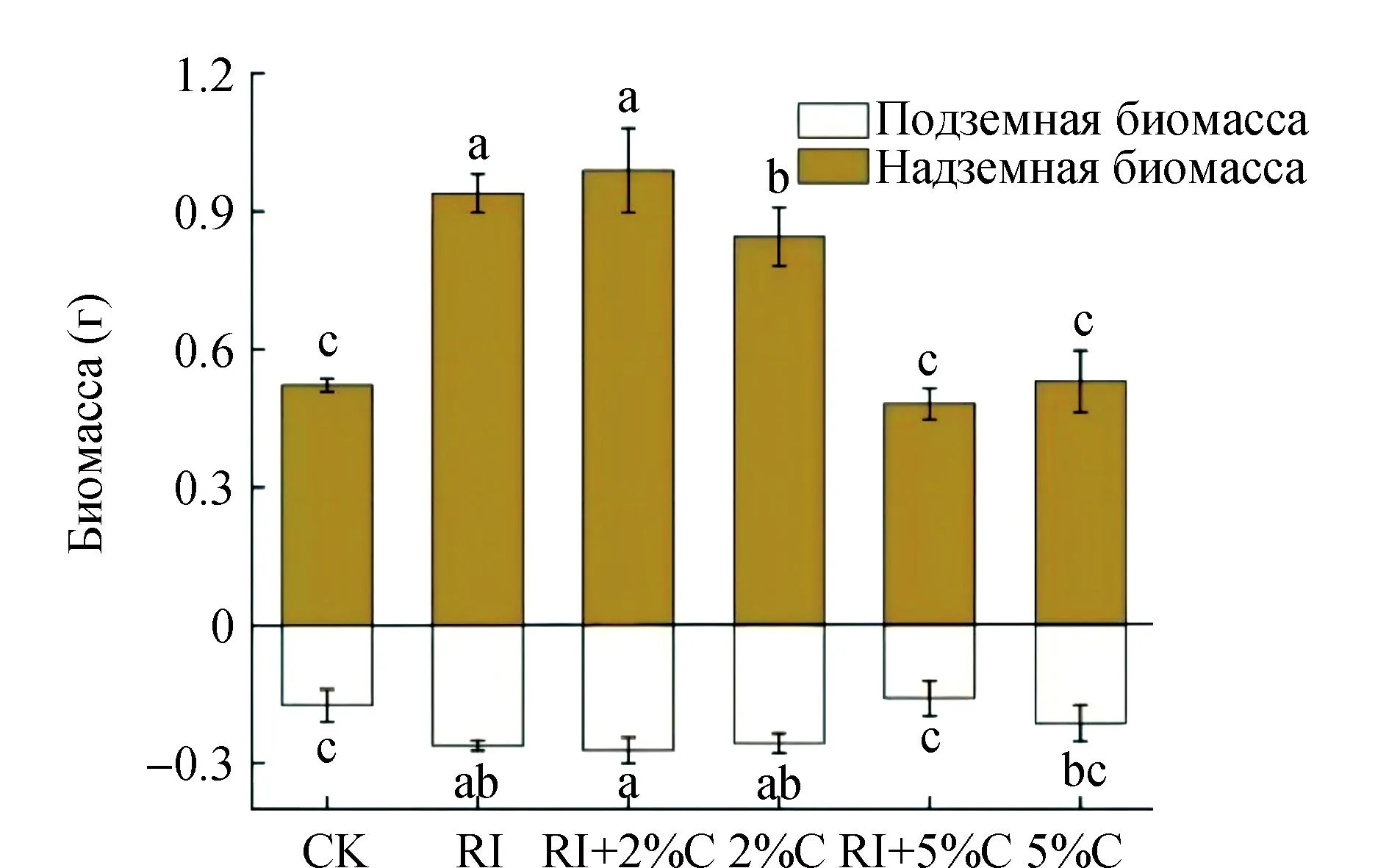
Рисунок 2 Надземная и подземная биомасса проростков сои при разными обработкамиВ результате получается среднее значение ± стандартное отклонение,а различные буквы указывают на статистическую разницу между различными обработками (P<0.05).
2.3 Влияние биоугля в сочетании с АМГ на фотосинтетическую способность проростков сои
Чистая скорость фотосинтеза влияет на накопление органических веществ растениями,а совместное применение биоугля и АМГ способствует фотосинтезу растений. По сравнению с CK обработка RI + 2% C привела к значительному увеличению скорости чистого фотосинтеза проростков сои на 30.12%,обработка RI значительно увеличила скорость чистого фотосинтеза на 25.97% (P<0.05),а другие обработки не оказывали значительных влияний (рис. 3a). После инокуляции AMГ скорость транспирации проростков сои значительно увеличилась на 22.58% (P<0.05)по сравнению с обработкой CK. По мере увеличения применения биоугля скорость транспирации проростков сои продемонстрировала тенденцию сначала увеличиваться,а затем снижаться,а обработка RI + 2% привела к максимальной скорости транспирации листьев проростков и показала значительные различия по сравнению с CK (P<0.05)(рис. 3b).
После совместного применения биоугля и RI,устьичная проводимость проростков сои значительно возросла. Как обработка RI+2%C,так и обработка RI+5%C были значительно выше,чем CK (P<0.05). Обработка RI значительно увеличила устьичную проводимость проростков сои,обработанных CK,на 93.54% (P<0.05)(рис. 3c). По сравнению с CK каждая обработка значительно снизила межклеточную концентрацию CO2в проростках сои (P<0.05),что свидетельствует о том,что совместное применение биоугля и AMГ снизило межклеточную концентрацию CO2в листьях проростков (рис. 3d),и взаимодействие между ними оказало чрезвычайно значительное влияние на межклеточную концентрацию CO2в проростках сои (P<0.001).
2.4 Влияние биоугля в сочетании с АМГ на параметры флуоресценции хлорофилла проростков сои
Динамика флуоресценции хлорофилла играет важную роль в изучении фотосинтетического физиологического состояния растений. Среди них исходная эффективность преобразования световой энергии PSⅡ (Fv/Fm)может представлять эффективность преобразования световой энергии реакционного центра PSⅡ. Максимальная эффективность флуоресценции(Fv/Fm) в каждой обработке была выше,чем в CK,но незначительно (рис.4а). Максимальная эффективность флуоресценции(Fv/Fm) в обработке RI+2%C увеличилась больше всего по сравнению с CK,что указало на то,что совместное применение 2% биоугля и RI может эффективно улучшить процесс фотосинтеза растений.
Кажущаяся скорость фотосинтетического переноса электронов(ETR)при отдельной инокуляцией RI была значительно выше,чем при CK,а коэффициент нефотохимического тушения(qN)при отдельной инокуляцией RI был значительно ниже,чем при CK (P<0.05). По сравнению с CK,ETR при обработке RI+2%C была значительно выше (P<0.05),аqNбыл значительно ниже (P<0.05). Однако,когда количество применения биоугля увеличилось до 5%,ETR при обработке RI+5%C была значительно ниже,чем у обработки RI (P<0.05)(рис.4b).
2.5 Влияние биоугля в сочетании с AMГ на кривую светочувствительности проростков сои
Была установлена тенденция изменения чистой скорости фотосинтеза (A) под 10 различной интенсивностью света (PAR),и обнаружено,что A имеет отношение экспоненциальной функции с увеличением PAR,и аппроксимация отличная (R2>0.99). Когда PAR находится на 0~500 мкмоль/м2/с,A увеличивалась с увеличением PAR. Однако,когда PAR увеличилась до 1 000 мкмоль/м2/с,A началась больше не увеличиваться и показала тенденцию стабилизироваться (рис.5). Максимальная чистая скорость фотосинтеза(Amax)при RI+2%C значительно выше,чем при CK,и значительно выше,чем при других обработках,что указало на то,что фотосинтетическая активность является самой сильной при совместного применения 2%C и RI.
Результаты исследования показали,что кажущаяся квантовая эффективность фотосинтеза (AQY)каждой обработки существенно не изменилася (табл.1). Как отдельная инокуляционная обработка RI,так и совместное применение могут значительно повыситьAmaxи точка светового насыщения(Lsp)проростков (P<0.05). Среди них наибольший стимулирующий эффект оказала обработка RI+2%C. По сравнению с CKAmaxиLspпри обработке RI+2%C значительно увеличились на 37.38% и 28.80%,соответственно (P<0.05),точка световой компенсации(Lcp)значительно снизилася на 31.63% (P<0.05). Результаты показали,что совместное применение биоугля и RI может повысить эффективность использования света и способность накапливать сухое вещество проростков сои.
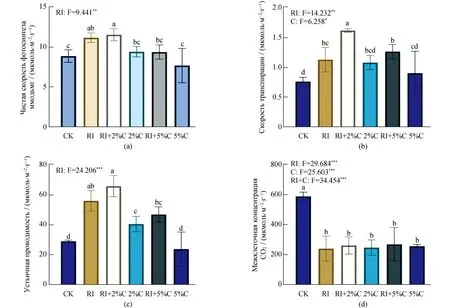
Рисунок 3 Изменение фотосинтетической способности проростков сои при различных обработкахВ результате получается средние значения ± стандартное отклонение от троекратного повторения. Разные буквы обозначают различия между разными обработками (P<0.05). (а)Чистая скорость фотосинтеза сои при различных обработках;(b)Скорость транспирации проростков сои при различных обработках;(c)Устьичная проводимость проростков сои при различных обработках;(d)Межклеточная концентрация CO2 проростков сои при различных обработках.

Таблица 1 Максимальная чистая скорость фотосинтеза(Amax),точка световой компенсации(Lcp),точка светового насыщения(Lsp)и кажущаяся квантовая эффективность фотосинтеза(AQY)для каждой обработки
3 Обсуждение
3.1 Влияние совместного применения биоугля и АМГ на уровень инфекции АМГ сои и рост проростков
Арбускулярные микоризные грибы (АМГ)могут инфицировать корневую систему сои,помогать корневой системе сои получать больше питательных веществ и способствовать росту проростков сои. Развитая пористая структура биоугля может обеспечить среду обитания для АМГ и почвенных микроорганизмов[20]. Их совместное применение может повысить плодородие почвы и водоудерживающую способность,тем самым способствуя росту растений. Figueiredo C.C.d[21]и др. обнаружили,что биоуголь может значительно увеличить колонизацию АМГ и улучшить способность мицелиевой сети поглощать питательные вещества. В этом исследовании уровень микоризной инфекции показал тенденцию сначала к увеличению,а затем к снижению с увеличением дозы внесения биоугля. Когда доза внесения биоугля составила 2%,уровень микоризной инфекции достигла своего пика и показала лучшую сродство с проростков сои (рис. 1).
Биомасса может напрямую характеризовать состояние роста растений и является важным параметром роста растений. Совместное применение биоугля и АМГ позволяет увеличить накопление биомассы растений[22]и улучшить условия роста растений. В этом исследовании биомасса растений при совместной обработке биоугля (2% C)и АМГ была значительно выше,чем при CK (рис. 2),а стимулирующий рост эффект совместного применения был значительно лучше,чем при отдельной обработке из двух. Это согласуется с работой Ohsowski B.M[23].
3.2 Влияние совместного применения биоугля и АМГ на параметры фотосинтетического газообмена проростков сои
После того,как АМГ инфицирует растение-хозяин,он образует арбускулярный микоризный симбиоз с растением,который может образовывать огромную сеть мицелия и объединяться с пористой структурой биоугля,помогая частицам почвы образовывать стабильные агрегаты[24]и повышать способность растений поглощать питательные вещества почвы и улучшать фотосинтез растений.
В этом исследовании совместное применение биоугля и АМГ значительно увеличило чистую скорость фотосинтеза,устьичную проводимость и скорость транспирации проростков сои,а также значительно снизило межклеточную концентрацию CO2(рис. 3),что согласуется с результатами предыдущих исследований[25],что указало на то,что совместное применение биоугля и АМГ эффективно повышает эффективность использования световой энергии проростками сои. Данное исследование показало,что совместная обработка более эффективна,чем отдельная инокуляция АМГ,вероятно,потому,что совместное применение может значительно увеличить содержание хлорофилла в листьях растений,тем самым повышая фотосинтетическую способность растения[26].
3.3 Влияние совместного применения биоугля и АМГ на параметры флуоресценции хлорофилла проростков сои
Параметры флуоресценции хлорофилла имеют характеристики,отражающие внутренность растений. Они используются для описания фотосинтетического механизма и фотосинтетических физиологических состояний растений. Они являются важными параметрами,характеризующими поглощение,передачу,диссипацию и распределение фотосинтетической энергии в растениях[27]. Максимальная эффективность флуоресценции(Fv/Fm) может отражать активный центр PSⅡ растения и степень фотоингибирования. В условиях стрессаFv/Fmрастений значительно снижалась,а в нестрессовых условиях измененияFv/Fmпрактически не наблюдались. В этом исследовании не было значительной разницы вFv/Fmмежду разными обработками,и на нее не влияло взаимодействие биоугля и АМГ (рис. 4).
Wang S и др.[28]обнаружили,что применение биоугля может увеличить коэффициент фотохимического тушения (qP)растений и снизить коэффициент нефотохимического тушения (qN),уменьшая рассеивание тепловой энергии для растений. В этом исследованииETR,выход иqPдля обработки RI+2%C были выше,чем для CK,аqNдля обработки RI+2%C был ниже,чем для CK (рис. 4),что указало на то,что совместное применение 2%C и RI может эффективно увеличить скорость переноса электронов и эффективность захвата световой энергии PSⅡ,снижая рассеивание тепла для листьев растений,тем самым улучшая фотозащитную способность растения.
Однако,когда доза применения биоугля увеличилась до 5%,параметры флуоресценции хлорофилла растений изменились. Кажущаяся скорость фотосинтетического переноса электронов(ETR)при обработке RI+5% была значительно ниже,чем при обработке отдельной инокуляцией RI. Это может быть связано с перевернутой U - образной зависимостью между дозой биоугля и ростом проростков. Низкие дозы биоугля будут стимулировать рост проростков,тогда как высокие дозы биоугля будут снижать антиоксидантную ферментативную активность проростков растений[29],тем самым подавляя фотосинтетические физиологические состояния и рост проростков.
3.4 Влияние совместного применения биоугля и АМГ на кривую светочувствительности проростков сои
Кривая светочувствительности растений состоит из параметров фотосинтеза,таких как максимальная чистая скорость фотосинтеза (Amax),точка световой компенсации (Lcp),точка светового насыщения (Lsp),квантовый выход (AQY)и т. д. Эти параметры помогают понять световые потребности растений и дают теоретическое руководство для анализа эффективности использования света растениями[30]. Данное исследование показало,что тенденция изменения кривых светочувствительности между обработками была схожей. По мере увеличения PAR чистая скорость фотосинтеза растений показала тенденцию сначала быстро расти,а затем стабилизироваться (рис. 5). В этом исследованииAmaxиLspпо отнонению к обработке 2%С+RI были значительно выше,чем по отношению к другим обработкам,аLcpбыла значительно ниже,чем по отношению к другим обработкам,что указало на то,что совместное применение AMF и 2% биоугля может эффективно повысить фотосинтетическую способность проростков сои и эффективность использования света при сильном и слабом освещении. Однако механизм влияния взаимодействия АМГ и биоугля на фотосинтетические характеристики проростков сои неясен,возможно,это связано с тем,что биоуголь увеличивает количество доступных питательных веществ в почве и изменяет содержание доступного фосфора и магния[31],что влияет на каналы передачи сигналов между растениями и AMГ,усиливая поглощение растениями магния и тем самым улучшая способность растений к фотосинтезу.
4 Выводы
Совместное применение 2% биоугля иRhiaophagusintraradices(RI)улучшило параметры фотосинтетического газообмена и параметры флуоресценции хлорофилла проростков сои,защитило систему PSⅡ проростков сои за счет увеличения устьичной проводимости листьев и энергии переноса электронов,повысило эффективность использования света проростками сои,значительно увеличило рост и биомассу проростков сои. Результаты данного исследования обеспечивают теоретическое руководство и практическую ценность для производства сои в нашей стране и имеют большое значение для устойчивого развития сельского хозяйства нашей страны.
Литература:
[1] Liang J,Wu H,Feng J,et al. Current situation,main problems and development strategies of soybean production in Sichuan[J]. Soybean Science &Technology,2020(3):7-10.
[2] Bender S F,Plantenga F,Neftel A,et al. Symbiotic relationships between soil fungi and plants reduce N2O emissions from soil[J]. ISME Journal,2014,8(6):1336-1345.
[3] Zaller J G,Frank T,Drapela T. Soil sand content can alter effects of different taxa of mycorrhizal fungi on plant biomass production of grassland species[J]. European Journal of Soil Biology,2011,47(3):175-181.
[4] Qin M,Zhang Q,Pan J,et al. Effect of arbuscular mycorrhizal fungi on soil enzyme activity is coupled with increased plant biomass[J]. European Journal of Soil Biology Science,2020,71(1):84-92.
[5] Cho E J,Lee D J,Wee C D,et al. Effects of AMF inoculation on growth of Panax ginseng CA Meyer seedlings and on soil structures in mycorrhizosphere[J]. Scientia Horticulturae,2009,122(4):633-637.
[6] Lehmann J,Cowie A,Masiello C A,et al. Biochar in climate change mitigation[J]. Nature Geoscience,2021,14(12):883-892.
[7] Mitchell K,French E,Beckerman J,et al. Biochar alters the root systems of large crabgrass[J]. Hortscience,2018,53(3):354-359.
[8] Hou J,Pugazhendhi A,Sindhu R,et al. An assessment of biochar as a potential amendment to enhance plant nutrient uptake[J]. Environmental Research,2022,214:113909.
[9] Yan P,Shen C,Zou Z,et al. Biochar stimulates tea growth by improving nutrients in acidic soil[J]. Scientia Horticulturae,2021,283:110078.
[10] Hossain M Z,Bahar M M,Sarkar B,et al. Biochar and its importance on nutrient dynamics in soil and plant[J]. Biochar,2020,2(4):379-420.
[11] Farhangi-Abriz S,Ghassemi-Golezani K,Torabian S,et al. A meta-analysis to estimate the potential of biochar in improving nitrogen fixation and plant biomass of legumes[J]. Biomass Conversion and Biorefinery,2022.
[12] Lebrun M,Miard F,Nandillon R,et al. Biochar application rate:Improving soil fertility and linum usitatissimum growth on an arsenic and lead contaminated technosol[J]. International Journal of Environmental Research,2021,15(1):125-134.
[13] Ullah Z,Ali S,Muhammad N,et al. Biochar impact on microbial population and elemental composition of red soil[J]. Arabian Journal of Geosciences,2020,13(16):757-765.
[14] Farhangi-Abriz S,Ghassemi-Golezani K. Improving electrochemical characteristics of plant roots by biochar is an efficient mechanism in increasing cations uptake by plants[J]. Chemosphere,2023,313:137365.
[15] Guo C X,Pan Z Y,Peng S. Effect of biochar on the growth of Poncirus trifoliata (L.)Raf seedlings in Gannan acidic red soil[J]. Soil Science and Plant Nutrition,2016,62(2):194-200.
[16] Jabborova D,Annapurna K,Paul S,et al. Beneficial features of biochar and arbuscular mycorrhiza for improving spinach plant growth,root morphological traits,physiological properties,and soil enzymatic activities[J]. Journal of Fungi,2021,7(7):571-586.
[17] Ping G,Yingde L,Yane G,et al. Co-inoculation of lucerne (Medicago sativa)with an AM fungus and a rhizobium reduces occurrence of spring black stem and leaf spot caused by Phoma medicaginis[J]. Crop and Pasture Science,2018,69(9):933-943.
[18] Liu R,Chen Y. Mycorrhizology[M].Beijing:Science in China Press,2007.
[19] Zi-Piao Y E,Hua-Jing K. Study on biological significance of coefficients in modified model of photosynthesis-irradiance[J]. Journal of Yangzhou University(Agricultural and Life Science Edition),2012,33(2):51-57.
[20] Harun N S N,Jaafar N M,Sakimin S Z. The effects of rice husk biochar rate on arbuscular mycorrhizal fungi and growth of soursop (AnnonamuricataL.)seedlings[J]. Sustainability,2021,13(4):1817-1827.
[21] de Figueiredo C C,Farias W M,Coser T R,et al. Sewage sludge biochar alters root colonization of mycorrhizal fungi in a soil cultivated with corn[J]. European Journal of Soil Biology,2019,93:103092.
[22] Ndiate N I,Saeed Q,Haider F U,et al. Co-application of biochar and arbuscular mycorrhizal fungi improves salinity tolerance,growth and lipid metabolism of maize (ZeamaysL.)in an Alkaline soil[J]. Plants-Basel,2021,10(11):2490-2506.
[23] Moland S,Robicheau B M,Browne R,et al. Determining the effects of biochar and an arbuscular mycorrhizal inoculant on the growth of fowl mannagrass (Glyceria striata)(Poaceae)[J]. Facets,2018,3(1):441-454.
[24] Zhao Z,Chen L,Xiao Y. The combined use of arbuscular mycorrhizal fungi,biochar and nitrogen fertilizer is most beneficial to cultivate Cichorium intybus L. in Cd-contaminated soil[J]. Ecotoxicology and Environmental Safety,2021,217:112154.
[25] Ohsowski B M,Dunfield K,Klironomos J N,et al. Plant response to biochar,compost,and mycorrhizal fungal amendments in post-mine sandpits[J]. Restoration Ecology,2018,26(1):63-72.
[26] Li J W,Yue F X,Wang Y F,et al. Effects of biochar amendment and arbuscular mycorrhizal inoculation on maize growth and physiological biochemistry under cadmium stress[J]. Acta Prataculturae Sinica,2018,27(5):120-129.
[27] Zheng W,Lu X,Li Y,et al. Hyperspectral identification of chlorophyll fluorescence parameters of suaeda salsa in coastal wetlands[J]. Remote Sensing,2021,13(11):2066-2085.
[28] Wang S,Zheng J,Wang Y,et al. Photosynthesis,chlorophyll fluorescence,and yield of peanut in response to biochar application[J]. Frontiers in Plant Science,2021,12:650432.
[29] Li Y,Shen F,Guo H,et al. Phytotoxicity assessment on corn stover biochar,derived from fast pyrolysis,based on seed germination,early growth,and potential plant cell damage[J]. Environmental Science and Pollution Research,2015,22(12):9534-9543.
[30] Rafique M,Ortas I,Rizwan M,et al. Effects of Rhizophagus clarus and biochar on growth,photosynthesis,nutrients,and cadmium (Cd) concentration of maize (Zea mays)grown in Cd-spiked soil[J]. Environmental Science and Pollution Research,2019,26(20):20689-20700.
[31] He L,Li C,Liu R. Indirect interactions between arbuscular mycorrhizal fungi and Spodoptera exigua alter photosynthesis and plant endogenous hormones[J]. Mycorrhiza,2017,27(6):525-535.
