质子辐射对人恶性黑色素瘤A375细胞的DNA损伤影响研究
2023-12-26王巧娟刘建成马立秋
王巧娟,隋 丽,*,刘建成,汪 越,马立秋,朱 润,郭 刚,*
(1.中国原子能科学研究院,北京 102413;2.国家原子能机构抗辐照应用技术创新中心,北京 102413)
黑色素瘤全称为恶性黑色素瘤,是一种具有高侵袭性、恶性度高、预后差和死亡率高等特点的恶性肿瘤,多发生于皮肤,也会出现在黏膜和内脏。近年来,恶性黑色素瘤的发生率和死亡率逐步上升,虽然皮肤黑色素瘤仅占皮肤恶性肿瘤的第3位(约占6.8%~20%),但其死亡率却占皮肤恶性肿瘤的第1位[1-2],2020年全球癌症统计中,新增黑色素瘤病例32万以上,新增死亡病例5.7万[3]。此外,2022年《柳叶刀》发表的首个针对我国儿童和青少年癌症发病率的数据显示,青少年中恶性上皮癌和黑色素瘤居第一[4]。
黑色素瘤常用的治疗方法有手术切除、免疫疗法、化疗和放射治疗,但手术切除会造成部分功能丧失或出现不良并发症,化疗和免疫疗法有较高的不良反应发生率[5],黑色素瘤对常规放疗高度抗拒,因此,常规放疗在黑色素瘤的临床应用中受到一定限制。随着核技术的飞速发展,粒子束治疗成为治疗恶性肿瘤的重要手段之一[6]。质子束同时拥有优越的肿瘤物理剂量分布和良好的生物效应双重优势,已成为国际上治疗肿瘤的重要物理疗法之一[7-11]。国际粒子治疗协作委员会(PTCOG)2022年9月发布的最新数据显示,截至2021年底,全球接受质子重离子治疗的患者已超过32万例,其中接受质子治疗的患者近28万例。因此,质子束在治疗具有辐射抗性的黑色素瘤中具有潜在应用价值。已有的临床数据显示,质子治疗葡萄膜黑色素瘤(一种眼部黑色素瘤),可以达到较高的生存率(5年生存率在80%以上)和较好的预后[12],但这些报道大多都是回顾性或术后随访研究,对于质子治疗黑色素瘤的具体机理机制的研究较少。
因此,本研究拟利用北京HI-13串列加速器提供的15 MeV质子及标准钴源提供的γ射线,以人恶性黑色素瘤A375细胞为研究对象,以肿瘤放疗中常规分割(约2 Gy)和大分割(通常为3~5 Gy,甚至会高达8 Gy)两种分割疗法中常用的剂量为参考,选择辐照剂量为1、2、4、8 Gy,以与DNA损伤相关的细胞存活、细胞周期、细胞凋亡以及γH2AX表达为生物学终点指标,开展不同射线对A375细胞损伤效应研究,以期为质子治疗黑色素瘤的优化提供基础数据。
1 实验材料与方法
1.1 细胞及其培养
人恶性黑色素瘤A375细胞,国家实验细胞资源共享平台——协和细胞资源中心;胎牛血清和DMEM培养基,Hyclone公司。
细胞培养:将A375细胞置于含10%胎牛血清的DMEM培养基中,在37 ℃、含5% CO2、饱和湿度的培养箱中培养,细胞增殖至80%~90%融合时进行传代培养。辐照实验前24 h将A375细胞接种于培养皿内,用于细胞克隆存活、细胞周期和细胞凋亡实验;免疫荧光实验样品于照射前24 h接种于盖玻片上,置于培养皿内培养。
1.2 辐照实验
本研究采用的细胞克隆、细胞周期、细胞凋亡和γH2AX检测的实验流程如图1所示。将A375细胞样品随机分为对照组和辐照组,其中,对照组不进行射线诱导,辐照组的照射剂量为1、2、4、8 Gy。对照组和辐照组均设3个平行样品。
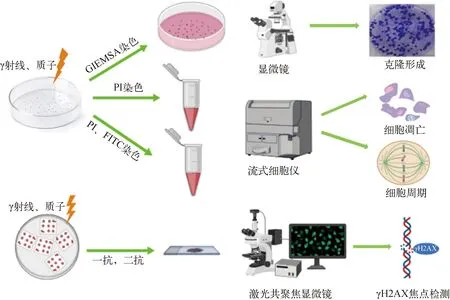
图1 细胞克隆、细胞周期、细胞凋亡和γH2AX焦点检测实验流程图Fig.1 Flow chart of cell cloning, cell cycle, apoptosis and γH2AX focu detection
1) 质子辐照
A375细胞的质子辐照实验在北京HI-13串列加速器上进行。加速器引出的15 MeV质子经异步二维磁铁扩束及均匀化后,从R20支线T4靶室引出,经100 μm封真空膜后引入大气。质子束流穿过用5 μm mylar膜(灭菌)封口的培养皿,到达细胞表面后质子能量降为13.7 MeV,此时的质子传能线密度(LET水)为3.6 keV/μm,质子束斑面积为5.0 cm×5.0 cm。
辐照前利用五路塑料闪烁体探测器对质子束流均匀性进行测量,结果显示均匀性好于97%。然后利用塑料闪烁体探测器S1和CsI闪烁体探测器M在线监测质子注量的相对准确性,通过改变质子注量率,同时监测M和S1在束时60 s内的计数,计算质子注量率,根据式(1)计算照射剂量。调节质子注量率,使照射剂量率为0.8 Gy/min。辐照实验中以上游的M为监督器,监测样品的受照注量。
(1)
式中:D为吸收剂量,Gy;F为质子注量,cm-2;ρ为水的密度,g/cm3。
由于质子束流为水平出射,细胞辐照前先将培养皿中的培养基倒掉,然后用PBS润洗。辐照时将培养皿面向束流进行辐照(图2,箭头所指为细胞样品放置处),辐照完成后立即加入培养基继续培养。

图2 HI-13串列加速器的辐射生物效应研究平台Fig.2 HI-13 tandem accelerator platform for radiation bioeffect research
2) γ射线辐照
A375细胞的60Co γ射线辐照实验在国防科技工业电离辐射一级计量站的γ射线辐照实验室进行,γ射线的LET水为0.3 keV/μm,辐照剂量为1、2、4、8 Gy。
1.3 细胞克隆实验
辐照实验后,立即收集细胞,计数后以单个细胞状态接种于培养皿内,置于37 ℃、含5% CO2、饱和湿度的培养箱中培养10 d。采用Giemsa对细胞染色后,统计细胞数大于50 个的克隆数。按式(2)计算克隆形成率:

(2)
其中,PE为对照组的克隆形成率。
根据克隆形成率绘制剂量-细胞存活曲线,利用线性二次方模型进行拟合,其表达式如下:
S=e-(αD+βD2)
(3)
其中:S为细胞存活率;α为线性效应;β为平方效应。
获取α、β参数后可得到不同射线下细胞的模型方程,采用该方程计算细胞经两种射线照射后的存活率,以γ射线为标准计算质子的相对生物学效应(RBE)。
1.4 细胞周期和凋亡实验
细胞周期测试:辐照后12、24、48 h,收集对照组和辐照组细胞,加入1 mL预冷的75%酒精,-20 ℃固定过夜;弃酒精,PBS清洗后收集细胞,根据细胞量,加入50~300 μL PI染液,室温避光孵育10~15 min,用流式细胞仪检测细胞周期。
细胞凋亡测试:辐照后12、24、48 h,收集对照组和辐照组细胞,加入预先配置好的Binding Buffer溶液,制成终浓度约为1×106mL-1的细胞悬液;取100 μL细胞悬液,分别加入5 μL Annexin V-FITC和PI染液,混匀后,室温避光孵育15 min;再次加入100 μL稀释的Binding Buffer,混匀后立即用流式细胞仪检测。
1.5 辐射诱导细胞γH2AX表达实验
以2 Gy的γ射线和质子辐照A375细胞,辐照后0.5、1、2、4、8、24 h收集长有细胞的玻片,PBS洗2遍后,用4 ℃预冷的4%多聚甲醛固定过夜;用0.3% Triton-100破膜后进行PBS清洗,然后使用3%胎牛血清白蛋白(BSA)常温下封闭1 h;4 ℃孵育抗γH2AX的一抗过夜;用1%BSA清洗后,使用荧光标记的二抗(FITC)室温避光孵育1 h;利用DAPI对细胞样品染色后,再用10%甘油封片。免疫荧光标定后,用激光共聚焦扫描显微镜40×物镜观察γH2AX焦点。
1.6 数据处理
2 结果与讨论
2.1 细胞克隆结果
细胞克隆形成实验是用于检测细胞增殖能力和对杀伤因素敏感性的重要方法,本研究首先从细胞层次研究了不同射线对A375细胞的杀伤效果。γ射线和质子以0、1、2、4、8 Gy剂量辐照A375细胞后,形成的典型克隆结果如图3所示,剂量-存活曲线如图4所示。由图4可看出,在相同射线辐照下,随着剂量的增加,γ射线和质子均能导致细胞的存活率下降;与γ射线的结果相比,相同剂量辐照后,质子辐照造成的A375细胞存活率更低,尤其是在4、8 Gy。

图3 细胞克隆的典型照片Fig.3 Typical pictures of cell clones

图4 A375细胞剂量-存活曲线Fig.4 Dose-survival curve of A375 cell
通过线性二次方模型S=e-(αD+βD2)拟合,可得A375细胞在γ射线和质子辐照后的细胞存活曲线方程及相应的参数α、β及二者的比值α/β,以及细胞10%存活率所对应的辐照剂量(D10),如表1所列。质子的α值大于γ射线的,说明质子的单击效应导致A375细胞的死亡率高于γ射线;质子的α/β值较γ射线高得多,说明当细胞受到质子照射后,其基因组稳定性下降,细胞修复能力变差,在1~8 Gy剂量下,与γ射线相比,A375细胞对质子辐照更敏感。而由存活参数D10可知,在相同存活率时,所需的质子剂量低于γ射线的剂量,这也说明质子对A375细胞的杀伤作用大于γ射线。根据RBE的定义,以γ射线为参考,A375细胞10%存活水平下,13.7 MeV质子的RBE值为1.52。

表1 γ射线及质子辐照后A375细胞的克隆存活参数Table 1 Survival parameters of A375 cell after γ-ray and proton irradiation
本研究中,A375细胞的存活率随剂量的增加(1~8 Gy)而降低,且相比于γ射线,相同剂量的质子辐照后A375细胞存活率更低,该结果与已报道的不同LET的辐射诱导鼠黑色素瘤细胞B16-F0的剂量存活曲线的趋势一致[13]。这可能是由于与低LET辐射相比,高LET的射线可使细胞DNA产生大比例无法修复的双链断裂和集簇性DNA损伤,使细胞呈现较低的存活率。质子辐照时的剂量-存活曲线的α和β值更高,表明质子的单击效应和损伤累积效应更显著,获得的RBE10=1.52,较接近重离子的RBE,说明质子有良好的生物学效应特性。
2.2 细胞周期结果
细胞周期是细胞从一次分裂完成开始到下一次分裂结束所经历的全过程,是细胞增殖过程的控制中心。细胞周期阻滞是细胞对DNA损伤的一种响应方式,当细胞受到外界(如辐射)刺激,引起DNA损伤时会造成细胞周期紊乱。本文以细胞周期为生物学终点指标,检测不同射线辐照后,A375细胞的周期进程随照射剂量和照后时间的变化。
流式细胞仪检测的周期结果如图5所示,对A375细胞辐照后12、24、48 h的周期分布进行统计,结果示于图6,图5中PE-A为PI染色液在流式细胞仪中的通道。由图5~6可知,对于γ射线,辐照后12 h,1~8 Gy诱导A375细胞G1期和G2/M期阻滞,其中,1~4 Gy时的G1期阻滞与对照组相比具有显著性差异(P<0.05),在4 Gy时G1期阻滞最强,G1期细胞由对照组的22.56%增加至4 Gy时的42.09%;2~8 Gy时的G2/M期阻滞与对照组相比具有显著性差异(P<0.05),8 Gy时G2/M期阻滞最强,G2/M期细胞由对照组的19.58%增加至61.05%。辐照后24 h,与对照组相比,辐照组由12 h时的G2/M期阻滞转为明显的G1期阻滞,且与对照组相比有显著性差异(P<0.05),由对照组的34.87%增加至8 Gy时的54.81%。辐照后48 h,与对照组相比,除8 Gy表现为明显的G2/M期阻滞外,1~4 Gy辐射造成的细胞周期阻滞已基本解除。
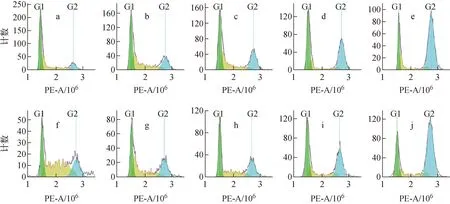
a~e——质子辐照后12 h,辐照剂量为0、1、2、4、8 Gy,f~j——γ射线辐照后12 h,辐照剂量为0、1、2、4、8 Gy图5 流式细胞仪检测的细胞周期结果Fig.5 Diagram of cell cycle result measured by flow cytometry
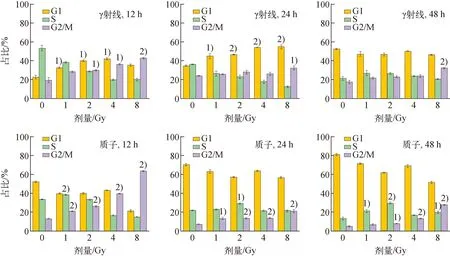
与对照组相比,1) P<0.05,2) P<0.01图6 A375细胞在照后不同时间的周期阻滞结果Fig.6 Cell cycle arrest of A375 cell at different time after irradiation
对于质子辐射,辐照后12 h,辐照组主要表现为G2/M期阻滞,且与对照组有显著性差异(P<0.05),照射剂量越大,G2/M期阻滞越严重,G2/M期阻滞程度由对照组的13.16%增加至8 Gy时的63.67%。辐照后24 h,辐照引起的G2/M期阻滞有所缓解,但1~8 Gy仍表现为G2/M期阻滞,且与对照组相比有显著性差异(P<0.05);辐照后48 h,2~8 Gy诱导的A375细胞的G2/M期阻滞尚未完全解除,且与对照组相比有显著性差异(P<0.05)。
通过对比不同射线对A375周期阻滞的程度可以看出,在辐照后12 h,相同射线条件下,辐照引起的A375细胞G2/M期阻滞程度随照射剂量的增加而增加。随着照后时间的延长,γ射线造成的细胞周期阻滞在48 h时已基本解除,而质子辐照造成的细胞周期阻滞在48 h时,2~8 Gy引起的G2/M期阻滞尚未完全解除,说明质子诱导的A375细胞G2/M期阻滞较γ射线强。
本研究中,辐照诱导A375细胞的周期阻滞程度具有一定的剂量依赖性。γ射线在低剂量诱导G1期阻滞,高剂量诱导G2/M期阻滞,到48 h时低剂量诱导的周期阻滞已基本解除,8 Gy诱导的G2/M期阻滞有所缓解,但没有解除。而质子诱导的A375细胞周期阻滞以G2/M期阻滞为主,到48 h时除1 Gy诱导的周期阻滞已基本解除外,2~8 Gy诱导的G2/M期阻滞有所缓解,但没有解除。说明质子辐射对A375细胞的周期进程影响更大,需要更多的时间来修复损伤。细胞周期阻滞可为DNA损伤修复提供时间,有研究认为正是由于细胞周期阻滞这种细胞的自我保护机制,使得肿瘤细胞能逃避射线的杀伤,进而影响恶性肿瘤的放疗效果[14]。
第三方支付是指具备一定实力和信誉保障的独立机构,通过互联网对接而促成双方进行交易的网络支付模式。第三方支付作为独立的中间平台,它的两端连接着消费者,商户和国内外的各大商业银行,可以提供较为安全,独立,有保障的交易服务。第三方支付已经不仅仅是一种简单的互联网支付,现在运用第三方支付进行线上线下交易已成为主流。两种模式,一种运营模式是完全独立于电子商务网站,仅为用户提供支付解决方案而不负担保功能;另一种以B2C、C2C电子商务网站并提供担保功能的第三方支付模式。
2.3 细胞凋亡结果
射线引起的细胞增殖死亡与细胞分裂过程密切相关,但究其关键,还是靶分子的DNA损伤。当细胞受到外界刺激,诱发DNA损伤时,会启动DNA损伤应答通路,当DNA损伤不能有效修复时,会发生细胞凋亡。本文以细胞凋亡为生物学终点指标,检测不同射线辐照后,A375细胞的凋亡率随照射剂量和照后时间的变化。细胞凋亡率的流式检测结果如图7所示,其中FITC-A为FITC染液在流式细胞仪中的通道。对A375细胞辐照后12、24、48 h不同剂量诱导的细胞凋亡进行统计,结果如表2、3所列。
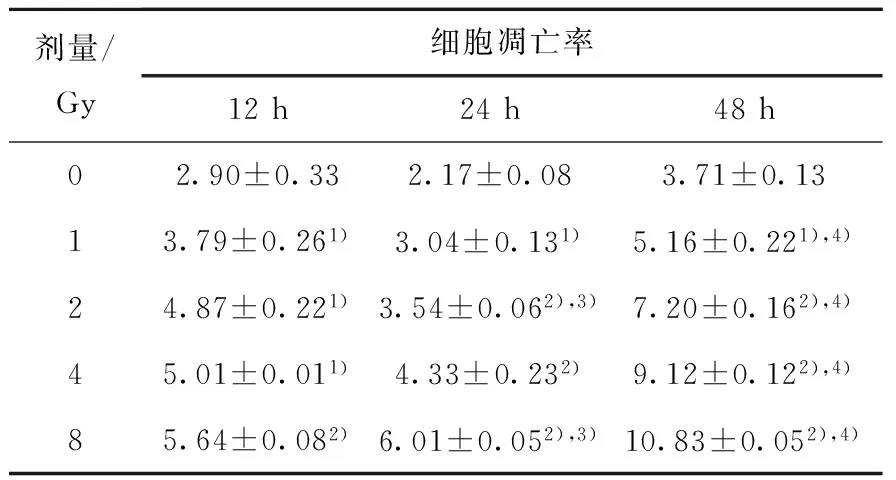
表2 γ射线辐照后12、24、48 h A375细胞凋亡率Table 2 Apoptosis rate of A375 cell induced by γ-ray irradiation after 12, 24 and 48 h

表3 质子辐照后12、24、48 h诱导A375细胞凋亡率的结果Table 3 Apoptosis rate of A375 cells induced by proton irradiation after 12, 24 and 48 h
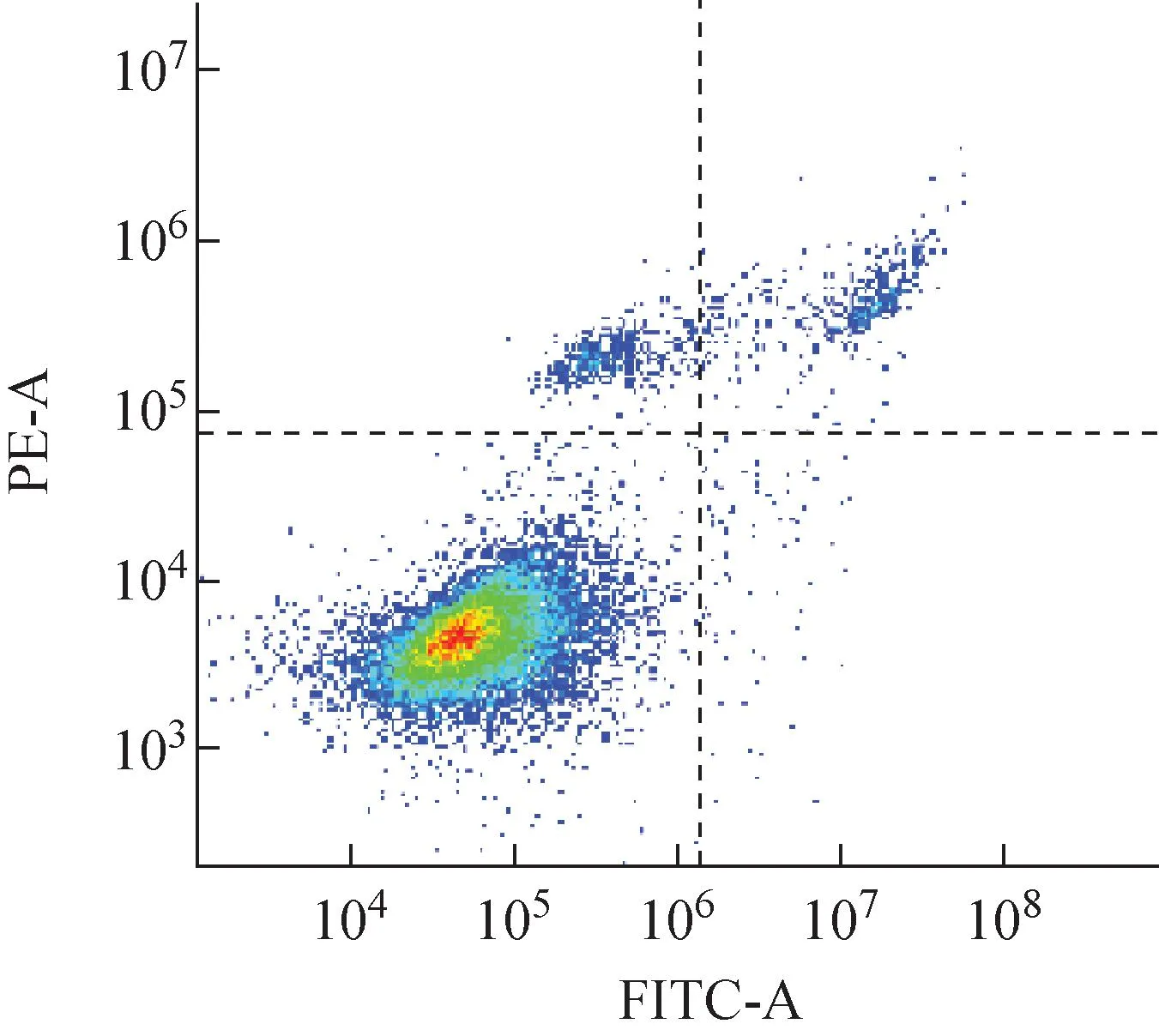
图7 细胞凋亡检测结果Fig.7 Apoptosis detected result
由表2、3可知,A375细胞辐照后12、24、48 h,在相同射线下,在1~8 Gy范围内,细胞凋亡率随辐照剂量的增加而增加,具有剂量依赖性,辐照诱导的凋亡率与对照组相比具有显著性差异(P<0.05)。随着时间的延长,同种射线诱导凋亡比例逐渐增加,γ射线辐照后,48 h相比于24 h有显著性差异(P<0.05),而质子辐射诱导的凋亡,辐照后24 h相比于12 h以及48 h均具有显著性差异(P<0.05)。不同射线辐照相同剂量时,在辐照后12 h,质子辐射诱导的细胞凋亡率与γ射线无显著差异;辐照后24 h,在1~8 Gy剂量辐照下,质子诱导的A375细胞凋亡率显著高于γ射线(P<0.05)。辐照后48 h,辐照剂量为1~2 Gy时,质子诱导的细胞凋亡与γ射线无显著差异,辐照剂量为4~8 Gy时,质子诱导的细胞凋亡显著高于γ射线(P<0.05)。
细胞凋亡是细胞针对所处环境的某种特定因素而产生的一种应答,电离辐射也是环境因素之一。γ射线和质子辐射对A375细胞凋亡的影响如下:1~8 Gy内,随着辐照剂量的增加,细胞的凋亡率也显著升高,具有明显的剂量依赖性;辐照后48 h内,随着时间的延长,细胞凋亡率也逐渐升高,具有较明显的时间依赖性。闵凤玲等[15]比较了等存活剂量的高LET12C6+离子(70 keV/μm,4.2 Gy)和低LET X射线(1.5 keV/μm,7.5 Gy)诱导A375的细胞凋亡,高LET辐射诱导的凋亡细胞比例增加,细胞凋亡高峰出现在辐照后48~72 h,凋亡率最高约为12%。本研究中,4 Gy的13.7 MeV质子辐照后48 h,A375细胞凋亡比例为10.4%,略低于闵凤玲等的结果,根据文献[15]中A375细胞凋亡随时间的变化趋势,推测辐照后72 h,4 Gy质子辐照后A375细胞凋亡比例还会有所增加。
目前,已有研究表明细胞周期和细胞凋亡密切相关[16]。综合分析本研究中不同射线对人黑色素瘤A375细胞的周期和凋亡变化,发现在照后12 h,2、4、8 Gy组均开始出现较明显的凋亡,并随时间的延长而逐渐增多,结合细胞周期变化发现,辐照后12 h,γ射线在辐照2 Gy后开始出现明显G2/M期阻滞,质子在辐照1 Gy后开始出现明显的G2/M期阻滞,这说明A375细胞在周期阻滞启动时,有可能细胞凋亡也被启动。
2.4 A375细胞形成的γH2AX焦点数和大小
在对电离辐射诱导的DNA双链断裂(DSB)的应答过程中,H2AX是最早被磷酸化的底物,是细胞中感应DNA双链损伤最敏感的分子,可作为DNA DSB损伤的标志物,并且γH2AX焦点数与DSB数基本是1∶1的关系[17-18],能实现DSB的准确定量。为深入研究辐射对细胞DNA的损伤情况,以DNA DSB标志物——γH2AX为生物学终点指标,用免疫荧光检测A375细胞照射后形成的γH2AX焦点数和大小随照后时间和射线的变化,结果如图8所示。
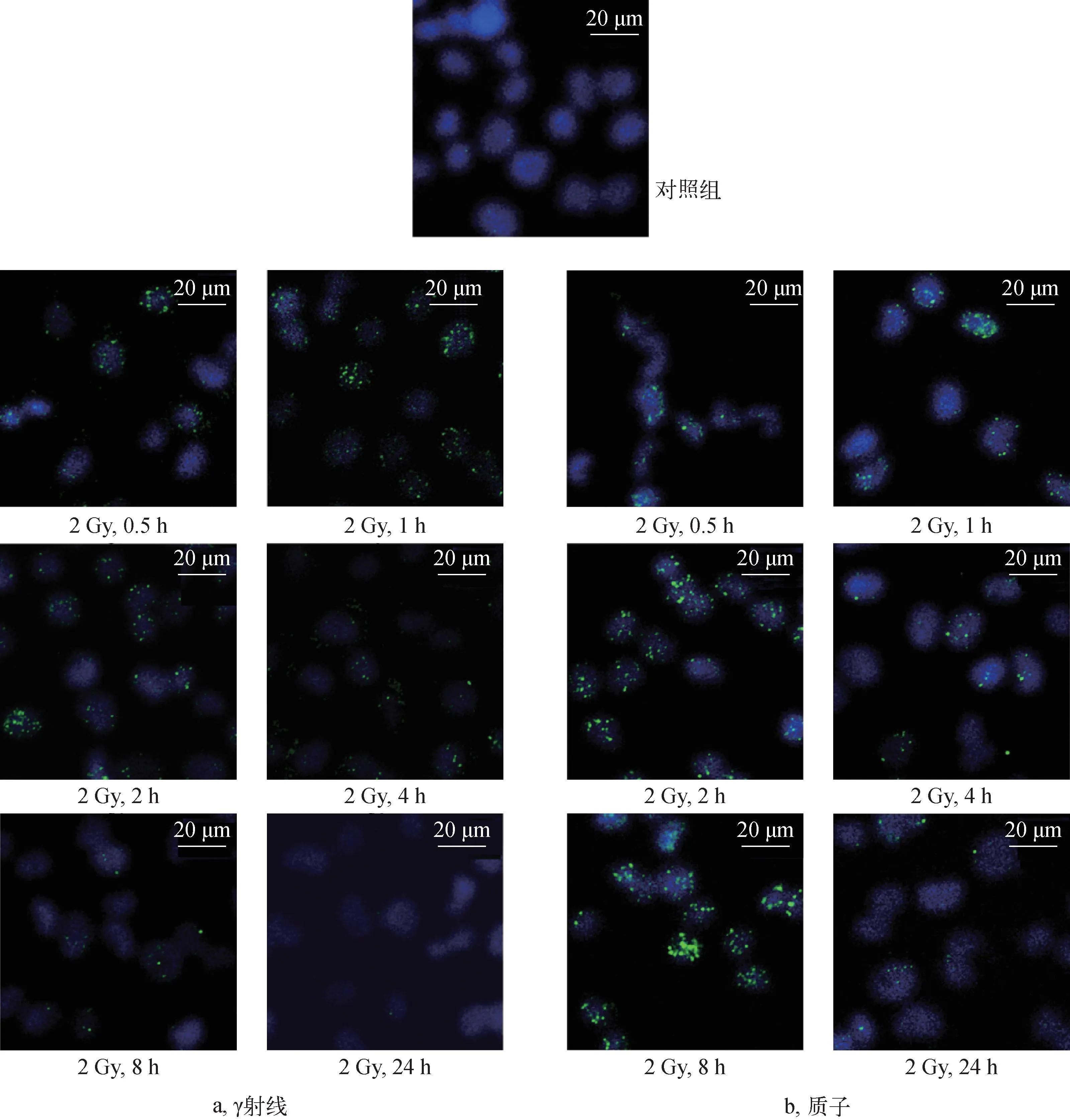
图8 2 Gy辐照下不同时间点A375细胞中的γH2AX焦点分布Fig.8 γH2AX foci distribution of A375 cell irradiated by 2 Gy at different time points
从图8a可见,与对照组细胞相比,γ射线辐照后0.5 h,细胞中γH2AX焦点数明显增加,随着时间的增加,焦点数呈先增大后减小的变化趋势,到辐照后24 h,γH2AX表达水平显著下降,只有在极少数细胞中能观察到γH2AX焦点。γH2AX焦点在细胞核中的分布较均匀和分散,在焦点数很多的细胞中表现出相同的分布趋势,体现了γ射线稀疏电离辐射的特点。
从图8b可见,2 Gy质子辐照后,随着时间的增加,γH2AX的表达也呈先增加后减小的变化趋势,与γ射线辐照下的趋势相同。但在相同时刻,质子辐射诱导A375细胞形成的γH2AX焦点的大小、亮度以及分布规律与γ射线辐照明显不同,质子诱导的γH2AX在细胞核有些区域十分集中,形成了尺寸较大的大焦点,焦点亮度较大,而且焦点在核内局部区域成簇出现,表现出与高LET射线造成的DSB簇损伤类似的情况。
统计γ射线和质子辐照后不同时间点A375细胞样品中的γH2AX焦点和细胞数,得到2种射线诱导的平均每个细胞中γH2AX焦点数随时间的变化,如图9所示。对于γ射线,辐照后0.5 h焦点数增加到1.2,至1 h时γH2AX表达达到峰值,焦点数增加至7.9,是0.5 h时的6倍以上,而后迅速减少,4 h时的焦点数与0.5 h时的相当,到24 h时焦点数与对照组水平一致,仅有0.056个焦点。质子辐照后0.5 h时,焦点数为3.1,到1 h时达到峰值,焦点数增加至9.6,1~8 h时,焦点数迅速下降,2 h时的焦点数为8.89,较γ射线峰值大,8 h时的焦点数为2.5,8~24 h焦点数减少十分缓慢,24 h时每个细胞中还有1.7个焦点,是γ射线的28倍,表明质子诱导的γH2AX表达持续的时间更长。焦点数的减少过程反映了细胞对DNA DSB损伤的修复水平。γH2AX高表达的持续时间越长,表明细胞进入快速修复的时间越滞后,细胞对DNA DSB损伤的修复能力越弱。
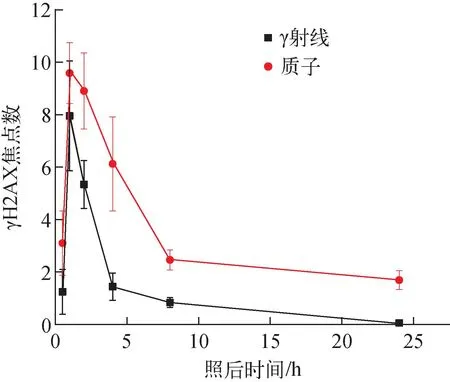
图9 每个细胞的焦点数与照后时间的关系Fig.9 Relationship between average number of γH2AX foci per cell and time after irradiation
辐射诱导的γH2AX焦点尺寸也能反映DNA的损伤情况,焦点尺寸越大,说明在该区域形成的损伤越复杂并难以修复。图10为统计得到2 Gy γ射线和质子辐照后不同时间点(0.5、2、8 h)A375细胞γH2AX焦点平均尺寸。γ射线辐照后,0.5、2、8 h焦点尺寸均处于0.4~0.7 μm2范围内。质子诱导的γH2AX尺寸在2 h时最大,为2 μm2,0.5 h和8 h时焦点平均尺寸均为0.8 μm2。相同照后时间,质子辐射形成的γH2AX焦点尺寸较γ射线大,且有显著性差异(P<0.05),说明在照后0.5~8 h,质子辐射对A375细胞的DNA损伤更严重。

与γ射线相比,1) P<0.05,2) P<0.01图10 不同LET射线辐照后不同时间点平均每个细胞的焦点尺寸Fig.10 Average focal size of each cell at different time points after irradiation by different rays
DSB损伤形成后,在损伤位点可迅速形成γH2AX焦点,在0.5~1 h达到峰值,然后随着DSB损伤的修复而逐渐消退,在24 h内迅速下降,并在几天内下降到基线水平(其修复时间与辐照剂量有关),故γH2AX焦点分析可较准确反映电离辐射诱导的DSB损伤修复,是理想的DSB损伤评价指标[19]。董隽等[20]、王依朝等[21]的研究显示,辐射诱导细胞DSB损伤后,细胞γH2AX焦点在1 h内迅速达到峰值并随时间延长而减少,呈现出动力学变化过程。本研究以不同射线诱导细胞DNA损伤,照后1 h出现γH2AX焦点峰值,随时间的延长,焦点数逐渐减少,反映了DSB损伤修复的动力学修复过程,且LET较高的质子辐射诱导的γH2AX焦点数及尺寸大于LET值较低的γ射线。本研究利用质子诱导的γH2AX焦点尺寸在照后2 h为2 μm2,与前期利用重离子射线(Li和C)诱导的MEF细胞的γH2AX焦点尺寸[22]类似,说明质子可能诱发了DNA较复杂的集簇性损伤,实际观察到的γH2AX焦点数与DSB数在数量上不完全是1∶1,这有可能是质子诱导的DNA损伤有复杂集簇性损伤,使得多个γH2AX焦点聚集,形成了尺寸较大的γH2AX焦点。由此可见,本文结果与文献结果基本相符,γH2AX焦点分析可较准确地反映A375细胞受辐射后,DNA DSB的损伤修复过程。
此外,γH2AX不仅参与DNA DSB的识别与修复,还可与p53相互作用,激活细胞周期检查点,阻滞细胞周期[23],使DNA损伤有时间修复,以此来保证遗传信息的正确性;当修复不能完成时,启动凋亡通路,使细胞发生程序性死亡[24]。
此外,近年来,随着先进的高通量测序技术出现,已有研究发现,长编码RNA(lncRNA)、微小RNA(miRNA)有抑癌或促癌作用,如已在肝细胞癌、胃癌、肺癌、乳癌等多种癌症中都异常表达的lncRNA[2]和miRNA[25]。因此,在今后的研究中,或许可以利用测序手段筛选出的lncRNA和miRNA,并采用沉默或过表达干预的方法,结合质子辐射,筛选可用于恶性黑色素瘤早期诊断的敏感标志物或治疗的分子靶点,为恶性黑色素瘤治疗提供新技术。
3 结论
本文系统探讨了辐射诱导A375细胞DNA损伤时,γH2AX焦点的动力学变化及其在DSB损伤评估中的应用,以及由DNA损伤引起的细胞周期阻滞、细胞凋亡和细胞存活,结果表明,质子辐射对A375细胞的DNA损伤更严重,A375细胞的存活率明显降低、周期阻滞程度更严重、凋亡率也更高,说明质子辐射可有效杀伤A375细胞,这表明质子束在治疗具有辐射抗性的恶性黑素瘤中具有潜在应用价值。
感谢北京HI-13串列加速器运行人员在辐照实验中给予的帮助与支持,感谢国防科技工业电离辐射计量一级站在60Co γ射线照射实验中给予的帮助和支持。
