基于非靶标代谢组学分析拜赖青霉菌株47M-1的抑菌活性成分
2023-12-25赵新贝倪云霞刘新涛闫文庆何碧珀刘红彦
赵新贝,倪云霞,刘新涛,赵 辉,闫文庆,何碧珀,刘红彦
(河南省农业科学院植物保护研究所/农业农村部华北南部作物有害生物综合治理重点实验室/河南省农作物病虫害防治重点实验室/河南省生物农药工程研究中心/河南省作物保护国际联合实验室/河南省农用微生物创新中心,郑州 450002)
芝麻是重要的油料作物之一,在我国河南、湖北、安徽和江西等省份大面积种植。由于芝麻生育期短,且整个生育期处于高温多雨的季节,导致芝麻易受多种病原菌的侵袭,严重影响芝麻产量和品质[1]。开发利用广谱高效的生防菌株及其抑菌活性代谢物,是芝麻病害绿色防控的重要手段。拜赖青霉因其良好的促生能力受到科研人员的广泛关注,近年来,其在植物病害防治中的潜力也逐渐被挖掘,拜赖青霉对立枯丝核菌Rhizoctoniasolani、尖孢镰刀菌Fusariumoxysporum、大丽轮枝菌Verticilliumdahliae、胶胞炭疽菌Colletotrichumgloeosporioides和禾谷镰刀菌F.graminearum等植物病原真菌具有良好的抑制作用[2-4],研究发现该菌可产生抑真菌活性化合物,如倍半烯萜penicibilaenes A 和B[4],此外,该菌还可产生多种杀线虫活性化合物[5,6]。
在前期研究中,筛选到一株拜赖青霉Penicilliumbilaiae47M-1,该菌培养滤液的10 倍稀释液对多种芝麻病原真菌具有显著的抑菌活性,表明产生抑菌活性物质,是该菌发挥抑菌作用的重要方式[7]。然而,生防菌的抑菌作用通常是多种代谢物共同作用的结果,目前对拜赖青霉的抑菌活性代谢物的研究尚不充分。快速发展起来的代谢组学技术,为生物代谢成分的高通量、整体全面的分析提供了保障,目前在微生物代谢成分研究中也得到了广泛的应用[8-10]。
本研究在明确菌株47M-1 最佳摇床培养条件和优化培养基的基础上[11],通过基于液相色谱-串联质谱技术的代谢组学平台,检测菌株47M-1 在不同培养时间所产生的代谢物的差异,对上调差异代谢物在HMDB 数据库二级结构中的分布情况及KEGG 代谢通路富集情况进行分析,结合文献报道,进一步筛选上调差异代谢物进行聚类分析,并通过含药平板法验证部分上调差异代谢物的抑菌活性。本研究为揭示菌株47M-1 的抑菌机理奠定了基础,为微生物制剂的研发提供了理论依据。
1 材料与方法
1.1 供试菌株
本研究所用拜赖青霉菌株47M-1,保藏于中国典型培养物保藏中心(CCTCC),保藏编号为M 2018899,供试芝麻枯萎病病原尖孢镰刀菌8F27,由河南省农业科学院芝麻研究中心段迎辉博士提供,其他供试芝麻病原菌立枯丝核菌、球黑孢和索氏平脐蠕孢,由河南省农业科学院植物保护研究所生物防治研究室分离和保存。
1.2 供试培养基
IM-CYA 培养基[11]:蔗糖30 g,蛋白胨 5 g,MgSO4·7H2O 0.5 g,KCl 0.5 g,FeSO4·7H2O 0.01 g,蒸馏水1000 mL。
PDA 培养基:去皮马铃薯200 g,葡萄糖20 g,琼脂15~20 g,蒸馏水1000 mL。
1.3 菌株47M-1 生长曲线测定
将菌株47M-1 接种到PDA 培养基上,待培养4~7 d 大量产孢时,用0.05%的吐温80 溶液洗脱孢子,用血球计数板计数孢子浓度,并调整孢子浓度为3×108孢子/mL,即为接种用孢子悬浮液。取1 mL 孢子悬浮液接种到100 mL IM-CYA 培养液中,于25 ℃、160 r/min 培养,分别在培养16、20、24、48、72、96、120、144、192 和240 h 取培养物,过滤收集菌丝球,用滤纸吸干水分后,置于80 ℃烘箱烘至恒重,称量菌丝干重。以培养时间为横坐标,菌丝干重为纵坐标,绘制生长曲线。
1.4 菌株47M-1 培养液对四种芝麻病原真菌的抑菌活性
将1 mL 孢子悬浮液接种到100 mL IM-CYA 培养液中,于25 ℃、160 r/min 培养。分别取培养48、96和144 h 的培养液,过0.22 μm 的微孔滤膜除菌即为培养滤液,将培养滤液与PDA 培养基1∶9 混匀制备平板,分别在平板中央接种芝麻病原尖孢镰刀菌、立枯丝核菌、球黑孢和索氏平脐蠕孢的菌饼(直径6 mm),将无菌水与PDA 按1∶9 混匀制备平板,分别在其上接种四种病原菌,作为对照。将PDA 平板置于28 ℃的恒温培养箱中培养8 d,测定菌落直径,计算培养滤液对靶标菌的抑制率。抑制率(%)=(对照组菌落直径-处理组菌落直径)/(对照组菌落直径-菌饼直径)×100。
1.5 菌株47M-1 代谢组样品收集、检测和分析
1.5.1 菌株47M-1 代谢组样品收集和检测 将菌株47M-1 的孢子悬浮液(3×108孢子/mL)按1%接种到100 mL IM-CYA 培养液中,于25 ℃、160 r/min 培养。分别于培养48、96 和144 h 时取样,标记为M2、M4 和M6,培养产物过无菌尼龙网后收集菌丝球,将菌丝球分装到2 mL 的无酶管中,于4 ℃、6000 g/min离心5 min,弃上清,迅速将样品放入液氮速冻1 min,置于-80 ℃冰箱保存,每样点分别取6 瓶培养物的菌丝球作为6 个重复,待样品收集完成,送至上海百趣生物医学科技有限公司进行代谢物提取和检测,具体方法如下。
取20 mg 样品,加入1 mL 含同位素标记内标混合物的提取液(甲醇:乙腈:水=2∶2∶1(V/V/V)),涡旋混匀30 s;35 Hz 研磨4 min,超声5 min(冰水浴),重复3 次;-40 ℃静置1 h;将样品4 ℃、12000 r/min 离心15 min;取上清上机检测。另取等量所有样品的上清混合(QC 样品)上机检测。
使用Vanquish 超高效液相色谱仪和Waters ACQUITY UPLC BEH Amide(2.1 mm×100 mm,1.7 μm)液相色谱柱对目标化合物进行色谱分离。液相色谱的A 相为水相(含25 mmol/L 乙酸铵和25 mmol/L 氨水),B 相为乙腈。梯度洗脱设置为:0~0.5 min,95% B;0.5~7 min,95%~65% B;7~8 min,65%~40% B;8~9 min,40% B;9~9.1 min,40%~95% B;9.1~12 min,95% B。流动相流速:0.5 mL/min,柱温:30℃,样品盘温度:4 ℃,进样体积3 μL。
高分辨质谱(Q Exactive Orbitrap, QE)的电离源为电喷雾电离,有正离子模式(positive ion mode,POS)和负离子模式(negative ion mode, NEG)两种电离方式,数据分析过程中对POS 和NEG 两组数据分别分析。Thermo Q Exactive HFX 质谱仪可在软件(Xcalibur,Thermo)控制下采集二级质谱(MS2)的数据。
1.5.2 代谢组数据预处理 使用ProteoWizard 软件,将原始数据转换为mzXML 格式,然后以R 程序包(内核为XCMS)进行峰识别、提取、对齐和积分等处理,然后对数据进行整理,包括对单峰的过滤去除噪音,基于变异系数去除偏离值;对单个峰过滤时保留单组空值不多于50%,或所有组中空值不多于50%的峰面积数据;以最小值二分之一填补缺失值;利用内标进行归一化处理。将处理过的数据与百趣生物医学科技有限公司自建二级质谱数据库BiotreeDB(V2.1)进行匹配来注释物质,算法打分的Cutoff 值设为0.3。
1.5.3 主成分分析 使用SIMCA 软件(V16.0.2,Umea,Sweden)进行主成分分析,对数据进行对数转换及中心化(CTR)格式化处理,然后进行自动建模分析。
1.5.4 正交偏最小二乘法-判别分析(OPLS-DA) 以SIMCA 软件对数据进行对数转换和UV 格式化处理,然后对第一主成分进行OPLS-DA 建模,并用七折交叉验证的R2Y(模型对分类变量Y 的可解释性)和Q2(模型的可预测性)对模型有效性进行评判,最后通过置换检验及随机多次(n= 200)改变分类变量(Y)的排序,获取随机模型的Q2值,避免模型的过拟合,对模型有效性进行进一步检验。
1.5.5 差异代谢物的筛选、HMDB 二级分类分析及上调差异代谢物的代谢通路富集分析 分别将48、96和144 h 时样品的代谢组数据标记为M2、M4 和M6,分别进行M4 和M2、M6 和M4、M6 和M2 三组数据的对比分析。以学生t检验(Student’st-test)的P<0.05,以及OPLS-DA 模型第一主成分变量投影重要度(VIP)>1 为卡值标准,筛选显著上调和下调的差异代谢物,由于培养液的抑菌活性随培养时间的延长逐渐增强,本研究以上调差异代谢物为分析对象,分析正离子模式和负离子模式中3 组对比共有和特有的上调差异代谢物数量,进一步进行去冗余后的上调差异代谢物在HMDB 数据库超类中的分布情况分析,以及KEGG 通路富集分析。
1.5.6 目标差异代谢物的筛选和层次聚类分析 对涉及上调差异代谢物的相关文献进行检索,将上调差异代谢物分布最多的超类中的代谢物,及其它超类中有抑菌活性相关报道的上调差异代谢物作为目标差异代谢物(表1),对目标差异代谢物的定量值计算欧式距离矩阵,以完全连锁方法对这些差异代谢物进行聚类,对具有相同特征的代谢物进行归类,并明确代谢物的组间变化特性。

表1 38 种目标代谢物的信息表Table 1 Information table of 38 target metabolites
1.6 目标差异代谢物对四种病原菌的抑菌作用测定
明确目标代谢物的CAS 号,并对其市售试剂或标准品进行检索,最终选择其中17 种代谢物的标准品(表2),使用含药平板法测定这17 种标准品对芝麻病原尖孢镰刀菌、立枯丝核菌、索氏平脐蠕孢和球黑孢的抑菌作用。拟定目标化合物的初筛浓度为2 mg/mL,由于规格限制,部分化合物初筛浓度为1 mg/mL。每平板倒10 mL PDA 培养基,待凝固后,再倒5 mL 含药的PDA 培养基制备平板,并以含等量相应溶剂的PDA 平板作为对照,在平板中央接种病原菌的菌饼(直径6 mm),将平板置于28 ℃的恒温培养箱中培养3~8 d,以十字交叉法测定菌落直径,计算抑制率。以2 mg/mL 的终浓度制备橙皮素、原卟啉、3,4-二羟基苯基丙酸、柚皮素、3(3-羟基苯基)丙酸、4',5,7-三羟黄烷酮、原儿茶酸、D-(-)-奎宁酸和尿囊素的含药平板。以1 mg/mL 的终浓度制备山奈素、迷迭香酸、表儿茶素、圣草酚、染料木苷、(-)-表没食子儿茶素、佛手苷内酯和隐绿原酸的含药平板。
1.7 数据统计与分析
使用软件SPSS 17.0 对抑菌活性相关试验数据进行描述性统计及方差齐性检测,并采用Duncan's 新复极差法进行显著性分析,利用GraphPad Prism 9.0 软件作图,图中不同小写字母代表同一系列不同处理间在P=0.05 水平上存在显著差异。
2 结果与分析
2.1 菌株47M-1 的生长曲线
将菌株47M-1 的孢子悬浮液接种到液体培养基中培养,并在接种后240 h 内取样测量菌丝球干重,由测量结果可知,在培养16~144 h 之间,菌丝生长较快,菌丝干重迅速增长,为菌丝快速生长期,在培养144 h 之后,菌丝干重开始下降,进入衰亡期,即菌株47M-1 的最佳培养时间是144 h(图1)。

图1 菌株47M-1 在IM-CYA 中培养时的生长曲线Fig.1 Growth curve of strain 47M-1 cultured in IM-CYA
2.2 菌株47M-1 的培养液对四种芝麻病原真菌的抑菌活性
分别测定菌株47M-1 培养48、96 和144 h 时培养滤液对尖孢镰刀菌、球黑孢、立枯丝核菌和索氏平脐蠕孢的抑菌活性,由结果可知,随着培养时间的延长,培养滤液的抑菌活性逐渐增强,培养48 h 时的滤液抑菌活性较低,尤其是对尖孢镰刀菌和立枯丝核菌的抑制率仅为32.5%和17.7%,培养96 h 时的滤液对尖孢镰刀菌、球黑孢、立枯丝核菌和索氏平脐蠕孢的抑菌活性均显著增强,抑制率分别为100%、99.0%、52.8%和72.0%(图2A,B),培养144 h 时的滤液对立枯丝核菌和索氏平脐蠕孢的抑菌活性相比96 h 时仍在增长,尤其对索氏平脐蠕孢的抑制率显著增加,达86.7%(图2C,D)。结合菌株47M-1 的生长曲线及其对四种芝麻病原真菌抑菌活性测定结果,将对其液体培养48、96 和144 h 的代谢物进行对比分析,来挖掘潜在的抑菌活性物质。
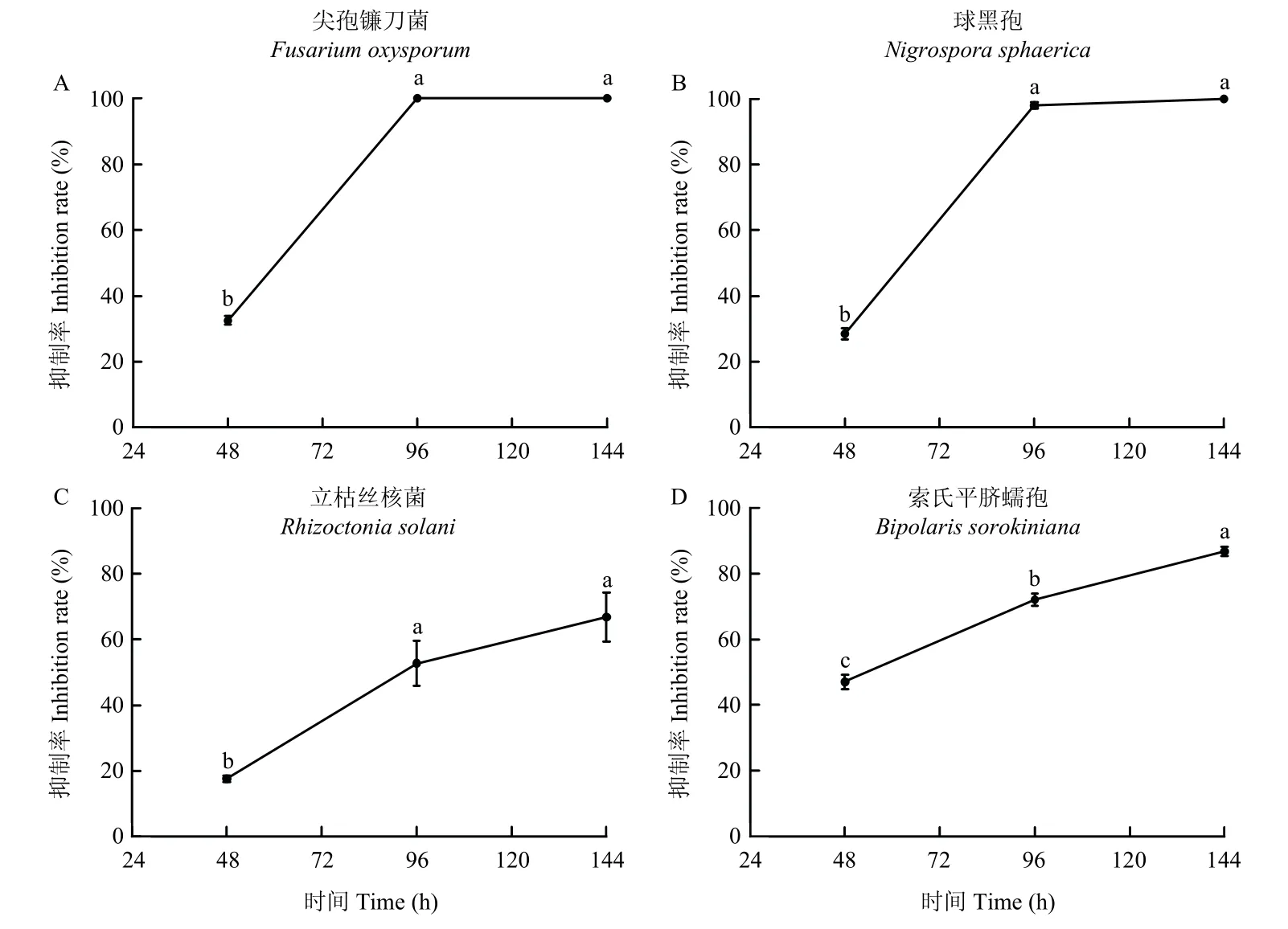
图2 菌株47M-1 培养滤液对四种芝麻病原菌的抑制作用Fig.2 Inhibitory effect of culture filtrate of strain 47M-1 on four kinds of sesame pathogens
2.3 代谢组数据处理和分析
2.3.1 数据预处理 经过数据处理后,正离子模式23871 个峰被保留,通过二级质谱(MS2)定性匹配到599 种物质;负离子模式13480 个峰被保留,通过二级质谱(MS2)定性匹配到225 种物质(表3)。

表3 代谢组预处理后数据Table 3 Clean data of metabolome
2.3.2 主成分分析 由图3A 和3B 可知,在正离子和负离子模式中,样本全部处于95%的置信区间内,正离子模式和负离子模式中第一主成分(PC1)的贡献值分别达到了76%和62.8%,两种模式中M2、M4 和M6 主要由PC1 进行区分,三组样本间分离趋势明显,表明M2、M4 和M6 的代谢物存在显著差异。
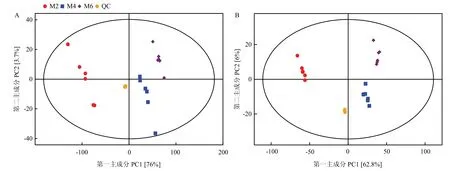
图3 正离子(A)和负离子(B)模式下样本PCA 模型的得分散点图Fig.3 Score scatter plot for PCA model in postive ion mode (A) and negative ion mode (B)
2.3.3 OPLS-DA 置换检验 由图4 可知,在正离子模式和负离子模式的六组对比中,原模型(横坐标为1处对应的R2Y 和Q2值)的R2Y 均趋近1,表明原模型符合样本数据真实情况,原模型Q2趋近1,表明原模型可以很好的解释两组样本之间的差异,且置换检验随机模型的Q2均小于原模型的Q2值,Q2的回归线与纵轴的截距小于0,随着置换保留度的降低,置换中Y 变量占比上升,随机模型的Q2逐渐下降,表明原模型具有良好的稳健性,不存在过拟合现象。
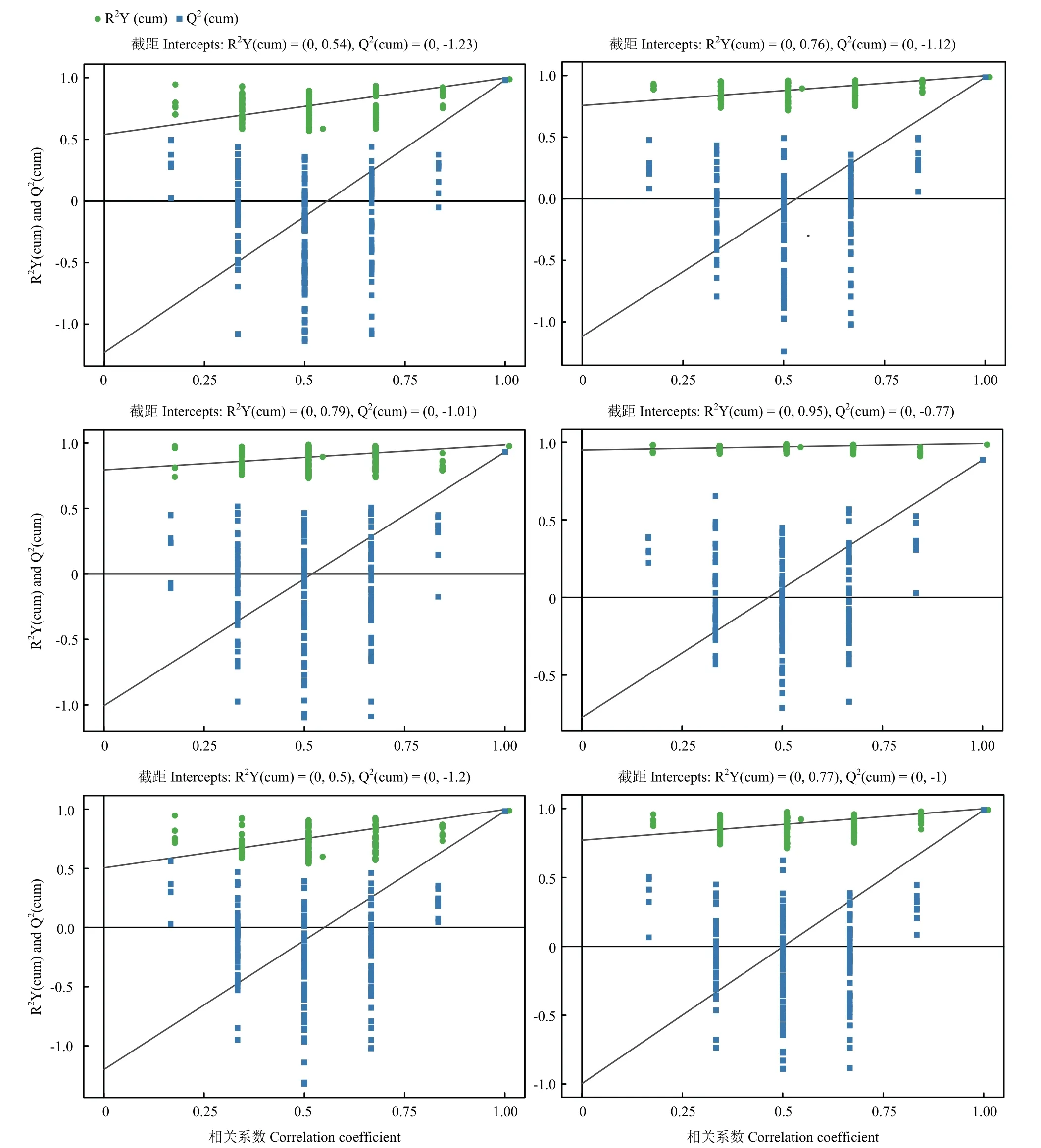
图4 正离子和负离子模式下三个对比组的OPLS-DA 模型的置换检验Fig.4 Permutation test of OPLS-DA model for three groups in postive ion mode and negative ion mode
2.3.4 差异代谢物的筛选 以t检验的P<0.05 和OPLS-DA 模型的VIP>1 为卡值筛选差异代谢产物(图5A)。正离子模式中,在M4-M2、M6-M4 和M6-M2 三组对比中分别筛选到下调差异代谢物15223、9361和16006 个,上调差异代谢物487、446 和420 个(图5B,C);在负离子模式中,在M4-M2、M6-M4和M6-M2 三组对比中分别筛选到下调差异代谢物4873、2117 和4885 个,上调差异代谢物2804、1546和2857 个(图5B,C);综合正离子模式和负离子模式筛选到的差异代谢物可知,上调差异代谢物在差异代谢物中占比仅为14.0%,且48~96 h(M4-M2)的上调差异代谢物数量较96~144 h(M6-M4)高出65%。
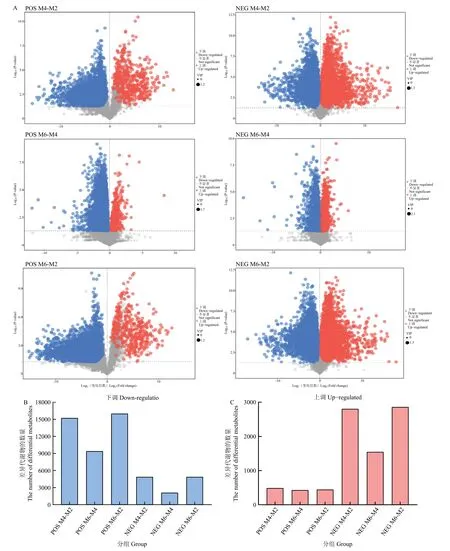
图5 正离子和负离子模式下三组中差异代谢物的筛选Fig.5 Screening of differential metabolites for three groups in postive ion mode (POS) and negative ion mode (NEG)
2.3.5 非冗余上调差异代谢物的筛选及其在HMDB 数据库二级分类中的分布 对代谢物进行注释,在正离子模式中,M4-M2、M6-M4 和M6-M2 三组对比的差异代谢物分别有397、349 和429 种匹配到物质,其中上调差异代谢物分别有21、9 和20 种(图6 A);在负离子模式下,4-2、6-4 和6-2 三组对比的差异代谢物分别有141、84 和151 种匹配到物质,其中上调差异代谢物分别为61、29 和64 种(图6 B)。正离子模式和负离子模式中分别筛选到非冗余上调差异代谢物28 个和77 个(图6 A, B),分析筛选到的105个非冗余上调差异代谢物在HMDB 数据库二级分类中的分布情况,发现其主要富集在脂质和类脂分子、有机酸及其衍生物、苯丙素和聚酮类化合物、有机杂环化合物、有机氧化合物、核苷和核苷酸及其类似物、苯环型化合物超类中,其中苯丙素和聚酮类化合物超类中富集上调差异代谢物最多,达29 个(图6 C)。

图6 非冗余上调差异代谢物的筛选及其在HMDB 数据库二级分类中的分布Fig.6 Screening of non-redundant up-regulated differential metabolites and their distribution in secondary classification of HMDB database
2.3.6 非冗余上调差异代谢物的代谢通路富集分析 对筛选到的105 个非冗余上调差异代谢物中的68个可注释到KEGG 数据库的化合物,进行KEGG 通路富集分析,富集的B 级通路涉及氨基酸代谢、碳水化合物代谢、细胞生长和死亡、全局和概述图谱、膜转运和核苷酸代谢,包括的C 级通路有代谢途径、辅因子生物合成、嘌呤代谢、氨基酸生物合成、ABC 转运体、酪氨酸代谢、半乳糖代谢和戊糖、葡萄糖醛酸转换途径,其中代谢途径富集比例最高,达84.4%,其次为辅因子生物合成途径,富集比例为20%(图7)。

图7 上调差异代谢物的KEGG 富集分析Fig.7 KEGG enriched analysis of up-regulated differential metabolites
2.3.7 目标差异代谢物的筛选及聚类分析 对筛选出来的105 种非冗余上调差异代谢物进行文献检索,检索结果表明,苯丙素和聚酮类化合物中上调的差异代谢物共29 种,其中文献报道有抑菌活性的有17种,其中12 种有抑制真菌活性,分别为3-羟基根皮素[12]、4-甲基表儿茶素[13]、二氢芒柄花黄素[14]、甘草素[15]、橙皮素[16]、表儿茶素[13]、樱花素[17]、茶碱[18]、迷迭香酸[19,20]、染料木苷[21-22]、柚皮素[23-24]和佛手苷内酯[25]。其中11 种具有抑制细菌活性,分别为4-甲基表儿茶素[13]、3-羟基根皮素[26]、燕麦生物碱1p[27]、水飞蓟亭[28]、山奈素[29]、表儿茶素[13]、迷迭香酸[19,20]、圣草酚[30]、染料木苷[21,22]、(-)-表没食子儿茶素[31,32]和柚皮素[23,24]。其中甘草素同时具备抗真菌和抗病毒活性,表儿茶素、迷迭香酸、染料木苷和柚皮素同时具备抑制真菌和细菌活性,而3-羟基根皮素和橙皮素对植物病原真菌表现抑菌活性。除苯丙素和聚酮类化合物外,其他超类中有抑菌活性报道的上调差异代谢物有9 种,分别为原卟啉[33]、N-(2-糠酰)甘氨酸[34]、异柠檬酸、原儿茶酸[35]、苯线磷、奎宁酸[36]、尿囊素[37]、新绿原酸[38]和隐绿原酸[38]。
以苯丙素和聚酮类化合物超类中的29 种上调差异代谢物,及其他超类中有抑菌活性报道的9 种上调的差异代谢物为目标差异代谢物(表1),进行聚类分析,结果表明,38 种代谢物被分为三类,从48 h 至96 h 至144 h,第一类代谢物积累量先降低再升高,仅包含3 种化合物;第二类代谢物积累量先升高,之后为持平状态,包含13 种化合物;第三类代谢物积累量持续升高,包含22 种化合物(图8)。
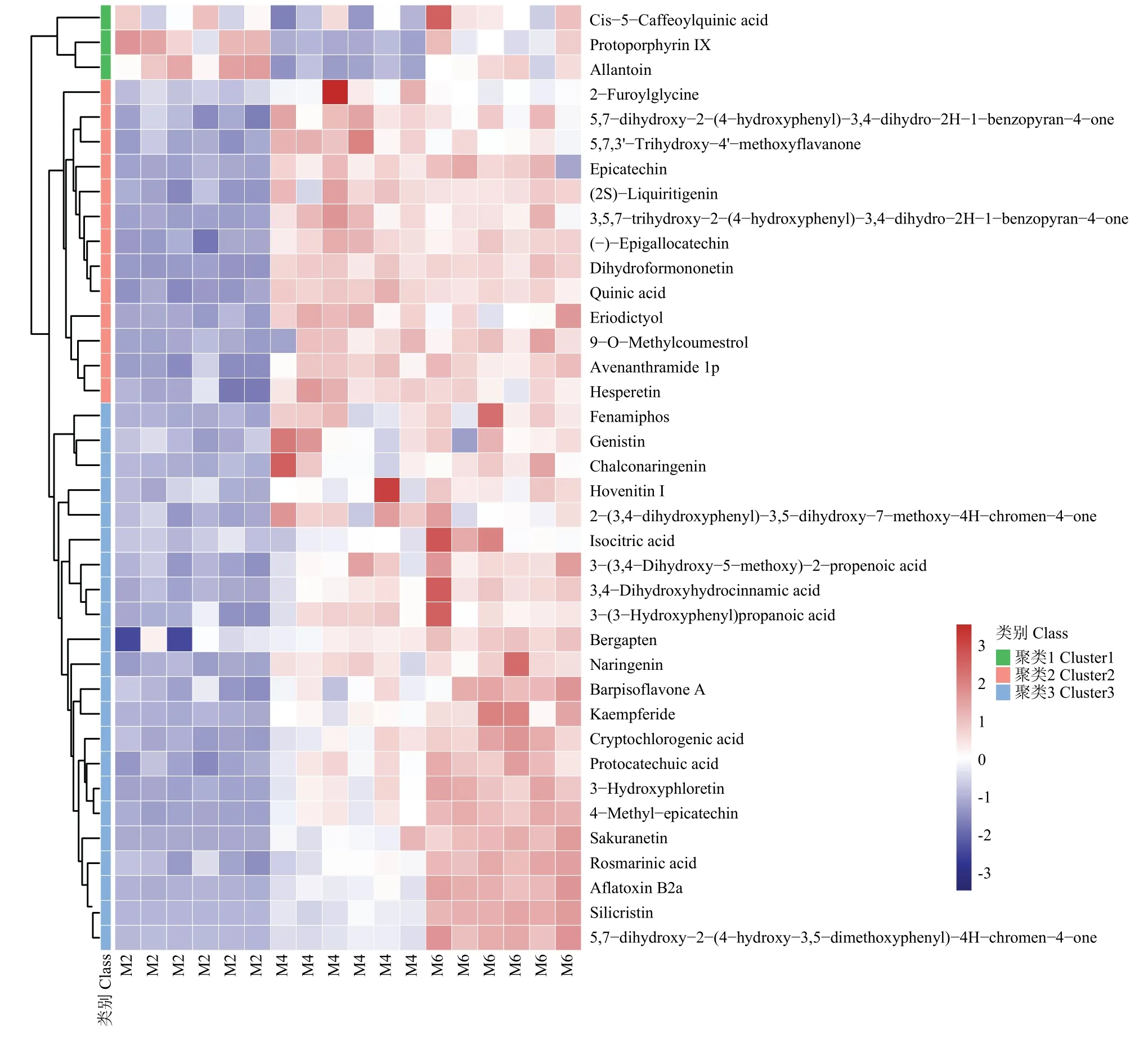
图8 38 种代谢物的聚类分析热力图Fig.8 Heatmap of hierarchical clustering analysis of 38 metabolites
2.4 目标差异代谢物对四种病原菌的抑菌作用测定
测定17 种目标差异代谢物的标准品的抑菌活性,结果表明,供试标准品对病原真菌均有一定的抑菌活性。在以2 mg/mL 的浓度筛选的化合物中,对尖孢镰刀菌抑菌活性最强的为柚皮素,其次为原儿茶酸和D-(-)-奎宁酸,对球黑孢抑菌活性最强的为橙皮素,其次为3-(3-羟基苯基)丙酸,对立枯丝核菌抑菌活性最强的为3-(3-羟基苯基)丙酸,其次为3, 4-二羟苯基丙酸、4’, 5, 7-三羟黄烷酮和D-(-)-奎宁酸,对索氏平脐蠕孢抑菌活性最强的为3, 4-二羟苯基丙酸,其次为原儿茶酸和D-(-)-奎宁酸(图9 A)。在以1 mg/mL 的浓度筛选的化合物中,对四种供试病原菌抑菌活性最强的均为迷迭香酸,除迷迭香酸外,对尖孢镰刀菌和立枯丝核菌抑菌活性最强的均为佛手苷内酯,对索氏平脐蠕孢抑菌活性最强的为圣草酚(图9 B)。即通过含药平板法,筛选到抑菌作用明显的化合物柚皮素、原儿茶酸、D-(-)-奎宁酸、橙皮素、3-(3-羟基苯基)丙酸、3, 4-二羟苯基丙酸、4’, 5, 7-三羟黄烷酮、迷迭香酸、佛手苷内酯和圣草酚,对4 种病原真菌均有抑菌活性的抑菌化合物有3, 4-二羟苯基丙酸、3(3-羟基苯基)丙酸、原儿茶酸、D-(-)-奎宁酸、尿囊素、迷迭香酸和佛手苷内酯。
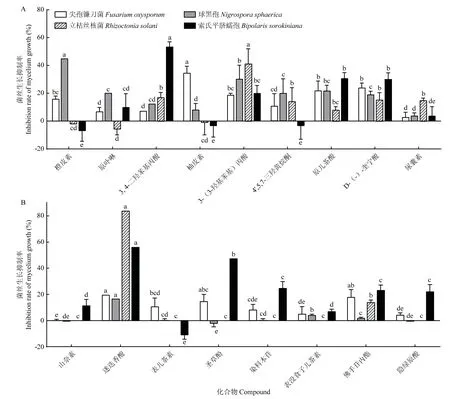
图9 17 种化合物对四种病原菌菌丝生长的抑制率Fig.9 Inhibition rates of 17 compounds on mycelial growth of four pathogens
3 讨论
青霉是植物病害防治中重要的生防资源之一,青霉代谢产物极其丰富,可产生多种抑菌活性物质抑制植物病原菌生长。研究人员从疣状青霉P.verrucosum、变灰青霉P.canescens、简青霉P.simplicissimum、产黄青霉P.chrysogenum和棘孢青霉P.aculeatum等多种青霉中分离到抗真菌化合物[39-44]。本研究中供试拜赖青霉菌株47M-1 是具备促生、诱导抗病性和广谱抑菌活性的高效生防菌株,其培养滤液对芝麻多种病原菌具备强烈的抑制作用[7],对其代谢产物的研究具有重要意义。本研究通过LC-MS/MS 技术检测菌株47M-1 发酵产物中的化合物,并去冗余分析后,从三组对比中共筛选出105 种上调差异代谢物,在苯丙素和聚酮类化合物超类中富集了29 种。据报道,2014—2017 年海洋真菌来源的天然产物中,聚酮类化合物占比仅次于生物碱[45],本研究中菌株47M-1 来自植物根际土壤,其产生的潜在的抑菌活性物质,以苯丙素类和聚酮类化合物为主。KEGG 富集分析发现上调差异代谢物主要富集在代谢途径、辅因子生物合成、嘌呤代谢、氨基酸生物合成、ABC 转运体等通路,其中代谢途径富集比例高达84.44%,其次为辅因子生物合成途径,富集比例为20%。辅因子在代谢网络中通过调控胞内关键酶,广泛参与物质合成和分解代谢反应,从而显著影响细胞生长和代谢速率,在微生物细胞中进行调控的辅因子主要包括NAD(P)H/NAD(P)+、乙酰辅酶A 和ATP/ADP,其中乙酰辅酶A 可以作为酰基载体和代谢物前体,可用于合成脂质、聚酮、类异戊二烯等化合物[46],同时,乙酰辅酶A 还参与了三羧酸循环、糖酵解、脂肪酸生物合成及氨基酸生物合成等重要的中心代谢途径[47]。由苯丙氨酸脱氨基开始的合成途径是苯丙素类化合物的主要合成途径,过氧化物酶体NAD+载体将辅酶A 从胞质向过氧化物酶体转运,为其中所有辅酶A 连接酶提供重要底物,而过氧化物酶体ATP 结合转运子对肉桂酰辅酶A 的转运和催化是β-氧化途径合成苯丙素类化合物的第一步[48]。此外,ABC 转运体作为转运蛋白主要从事胞内外的物质转运,它可以结合辅因子ATP,ABC 转运体的转膜蛋白在跨膜区组成通道,胞浆内的ATP 结合区在Mg2+参与下水解ATP 完成底物跨膜转运[49,50],从而协助菌体细胞完成一系列的代谢。综上,菌株47M-1 的上调差异代谢物在辅因子生物合成途径的富集比例仅次于代谢途径,辅因子不仅可以作为聚酮类化合物合成的前体,参与苯丙素类化合物的合成,为化合物的合成和分解提供必须的能量,调控化合物的合成和分解代谢,同时可与ABC 转运体协作进行胞内外化合物运输,因此辅因子生物合成途径是菌株47M-1 抑菌活性代谢物发挥作用的关键途径。
对上调差异代谢物中部分代谢物的抑菌活性进行验证,发现供试标准品中10 种化合物:柚皮素、原儿茶酸、D-(-)-奎宁酸、橙皮素、3-(3-羟基苯基)丙酸、3,4-二羟苯基丙酸、4′,5,7-三羟黄烷酮、迷迭香酸、佛手苷内酯和圣草酚,对芝麻病原真菌抑菌作用较好,其中柚皮素、原儿茶酸、橙皮素、迷迭香酸和佛手柑内脂均有抑制植物病原真菌的相关报道。柚皮素是黄酮途径的第一个中间体,其对稻瘟病菌黄单胞菌的生长和孢子萌发均有抑制作用[51],从红豆树茎枝中分离的柚皮素,对禾谷镰孢、西瓜尖孢镰刀菌、茄病镰刀菌的菌丝生长显示出了中等强度的抑制作用[24];原儿茶酸对引起水果腐烂病的扩展青霉的生长有抑制作用[52];橙皮素是一种天然的黄烷酮类化合物,具有抗氧化、消炎、抗菌的作用,其在柑橘果实与胶孢炭疽菌互作中起到防御作用[16],另外施用到种子表面或种植沟中均可促进豌豆结瘤[53],该化合物可能通过激活宿主免疫系统,破坏细菌细胞膜,干扰微生物酶来发挥抗细菌特性[54];迷迭香酸是一种植物来源的天然化合物,对尖孢镰刀菌和灰葡萄孢等6 种植物病原真菌的菌丝生长和孢子萌发有明显的抑制作用[20];无花果叶的正丁醇提取物中分离到的佛手柑内脂,对油菜菌核病菌、苹果腐烂病菌和黄瓜枯萎病菌等5 种供试病原真菌均有抑制作用,且该化合物具有强光敏抑菌作用,可见光照射显著增强了佛手柑内脂的抑菌活性[25]。在10 种具有良好抑菌活性的化合物中,D-(-)-奎宁酸、3(3-羟基苯基)丙酸、3, 4-二羟苯基丙酸、4',5,7-三羟黄烷酮和圣草酚并无对植物病原真菌抑制作用的相关报道。
Meng 等[4]从海洋来源的拜赖青霉MA-267 分离到的抑真菌活性化合物倍半烯萜A 和B,属于脂质和类脂分子超类倍半萜类化合物,通过代谢组检测鉴定,在拜赖青霉菌株47M-1 中注释到的倍半萜类化合物13 种,但是并未注释到倍半烯萜A 和B,可能是由于菌株来源不同,不同分离株间存在个体差异,也可能是由于分离检测手段不同,且LC-MS 定性数据库也尚在完善中。本研究基于代谢组分析,明确了菌株47M-1抑菌活性物质以聚酮类化合物为主,菌株47M-1 发挥抑菌作用的关键途径是辅因子生物合成途径。在具备抑菌活性的化合物中,一部分已有抑制植物病原菌的相关报道,也有一部分尚未检索到植物病原菌抑菌活性相关报道,且抑菌活性化合物的抑菌作用均未超越培养滤液10 倍稀释液,表明其培养滤液广谱显著的抑菌活性,是大量活性代谢物共同作用的结果,将筛选到的化合物复配使用,可能增强对病原菌的抑制作用。本研究将为拜赖青霉菌株47M-1 的深入研发提供理论依据。
