ganA在路德维希肠杆菌杀松材线虫中的功能解析
2023-12-25王浩宇张弘弢王传珍张丽霞于翠芳李海勇
王浩宇,张弘弢,张 莹,赵 宇,7,王传珍,张丽霞,王 琦,吴 迪,于翠芳,李海勇,王 爽*,牛 犇*
(1.北京市颐和园管理处,北京 100091;2.东北林业大学林木遗传育种国家重点实验室,哈尔滨 150040;3.东北林业大学生命科学学院,哈尔滨 150040;4.烟台市森林资源监测保护服务中心,烟台 264000;5.中农绿康(北京)生物技术有限公司,北京 102101;6.中国农业大学植物病理学系,北京 100193;7.牡丹江师范学院,牡丹江 157000;8.青州市云驼风景区运行服务中心,青州 262500)
松材线虫病,又称松树枯萎病,是由松材线虫Bursaphelenchusxylophilus(pine wood nematode,PWN)引起的毁灭性森林病害,至今为止,江苏、浙江、辽宁等18 个省份666 个县级行政区已被列入疫区名单[1],对我国的林业经济及生态环境造成了极大的破坏。对于松材线虫病的防治,传统方法采用烟熏、焚烧、砍伐、杀虫剂喷洒、树干注射化学农药等[2,3]。这些方法存在成本高、环境友好性差等问题,同时也会增加松材线虫的耐药性。利用环境友好型微生物制剂是控制松材线虫病的重要方向[4],但是利用生防微生物对松材线虫抑杀机制的相关研究还不完善。本研究通过构建路德维希肠杆菌EnterobacterludwigiiAA4β-半乳糖苷酶基因ganA的突变体,对其抑杀松材线虫作用机制进行解析,以期为松材线虫病有效防控以及生防菌剂应用技术的建立提供理论依据。
具有杀线活性的细菌主要来源于芽胞杆菌属、链霉菌属、沙门氏菌属、寡养单胞菌属、假单胞菌属以及肠杆菌属等[4]。生防菌通过产生毒素、竞争营养、消解线虫体表组织、干扰线虫行为模式以及动员真菌捕食线虫等作用方式杀死线虫[4]。苏云金芽胞杆菌Bacillusthuringiensis(Bt)可产生多种具有杀虫作用的伴胞晶体蛋白毒素,主要包括α-外毒素、β-外毒素、γ-外毒素和δ-内毒素,其中β-外毒素和δ-内毒素具有线虫致死活性[5,6];穿刺芽胞杆菌Pasteuriapenetrans的孢子能够附着在线虫幼虫的表皮表面,通过争夺环境中的硒(Se)元素,使线虫表皮缺乏硒结合蛋白(SeBPs)[7];侧胞短芽胞杆菌Brevibacilluslaterosporus和荧光假单胞菌Pseudomonasfluorescens等分泌的细胞外蛋白酶,能在线虫的体表形成孔洞,并由表皮细胞向内连续降解并消化内部组织[8-10];铜绿假单胞菌Pseudomonasaeruginosa生物膜中含有的胞外多糖Psl能够抑制线虫的运动,Psl 通过降低线虫的爬行速度来降低线虫的定殖能力,从而阻止线虫逃脱,降低线虫在植物上的定殖和种群数量[11];当环境中无毒的嗜麦芽寡养单胞菌Stenotrophomonasmaltophilia感受到线虫分泌的信号后,通过释放尿素激活真菌的生存策略转化开关,产生捕食器官帮助其消灭线虫[12]。
肠杆菌属Enterobactersp.细菌广泛存在于土壤,植物和动物,包括人类等环境中,许多肠杆菌菌株为植物有益菌[13]。肠杆菌菌株可以通过产生吲哚乙酸(IAA)、水杨酸、铁载体、胞外多糖以及固氮作用等方式促进其植物宿主生长[14,15]。目前已有报道证实肠杆菌能够抑制串珠镰刀菌Fusariummoniliforme、黑曲霉Aspergillusniger、青枯菌Ralstoniasolanacearum等植物病原菌,起到保护植物的作用。少数肠杆菌株对根结线虫表现出显著的杀线虫活性,如阿氏肠杆菌EnterobacterasburiaeHK169 对根结线虫卵囊产生的抑制率达到66%,并在48 h 内杀死2 龄幼虫[16]。番茄根部分离的内生菌中肠杆菌EnterobacterintermediusMK-42 可显著减少感染根结线虫植物的根部卵囊形成[17]。然而对于肠杆菌菌株抑制植物寄生线虫的分子机制目前尚不清楚。
β-半乳糖苷酶(β-galactosidase,GAL)广泛存在于植物以及微生物中,此酶由500 kDa 的四聚体构成,该水解酶可以水解氨基多糖与核心蛋白连接区的糖苷键,使氨基多糖侧链与核心蛋白解离,从而使大分子多糖解体,进而破坏基底膜和细胞外间质屏障,使得细菌易于粘附与侵袭宿主细胞[18]。在 2 型猪链球菌Streptococcussuisserotype2 中,β-半乳糖苷酶可以通过水解作用抑制或破坏细菌和宿主上皮细胞间的连接,水解宿主细胞表面半乳糖基团,从而改变肺炎链球菌对宿主细胞的粘附及其在鼻咽部的侵袭定殖能力[19]。荧光假单胞菌菌株CHA0 处理爪哇根结线虫Meloidogynejavanica幼虫的死亡率与其β-半乳糖苷酶的活性强弱呈正相关[20]。
在前期工作中,从玉米根际分离的路德维希肠杆菌AA4[21],在与松材线虫互作的模型中,松材线虫校正死亡率达到85%以上,在温室盆栽试验中菌株AA4 可将3 年生樟子松幼苗的松材线虫病病情指数由86.9降至19.5,具有成为生防菌的潜力[22,23]。为了探究其β-半乳糖苷酶对菌株AA4 杀松材线虫活性的影响,本研究采用同源重组法敲除路德维希肠杆菌AA4 中β-半乳糖苷酶编码基因ganA,探究基因ganA在菌株AA4 抑杀松材线虫中的作用与功能,解析路德维希肠杆菌AA4 杀松材线虫的作用机制,为揭示细菌抑杀松材线虫作用机制及生防菌开发应用提供理论基础。
1 材料与方法
1.1 供试材料
1.1.1 供试菌株 路德维希肠杆菌AA4 由玉米根际中分离获得[21]。细菌菌株与50%的甘油等体积混合后在-80℃中冷冻保存。在LB 固体培养基上活化菌株,30 ℃,培养16 h。挑取单克隆于5 mL LB 液体培养基,30 ℃,200 r/min,培养16 h,获得待测菌液。在必要时补充抗生素卡那霉素50 µg/mL,氯霉素50 µg/mL(表1)。

表1 菌株与质粒Table 1 Strains and plasmids
1.1.2 供试线虫及培养 松材线虫由河北省农林科学院遗传生理研究所惠赠;灰葡萄孢Botrytiscinerca购买自上海保藏生物技术中心,菌株编号AS3.3789。将浓度为2500 头/mL 的松材线虫悬浮液接到新鲜的灰葡萄孢平板上,于25 ℃生长至线虫扩散达培养皿面积的2/3(约培养5 d)。
向含线虫的真菌平板中加入10 mL 无菌水,浸泡1 h。将线虫悬浮液转入15 mL 离心管,静置沉淀,弃上清。加入5 mL 含有2%硫酸链霉素的无菌水,轻轻混匀,对线虫进行消毒,处理5 min 后,静置,弃上清,用无菌水重复洗涤3 次。
取1 支50 mL 酸式滴定管,竖直固定在铁架台上,装入49 mL 0.3%的羧甲基纤维素钠盐(CMC)溶液,再从管口缓慢加入1 mL 松材线虫悬浮液(约7000 条线虫),静置12 h。取滴定管上端25 mL 悬浮液,离心5 min(2000 r/min),除去上清液,获得2 龄松材线虫幼虫。将2 龄松材线虫幼虫滴加到新鲜的真菌平板上,48 h 后,获得4 龄松材线虫。
1.2 基因ganA 敲除与回补菌株的构建
1.2.1 基因ganA的敲除 根据Red(λ,β,exo)介导的同源重组原理设计引物[24]。利用引物ganA- h1up和ganA- h1down 从菌株AA4 基因组中扩增出ganA基因上游同源臂,利用引物ganA- h2up 和ganA- h2down扩增出ganA基因下游同源臂。利用引物Kana up 和Kana down,从质粒pKD4 中扩增出一个两侧与ganA基因23 bp 相同序列的卡那霉素片段。利用引物pUC19up 和pUC19down,从pUC19 质粒中扩增出另一个与ganA基因同源的22 bp 长的片段。将纯化的PCR 产物按照Gibson DNA 连接酶(sosomix,Tsingke)的说明书进行组装,转入大肠杆菌EscherichiacoliDH5α感受态细胞中。在添加了卡那霉素的LB 固体平板上筛选含有重组pUC19ΔganA载体的克隆。提取重组质粒pUC19ΔganA,以其为模板,引物ganA-H1up 和ganA-H2down 进行PCR 扩增。纯化后的PCR 产物经2.5 KV/0.2 cm 电击转化(BIO-RAD,411BR11661)进入携带Red(λ,β,exo)重组酶质粒pKD46 的AA4 感受态细胞,30 ℃下孵育24 h 后在加卡那霉素的LB 固体平板上筛选得到的转化子。利用PCR 和测序验证同源重组。在42 ℃,200 r/min 的条件下摇床培养正确的转化子,消除pKD46 质粒,获得基因敲除株[25](表2)。

表2 文中所用引物Table 2 Primers used in this study
1.2.2 基因ganA回补 利用引物ganA-up 和ganA-down 从菌株AA4 基因组中扩增出基因ganA片段,以质粒pBBRI 为模板,利用引物ganA-PBBR1-up 和ganA-PBBR1-down 扩增出于ganA基因具有22 bp 相同序列的片段。利用Gibson DNA 连接技术连接两个基因片段构成回补质粒。用2.5 KV 电击转化法将回补质粒转入到ΔganA的感态细胞中,在30 ℃加卡那霉素和四环素的LB 固体平板培养24 h,通过PCR 和测序确认回补菌株[26](表2)。
1.3 杀松材线虫活性检测
将待测菌液浓度调为OD600值为1.0(含菌量1012CFU/mL),在96 孔细胞培养板中加入20 μL(约含50 头)松材线虫悬浮液,40 μL 待测菌悬液,对照组(CK)加入40 μL LB 培养基,黑暗条件下在25 ℃培养24 h 后除去菌液,停止共培养[27,28]。
采用4’6-二氨基-2-苯基吲哚(DAPI)对与细菌共培养后的松材线虫进行染色[29],DAPI 溶液最终浓度为5.0 μg/mL。染色1 h 后,用无菌水清洗3 次,除去染料。当线虫死亡后,线虫细胞结构不完整,细胞膜的通透性增加,DAPI 可以进入线虫细胞核与双链DNA 结合,发挥标记作用。使用激光共聚焦显微镜(Zeiss,LSM 800),激发光波长353 nm,吸收光波长465 nm 处可观察到死亡线虫因被染色而产生的荧光,而活线虫不被染色,不产生荧光。死亡率(%)=(死亡虫数量/供试虫数量)×100;校正死亡率(%)=(处理死亡率―对照死亡率)/(1―对照死亡率)×100。
1.4 松材线虫病防治效果检测
用5%的高锰酸钾溶液浸泡樟子松种子1 h,对种子进行表面灭菌。用无菌水清洗至无色,除去种子表面的高锰酸钾溶液。将灭菌后的种子用无菌纱布包裹,用无菌水润湿纱布,置于30 ℃进行催芽。48 h 后挑选出芽的种子,种植到灭菌土中,25 ℃温室培养30 d,每3 d 给幼苗浇水一次[30,31]。
种子萌发1 月后,樟子松幼苗苗高4~6 cm,具有针叶50~70 片,向该时期的樟子松幼苗喷淋5 mL OD600=1.0 的待测菌液。用注射针头在距离根部2~3 cm 处,将松树幼苗主干部位的韧皮部割开伤口,在伤口处安装1 mL 的注射器针头,用10 cm 左右的小木棒和封口膜固定针头和包扎伤口,在注射器枪头内注入100 μL 30 头/μL 的松材线虫悬浮液。
每组处理10 棵樟子松幼苗。接种9 d 后,根据病级分类(图1)获得相应病情指数。0 级,树苗生长正常,茎部饱满呈绿色、浅绿色,分支饱满较舒展呈深绿色,除有针头戳伤外无其他异样;1 级,树苗轻微畸形,茎部仍较饱满但开始泛黄,分支失水弯曲,分支尖端变黄,整株树苗失水呈现分支蜷缩现象;2级,树苗畸形,茎部失水轻微干瘪泛黄,分支蜷缩出现干瘪皱缩现象且尖端枯黄,整株树苗失水明显,出现轻微干枯现象;3 级,茎部枯黄干瘪,分支弯曲低垂失水严重且皱缩现象明显,整株树苗严重失水,濒临枯萎;4 级,茎部枯黄,分支弯曲干瘪枯黄,整株树苗完全失水,树苗枯萎死亡。病情指数(DI)=Σ(病级数×该病级株数)/(试验幼苗总数×最高病级数)×100。

图1 樟子松幼苗松材线虫病病级分类(比例尺:2 cm)Fig.1 Severity ranks of the PWD on Pinus sylvestris seedlings caused by B.xylophilus (Scale bars: 2 cm)
1.5 细菌的松材线虫定殖检测
将待测菌液浓度调为OD600值为1.0(含菌量1012CFU/mL),取400 μL 菌悬液涂布在LB 固体平板培养基上,黑暗条件,25 ℃培养24 h。将消毒好的线虫悬浮液滴加至该平板上,共培养到测试时间后,挑取20 头存活线虫,用无菌的PBS 缓冲液清洗3 次,然后加入1 mm 锆10 颗和500 μL 的PBS 缓冲液,使用中通量组织研磨仪破碎虫体30 s 后置于冰上,按1:10 比例稀释涂布,菌落计数[32]。
1.6 细菌限制松材线虫运动能力检测
将待测菌液浓度调为OD600值为1.0(含菌量1012CFU/mL),取400 μL 菌悬液涂布在LB 固体平板(半径45 mm)培养基上,对照组(CK)LB 固体平板不涂布菌悬液,黑暗条件,25 ℃培养24 h。松材线虫4龄幼虫对蓝光照有明显的避光性[11],挑取20 头具有运动能力的4 龄松材线虫幼虫,放置在铺有细菌的平板中央,用蓝光照射线虫,分别在10、20 和30 min 观察记录线虫分别在存在野生型AA4 和基因敲出ΔganA的细菌平板上的运动距离。
1.7 细菌生物膜形成检测
将处于对数生长期的待测菌液(OD600=0.6),用新鲜LB 培养基进行稀释至OD600=0.17, 取2 μL 滴加在胰蛋白胨大豆肉汤培养基(TSB)的表面,30 ℃静置培养72 h,对形成的菌膜拍照。移除培养基,用蒸馏水清洗3 次。吸出蒸馏水后,加入200 µL 2%结晶紫溶液染色30 min,移除结晶紫溶液,用蒸馏水清洗3 次,晾干,加入100 µL 10%醋酸溶解30 min,用酶标仪检测并记录孔中液体于OD570处的吸光值[33,34]。
1.8 细菌运动性检测
将待测菌液调整吸光度至OD600=0.17。用牙签蘸取菌液,穿刺接种于含有0.2%的琼脂的LB 平板(半径45 mm)培养基。黑暗条件下,30 ℃,静置14 h 后,测量待测菌株运动半径[34]。
1.9 β-半乳糖苷酶纯品杀线活性检测
将β-半乳糖苷酶纯品溶于无菌水中,调节浓度至400 μg/mL,在96 孔细胞培养板中加入20 μL(约含50 头)松材线虫悬浮液,40 μLβ-半乳糖苷酶溶液,对照组(CK)加入40 μL 无菌水,黑暗条件下在25 ℃培养24 h 后除去菌液,停止共培养。用DAPI 染色1 h,无菌水清洗3 次除去染料,使用激光共聚焦显微镜观察线虫染色情况,进而计算死亡率[28]。
2 结果与分析
2.1 基因ganA 与路德维希肠杆菌AA4 杀松材线虫活性的相关性
利用Red(λ,β,exo)介导DNA 同源重组系统敲除了菌株AA4 的β-半乳糖苷酶编码基因ganA(图2A),获得ganA基因敲除菌株ΔganA。利用质粒pBBR1,通过Gibson 连接构建回补质粒,获得ganA基因回补菌株CΔganA。基因敲除菌株ΔganA和基因回补菌株CΔganA的生长曲线与野生型菌株AA4 无显著性差异(图2B),即ganA基因的敲除与回补对路德维希肠杆菌AA4 的生长没有影响(图2B)。为研究β-半乳糖苷酶纯品是否具有杀松材线虫活性,将松材线虫置于400 μg/mL 的β-半乳糖苷酶溶液中培养24 h后,发现β-半乳糖苷酶溶液处理组与空白对照组无菌水处理组的杀线活性无显著差异(图2C),说明β-半乳糖苷酶纯品无杀线活性。

图2 基因ganA 在AA4 基因组上的位置(A),野生型菌株AA4、基因敲除菌株ΔganA 和基因回补菌株CΔganA 的生长曲线(B),β-半乳糖苷酶的杀松材线虫死亡率(C)Fig.2 The location of gene ganA on the genome sequence of E.ludwigii AA4 (A), growth curves of AA4, ΔganA and CΔganA (B),mortality rate of the PWNs treated with GAL (C)
分别将AA4、ΔganA及CΔganA菌液(OD600=1.0)与松材线虫共培养24 h,统计松材线虫校正死亡率,比较杀松材线虫活性。结果发现与AA4 共培养的松材线虫校正死亡率达到86.25%,而与ΔganA共培养的松材线虫校正死亡率为51.18%,与CΔganA共培养的松材线虫校正死亡率为80.76%。说明当基因ganA被敲除后AA4 的杀松材线虫活性显著下降,但是当基因ganA回补后,AA4 的杀松材线虫活性回升,与野生型菌株AA4 的杀松材线虫能力无显著差异(图3A)。为更直观地观察试验结果,将分别与AA4,ΔganA及CΔganA菌液(OD600=1.0)共培养的松材线虫用DAPI 溶液染色。经DAPI 溶液染色后发现,与AA4共培养的线虫几乎全部死亡,而与ΔganA共培养的死亡线虫明显减少,与CΔganA共培养的线虫死亡情况与AA4 相近(图3B)。表明基因ganA对AA4 的杀松材线虫活性至关重要,是其杀松材线虫作用机制中的关键基因。

图3 菌株AA4、ΔganA 及CΔganA 的杀松材线虫校正死亡率(A)及杀松材线虫效果DAPI 染色图像分析(B)Fig.3 Mortality of the PWNs treated with AA4, ΔganA and CΔganA (A) and imaging analysis of the PWN-killing efficacy of AA4,ΔganA and CΔganA against B.xylophilus after being stained by DAPI (B)
2.2 基因ganA 与路德维希肠杆菌AA4 防治松材线虫病功能的相关性
接种松材线虫后,发现野生型AA4 处理组(AA4)和回补菌株(CΔganA)处理组症状较轻,部分幼苗未表现出松材线虫病症状(图4A)。而仅接松材线虫处理组(PWN)和基因敲除菌株(ΔganA)处理组全部表现出松材线虫病症状,且病情较重,部分樟子松幼苗完全死亡。将AA4 喷淋在接种松材线虫的1月龄樟子松幼苗9 d 后,病情指数由91.4 降至41.2,与仅接松材线虫组差异显著(P<0.05);而ΔganA处理组病情指数为79.8,与仅接松材线虫组没有显著性差异;CΔganA处理组病情指数为46.2,生防效果有所恢复(图4B)。基因ganA敲除菌株ΔganA对松材线虫病的防治效果显著下降(P<0.05),而基因ganA的回补菌株CΔganA对松材线虫病的防治效果有明显恢复,说明基因ganA对路德维希肠杆菌AA4的松材线虫病防病效果的发挥有调控功能。

图4 在1 月龄樟子松幼苗上AA4,ΔganA 及CΔganA 松材线虫病防病效果(A)及防松材线虫病病情指数(B)Fig.4 Disease-suppressing effect of AA4, ΔganA and CΔganA against PWD caused by B.xylophilus on one-month-old P.sylvestris seedlings(A) and disease index of PWD on one-month-old P.sylvestris seedlings treated by PWN with AA4, ΔganA and CΔganA (B)
2.3 基因ganA 对路德维希肠杆菌AA4 生物膜的形成及运动性的影响
细菌生物膜形成能力测定结果发现,AA4 和ΔganA形成的生物膜表面平整,边缘光滑,且有一定厚度(图5A)。结晶紫染色后,AA4 生物膜OD570平均值为1.279,而ΔganA生物膜OD570平均值为1.205,无显著性差异(图5B)。

图5 菌株AA4 与ΔganA 的生物膜(A),2%结晶紫染色后菌株AA4 与ΔganA 的生物膜的吸光值(B)Fig.5 The biofilm of AA4 and ΔganA (A), the absorbance values of the biofilm of AA4 and ΔganA after stained by 2% crystal violet (B)
菌株的swimming 能力检测结果表明,菌株AA4 的swimming 运动半径平均为4.20 cm,而突变体ΔganAswimming 运动半径平均为3.44 cm(图6A)。统计分析结果表明,突变体ΔganA的swimming 能力显著下降(图6B)。

图6 菌株AA4 与ΔganA 的swimming 运动性(A), 菌株AA4 与ΔganA 的swimming 运动半径(B)Fig.6 The motility of swimming by AA4 and ΔganA (A), the moving radius (cm) of swimming by AA4 and ΔganA (B)
2.4 基因ganA 对路德维希肠杆菌AA4 定殖松材线虫的影响
随着AA4 与松材线虫共培养时间的增加,AA4 在松材线虫上共培养2 h 后的定殖量从7.4×103CFU/头不断增加,12 h 后达到1.3×104CFU/头。在共培养前期定殖量平缓上升,在共培养10 h 后,定殖量陡然上升。可以推断在共培养前期,AA4 与松材线虫相互作用,处于黏附入侵阶段,当定殖稳定后,AA4在松材线虫上大量繁殖,数量上升迅速,导致松材线虫死亡。ΔganA与松材线虫共培养2 h 后,定殖量仅有2.1×103CFU/头,与AA4 具有显著性差异;共培养12 h 后,定殖量也仅有7.2×103CFU/头;共培养10 h后,定殖量上升幅度减小(图7A)。基因ganA的缺失导致AA4 在松材线虫上的定殖量显著降低,定殖量的下降将影响细菌入侵、产毒过程,导致ΔganA杀松材线虫活性降低。
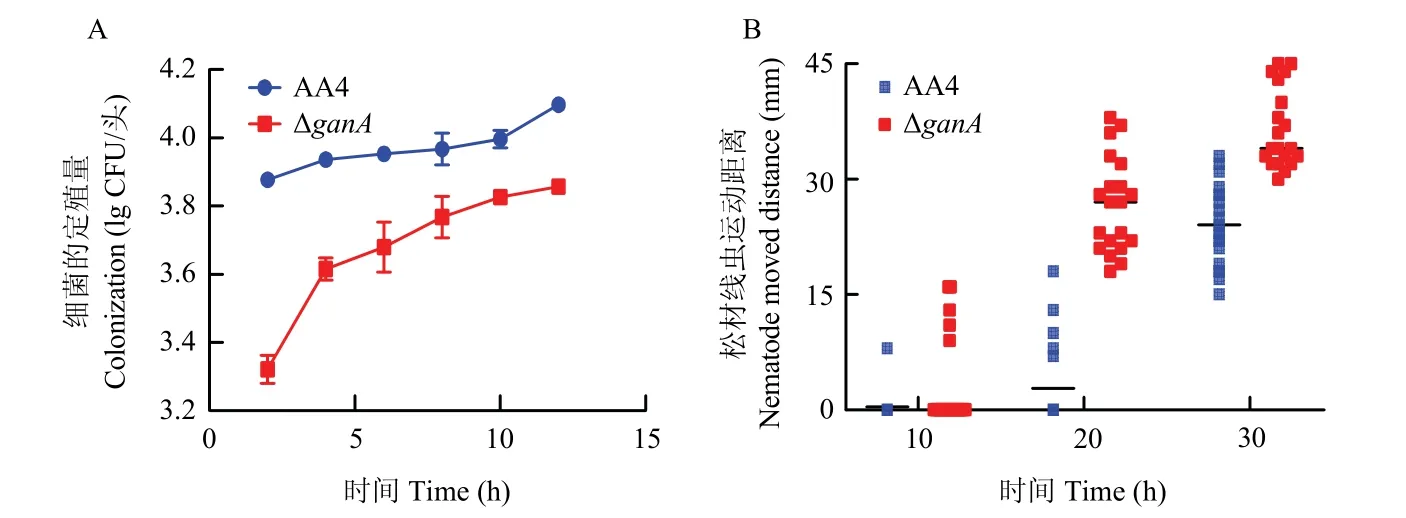
图7 菌株AA4 与ΔganA 在松材线虫体上的定殖量随时间变化趋势(A),菌株AA4 与ΔganA 限制线虫运动情况(B)Fig.7 The colonization of AA4 and ΔganA on pine wood nematode varied with time (A), restriction of nematode move by AA4 and ΔganA (B)
2.5 基因ganA 对路德维希肠杆菌AA4 限制线虫运动能力的影响
该试验测定结果发现,10 min 后,在AA4 细菌平板上仅有1 头线虫产生了移动距离,而在ΔganA细菌平板上,有5 头线虫产生了移动距离;20 min 后,在AA4 细菌平板上有5 头线虫产生了移动距离,在ΔganA细菌平板上,大部分线虫产生了移动距离,且最远移动距离达到38 mm;30 min 后,虽然在AA4 细菌平板上大部分线虫产生了移动距离,但最远距离仅有15 mm,而在ΔganA细菌平板上,所有线虫都移动了20~43 mm(图7B)。结果表明路德维希肠杆菌AA4 有限制松材线虫运动的能力。
3 讨论
细菌的运动是由细菌鞭毛逆时针或顺时针旋转引起的,细菌的运动性在细菌入侵宿主的初始阶段促进了细菌与宿主细胞的接触几率,同时鞭毛可作为黏附素与宿主细胞上的鞭毛受体结合,参与促进黏附过程[35]。Swimming 运动是单个细菌在液体环境中依靠鞭毛的旋转来进行的。鞭毛不仅仅是一个细胞器,通过调整旋转功率,控制细菌运动方式,帮助细菌向最适环境移动,还是一种能够检测和转导环境信号的传感器,调节基因表达和第二信使活性。Swimming 运动促进细菌找到理想的定殖位置,在生物膜的形成、共生和致病机制中起着关键作用。
本研究发现,β-半乳糖苷酶编码基因ganA,对路德维希肠杆菌AA4 杀松材线虫活性和松材线虫病防病能力都有显著影响,同时基因ganA能够影响路德维希肠杆菌AA4 在松材线虫上的定殖与限制松材线虫运动的能力。当基因ganA缺失时,路德维希肠杆菌AA4 的运动性受到显著抑制。鞭毛的运动可以促进细菌找到理想的定殖位置,传导生物学信号,细菌的运动性是细菌在环境中定殖的关键,所以基因ganA是路德维希肠杆菌AA4 在松材线虫上定殖的关键基因,在细菌与宿主相互作用过程中,稳定快速的定殖对细菌入侵,产毒,占据优势至关重要。松材线虫入侵松树之后,大量繁殖并随松树输导组织迅速遍布整株树木[36],路德维希肠杆菌AA4 能够减缓松材线虫的运动性,这可以减缓松材线虫在松树上的移动,利于AA4 在松材线虫上定殖,发挥杀松材线虫功能,起到防治松材线虫病的效果,而基因ganA的敲除后,AA4 的运动性减弱,使其在松材线虫上的定殖能力显著下降,进而限制松材线虫运动的能力减弱,生防效果降低。
在已报道的研究中,基因ganA的功能仅限于编码β-半乳糖苷酶。β-半乳糖苷酶是一种糖苷外切酶,广泛存在于多种细菌中能够促进乳糖转化和利用,供给细菌的生长[37];在链球菌中,β-半乳糖苷酶与定殖宿主相关,荧光假单胞菌菌株CHA0 处理爪哇根结线虫幼虫的死亡率与β-半乳糖苷酶的活性呈正相关[19],然而基因ganA与杀松材线虫活性相关为首次报道,并且基因ganA与细菌运动性的关系也未见报道。鉴于基因ganA与β-半乳糖苷酶的普遍存在性,本研究不仅拓宽了基因ganA与β-半乳糖苷酶的研究方向,也为松材线虫病的防治提供了新颖思路。
在植物寄生线虫与植物互作过程中,线虫能够感应植物或者根际微生物释放的化学信号而寻找寄主或远离恶劣环境[38]。AA4 具有限制松材线虫运动的能力,这种能力既限制了松材线虫的逃脱,也利于其在松材线虫上定殖,发挥杀松材线虫的功能。在防治松材线虫病的过程中,这种能力可以降低松材线虫在植物中扩散繁殖,以减少松材线虫的种群数量,达到防治效果。而基因ganA的敲除减弱了AA4 限制松材线虫运动的能力,使松材线虫更容易逃脱,这对于AA4 防治松材线虫病活性的发挥造成了显著影响。
