一株PAHs 降解菌Bacillus halotolerans M-7 的筛选、鉴定及其特性
2023-12-25张世堂胡泽祥娄国生张再美高盛嵩
张世堂,胡泽祥,娄国生,张再美,高盛嵩,陈 爽
(1.92228 部队,北京 100072;2.91286 部队,山东青岛 266021;3.中国石油大学(华东)化学化工学院,山东青岛 266580)
航空煤油是一种重要的战略资源,如果储存不当就会受到微生物的污染。一方面,这些微生物污染会引发许多问题,如:燃料燃烧性能下降;燃料中微生物代谢产物可能会腐蚀贮藏设备、管道、氧化密封项圈,微生物的团簇也会造成飞机过滤器等的堵塞[1],对航空煤油中主要的污染微生物进行研究,将有助于微生物污染的防治。而另一方面,这些微生物能够在营养物质匮乏,氧气浓度低的环境下生存,能够利用并降解多种烃类,包括链烷烃、环烷烃甚至是难降解的多环芳烃(polycyclic aromatic hydrocarbons,PAHs)等石油物质,其生物降解特性值得关注[2]。PAHs 是指含2 个或2 个以上苯环的芳烃,是一类有毒的有机污染物。在人类社会的发展过程中,人为造成的PAHs 排放量越来越大,主要是由于各种矿物燃料(如煤、石油和天然气等)、木材、纸以及其他含碳氢化合物的不完全燃烧或在还原条件下热解形成等[3],其污染问题引起了世界各国的普遍重视。研究发现,随着多环数目的增加,PAHs 的抗生物降解能力和致癌性会增大,且由于在许多生物链中都存在生物积累效应,导致PAHs 污染严重危害着土壤的生产、生态功能以及农产品质量和人类健康[4]。
有研究表明,微生物降解PAHs 是解决PAHs 污染最主要的途径[5]。受烃类污染的土壤、海水或油品是高效降解菌株的主要来源。目前已知的能够降解PAHs 的微生物包括芽孢杆菌属、假单胞菌属、红球菌属、鞘氨醇单胞菌属和黄杆菌属等[6-10]。孟建宇等[11]从乌梁素海水中筛选出一株假单胞菌,可降解质量浓度为3.5 g/L 的萘。马丹[12]从含油废水分离出一株菲降解菌,培养5 d后对菲的降解率为43.57%。但是,很少有降解菌能够同时高效降解航空煤油和PAHs,对于降解PAHs 的研究也很少关注对同分异构体的降解效果。
本研究以污染的航空煤油为污染微生物来源,富集后通过平板分离法筛选得到降解菌,通过形态观察、生理生化特征及16S rRNA 序列比对对筛选的降解菌进行鉴定,最后对该菌株降解不同种类PAHs 的能力进行了测定,以期为受PAHs 污染土壤的微生物降解提供微生物资源,同时鉴定航空煤油中的污染菌株并研究其降解特性,对减少航空煤油中微生物的污染和提高油品质量有重要意义。
1 材料与方法
1.1 培养基
无机盐培养基:磷酸二氢钾0.5 g、硫酸铵2.5 g、硫酸钠1.0 g、无水氯化钙0.1 g、无水硫酸镁1.0 g、酵母粉0.1 g、氯化钠30.0 g、乳酸钠水溶液1.0 mL、磷酸氢二钾0.5 g。加入适量去离子水,完全溶解后,定容至1 L。取若干250 mL 锥形瓶,每瓶分装50 mL,121 ℃高压灭菌20 min 备用。
筛选液体培养基:向灭菌后的50 mL 无机盐培养基加入过滤器除菌的油品0.75 mL,即为筛选液体培养基。每50 mL 筛选液体培养基中加入0.9 g 琼脂粉即为筛选固体培养基,121 ℃高压灭菌20 min 后备用。
胰酪大豆胨液体培养基(TSB):称取胰酪大豆胨液体培养基粉末30.0 g,加入适量去离子水,完全溶解后,定容至1 L。取若干250 mL 锥形瓶,每瓶分装50 mL;每50 mL TSB 中加入0.9 g 琼脂粉即为胰酪大豆胨固体培养基(TSA),121 ℃高压灭菌20 min 后备用。
萘、蒽、菲降解培养基:以萘为例,用正己烷溶解固体萘,将其配制成1.0 g/L 的母液;向灭菌后的50 mL无机盐培养基加入2.5 mL 的母液,使萘的工作浓度为50 mg/L。待正己烷挥发后即为萘降解培养基,蒽、菲降解培养基配制方法同萘。
1.2 降解菌的富集及筛选
在无菌环境下,用无菌的0.22 μm 滤膜抽滤4.0 L污染的油品,得到带有菌体的滤膜,低温环境下运输至实验室。用2.0 mL 无菌水冲洗上述滤膜,得到的菌悬液加至50 mL 筛选液体培养基中,放置于恒温震荡摇床中,35 ℃、165 r/min 培养至浑浊,同样的条件转接3次,经过富集最终得到能够利用油品的微生物菌群。取富集液进行梯度稀释,稀释的菌液涂布于筛选固体培养基平板上,在35 ℃恒温培养箱中培养48 h,直到长出单菌落,并对菌株进行划线纯化,得到的菌株即为初筛得到的降解菌。将初筛得到的降解菌接种至TSB中,35 ℃、165 r/min 活化12 h。按照1%的接种量将活化的种子液转接至筛选液体培养基中,35 ℃、165 r/min条件下培养7 d,每组3 个平行,以不接种菌株的培养液作为对照。利用紫外分光光度法测定菌株对油品的降解率,根据降解率筛选获得高效降解菌。
1.3 紫外分光光度法测定油品降解率
1.3.1 最佳吸收波长的确定 利用石油醚(60~90 ℃)(以下简称石油醚)作为萃取剂,萃取加入至筛选液体培养基中的油品,每次加入10.0 mL 的石油醚,在分液漏斗中静置10 min,等待分层,收集有机相,以上步骤重复3 次,收集后的有机相稀释至适当浓度后进行紫外全波长扫描。同时,配制1.0 g/L 的油品标准溶液,以石油醚为空白对照,在波长200~300 nm 的范围内利用紫外可见分光光度计对萃取后溶液及1.0 g/L 的油品标准溶液的吸光度进行测定,确定最佳吸收波长[13]。
1.3.2 绘制标准曲线 配制浓度为100~1 000 mg/L的油品标准溶液,以石油醚为空白对照,利用紫外-可见分光光度计测定最佳吸收波长处的吸光值,以油品的质量浓度为横坐标,吸光度为纵坐标来绘制标准曲线。
1.3.3 菌株降解率的测定 将降解菌接种至TSB 中,置于恒温培养摇床中,在35 ℃、165 r/min 条件下活化12 h。将活化后的种子液按照1%的接种量转接至筛选液体培养基中,35 ℃、165 r/min 条件下培养7 d,每组3 个平行,以不接种菌株的培养液作为对照。利用紫外分光光度法测定降解率,通过标准曲线计算油品的残留量,借助公式(1)计算出菌株的降解率。
1.4 降解菌的鉴定
依据文献《伯杰氏细菌鉴定手册》[14]和博检鉴定试剂盒中的使用说明对降解菌进行形态观察和生理生化特性鉴定。提取M-7 的DNA,以细菌通用引物27F(5' -AGAGTTTGATCCTGGCTCAG -3')、1492R(5' -GGTTACCTTGTTACGACTT-3')分别为上下游引物[15],进行PCR 扩增。PCR 反应体系总体积为20.00 μL,LA-Taq 酶0.25 μL,模板1.00 μL,无菌水5.25 μL,2×GC Buffer Ⅰ12.50 μL,dNTP 2.00 μL,上下游引物各0.50 μL。循环条件为95 ℃预变性300 s;95 ℃变性50 s;46.4 ℃退火45 s;72 ℃延伸90 s。用1%的琼脂糖凝胶电泳检测上述PCR 产物。将条带大小正确的PCR 产物送去北京擎科生物科技有限公司青岛分公司进行测序。利用BLAST 比对已知微生物的16S rRNA 序列,分析得到同源序列。采用ClustalX2.0[16]和MEGA7.0[17]构建系统进化树,采用邻接法并通过自举分析(1 000 次)进行置信度检测。
1.5 气相色谱法测定PAHs 降解率
首先绘制PAHs 标准曲线。以萘为例,配制浓度为20、40、60、80、100 mg/L 的萘标准溶液,利用气相色谱法测定其峰面积。以萘的质量浓度为横坐标,峰面积为纵坐标绘制标准曲线。菲、蒽标准曲线的绘制方法同萘。气相色谱条件如下:进样口温度300 ℃,检测器温度330 ℃,毛细管柱50 m×0.25 mm×0.25 μm,柱温130 ℃保持3 min,以45 ℃/min 的升温速率升温至180 ℃,保持5 min,再以45 ℃/min 的升温速率升温至280 ℃,保持5 min,进样量1 μL[18]。
随后,测定菌株对不同PAHs 的降解率。降解菌在TSB 中活化12 h 后,按照1%的接种量转接至萘、蒽、菲降解培养基中,35 ℃、165 r/min 条件下培养6 d,每隔24 h 取样,测定菌株的PAHs 降解率,具体方法包括:吸取5 mL 培养液加入装有2.0 g 氯化钠和10 mL正己烷溶液的离心管中,用旋涡混合器混匀2 min,7 000 r/min 离心10 min,转移上清液至玻璃小瓶中。用2.0 g 无水硫酸钠脱水,30 ℃旋转蒸发,氮气吹至1 mL以下,正己烷定容至1 mL[19]用气相色谱仪测定各PAHs 的质量浓度。
2 结果分析与讨论
2.1 建立紫外分光光度法测定油品的降解率
2.1.1 最佳吸收波长的确定 首先,利用紫外可见分光光度计对1.0 g/L 的油品标准溶液进行全波长扫描,结果见图1,标准溶液在226 nm 和266 nm 处有最大吸收峰,随后,用同样的方法对萃取后的油品进行了全波长扫描,结果表明,二者最大吸收峰位置一致,证明该检测方法适用于接下来油品降解率的测定。由于在200~238 nm 内石油醚的吸收性很强,容易干扰实验测定结果[20],为减少干扰而优选266 nm 为最佳吸收波长。
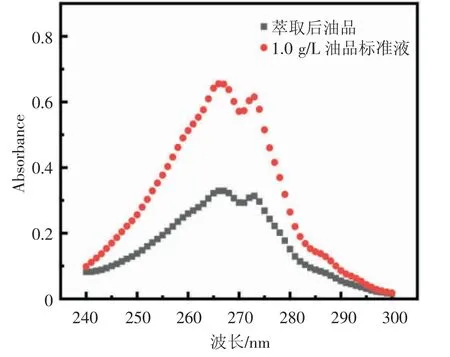
图1 萃取后油品和油品标准液紫外全波长扫描结果
2.1.2 绘制标准曲线 以石油醚为空白对照,用紫外可见分光光度计测定266 nm 处的吸光度,以油品浓度为横坐标,以吸光度为纵坐标绘制标准曲线(图2),得到线性方程为y=0.000 6x+0.021 9,相关系数R2=0.993,表明吸光度与油品浓度之间呈较好的线性关系,该方法可用于油品含量测定。

图2 油品浓度-吸光度标准曲线
2.2 降解菌富集及筛选
从受污染的油品中初筛得到9 株能够以油品为唯一碳源进行生长代谢的菌株,分别将其编号命名为:M-1、M-2、M-3、M-4、M-5、M-6、M-7、M-8、M-9。将9株菌株培养7 d 后,利用石油醚萃取残余油样,适当稀释后测定266 nm 波长处的吸光度,根据标准曲线计算得到菌株降解后残余油品的浓度,最后通过公式(1)计算各菌株的降解率,结果见图3。9 株菌株对油品都具有一定的降解能力,其中菌株M-7 降解率最高,为99.00%,表现出高效降解混合油品的能力,因此,确定菌株M-7 为后续实验菌株。
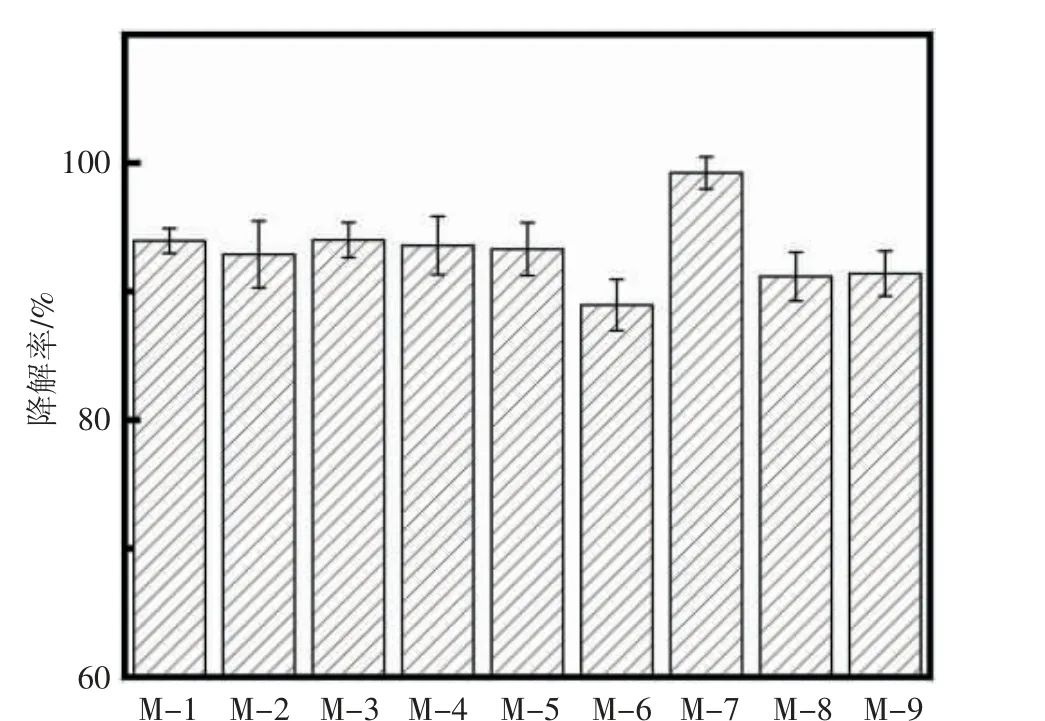
图3 9 株菌株培养7 d 的油品降解率
2.3 降解菌M-7 的鉴定
对菌株M-7 在TSA 上的菌落形态进行观察,结果见图4a,菌落呈乳白色、粗糙、不透明状,边缘不规则,与芽孢杆菌的形态特征相似。扫描电镜图显示M-7 为短而小的杆菌,见图4b。随后,对该菌株进行生理生化鉴定,结果见表1。菌株M-7 对β-半乳糖苷酶、脲酶、葡萄糖、蔗糖、柠檬酸盐利用、硫化氢产生、VP、氧化酶的实验结果为阳性,其余实验结果均为阴性,说明菌株M-7 可产生β-半乳糖苷酶、脲酶、氧化酶,能够利用葡萄糖、蔗糖、柠檬酸盐产酸,可分解含硫氨基酸产生硫化氢等,实验结果与《伯杰氏细菌鉴定手册》和王青华等[21]报道的芽孢杆菌的生化结果相似。

表1 生理生化鉴定结果

图4 a.M-7 菌落形态和b.扫描电镜形态观察
最后,对该菌株进行遗传学鉴定。提取菌株基因组,经PCR 扩增得到1 300 bp 左右的条带并进行测序。通过BLAST 对测序结果进行同源比对,利用ClustalX2.0 和MAGE7.0 构建系统进化树(图5),菌株M-7 与芽孢杆菌属(Bacillus)菌株Bacillus halotolerans的16S rRNA 序列同源性最高,达到了99.86%,因此,确定该菌株为Bacillus halotolerans,将其命名为Bacillus halotolerans M-7。
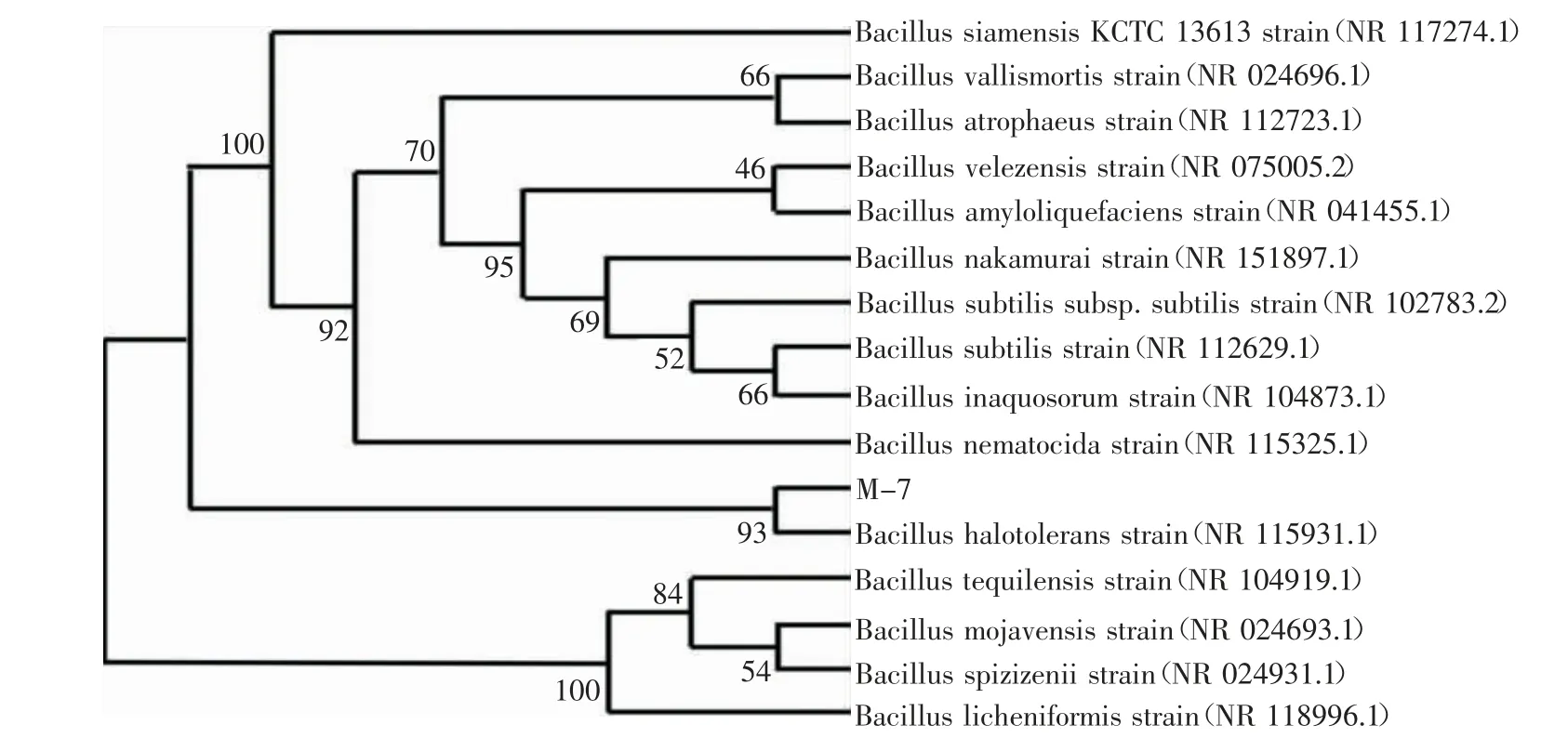
图5 M-7 菌株系统进化树
2.4 气相色谱法测定PAHs 降解率
2.4.1 PAHs 标准曲线绘制 配制不同浓度的萘、蒽、菲标准溶液用气相色谱法分别测定峰面积,分别作出萘、蒽、菲浓度-峰面积标准曲线,见图6,萘的线性方程为y=180.500 0x+520.000 0,R2=0.996;蒽的线性方程为y=635.357 1x+1 562.857 1,R2=0.997;菲的线性方程为y=498.228 7x+495.238 1,R2=0.991,相关系数都大于0.990,线性关系较好。
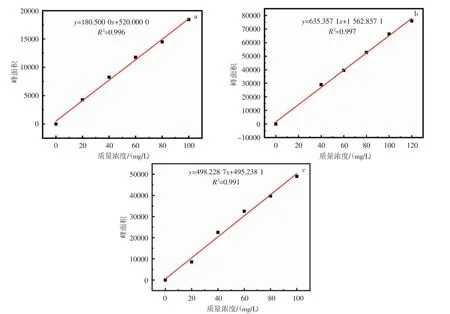
图6 a.萘、b.蒽和c.菲的标准曲线
2.4.2 降解菌对PAHs 萘、蒽、菲的降解性能测定Bacillus halotolerans M-7 对三种PAHs 都有不同程度的降解(图7)。该菌株对二环芳烃萘的降解率最高,第1 d 的降解率就能达到60.00%以上,第6 d 几乎全部降解。但是,对三环芳烃的降解率要低。蒽在前4 d 的降解率几乎为0,4 d 之后才开始有所降解,这可能是因为50 mg/L 的蒽在作为唯一碳源和氮源的情况下,不足以支撑菌株的快速生长,因此,Bacillus halotolerans M-7 在前4 d 的代谢十分缓慢,需要经历较长的迟滞期才进入快速生长的对数期。同样的,该菌株对蒽的同分异构体菲的降解也出现类似现象。随着培养时间的延长,蒽和菲开始被降解,在第6 d 时,降解率分别为39.89%、47.69%,且降解率依然呈现上升趋势。对比该菌株对不同环数的PAHs 的降解能力发现,Bacillus halotolerans M-7 对二环芳烃萘的降解率明显优于对三环芳烃蒽和菲,根据思显佩等[22]的研究,推断PAHs苯环的断开主要是靠加氧酶的作用,加氧酶把氧加到C-C 键上形成C-O 键,经加氢、脱水等作用使C-C 键断裂,从而使苯环数减少,因此,推断苯环越多越难降解。故该菌株对于两环的萘的降解效果优于三环的蒽、菲。对于相同环数的蒽和菲而言,该菌株对菲的降解要优于对蒽的降解。刘俊等[23]研究发现乳白耙齿菌F17 对菲的降解效果比蒽要好,杜丽娜等[24]同样发现青顶拟多孔菌对菲的降解能力要优于蒽的降解,这与本实验结果一致。这种差异显然是由于菲和蒽分子结构的不同所引起[23],蒽和菲3 个苯环的位置不同而有着不同的降解途径。
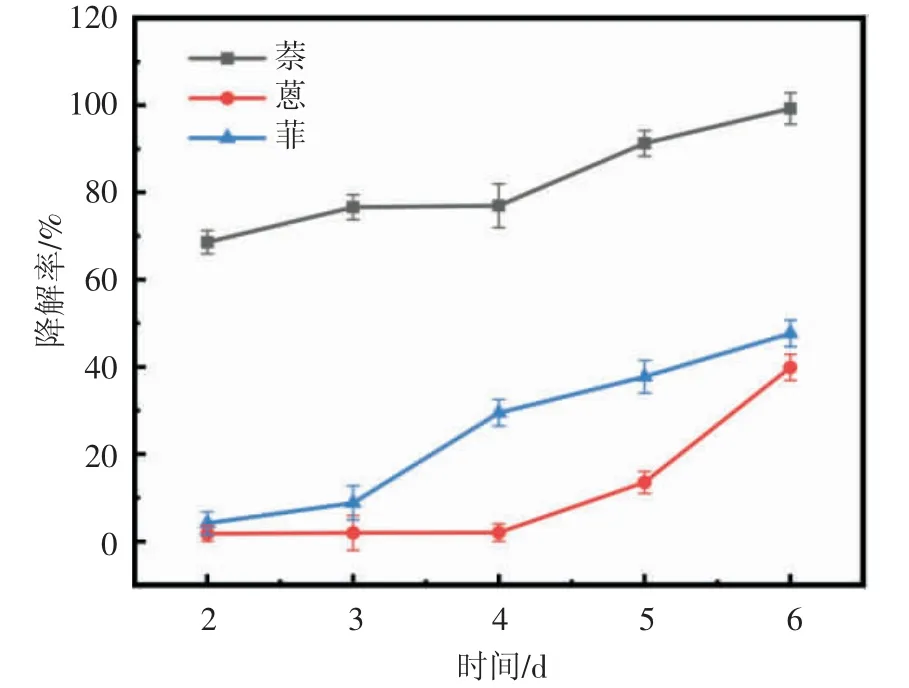
图7 Bacillus halotolerans M-7 对萘、蒽、菲的降解性能
3 结论
本文从污染的航空煤油中筛选获得1 株能够高效降解航空煤油混合物和PAHs 的菌株,通过形态观察、生理生化特征及16S rRNA 序列分析对筛选的降解菌进行鉴定,最后对该菌株降解不同种类PAHs 的能力进行测定,主要得出以下结论:
(1)从污染的油品中筛选出9 株能够高效降解油品混合物的菌株,9 株菌株对油品的降解率都在80.00%以上。通过二次筛选,筛选出1 株表现较好的M-7 菌株,其对油品的降解率达到99.00%以上。通过形态观察、生理生化实验及16S rRNA 序列比对对菌株进行鉴定,该菌株属于芽孢杆菌属,命名为Bacillus halotolerans M-7。
(2)利用气相色谱法检测该菌株对不同PAHs 的降解率,结果表明,培养7 d 后,Bacillus halotolerans M-7 对萘、蒽、菲的降解率分别为99.26%、39.89%、47.69%,其中二环芳烃萘的降解率明显优于三环芳烃的蒽和菲,同为三环芳烃的同分异构体蒽和菲,对菲的降解率大于蒽,表明该菌株对于同分异构体的降解具有不同的途径。
本研究为受PAHs 污染土壤的微生物降解提供了微生物资源,同时鉴定航空煤油中的污染菌株并研究其降解特性,对减少航空煤油中微生物的污染和提高油品质量有重要意义。
