基于Gd-EOB-DTPA增强MRI纹理分析与血清学指标预测肝细胞癌微血管侵犯
2023-12-25陈新蕾李雨蒙孙潇楠朱文玲朱丽平李绍东
陈新蕾,李雨蒙,孙潇楠,朱文玲,朱丽平,李绍东
微血管侵犯(microvascular invasion,MVI)是肝细胞癌(hepatocellular carcinoma,HCC)具有侵袭性的特征之一,是患者术后复发的重要危险因素[1-2]。术前预测MVI有助于临床医师采取合适的治疗方案和评估患者的预后具有重要的临床意义,也是近年来研究的热点和难点。病理活检是诊断MVI的金标准,但术前穿刺活检的准确性较低且具有一定侵入性。既往研究已经报道了常规MRI纹理分析预测MVI的初步价值[3]。同时,作为HCC患者的常规检查项目之一的血清学指标的检测在MVI的诊断和预后评价方面同样具有重要作用[4]。GD-EOB-DTPA是肝细胞特异性对比剂,已初步应用于肝细胞癌微血管侵犯的评价[5]。本研究中拟对GD-EOB-DTPA增强MRI纹理分析联合血清肿瘤标志物检测在术前预测HCC伴有MVI中的价值进行探讨。
材料与方法
1.研究对象
回顾性分析2018年12月-2022年6月在本院经手术病理证实为原发性HCC患者的影像学数据和临床资料。纳入标准:①经术后病理证实为HCC并能获得是否存在MVI的明确诊断;②术前一个月内接受GD-EOB-DTPA增强MRI检查和肿瘤标志物的血清学检查,后者包括甲胎蛋白(AFP)、谷丙转氨酶(ALT)、谷草转氨酶(AST)和异常凝血酶原-Ⅱ(PIVKA-Ⅱ);③无其他恶性肿瘤病史。排除标准:①术前进行消融或栓塞等HCC相关治疗;②病理或影像学检查提示肝内病变为多发;③术前MRI检查提示存在大血管侵犯;④MRI图像质量欠佳,影响判读。
最终将206例HCC患者纳入本研究。按照9:1的比例将所有患者分为训练组及验证组。训练组共纳入185例患者,男128例,女57例,年龄37~76岁,中位年龄56岁;91例有MVI,94例无MVI。验证组共纳入21例患者,男13例,女8例,年龄40~75岁,中位年龄58岁;9例有MVI,12例无MVI。记录患者的各项临床资料,包括性别、年龄、身高、体重以及有无肝硬化。
2.MRI扫描
使用GE Signal 3.0T磁共振扫描仪进行MRI扫描。常规行T1WI、T2WI以及肝脏容积加速采集(li-ver acquisition with volume acceleration,LAVA)增强扫描。采用水脂分离及同反向位技术的LAVA-FLEX序列进行T1WI扫描;采用呼吸触发单次激发快速自旋回波(FSE)序列进行T2WI扫描;LAVA增强扫描主要参数:TR 5.0 ms,TE 2.5/1.3 ms,矩阵256×180,带宽142.86 KHz,视野40 cm×40 cm,层厚5.0 mm;预扫描蒙片后,利用高压注射器以2.5 mL/s的流率静脉注射Gd-EOB-DTPA,剂量0.025 mmol/kg,随后注射20 mL生理盐水,分别于注射Gd-EOB-DTPA后20 s、70 s、300 s和20 min采集动脉期、门静脉期、延迟期及肝胆期图像,单期扫描时间为15 s,每期扫描88层。
3.纹理分析
所有患者的MRI图像均以DICOM格式从PACS系统导入MaZda 4.6软件进行纹理分析。在纹理特征提取之前,对图像进行预处理,主要步骤:①将图像的像素调整为12位;②使用MaZda软件对图像灰度进行标准化,减少由于图像对比度和亮度带来的误差。然后,由两位高年资医师(具有10年以上工作经验)分别进行ROI的勾画:在肝胆期MRI图像上选择肿瘤直径最大层面,沿肿瘤的实性区域勾画ROI,注意避开血管、坏死和囊变区域(图1)。为了减少主观因素可能带来的误差,这两位医师对所有患者的病情并不知情。每例患者自ROI共提取纹理特征参数837个。

图1 患者,男,63岁,发现肝右后叶巨大占位,术后病理证实为HCC合并MVI。a)动脉期图像示肝右后叶内类圆形病灶呈明显不均匀强化;b)门静脉期图像示病灶强化程度减低;c)肝胆期图像示病灶呈低信号,表明病灶总体而言呈“快进快出”样强化;d)使用MaZda纹理分析软件,在肝胆期图像上沿病灶边缘勾画ROI,提取病灶的纹理特征。
4.纹理特征的选择和降维
使用组内相关系数(intraclass correlation coefficient,ICC)分析两位医师自勾画的ROI所提取的组学特征值的一致性。ICC>0.75认为一致性良好。首先排除ICC<0.75的纹理特征,以此提高实验的可重复性;然后,对含有方向的纹理特征进行平均整合;随后,采用随机森林算法剔除次要特征;最后,为了排除不同纹理特征之间的共线性,剔除相关系数值>0.6的特征。
5.统计学分析
使用R 3.5.1和SPSS 23.0软件对数据进行统计分析。采用Shapiro-Wilk和Levene检验分别对数据进行正态性和方差齐性检验,然后采用Mann-WhitneyU检验(不符合正态分布)或t检验(符合正态分布)比较MVI组与非MVI组之间各项纹理特征和血清学指标的差异。最后,采用多因素logistic回归分析探究MVI的影响因素。
结 果
肝细胞癌MVI组与非MVI组之间临床资料的比较结果见表1。两组之间BMI的差异有统计学意义(P<0.05),年龄、性别构成和合并肝硬化者的占比在两组之间的差异均无统计学意义(P>0.05)。

表1 MVI组与非MVI组之间临床资料的比较
2.纹理特征提取
本研究中自训练集中每个HCC病灶共提取837个纹理特征。首先将ICC<0.75的438个一致性较小的纹理特征剔除;随后,将剩余的特征进行方向选择,对0°、45°、90°和135°四个方向的特征值取平均值;再将剩余的72个特征采用随机森林法进行降维后,得到20个最优纹理特征(图2)。对这20个特征进行相关分析以排除高共线性特征,最终获得7个相关性最大的纹理特征:GLCM_Energy,SumAverg,DifVarnc,CE_Entropy、Teta2、Mean和Sigma(图3)。
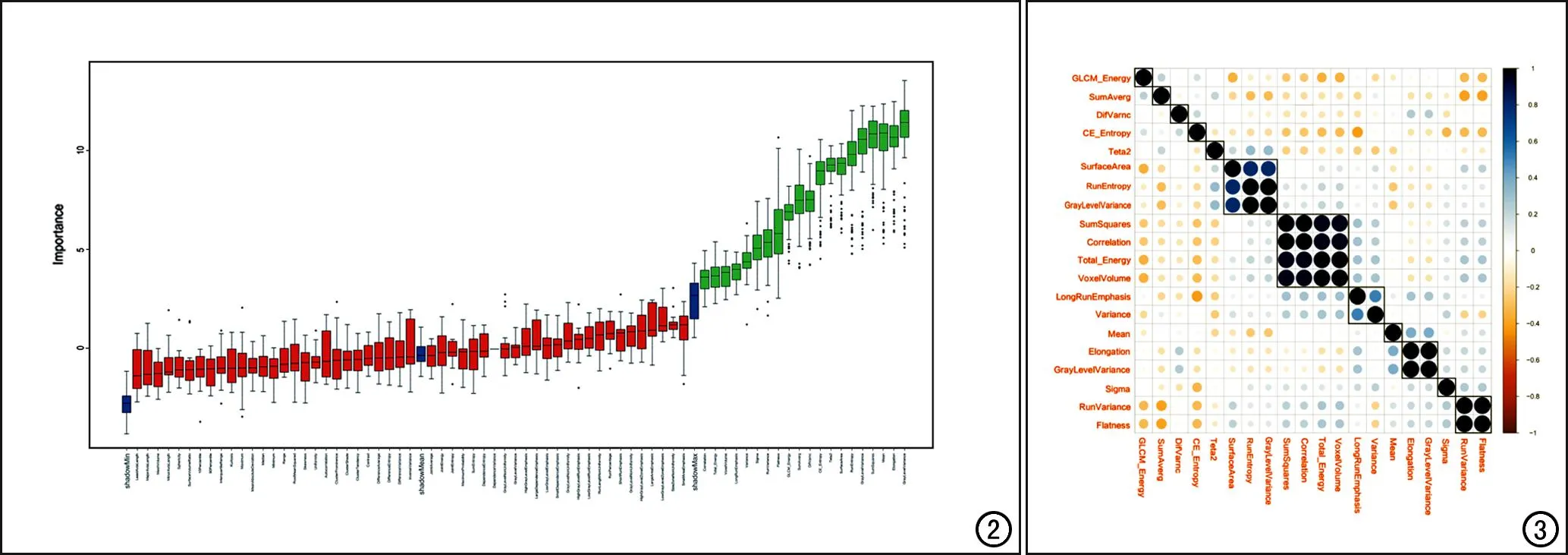
图2 降维图。将72个特征采用随机森林法进行降维,图中显示每个变量的重要性(纵坐标为变量重要性),再进行方差检验筛选出20个特征(绿色框)。
对7项纹理特征进行组间比较,结果显示:MVI组的GLCM_Energy、SumAverg、DifVarnc和CE_Entropy值显著高于非MVI组,而Teta2值显著低于非MVI组,差异均有统计学意义(P<0.05)。
3.血清学指标分析
两组的血清学指标测量值及组间比较详见图4。统计分析结果显示,MVI组的ALT、AFP和PIVKA-Ⅱ水平均高于非MVI组,差异均有统计学意义(P<0.05)。
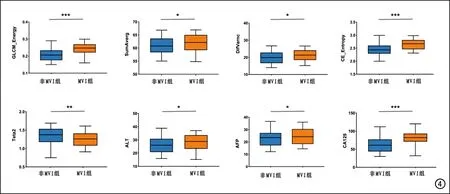
图4 7个相关性最大的纹理特征及3个血清学指标测量值的箱式图及组间差异分析结果。MVI组的2个纹理特征(GLCM_Energy、CE_Entropy)和血清学指标PIVKA-Ⅱ的均值显著高于非MVI组,组间差异均有统计学意义。注:*P<0.05;** P<0.01;*** P<0.001。
4.纹理特征、血清学指标及联合模型预测MVI的效能
在校正相关协变量后,MVI组的GLCM_Energy和CE_Entropy仍显著高于非MVI组(P<0.05),而其它纹理特征的组间差异无统计学意义(P>0.05);在校正相关协变量后血清学指标中仅PIVKA-Ⅱ值的组间差异有统计学意义(P<0.05)。基于上述的2项纹理特征和1项血清学指标构建的联合模型预测MVI的ROC曲线如图5所示。Logistic回归分析结果见表2。统计分析结果显示GLCM_Energy、CE_Entropy和PIVKA-Ⅱ均对HCC发生MVI具有一定的预测效能(P<0.001)。
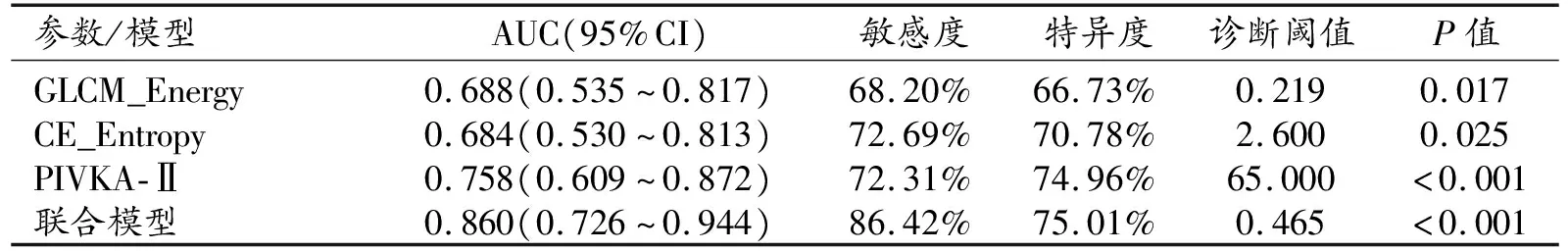
表2 独立影响因素和联合模型在验证集中预测HCC合并MVI的效能
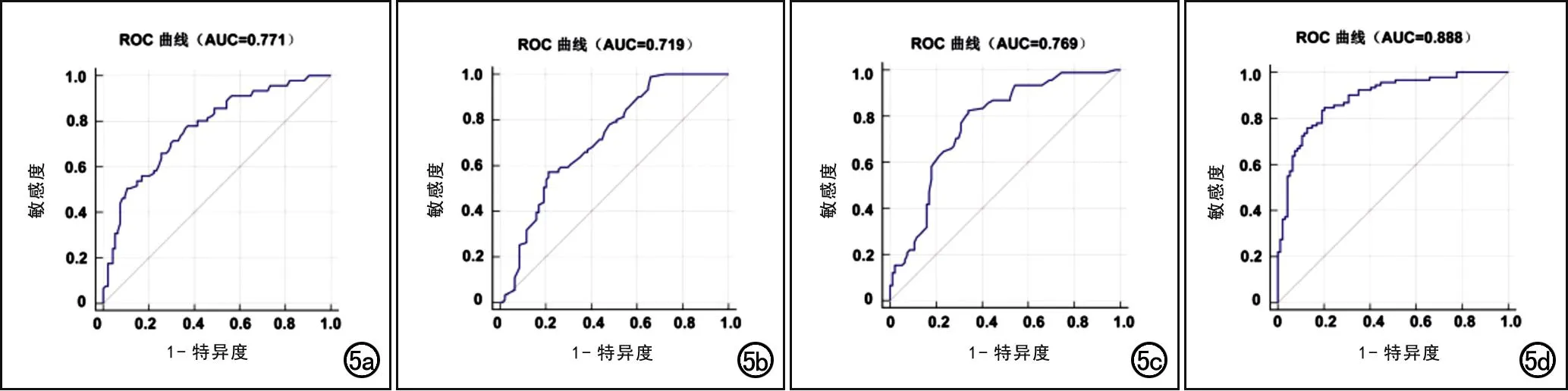
图5 各单一变量及联合模型对MVI预测效能的ROC曲线。a)GLCM_Energy,AUC为0.771(95%CI:0.704~0.829);b)CE_Entropy,AUC为0.719(95%CI:0.648~0.782);c)PIVKA-Ⅱ,AUC为0.769(95%CI:0.701~0.827);d)联合模型,AUC为0.888(95%CI:0.833~0.930)。
联合上述2项纹理特征及血清学指标PIVKA-Ⅱ构建的联合模型对HCC发生MVI具有更高的预测效能(图5),AUC 达0.888(95%CI:0.833~0.930),敏感度为84.6%(95%CI:75.5%~91.3%),特异度为79.8%(95%CI:70.2%~87.4%)。
5.独立队列验证
在验证集中,使用训练集拟合模型在验证集上测试模型,通过比较不同模型的测试MSE选出最佳模型,结果表明,纹理特征GLCM_Energy、CE_Entropy和血清学指标PIVKA-Ⅱ能够预测MVI(P<0.05);联合模型具有更高的预测效能,AUC为0.860(95%CI:0.726~0.944),详见表2。
讨 论
建立合适的预测模型是术前预测MVI的一种较被广泛认可的方法[6],本研究中初步探讨了基于Gd-EOB-DTPA增强MRI提取的纹理特征联合肿瘤标志物相关的血清学指标在术前预测MVI中的价值,结果表明基于MRI纹理特征与血清学指标构建的联合模型在术前预测HCC伴有MVI中具有较高的应用价值,有利于提高预测效能。
对于HCC MVI的预测,既往的临床研究中采用了多种模式。基于HCC患者的DWI图像预测MVI的研究结果显示,因MVI 1~2级的病灶内毛细血管微循环血流灌注减低,故病灶的ADC值下降[7,8],但DWI稳定性相对较差,总体而言相关研究结果的准确性不够高。基于MR T2WI的纹理分析预测MVI的研究结果表明,T2WI因其较好的分辨率、一致性和可重复性,在术前预测HCC合并MVI方面具有一定价值,预测的准确性较高[3]。但由于选取的参数单一,尚需探讨能否基于其它序列(动态增强)的图像提取更多有意义的纹理特征信息。
本研究中联合运用基于Gd-EOB-DTPA增强肝胆期磁共振图像的纹理分析和血清学指标的检测来探讨其预测HCC合并MVI的价值[9]。首先,作为肝胆特异性MRI对比剂,具有正常功能的肝细胞在摄取Gd-EOB-DTPA对比剂后的肝胆期表现为明显强化呈高信号,肝细胞功能受损或不含正常功能肝细胞的病变对Gd-EOB-DTPA的摄取能力下降,导致其肝胆期信号不同程度减低,故此期图像上肿瘤组织与周围肝实质的信号差异较使用常规对比剂时更为明显,且肿瘤的边界更清晰,使得对肝癌病灶的分割更加准确[10]。此外,肝胆期图像在一定程度上能反映肝癌细胞的分化程度,不同分化程度的HCC发生MVI的风险不同[11]。因此,本研究中选择肝胆期图像进行纹理分析。其次,纹理分析技术是放射学领域一种较新的研究方法,该方法能够从图像中提取高通量信息,并将其转换为可进行分析的定量数据。此外,有研究结果显示部分临床血清学指标,如AFP、去饱和-γ-羟基凝血酶原(DCP)、PIVKA-Ⅱ、血小板与淋巴细胞的比值(PLR)、中性粒细胞与淋巴细胞的比值(NLR)、淋巴细胞与单核细胞的比值(LMR)和天冬氨酸转氨酶与血小板比值(APRI)等,与HCC患者MVI的发生和发展密切相关[12]。因此,血清学指标的检测常作为肝脏肿瘤患者术前的一项常规检查项目,并且血清学指标相对于病理及影像学资料而言,在临床实践中更易获得,其准确性、客观性较强,因此利用血清学指标建立预测模型对于MVI的早期预测具有较高的临床实用价值[4,13]。
本研究中对自每个病灶ROI初步提取的837个纹理特征进行统计学降维后,筛选出7个独立的纹理特征,再进行组间比较,获得组间差异有统计学意义的5个纹理特征,采用ROC曲线分析这5个参数对MVI的预测效能,结果显示GLCM_Energy和CE_Entropy的AUC分别为0.771和0.719。GLCM_Energy(能量)是灰度共生矩阵各元素值的平方和,是度量图像纹理灰度变化的稳定程度的指标,反映了图像灰度分布均匀程度和纹理粗细度。能量值大表明图像上ROI内是一种规则变化的较为稳定的纹理。CE_Entropy(熵),用于估计ROI内灰度像素强度的不均匀性和不规则性。较高的熵值反映了更大的成像不均匀性,它可能是组织病理学上显示的肿瘤异质性和侵袭性的一种成像生物标志物。在广谱的纹理特征的分析中,熵已被证明是局灶性肝脏病变的一个潜在预测因子[6]。另外,本研究结果显示组间差异有统计学意义的血清学指标为PIVKA-Ⅱ,其AUC为0.769,与Poté等[14]的研究结果基本一致。PIVKA-Ⅱ在一定程度反映了机体在对抗肿瘤生长的平衡状态[15]。有研究表明,与术前血清内低水平PIVKA-Ⅱ的HCC患者相比,术前血清内高水平PIVKA-Ⅱ的HCC患者更容易形成门静脉癌栓和微血管浸润[16]。虽然这些参数在一定程度上能反映MVI组与非MVI组之间肿瘤的异质性,但单一参数预测HCC伴有MVI的效能较低。进一步分析比较纹理特征及纹理特征联合血清学指标诊断MVI的效能,结果显示,纹理特征联合血清学指标的诊断效能明显高于单一的纹理特征,联合模型的AUC提高至0.888,敏感度达84.62%,特异度为79.79%。并且在验证组中也能获得较好的预测效能。
目前,已有学者报道了增强MRI纹理分析在预测HCC合并MVI中的应用价值。马霄虹等[17]基于常规增强MRI的纹理分析预测HCC合并MVI,训练集中动脉期和门静脉期影像组学模型诊断MVI的ROC下面积分别为0.774和0.681,基于动脉期纹理特征构建的模型预测准确性更高,但其AUC略低于本研究中Gd-EOB-DTPA增强MRI肝胆期纹理特征GLCM_Energy和CE_Entropy的AUC(分别为0.771和0.719),其原因可能是上述研究采用常规Gd对比剂进行增强MRI,而本研究中采用Gd-EOB-DTPA作为对比剂,选取的是肝胆期增强图像,所提取的特征能更准确地反映HCC的异质性等相关信息。黄京城等[18]对增强MRI动脉期、门静脉期及延迟期图像分别进行影像组学特征的提取,选择最优影像组学模型并结合临床-影像特征模型构建临床-影像-组学模型。结果显示3期联合影像组学模型的诊断效能达到最优,在训练组与测试组中的AUC分别为0.934及0.911,其AUC高于本研究中的结果,其原因可能是采用了3期图像来提取纹理特征。张泳欣等[19]建立了一个基于临床-影像特征及血液学指标的预测模型,其术前预测肝癌MVI的AUC为0.895,略高于本研究中的联合模型,其原因可能是上述研究在评估影像特征时,较本研究中纳入了更多的临床和影像特征,如淋巴结计数、VEGF-A血清浓度等指标,既往已有研究结果表明这些指标是MVI的重要预测因子[20]。
本研究存在一定的局限性:第一,这是一项回顾性研究,可能存在样本选择偏倚;第二,纹理分析中ROI边界的勾画由放射科医师手动完成,受个人经验的影响较大;第三,仅对本研究中纳入的病例基于是否存在MVI进行分组和评价,而实际工作中HCC MVI分为三个级别,MVI 0级(即本研究中的HCC无MVI)、MVI 1级、MVI 2级(MVI 1级和MVI 2级即本研究中的HCC合并MVI),尚需要针对MVI分级进一步展开研究。
综上所述,基于Gd-EOB-DTPA增强肝胆期MRI图像提取的纹理特征(GLCM_Energy和CE_Entropy)和血清学肿瘤标志物(PIVKA-Ⅱ)构建的联合模型可用于术前预测HCC合并MVI,且具有较高的预测效能。
