鸡源大肠杆菌的分离鉴定及其致病性分析
2023-12-25陈家乐何金灵杜荣起李丹若金天明张东超通信作者
陈家乐,何金灵,杜荣起,李丹若,金天明,张东超,通信作者
(1. 天津农学院 动物科学与动物医学学院 天津市农业动物繁育与健康养殖重点实验室,天津 300392;2. 天津市农业科学院,天津 300192)
鸡大肠杆菌病是由禽致病性大肠杆菌(Avian pathogenicEscherichia coli,APEC)引起的鸡大肠杆菌相关疾病的总称,主要临床特征为腹膜炎、肝周炎、肠炎、输卵管炎、气囊炎、大肠杆菌肉芽肿及败血症等。大肠杆菌是感染鸡的主要细菌之一[1],不同年龄、品种的鸡均可感染该菌[2],给我国养鸡业带来严重的经济损失[3]。
鸡大肠杆菌血清型众多,临床上主要使用抗生素治疗,但抗生素长期不规范使用导致大肠杆菌的耐药菌谱逐渐扩大,有效抗菌药物越来越少[4],给大肠杆菌病的治疗增加了难度。本研究通过对天津地区某鸡场疑似大肠杆菌感染病鸡进行细菌分离鉴定、致病性分析和敏感药物筛选,为鸡场对大肠杆菌病的防控管理及科学用药提供参考依据。
1 材料与方法
1.1 试验材料
1.1.1 病料来源
天津地区某规模化肉鸡养殖场中的一批病鸡。
1.1.2 试验动物
18~20 g 健康的雄性SPF 级昆明小鼠[许可证编号:SCXK(京)2017-0005],购自中国食品药品检定研究院。
1.1.3 主要试剂
革兰氏染色液、吉姆萨染色液、瑞氏染色液、HE 染色液购自Solarbio 公司;肠杆菌细菌生化编码鉴定管、抗菌药物药敏纸片购自杭州微生物试剂有限公司;胰蛋白胨、酵母提取物、LB 琼脂培养基、麦康凯培养基、伊红美蓝培养基等购自青岛高科技工业园海博生物技术有限公司;DNA 相对分子质量标准(DL2501/DL2000)、2×TaqMaster Mix购自上海捷瑞生物工程有限公司。
1.1.4 主要仪器
高压灭菌器(LMQ.C-50E)购自山东新华医疗器械股份有限公司;恒温培养箱(DNP-9162)购自上海福玛实验设备有限公司;低温高速离心机(TGL-6)购自湖南湘仪实验室仪器开发有限公司;PCR 仪(S1000TM96 Well)购自伯乐生命医学产品(上海)有限公司;游标卡尺(16DN)购自马尔精密量仪(苏州)有限公司;病理组织切片制备系统购自徕卡显微系统(上海)贸易有限公司。
1.2 试验方法
1.2.1 临床症状观察、病理剖检与病料采集
观察发病鸡群的临床症状,取病鸡进行解剖检查。用无菌注射器取其心包积液,无菌操作采集肝脏组织。
1.2.2 细菌分离培养
分别使用灭菌接种环蘸取心包积液、穿刺肝脏后,划线接种于普通营养琼脂培养基,37 ℃条件下培养24 h。在超净工作台中无菌操作挑取单菌落,对单克隆细菌菌体进行革兰氏染色并镜检,将分离菌株命名为TJzdc-2021。分别将分离菌株接种于LB 液体培养基中,置于37 ℃摇床中,培养14 h。无菌操作将培养的菌液分别划线接种于麦康凯培养基和伊红美蓝培养基,37 ℃条件下培养24 h,观察菌落形态。
1.2.3 细菌生化鉴定
在超净工作台中使用灭菌的接种环挑取分离的单菌落至1 mL 灭菌生理盐水中,振荡悬浮。按照肠杆菌科细菌生化编码鉴定管说明书要求,将菌液接种于葡萄糖、乳糖、麦芽糖、甘露醇、硫化氢、枸橼酸盐、靛基质、MR、V-P 生化鉴定管中,置于37 ℃生化培养箱中培养24 h,并对反应结果进行鉴定[5]。
1.2.4 细菌16S rRNA 鉴定
取1 mL 新鲜的菌液于离心管中,置于4 ℃离心机中12 000 r/min 离心2 min,弃去上清液,取1 mL ddH2O 重悬菌体。再次同上述方法离心、洗涤弃液后,取100 µL ddH2O 重悬洗涤菌体,金属浴中100 ℃放置10 min,立即冰浴2 min。随后,置于4 ℃离心机10 000 r/min 离心2 min,收集上清液为DNA 模板,置于-20 ℃冰箱保存备用。
采用参考文献[6]中16S rRNA 引物,上游F:5'-AGAGTTTGATCCTGGCTCAG-3',下游R:5'-GGTTACCTTGTTACGACTT-3',由生工生物工程(上海)股份有限公司合成。PCR 体系为:1µL 上游引物16S rRNA-F、1 µL 下游引物16S rRNA-R、10 µL 2×TaqMaster mix、6 µL ddH2O、2 µL DNA 模板;PCR 条件为:94 ℃ 5 min 预变性,94 ℃ 30 s变性,49 ℃ 45 s退火,72 ℃ 1 min延伸,共30 个循环,72 ℃ 10 min 延伸。取5 µL PCR 产物,加至10 g/L 琼脂糖凝胶孔中,使用电泳仪110V 恒压电泳25 min,再利用凝胶成像系统观察电泳条带。将PCR 产物送至生工生物工程(上海)股份有限公司进行测序。
1.2.5 分离菌株的系统进化树构建与分析
将测序得到的16S rRNA 序列在NCBI 中与GenBank 数据库进行序列对比,然后使用MEGA 7.0将分离菌株和同源性较高菌株的16S rRNA 序列进行同源性对比分析,并使用Neighbor- joining 法构建系统进化树。
1.2.6 药物敏感性试验
采用K-B 纸片扩散法进行药敏试验。利用微量UV-Vis 分光光度仪检测菌液浓度,将新鲜的菌液使用培养基稀释至1×108cfu/mL,在超净工作台中使用微量移液器吸取1 mL 菌液均匀涂布于LB琼脂培养基上,静置5 min 晾干。用灭菌的眼科镊子取药敏试纸片均匀贴布在晾干的LB 琼脂培养基上,在37 ℃培养箱中倒置培养24 h 后,观察并使用游标卡尺测量抑菌圈直径。每种药敏片重复三次,计算平均值及标准误。药物敏感性判定参照临床实验室标准化协会(CLSI)的判定标准[7]。
1.2.7 毒力基因检测
采用水煮法制备菌株DNA 模板,步骤同1.2.4所述DNA 模板制备的方法。选用参考文献[8-9]中6 对常见的大肠杆菌毒力基因引物(表1),并由生工生物工程(上海)股份有限公司合成。
表1 大肠杆菌的毒力基因引物序列及PCR 条件
利用1.2.4 中制备的菌株DNA 作为PCR 模板,参照1.2.4 中PCR 反应体系(引物分别为毒力基因引物,其他成分和体积均相同),设置PCR 条件:94 ℃预变性5 min,{94 ℃变性30 s,退火45 s(退火温度见表1),72 ℃延伸1 min}共30个循环,72 ℃总延伸10 min,进行PCR 扩增。PCR 产物进行电泳检测并测序。
1.2.8 小鼠致病性试验
将20 只昆明小鼠随机分为2 组,分别为分离菌株感染组和生理盐水对照组,每组10 只。参照1.2.4 洗涤菌体方法,利用生理盐水将新鲜的大肠杆菌分离株菌液浓度稀释至1×108cfu/mL[10]。分别对分离菌株感染组小鼠腹腔注射菌液0.2 mL/只,生理盐水对照组小鼠经腹腔注射等量灭菌生理盐水。随后,观察小鼠的情况及存活时间并记录。待小鼠濒死状态剪尾采血,处死后无菌采集肝脏,分别制作抹片,利用瑞氏染色液和吉姆萨染液染色并进行显微镜检查。
1.2.9 病理切片制备与病理组织学观察
分别对濒死鼠和对照组健康小鼠进行处死,解剖检查,并将组织器官浸入10%中性福尔马林溶液固定。固定48 h 后,按常规石蜡切片制备及HE 染色技术,经修块、冲水、脱水、透明、包埋、切片、摊片、捞片、烘片、染色、封片等步骤制备成病理组织切片,在显微镜下观察不同组的组织学病理变化并拍照。
2 结果与分析
2.1 临床症状与剖检病变
发病肉鸡排黄色稀便,精神萎靡,食欲不振。剖检可见,腹腔和胸腔有大量黄色纤维素性渗出物;心脏包膜浑浊增厚,与心外膜粘连(图1A),部分心包膜腔内有黄色液体;肝脏及肠道表面有黄白色纤维素性渗出物附着,肝脏肿大呈暗红色,边缘钝厚,质地变脆(图1B);脾脏肿大(图1C);肾脏明显肿大、突出(图1D);十二指肠与空肠肠壁变薄,黏膜有出血点、出血斑,表面有卡他性黏液,淋巴滤泡肿大、出血(图1E)。

图1 病理检查结果
2.2 分离菌株的菌落与菌体的形态和生长特征
分离菌株在麦康凯培养基上生长为桃红色、光滑的菌落(图2A);在伊红美蓝培养基上为紫黑色、有金属光泽的菌落(图2B)。将菌体革兰氏染色后在油镜下观察,可见菌体呈两端钝圆的淡红色短小杆状,个别菌体呈球状或长丝状(图2C)。分离菌株的菌落和菌体形态及生长特征与大肠杆菌相符。
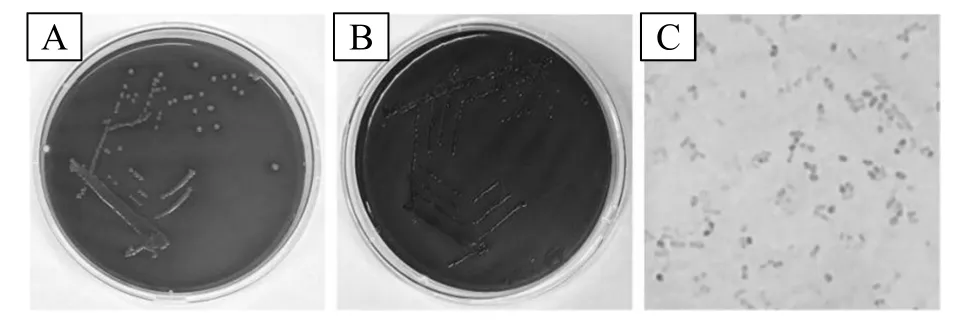
图2 大肠杆菌分离株的菌落与菌体形态
2.3 分离菌株生化鉴定
分离菌的生化试验反应结果显示:V-P(乙酰甲基甲醇试验)、硫化氢、枸橼酸盐鉴定结果为阴性,靛基质、MR(甲基红试验)为阳性,葡萄糖、乳糖、麦芽糖、甘露醇鉴定结果均产酸产气,与大肠杆菌生化特性一致。
2.4 分离菌株16S rRNA 鉴定
大肠杆菌16S rRNA 特异性引物经PCR 扩增后电泳,发现在1 000~2 000 bp 间有清晰明亮的条带(图3),经过测序分离菌株16S rRNA 的PCR产物大小为1 437 bp,与预期大小相符。将测序的16S rRNA 序列与GenBank 数据库对比分析,与E.coli株同源性均在99.99%以上。
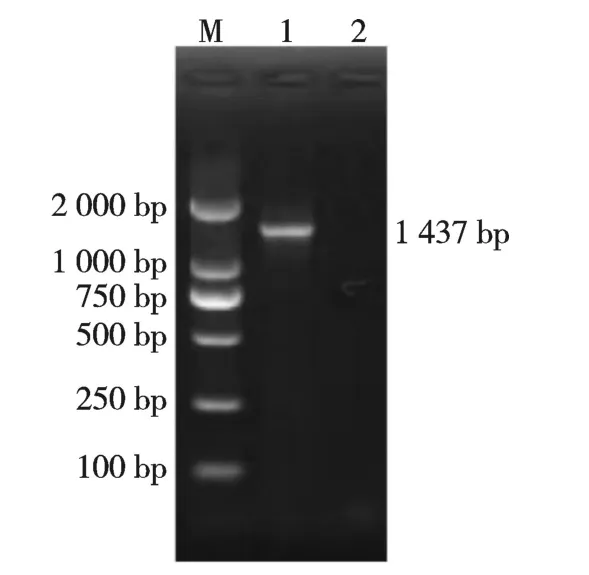
图3 分离菌株16S rRNA 基因序列PCR 扩增结果
2.5 分离菌株16S rRNA 系统进化树和同源性分析
选取GenBank 数据库中与分离菌株16S rRNA序列同源性较高的20 个菌株的16S rRNA 序列,在MEGA 7.0 上使用Neighbor-joining 法构建系统进化树。结果显示:分离菌株与E.coliNBRC 株和E.coliU5/41 株的距离最近,在同一大分支上(图4A),经比对分析,分离菌株与E.coliNBRC株和E.coliU5/41 株的同源性均在99.99%以上(图4B)。
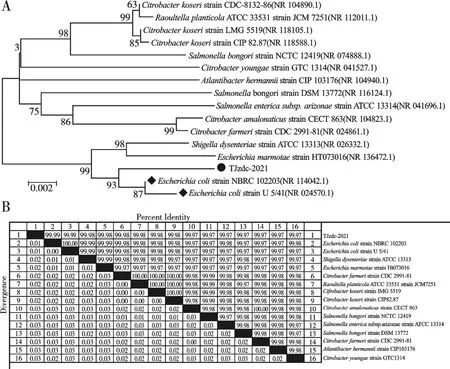
图4 分离菌株16S rRNA 基因序列的系统进化树和同源性分析结果
2.6 药物敏感性分析
药敏试验结果显示,分离菌株对氟苯尼考高度敏感,对四环素、多西环素中度敏感,对氨苄西林、羧苄西林、哌拉西林、青霉素、米诺环素、丁胺卡那、庆大霉素均不敏感(表2)。
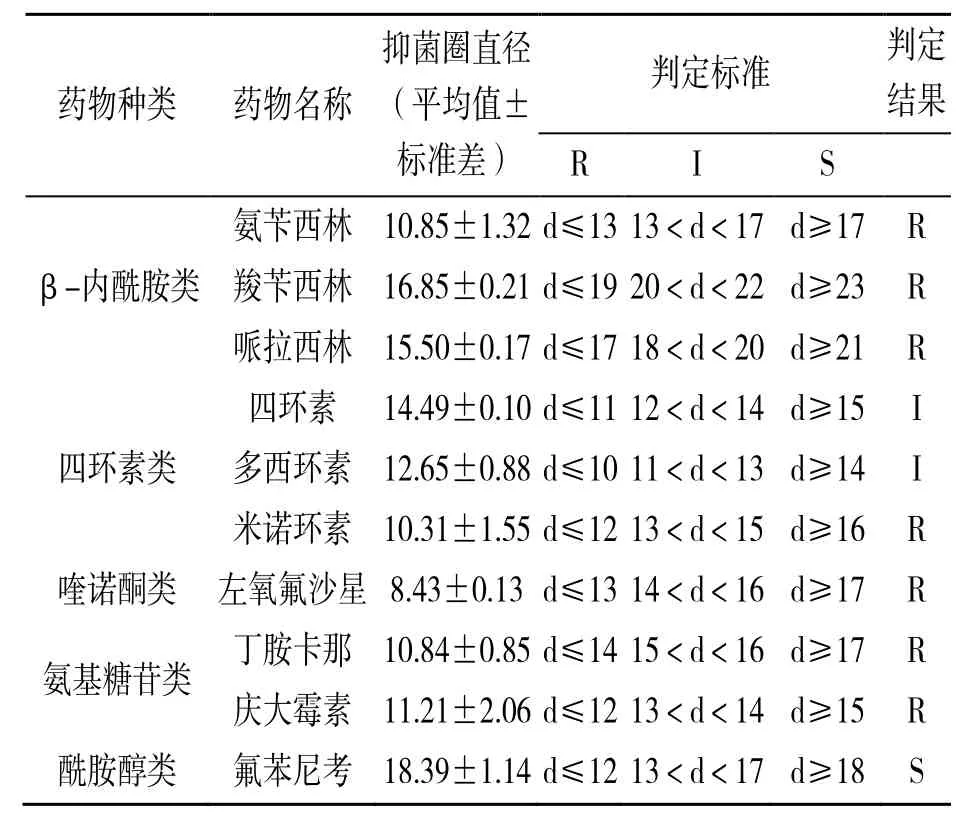
表2 药敏试验结果
2.7 毒力基因检测结果
对分离菌株进行大肠杆菌的6 种常见毒力基因的PCR 检测。结果显示,该菌株可扩增出fimC、hlyF、ompT和iroN4 种毒力基因,目的基因片段大小分别为:497、450、496 和553 bp,经测序与预期大小一致,且无碱基增添、缺失和突变;毒力基因irp2和Vat未检出(图5)。
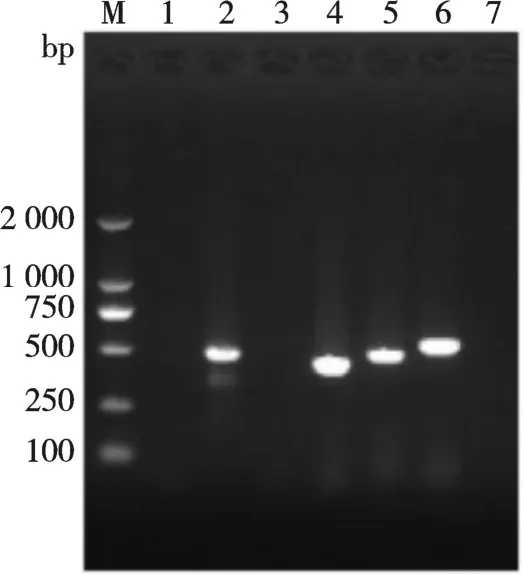
图5 大肠杆菌6 种毒力基因的PCR 扩增结果
2.8 分离菌株对小鼠的致病力分析
小鼠在接种分离菌株后出现精神萎靡、食欲废绝、被毛蓬乱等临床症状,且在16 h 内全部死亡(图6A)。生理盐水对照组小鼠无死亡,且未见异常。瑞氏和吉姆萨染色感染分离菌株和注射生理盐水小鼠的血液和肝脏抹片,结果显示:腹腔注射分离菌株组小鼠的血液和肝脏抹片中均发现有细菌(图6B,箭头指示),生理盐水对照组小鼠的血液和肝脏抹片中均未发现细菌。
2.9 分离菌株感染小鼠的病理组织学分析
感染分离菌株的小鼠组织和脏器出现不同程度的病理变化(图7)。肝脏组织中有含铁血黄素;中央静脉有大量红细胞和炎性细胞;部分肝细胞核碎裂,甚至消失,部分肝索出现紊乱。心肌纤维间隙增宽,有大量红细胞渗出,伴有炎性细胞浸润。肾小囊及肾脏组织间隙有大量红细胞渗出;部分肾小球崩解消失;近曲小管上皮细胞出现变性、坏死,脱落至管腔,部分近曲小管和远曲小管管腔中充有大量黏液。肺脏组织部分肺泡皱缩,肺泡中充有不同数量的红细胞,间质及肺泡内巨噬细胞数量增多;肺静脉中中性粒细胞数量明显增多。肠道组织黏膜固有层有红细胞渗出。脾脏红细胞明显增多,脾细胞细胞核浓缩、崩解,细胞坏死,脾组织中有大量含铁血黄素。生理盐水对照组小鼠脏器和组织未见明显异常。
3 讨论
本研究的分离菌株是从病鸡肝脏组织中分离获得的。通过病鸡临床症状观察和病理剖检发现,患病鸡只排黄色稀便,出现典型的心包炎和肝周炎症状,肠黏膜出血,与鸡大肠杆菌病的病变特征一致[11-13],故怀疑该患病鸡为感染致病性大肠杆菌所致。分离菌株培养在MCA 培养基上为桃红色的光滑圆润菌落,在EMB 培养基上为有金属光泽的菌落,革兰氏染色为革兰氏阴性短杆菌,生化试验反应结果为阳性,细菌菌落与菌体形态特征及生化鉴定结果与E.coli相符。此外,分离菌株16S rRNA 经PCR 鉴定、系统进化树分析及同源性比对,发现其与埃希氏菌属的同源性在99.99%以上,为判定分离菌株是大肠杆菌提供了佐证。
通过药物敏感性筛选发现,本研究分离的菌株TJzdc-2021 对β-内酰胺类、四环素类、喹诺酮类和氨基糖胺类药物不敏感,表明该鸡源大肠杆菌分离株在临床上已产生了严重的多重耐药性。其中,APEC 对β-内酰胺类药物产生耐药性可由多种耐药机制导致,如β-内酰胺酶产生[14],青霉素结合蛋白结合位点突变[15]等。该分离菌对β-内酰胺类和四环素类产生耐药性的现象与杨晶晶等[16]分离的鸡源大肠杆菌耐药性相似,但不同的是,该分离菌对喹诺酮类药物也产生了耐药性。研究发现,E.coli分离菌株对氟苯尼考高度敏感,可根据鸡场实际情况,用以控制该鸡场大肠杆菌病;同时注意药物定期更替,减少耐药菌株产生。
该E.coli分离菌株检测出了fimC、hlyF、ompT和iroN4 种毒力基因,而分离菌株携带的毒力基因hlyF、ompT和iroN与高致病性E.coli显著相关[17],提示了该分离菌可能具有较高致病力。此外,动物致病性试验中,腹腔注射E.coli分离菌株的小鼠在8~16 h 内死亡,且在肝脏和血液中均检测到接种菌,再次证明了该E.coli分离菌株具有致病力且易形成菌血症。病理组织学观察表明,感染该E.coli分离菌株对动物心脏、肝脏、肺脏、肠道及脾脏等均可造成损伤,佐证了该分离菌的致病力特性。本研究从毒力基因检测、动物试验、病原菌侵袭部位及病理组织学评价等多角度综合分析E.coli分离菌株的致病性,研究思路及结果可为病原菌的致病性相关研究提供参考。
