红花黄色素与牛血清蛋白的相互作用研究
2023-12-24刘萍郭嘉鑫刘中天
刘萍,郭嘉鑫,刘中天
(商洛学院化学工程与现代材料学院/陕西省尾矿资源综合利用重点实验室/陕西省矿产资源清洁高效转化与新材料工程研究中心,陕西商洛 726000)
牛血清蛋白(Bovine serum albumin,简称BSA)为淡黄色晶体颗粒,易溶于水。在蛋白质与药物的相互作用研究中,牛血清蛋白是常用的蛋白质选取对象。BSA是牛血清中的一种球蛋白,与人血清蛋白(HSA)具有相类似的氨基酸组成和排列顺序。由于牛血清蛋白在结构上与人血清蛋白高度近似,本身又结构稳定、容易获取且价格低廉,因此常被用作HSA的替代品。药物一直与人类生活密切相关,从药物进入人体到起效,要经历释放、与靶点相互作用和代谢三个过程。药物在体内的吸收和代谢情况,会直接影响药物在目标部位的浓度及持续生效的时间,也决定着药物的功效和稳定性[1]。红花,属于菊科植物的干燥管状花,是一种传统的草药,可以通过消除血瘀来激活血液循环和缓解疼痛。红花及其主要活性成分红花黄色素和羟基红花黄色素A(HYSA)已被开发成多种药用产品,如红花和HYSA注射液,主要用于治疗心血管疾病,临床疗效明显[2-5]。红花黄色素易溶于水,是临床上广泛使用的查尔酮类化合物[6-7],具有减轻疼痛、降低胆固醇和血压的作用。因此,了解红花黄色素和BSA作用的机制,并结合理论分析其结合的参数,对医生可以帮助指导临床的医学实践,对药理工作者有助于完成新药的设计与筛选,减轻药物的副作用,为寻找新药提供理论依据。
1 材料与方法
1.1 仪器与试剂
UV-1200紫外可见光谱仪(上海光谱仪器有限公司)、F-4600荧光光谱仪(日本日立高新技术公司)、JV-2004N电子天平(南京精密科学仪器有限公司)、DG-214恒温水浴锅(石家庄天宇实验仪器公司)、pHs-3c pH计(上海分析仪器厂)。
试验所用的红花黄色素(麦克林试剂有限公司)、BSA(美国Sigma公司),三羟甲基氨基甲烷、盐酸、硫酸铜、氯化镍、氯化锌、氢氧化钠均为上海国药化学试剂有限公司产品。
1.2 方法
1.2.1 Tris-HCl缓冲液储备液
称取12.114 g三羟甲基氨基甲烷,加入5.844 g NaCl,溶于蒸馏水中,用HCl或NaOH,调节溶液pH值为7.4,然后再加蒸馏水定容至1 000 mL,制备浓度为0.1 mol/L Tris-HCl缓冲常溶液。
1.2.2 BSA储备液
称取0.133 6 g BSA,将其放入100 mL容量瓶中,用Tris-HCl缓冲溶液溶解,然后用Tris-HCl缓冲溶液补足体积,制备浓度为2×10-5mol/L BSA溶液,并在4℃的冰箱中保存。
1.2.3 红花黄色素储备液
称取0.019 4 g红花黄色素,放入100 mL容量瓶中,用Tris-HCl缓冲溶液溶解,然后用缓冲溶液补足体积至刻度,制备浓度为1×10-4mol/L红花黄色素。
1.2.4 紫外吸收光谱法测定
分别准确移取 3.0 mL 2×10-5mol/L BSA 溶液和3.0 mL 0.1 mol/L Tris-HCl缓冲溶液于两个1 cm石英比色皿中,以Tris-HCl缓冲液为参比溶液,先测试BSA溶液的紫外吸收光谱,然后用微量进样器分别向BSA溶液比色皿和参比溶液比色皿中加入一定体积的红花黄色素溶液(红花黄色素的累加体积为100 μL),混合均匀,保持10 min后,以相应浓度的红花黄色素溶液为参比测试BSA与红花黄色素混合溶液的紫外吸收光谱。
1.2.5 荧光光谱法测定
分别在283 K和310 K温度下,准确移取3.0 mL 2×10-5mol/L BSA溶液,置于石英比色皿中,分别加入相同浓度的红花黄色素溶液,混合均匀,保持10 min后,以365 nm为激发波长,测试BSA和混合样品的荧光光谱。
2 结果与讨论
2.1 紫外光谱法
2.1.1 红花黄色素与牛血清蛋白的结合常数
用紫外光谱法测定红花黄色素与BSA的结合常数,红花黄色素与BSA的结合可以表示为:
其中,[P]为游离受体BSA的浓度,KA为结合常数,K0为解离常数,[Q]为红花黄色素的浓度,[QP]为结合物浓度,[P0]为受体BSA总浓度。
当生成物QP不存在紫外吸收时,游离的受体蛋白的摩尔浓度可用相应的紫外吸收强度表示为:
经整理式(1)~式(5)得:
其中,以(A0-A)-1对[Q]-1作Lineweaver-Burk双倒数曲线图,药物与蛋白质结合常数KA可以从该图的斜率和A0求得。
BSA在280 nm附近的吸收峰是蛋白质的吸收峰,它能够反映蛋白的骨架状态。由此,可以从蛋白质的吸收峰强度和最大吸收峰位移的角度来分析和判定它们之间的结合。在283 K和310 K条件下,研究了不同浓度的红花黄色素对BSA的紫外吸收光谱的影响,结果如图1所示。由图1显示红花黄素与BSA之间发生了一定的相互作用。图2是将(A0-A)-1对[Q]-1在 283 K 和 310 K条件下,红花黄色素与BSA相互作用的Lineweaver-Burk双倒数曲线图。通过拟合得到红花黄色素与BSA在283 K和310 K下的相互作用的线性回归方程,分别为y=1.044 38+1.802 72×10-5x,R=0.995 24 和 y=1.044 38+1.675 71×10-5x,R=0.993 11,结合常数KA分别为5.70×104L/mol和 6.34×104L/mol。

图2 283 K和310 K时红花黄色素与BSA相互作用的Lineweaver-Burk曲线
2.1.2 红花黄色素与牛血清蛋白的结合作用力
考虑到血清蛋白的结构复杂,它和药物小分子之间通常有多种作用力。蛋白大分子与药物小分子之间的作用力包括范德瓦尔斯力、氢键、疏水力和静电引力。当反应的焓变大于零,熵变不低于零时,分子间相互作用力为疏水力。当反应的焓变不大于零,熵变不低于零时,分子间相互作用力为静电引力。当焓变小于零和熵变小于零时,分子间相互作用力为范德瓦尔斯力和氢键。当自由能变化(ΔG)<0时,小分子之间的相互作用可以自发发生。如果温度变化不大,可以认为ΔH是常数,计算公式为:
式(7)中,K1、K2是在温度 T1和 T2下牛血清蛋白与药物小分子的结合常数,即为Lineweaver-Burk静态猝灭常数。
通过计算作用前后的热力学数据,如ΔH和ΔS的大小,能够判断药物小分子与蛋白质之间的作用力类别,结果如表1。由表1可见,BSA与红花黄色素的结合过程的 ΔH<0,ΔS>0,同时ΔG<0,因此该过程是一个同时受到焓和熵二者共同驱动完成的自发过程,二者之间的作用力类型主要是静电引力。

表1 红花黄色素与BSA相互作用的热力学参数
2.1.3 共存金属离子对红花黄色素与BSA结合常数的影响
各种微量元素是生物体维持正常生命活动必不可少的物质。因此,研究微量元素离子对小分子药物与BSA结合常数的影响情况,是获得药物小分子与生物体内的药理活性信息的重要手段。本研究选择三种常见的Cu2+、Ni2+和Zn2+作为共同存在的金属离子,在pH=7.4的Tris-HCl缓冲溶液中,测定了它们在310 K时对红花黄色素与BSA结合常数的影响情况。图3为Cu2+、Ni2+和Zn2+存在时的Lineweaver-Burk曲线,其线性回归方程、线性相关系数和结合常数的结果见表2。由表2可以看出,所选的三种金属离子和BSA之间均有一定程度的结合,形成的键会影响到蛋白质结构的变化[8]。在金属离子存在时,红花黄色素与BSA的结合常数有微弱的减小,说明金属离子的加入使得二者的结合能力略有降低,从而证明Cu2+、Ni2+和Zn2+与红花黄色素之间存在着竞争效应,红花黄色素在血浆中的储存时间有所缩短,药物作用的效率有所提高[9-10]。
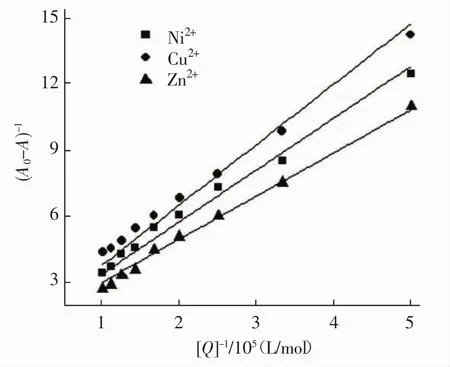
图3 共存金属离子存在时红花黄色素与BSA相互作用的Lineweaver-Burk曲线
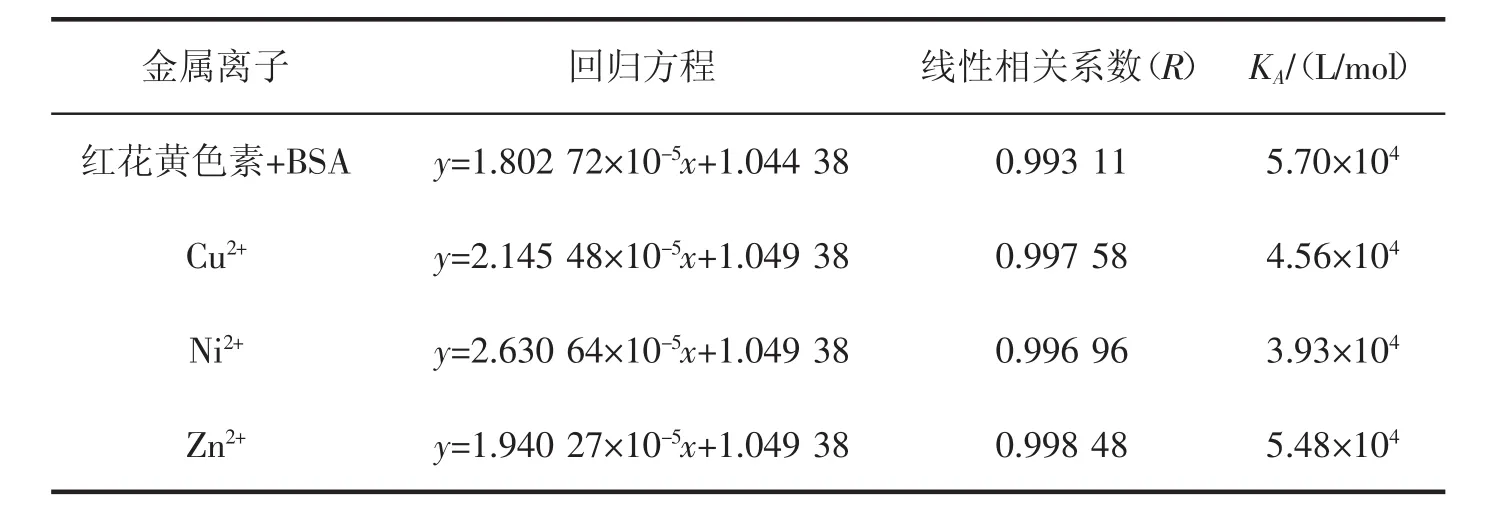
表2 金属离子对红花黄色素-BSA体系结合常数的影响
2.2 荧光光谱法
2.2.1 红花黄色素对牛血清蛋白的荧光猝灭
荧光光谱可以帮助了解药物与蛋白的结合信息,结合位点数等结合特征的参数。为了考察红花黄色素对BSA荧光光谱的影响,保持BSA的浓度固定不变,改变红花黄色素的浓度,测试了二者在283 K和310 K时相互作用的荧光光谱,见图4。由图4显示,牛血清蛋白的内源性荧光强度,会伴随着红花黄色素浓度的增加而逐渐降低,但其峰位和峰形大体保持不变,证明红花黄色素对牛血清蛋白的荧光有猝灭效用。
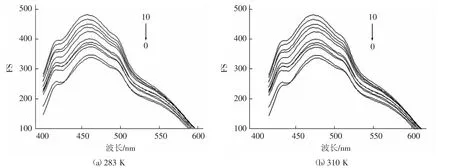
图4 不同温度红花黄色素对牛血清蛋白的荧光猝灭光谱
2.2.2 荧光猝灭的类型
其它分子与荧光分子发生相互作用导致荧光分子荧光强度和寿命减少的所有现象,被称作荧光猝灭。荧光猝灭包括动态猝灭和静态猝灭两种类型。如果温度升高,Stern-Volmer猝灭常数KSV增大,此时荧光体与荧光猝灭分子之间属于动态猝灭类型。其原因是有效碰撞的几率随着温度的升高而增大,电子转移的过程得到了促进。相反如果升高温度,猝灭结合常数减小,则说明属于静态猝灭类型[1]。
动态猝灭过程遵循Stern-Volmer方程:
式(10)中,F为加入药物浓度为[Q]时荧光物质的荧光强度,KSV为Stern-Volmer猝灭常数,Kq是猝灭速率常数,F0为不加猝灭剂时荧光物质的荧光强度,τ0为不加猝灭剂时荧光分子的平均寿命。
将生物分子的荧光寿命τ0=10-8s带入式(10)中,可以求出猝灭常数KSV和猝灭速率常数Kq[11-12]。运用动态猝灭的Stern-Volmer方程,在温度283 K和310 K时,以F0/F对[Q]作图,见图5。可根据拟合曲线 y283K=7.247×104x+0.952 4,y310K=3.323 3×104x+1.015 3,所得结果见表3。由图5可见,310 K时的曲线斜率明显小于283 K时的曲线斜率,且Kq大于最大扩散碰撞猝灭速率常数,这是静态猝灭类型的表现,因此红花黄色素与BSA之间的荧光猝灭属于静态猝灭。

图5 红花黄色素对BSA荧光猝灭的Stern-Volmer曲线

表3 红花黄色素与BSA间的荧光猝灭常数
静态猝灭遵循Lineweaver-Burk双倒数方程:
式 (11)中,KLB为猝灭剂与荧光物质的结合常数,F为猝灭剂浓度为[Q]时荧光物质的荧光强度,F0为猝灭剂浓度为零时荧光物质的荧光强度。KLB为猝灭剂与荧光物质的结合常数,又称为Lineweaver-Burk猝灭常数。红花黄色素猝灭牛血清蛋白的Lineweaver-Burk双倒数曲线与(F0-F)-1和[Q]-1的关系,见图6。可根据拟合曲线求得283 K和310 K时的静态猝灭结合常数KLB值,见表3。由表3可见,随着温度升高KLB而减小,说明红花黄色素对牛血清蛋白的荧光猝灭属于静态猝灭。
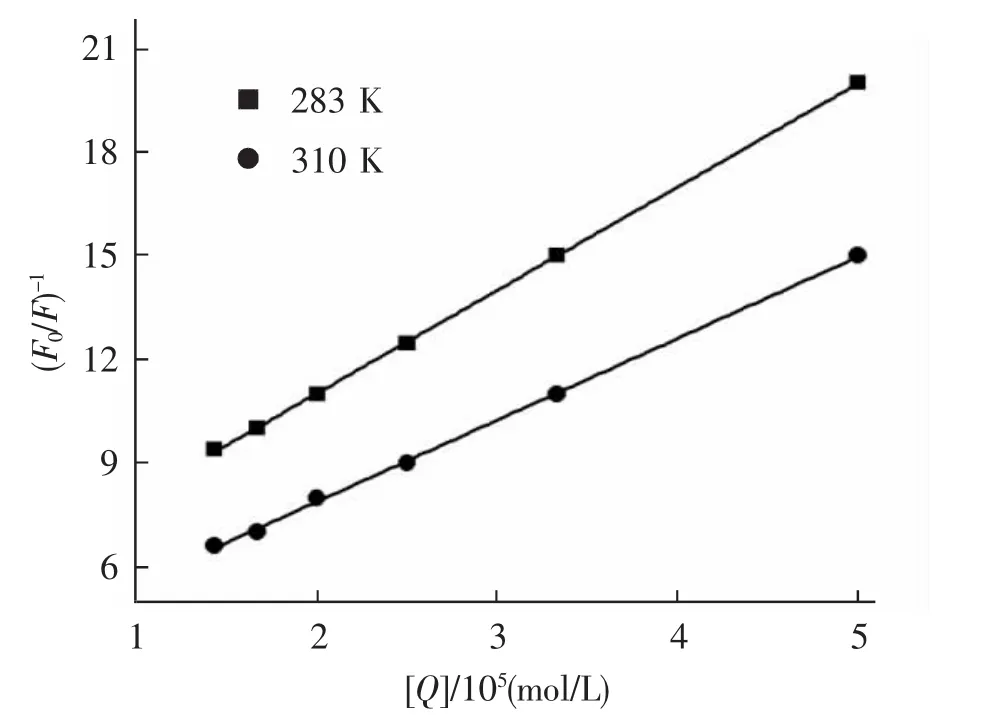
图6 红花黄色素对BSA荧光猝灭的Lineweaver-Burk曲线
2.2.3 结合位点数及结合常数
根据式(12)可以计算小分子药物与大分子蛋白的结合位点数和结合常数。
式(12)中,F0为未加猝灭剂的荧光强度,F为加入浓度为[Q]的猝灭剂时的荧光强度。以lg[(F0-F)/F]对lg[Q]作图,见图7,通过线性拟合可以求得红花黄色素与BSA的结合位点数(n)和结合常数(K),结果见表4。由表4可见,红花黄色素与BSA的结合位点数n约等于0.5,二者的结合常数随着温度的升高而减小。

图7 红花黄色素与牛血清蛋白的结合常数曲线
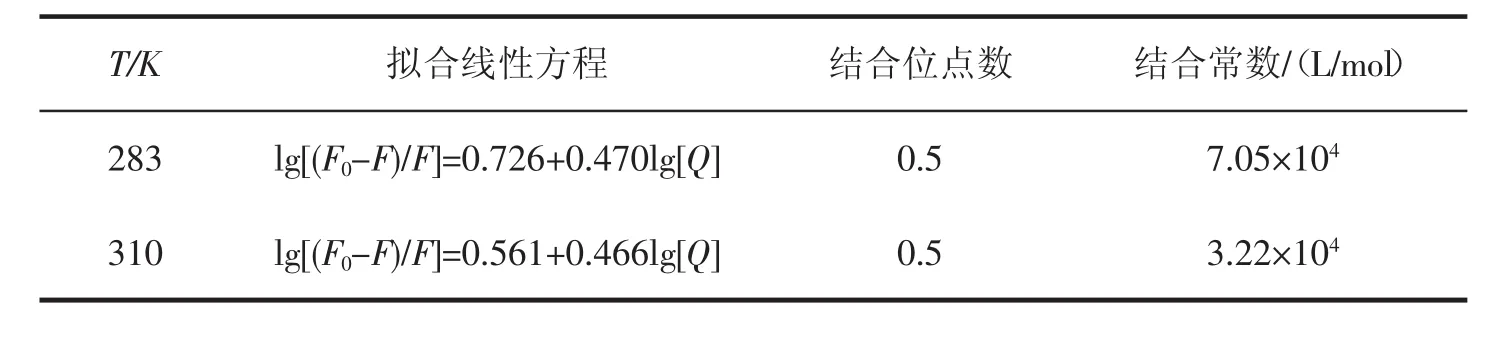
表4 结合位点数及结合常数
3 结论
通过紫外可见吸收光谱研究了中药小分子红花黄色素与牛血清蛋白(BSA)的相互作用情况,考查了温度和共存金属离子 Cu2+、Ni2+、Zn2+对二者结合常数的影响。采用荧光光谱研究了红花黄色素对生物大分子BSA的荧光猝灭的类型及结合常数和结合位点数。红花黄色素与BSA的结合作用力主要表现为静电引力。结合常数随温度的升高而降低,结合常数的数量级约为104,并且二者的结合过程的 ΔH<0,ΔS>0,ΔG<0,驱动力为 ΔH 和 ΔS,结合位点数为 0.5。在 Cu2+、Ni2+和Zn2+存在情况下,红花黄色素与BSA的结合常数略小于无金属离子存在,说明竞争效应存在于金属离子和红花黄色素之间,使得小分子药物红花黄色素在血浆中的存储时间得到有效地缩短,进而提高了红花黄色素的药效。
