厦门湾瘦枝珊瑚属空间分布及新记录种
2023-12-22刘佳英王云沛施宜佳
阳 静,刘佳英*,王云沛,施宜佳
(1.集美大学水产学院,福建 厦门 361021; 2.福建省海洋渔业资源与生态环境重点实验室,福建 厦门 361021)
瘦枝珊瑚属(Carijoa)隶属于珊瑚虫纲(Anthozoa)、八放珊瑚亚纲(Octocrallia)、软珊瑚目(Alcyonacea)、根枝珊瑚亚目(Stolonifera)、棒花软珊瑚科(Clavulariidae)。该属珊瑚对环境适应性强,广泛分布于热带及亚热带的珊瑚礁区、红树林区,甚至能生活在富含有机物的浑浊水域[1]。作为八放珊瑚的成员之一,同其他八放珊瑚一样,在维持海洋生态系统结构完整性和生物多样性方面具有重要作用[2],该属物种主要以浮游动物和有机颗粒为食[3]。瘦枝珊瑚属于1867年建立[4],世界海洋物种名录(World Register of Marine Species,WoRMS,https://www.marinespecies.org/)于1998年记录该属,截止2022年10月5日WoRMS显示有效物种2种,Carijoaoperculata和Carijoariisei。
2022年戴昌凤报道中国台湾附近海域栖息有Carijoariisei,同时发现该属一新物种Carijoananwanensis[5]。中国大陆对于该属物种的研究,仅有杨顺良等[6]对于瘦枝珊瑚属待定种Carijoasp.名录式报道及未定种生物活性[7-9]的研究,并未有形态学的描述。在关于瘦枝珊瑚属物种的地理分布及物种鉴定研究中,1860年Duchassaing等在安的列斯群岛附近发现瘦枝珊瑚属物种,鉴定为Clavulariarusei,后更正为Carijoariisei,该物种为此属最早发现的物种[10]。1866年Verrill对Balanus附近发现的珊瑚物种进行初步形态学描述后,鉴定为Carijoarupicola,后经学者确认C.rupicola为C.riisei的同种异名[11]。1961年Bayer在西印度地区发现一新物种并命名为Telestooperculata,后更正为瘦枝珊瑚属Carijoaoperculata[12]。
目前对瘦枝珊瑚属的研究主要由形态学方法为主,分子系统发育研究为辅。近年来随着分子生物学技术的快速发展,基因片段定序在珊瑚分类研究中得以广泛应用。Concepcion等通过对C.riisei的个案研究,发现核标记编码信号识别颗粒54 kDa亚基(SRP54)核基因在序列上具有较高水平的变异,并对近缘物种生物地理学的研究具有重要意义[13]。1972年C.riisei首次在夏威夷附近海域被发现,同时该海域的C.riisei被认为起源于加勒比海。Concepcion等为确认夏威夷附近海域的C.riisei起源,利用线粒体基因(mtDNA)和核基因(nDNA)基因序列对采集于夏威夷和世界各地的244株C.riisei样本进行了研究,结果发现夏威夷C.riisei原产于印度-太平洋[14]。Easton等报道了C.riisei完整的线粒体基因组[15]。而有关该属另一物种C.operculata分子信息未见有关报道。截止2022年3月14日NCBI查询到该属共有90条分子数据。
国内外广泛开展了瘦枝珊瑚属次级代谢产物及其生物活性的研究,发现其次级代谢产物对药物筛选具有启示作用,从Carijoa属珊瑚中提取的化合物具有抗病毒、抗炎、抗肿瘤、抗菌等功效[7-8,16-17]。此外,韩磊对瘦枝珊瑚属Carijoasp.提取物的化学生态学作用进行了研究[9]。以上关于瘦枝珊瑚活性物质的研究,多数基于该属的待定种,这不利于未来对其活性物质的深入研究以及生产应用。因此,需要对该属物种进行深入的分类研究。
黄宗国等主编的《厦门湾物种多样性》一书显示,厦门湾历史上记录有珊瑚虫纲19科56种,其中八放珊瑚28种[18]。黄晖等在厦门湾镇海角及浯屿发现4科7属9种八放珊瑚[19]。杨顺良等在对福建沿海进行珊瑚资源调查时,累计记录9科22属54种八放珊瑚,其中瘦枝珊瑚为待定种[6]。
为了解厦门湾瘦枝珊瑚属物种及其分布现状,对从厦门湾采集的25株瘦枝珊瑚属样本进行了形态学和基因片段定序技术的研究,并对该属珊瑚的空间分布进行了初步研究。
1 材料与方法
1.1 调查方法与样品采集
2014—2021年在厦门湾内白哈礁、角屿等10个岛屿附近海域进行潜水调查采样,具体采样站位信息见表1。
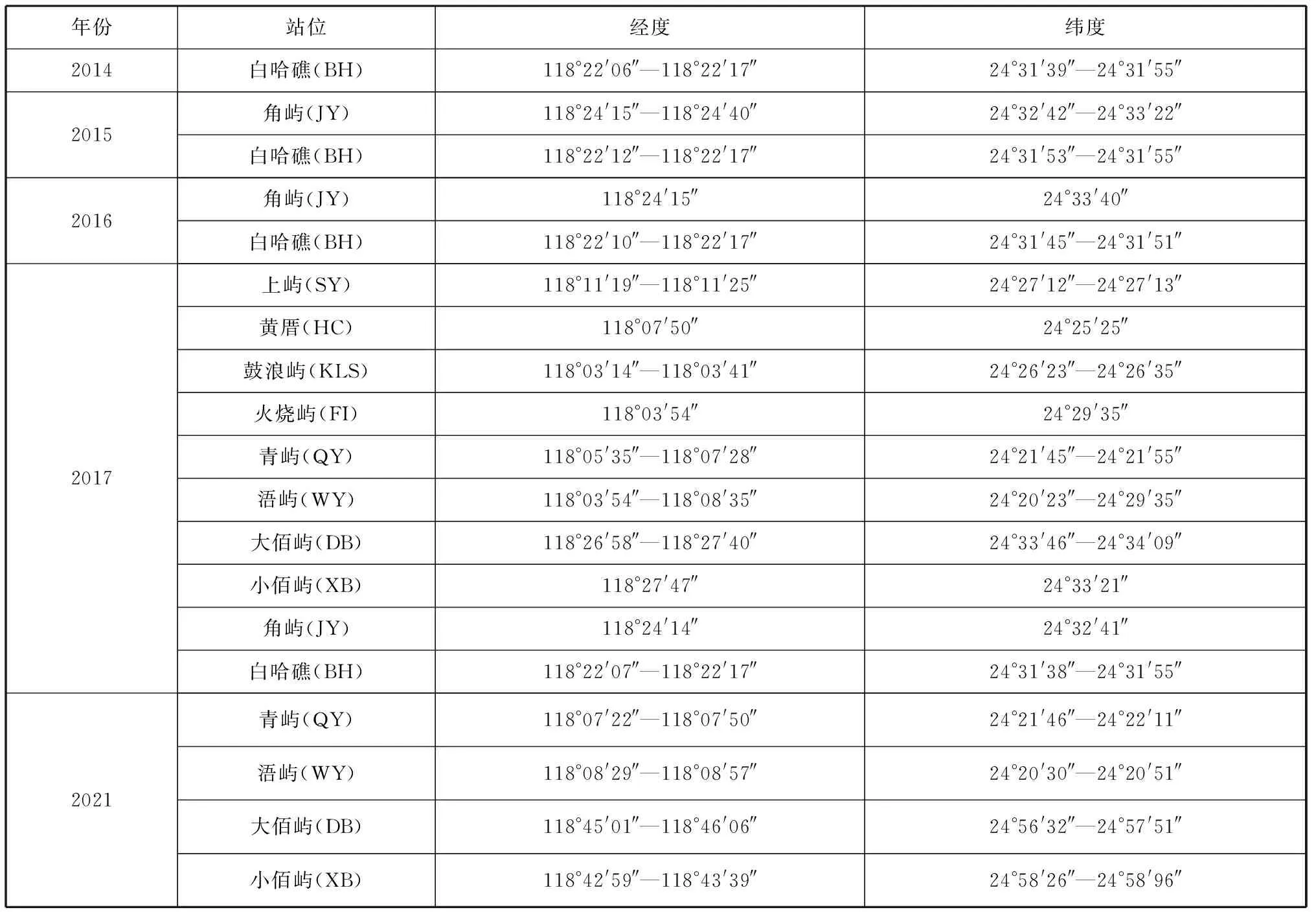
表1 采样站位信息Tab. 1 Sampling station and their locations
1.2 样本处理、观察与鉴定方法
将珊瑚样本带回实验室,对样本进行编号、观察样本外观形态、颜色等,拍照并记录描述群体特征及测量数据。利用解剖镜(Nikon SMZ1270)对样本中轴、珊瑚虫收缩及舒展状态进行观察并拍照。截取5~6 cm左右珊瑚枝条保存于95%乙醇中用于形态鉴定与分子生物学实验,剩余样本放置于-70 ℃超低温冰箱保存。
利用5%次氯酸钠溶解分离骨针,骨针用蒸馏水洗净,并用鼓风干燥器烘干,利用厦门大学国家重点实验室的扫描电子显微镜(SEM,G5 Phenom ProX2017)拍摄珊瑚骨针。
物种鉴定参考Galván-Villa等[20]、Concepcion等[14]发表的文献,及《Soft corals and sea fans》[21]、戴昌凤等出版的《台湾珊瑚全图鉴(下):八放珊瑚》[5]以及世界海洋物种名录。
1.3 DNA的提取、引物合成
利用TIANamp海洋动物组织基因提取试剂盒,按照说明书提取瘦枝珊瑚样本的基因组DNA。使用的PCR扩增引物为COⅠ:COⅠoct 5′-ATCATAGCATAGACCATACC-3′和COII8068F 5′ -CCATAACAGTAGCAGCATC-3′[22]、ND2:16S-647F 5′-ACACAGCTCGGTTTCTATCTACAA-3′和ND2-1418R 5′-ACATCGGGAGCCCACATA-3′[23]。
1.4 PCR扩增及测序
PCR反应体系总体积为50 μL :DNA聚合酶2×PCR Mix(购自兰博利德公司) 25 μL;上下游引物各2.5 μL;DNA 模板2 μL;去离子水18 μL。
PCR反应条件:3 min 预变性(94 ℃),30 s 变性(94 ℃) ,30 s 退火,1 min延伸(72 ℃) ,共35 个循环,最后72 ℃延伸7 min(各个引物的退火温度依据各引物Tm值,其他程序不变,如COⅠ:50 ℃;ND2:55 ℃)。扩增产物在1%琼脂糖凝胶中检测,选取扩增条带单一、浓度较高的PCR产物,产物的纯化和测序由生工生物工程(上海)股份有限公司进行。用BioEdit软件对测序所得序列进行编辑、剪切、校正,再将校正好的序列与NCBI非冗余数据库进行同源性比对,以确保所获得的序列为目标序列。序列碱基组成分析利用DNAMAN 6.0.3.99软件。
1.5 系统进化树的构建
使用本研究所扩增的COⅠ序列3条、ND2序列3条与NCBI基因库中COⅠ序列16条、ND2序列21条共同构建系统发育树,系统发育进化树外群的选择为瘦枝珊瑚属同科(Clavulariidae)下的不同属,包括Cervera属、Clavularia属、Rhodelinda属及Telesto属。首先利用MEGA7.0进行序列比对,基于Kimura 2-parameter(K2P)双参数模型,通过邻位连接法(Neighbor-joining, NJ)构建系统发育树,置信度来自1 000次非参数自展(bootstrap)抽样分析。
2 结果
2.1 形态学鉴定结果
CarijoaMüller,1867
ClavulariaruseiDuchassaing &Michelotti, 1860:310
CarijoarupicolaMüller, 1867:330-332,Fig.56-57
TelestoafricanaVerrill, 1870:372,Fig.3
模式种:Carijoariisei(Duchassaing &Michelotti, 1860);模式产地:安的列斯群岛(Antilles)
研究样本编号:20210403-XB-3-18
珊瑚体:珊瑚体分枝型,枝条为细长状,主枝以合轴分枝型衍生次生分枝,酒精浸泡后主枝长度约12 cm,枝干颜色为淡橙色,主枝表面具有纵向的沟槽,分枝中空圆柱形,可弯曲,分枝轴直径约为1.7 mm。分枝管状茎由匍匐的基底相连,基底下生有更细小的管状根系。每个分枝末端都有一个突出水螅体,分枝末端附近水螅体分布相较于其他部位密集。
水螅体:单体型,可以自由收缩,触手可缩回的部分为羽枝状,白色。水螅体细管状,单个伸展的水螅体约3.5 mm长,收缩的水螅体约3.0 mm,通常成对或三个一组分布于分枝侧面及顶端(图1)。
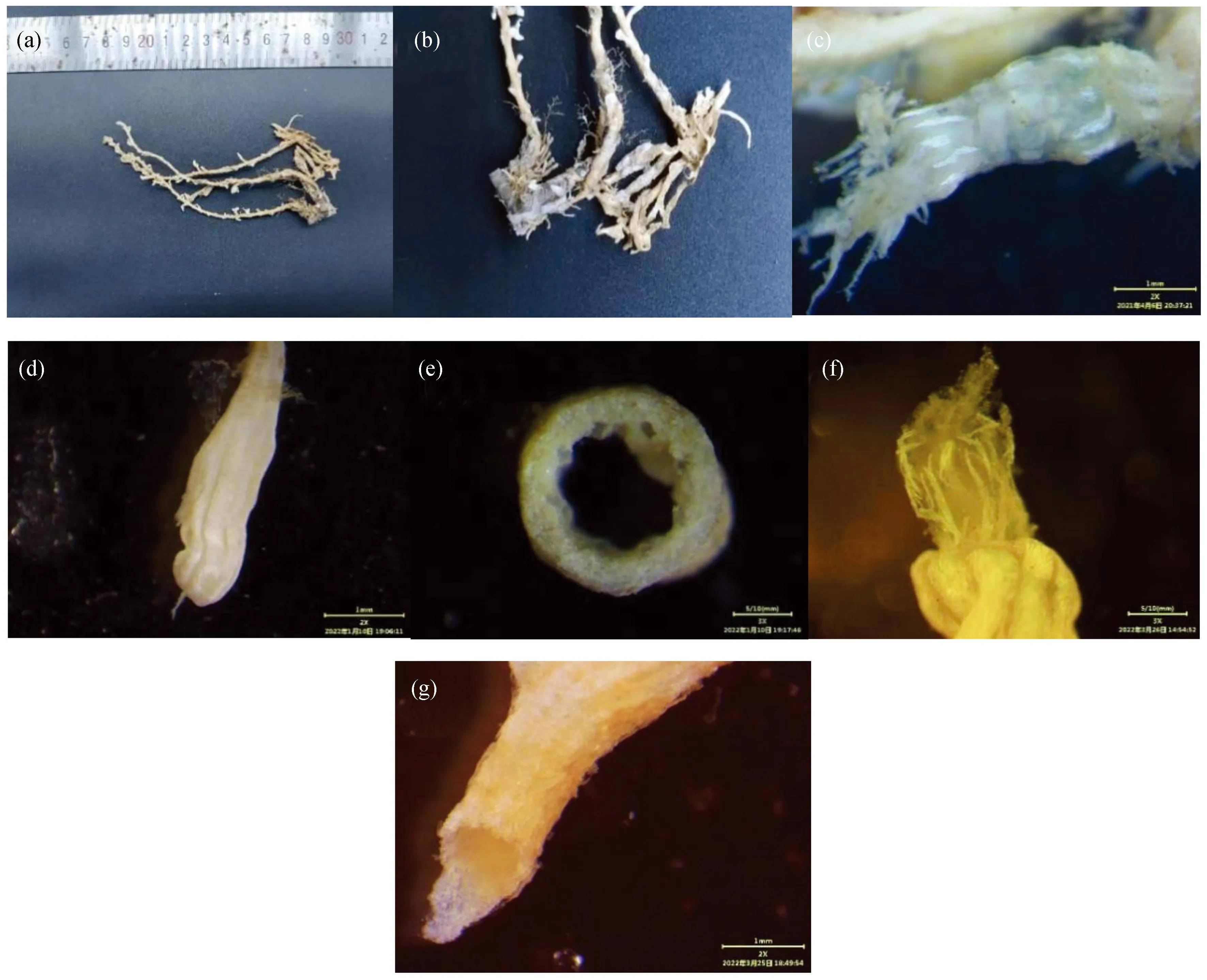
图1 C. riisei外部形态、中轴和珊瑚虫Fig. 1 External morphology, axis and polyps of C. riisei(a)酒精浸泡珊瑚样本;(b)基底;(c)水螅体伸展;(d)水螅体收缩;(e)中轴;(f)触手骨针排列;(g)管状茎。
骨针:多数为柱形骨针,在柱形骨针外带有棘突,细长、不规则。水螅体具有小柱状骨针,水螅体管壁具有稍弯曲的纺锤形骨针,骨针长约0.08~0.40 mm,分枝骨针为具有多棘突的柱状骨针,骨针长约0.11~0.35 mm(图2)。

图2 C. riisei骨针Fig. 2 Sclerites of C. riiseiA:珊瑚虫及管壁骨针;B:分枝骨针,比例尺为0.2 mm。
颜色:酒精浸泡后水螅体呈白色或奶白色,枝干为淡橙色,冻干珊瑚样本为淡绿色。
全球分布:哥伦比亚[24-25]、墨西哥科利马的曼萨尼约港[20]、波尔图德加林哈斯[26]、夏威夷[27]、巴西[28]、安达曼和尼科巴群岛[29]、印度尼西亚[30]、曼纳尔湾[31]、库奇湾[32]、西大西洋、佛罗里达、加勒比海、丘克、帕劳、菲律宾、澳大利亚、苏门答腊、马尼拉、泰国[33]。
2.2 碱基序列组成分析
通过扩增测序得到样本20160529-BH-3-1、20160826-BH-3-1及20210403-XB-3-18的COⅠ、ND2基因序列各1条。COⅠ基因序列长度为671~698 bp,碱基组成为:T含量36.8%~37.3%; C含量16.2%~16.5%; G含量19.6%~19.7%; A含量26.5%~27.0%。ND2基因序列长度为678~720 bp,碱基组成为:T含量33.2%~34.7%; C含量16.4%~16.7% ; G含量21.3%~22.0% ;A含量27.6%~28.0%。扩增所得的基因碱基序列A、T的含量均高于G、C,具有明显的AT偏倚。
2.3 基于COⅠ、ND2基因对珊瑚进行系统进化分析
利用MEGA7.0对所得COⅠ、ND2基因序列进行排序并裁剪序列后,通过邻位连接法构建系统发育树(图3、4)。

图3 NJ法构建的COⅠ基因片段系统发育进化树Fig. 3 Phylogenetic tree of COⅠ sequences constructed by NJ method
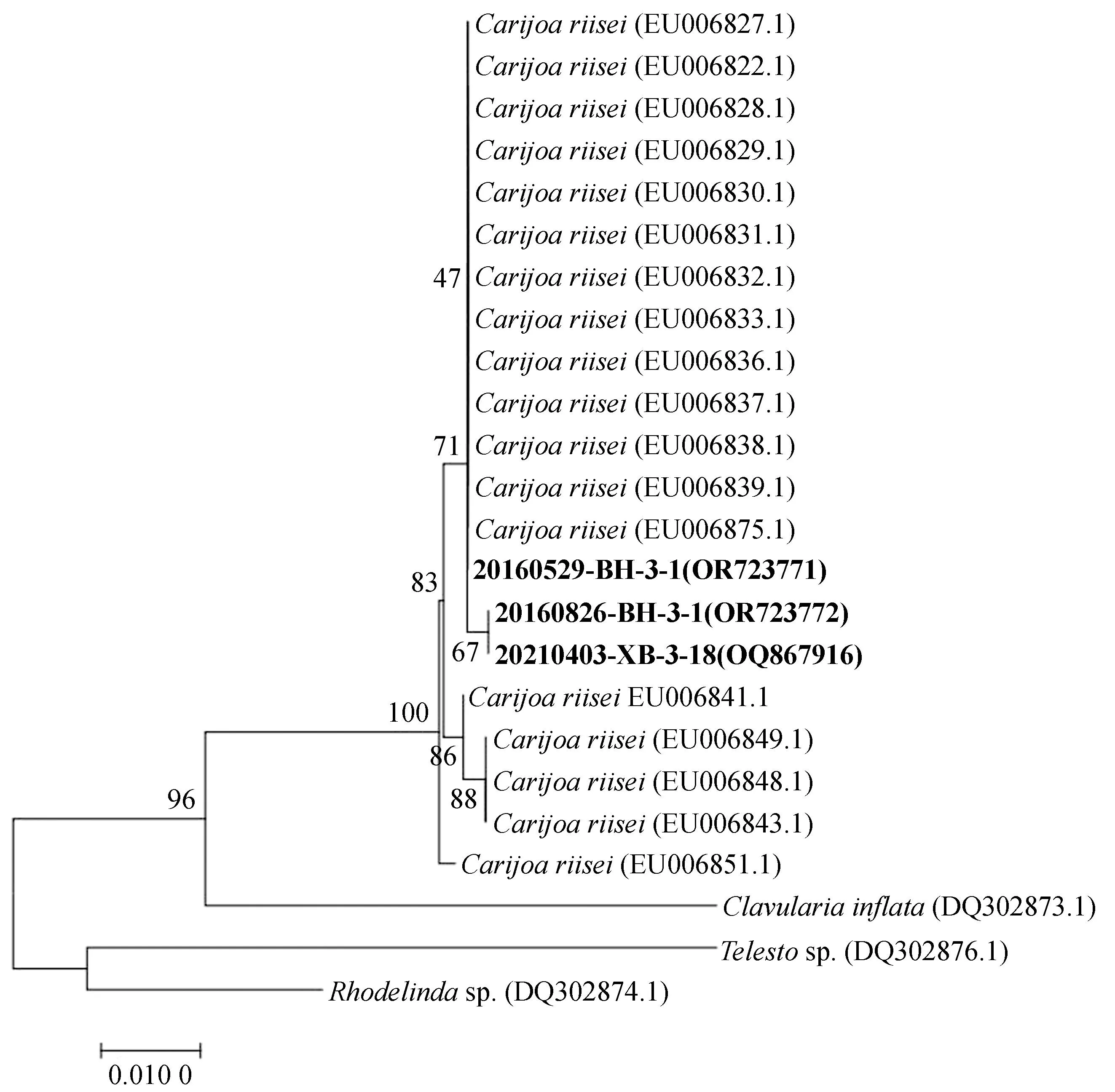
图4 NJ法构建的ND2基因片段系统进化树Fig. 4 Phylogenetic tree of ND2 sequences constructed by NJ method
COⅠ基因系统发育进化树如图3所示,19个样本数据聚为2个大分支,Carijoa属、Cervera属、Clavularia属为一个大分支,Rhodelindasp.单独为一个分支。样本20160529-BH-3-1、20160826-BH-3-1和20210403-XB-3-18与C.riisei聚为一支,与同科下另一属物种Rhodelindasp. 亲缘关系较远。
ND2基因系统发育进化树如图4所示,24个样本数据聚为2个大分支,分别为Carijoa属、Clavularia属为一支,Telesto属与Rhodelinda属为一支。其中样本20160529-BH-3-1、20160826-BH-3-1和20210403-XB-3-18与C.riisei聚为一支,与Telesto属和Rhodelinda属亲缘关系较远。
2.4 厦门湾瘦枝珊瑚C. riisei的空间分布
对2014—2021年潜水调查采集的25株瘦枝珊瑚样本的站位进行统计分析,结果见表2,其中6个站位有C.riisei分布,分别是小佰屿、角屿、白哈礁、上屿、鼓浪屿和火烧屿站位,表明C.riisei在厦门湾内分布较广。由于本研究的样本是历年调查的结果,白哈礁站位与角屿站位样本数量多可能是因为这两个站位调查的频次较多,采样相对全面。另外4个站位未见到瘦枝珊瑚属分布,可能是该站位确实没有C.riisei栖息,也可能是这些站位由于采样频次少,采样不全面造成的。
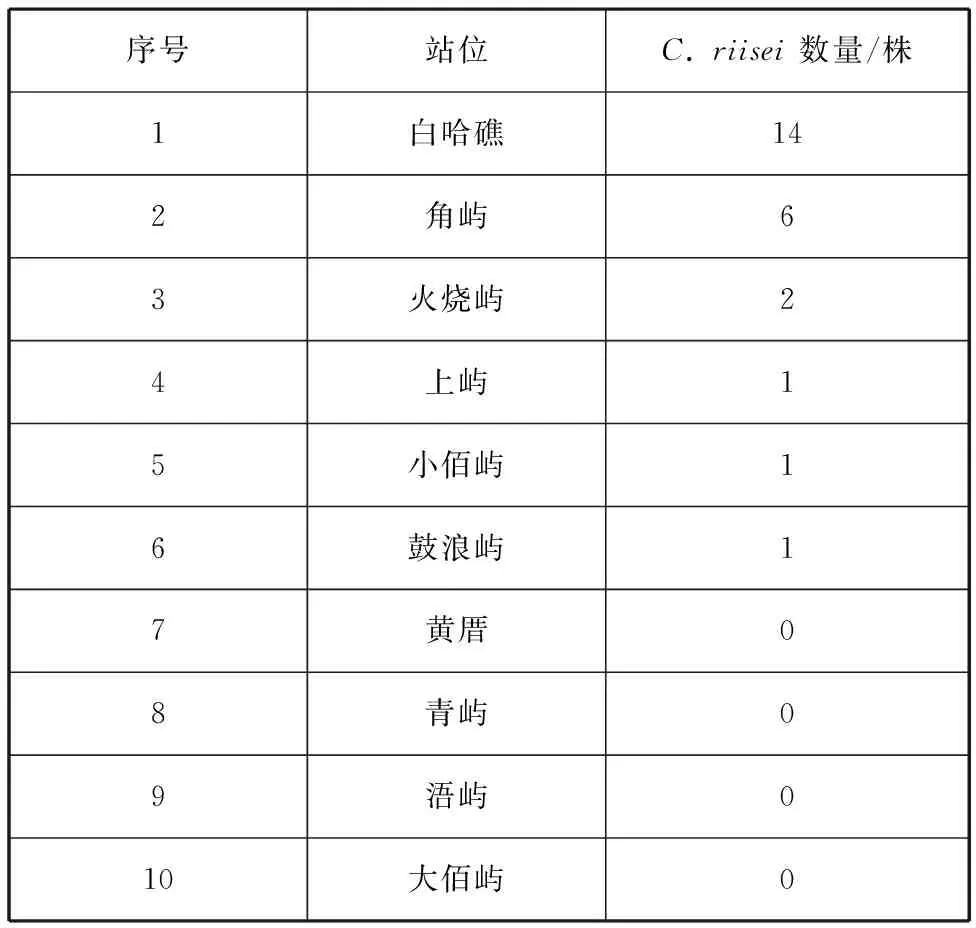
表2 各站位C. riisei物种分布Tab. 2 Distribution of C. riisei species at stations surveyed
3 讨论
瘦枝珊瑚属自建属以来,属下物种多次出现变更,例如Carijoaarborea变更为Telestoarborea[34];Carijoamultiflora变更为Telestomultiflora[35]。说明Carijoa属与Telesto属下物种外部形态相似,易发生鉴定错误,因此对属下物种进行鉴定时最好结合分子生物技术进行。本研究通过对C.riisei样本的ND2基因片段构建系统发育进化树进行分析,结果显示,Carijoa属与Telesto属物种在系统发育进化树未聚为一支,可以将二属物种区分开来。
Dhivya等给出的C.riisei关键的识别特征为:①八根白色羽状触手;②每个高的轴向水螅体都有许多短的侧水螅体;③骨针纤细,有分叉,末端不钝且多刺[29]。样本20210403-XB-3-18与Dhivya等[29]、戴昌凤[5]、Verrill[11]及Müller[4]对C.riisei物种的形态学特征描述吻合,但与Duchassaing等[10]发现的颜色灰红色不一致,可能是环境导致的表型灵活性或是酒精浸泡后导致珊瑚体变色。样本20210403-XB-3-18单个伸展的水螅体约3.5 mm长,收缩的水螅体约3.0 mm,Verrill测量的水螅体长度为2.53~3.04 mm[11],戴昌凤测量的水螅体长度为2~5 mm[5],数据基本相符。
样本20210403-XB-3-18珊瑚虫骨针约0.08~0.40 mm,分枝骨针约0.11~0.35 mm。Verrill未对珊瑚虫及共肉骨针进行区分,但测量了较粗壮骨针长度,约达0.252 mm,细长骨针达0.528 mm[11];Yogesh-Kumar等描述骨针为细长杆状,上有棘刺,长约0.1~0.4 mm[32];戴昌凤描述了水螅体管壁含细长弯曲的纺锤形骨针,长约0.20~0.35 mm,分枝含多突起的柱形骨针,长约0.15~0.30 mm[5]。样本20210403-XB-3-18骨针与前人描述基本吻合,因而形态学鉴定为C.riisei。
在分子生物学方面,线粒体ND2基因是变异较大的基因,适合属以上阶元系统发育研究[36]。COⅠ基因具有长度适宜、进化速率慢及富含系统发育信号等特点[37],被广泛用于属间、种间或群体水平等系统进化分析[38]。例如Mcfadden等研究表明,COⅠ基因能够有效区分Alcyonium属70%的物种[22]。徐雨在金柳珊瑚科的鉴定中利用mtMutS基因构建系统发育树,表明mtMutS基因系统发育树支持Iridogorgiadensispicula为新种的有效性[39]。周洋等在肉芝软珊瑚属(Sarcophyton)的鉴定上运用了msh1及COⅠ基因片段,结果表明二者对肉芝软珊瑚属的分子鉴定具有一定的辅助作用[40]。Liu等在星柳珊瑚属(Astrogorgia)下3个物种鉴定分析中,表明COⅠ基因片段系统发育结果支持形态学鉴定结果[41]。
本研究利用COⅠ、ND2基因序列构建的系统进化树表明,样本20160529-BH-3-1、20160826-BH-3-1及20210403-XB-3-18与数据库中的C.riisei聚为一支,系统发育结果支持形态学鉴定结果。GenBank中C.riisei的COⅠ、ND2基因片段数据较全,有COⅠ序列 4条、ND2序列 1条、16S-ND2-ND6-ND3序列 30条。由此对该属进行物种鉴定研究时,可以运用以上基因片段。
4 结论
(1)对2014—2021年在厦门湾采集的25株瘦枝珊瑚属样本进行鉴定,结果显示是瘦枝珊瑚属物种Carijoariisei。C.riisei是厦门湾首次记录的瘦枝珊瑚属物种,也是除了在中国香港和台湾外,在中国大陆近海海域首次记录到该种。C.riisei丰富了厦门湾和中国大陆近海海域的珊瑚物种多样性记录和地理分布信息,也为全球Carijoa属珊瑚地理信息研究提供重要数据支撑。
(2)C.riisei在厦门湾内空间分布较广,如厦门湾内的小佰屿、角屿、白哈礁、鼓浪屿、上屿和火烧屿的附近海域都有该物种栖息分布。
