进展期胃癌脉管侵犯术前列线图预测模型的建立和验证
2023-12-22郭振江赵光远杜立强刘防震
郭振江,赵光远,杜立强,刘防震
我国胃癌的发病率和死亡率分别高居第4位和第3 位[1]。脉管侵犯(lymphovascular invasion,LVI)是以血管和(或)淋巴管中出现癌细胞为特征的病理学表现,是肿瘤细胞扩散的重要途径[2-3]。有研究表明,LVI是胃癌复发的独立危险因素[4]。术前评估胃癌LVI有助于临床医生制定治疗策略和进行预后风险分层。当前已有应用影像学或血清学指标在术前预测胃癌LVI的研究[5-6],然而由于预测变量过度依赖影像学技术以及计算方式复杂,临床应用价值有限。此外,既往研究认为系统性免疫炎症指数(systemic immune-inflammation index,SII)是影响胃癌患者预后的因素[7],但其预测LVI 的研究鲜见报道。列线图能将复杂的回归方程可视化,进而个体化预测肿瘤患者的预后[8],为临床诊疗提供指导。本研究拟整合患者临床病理、术前影像学分期及血清学指标建立胃癌LVI的术前预测模型并对模型进行内部验证。
1 对象与方法
1.1 研究对象 回顾性收集2018年1月—2021年12月衡水市人民医院胃肠外科手术切除的246 例进展期胃癌患者资料。纳入标准:(1)组织病理证实为进展期胃癌。(2)接受D2或D2+淋巴结清扫术。(3)R0 根治性切除。(4)非急诊手术。排除标准:(1)术前接受辅助治疗。(2)存在远处转移。(3)多灶性胃癌。(4)既往有胃部手术史。(5)合并其他活动期肿瘤。246 例患者中男158 例,女88 例,年龄22~84 岁,中位年龄63(42,73)岁。根据术后病理诊断分为LVI 阳性组(95 例)和LVI 阴性组(151 例),LVI 的阳性率为38.6%(95/246)。本研究符合《赫尔辛基宣言》原则,通过本院伦理委员会批准(伦理号:2022-2-015),患者或患者家属签署知情同意书。
1.2 手术方法 由固定团队完成手术。包括腹腔镜或开腹近端胃切除、远端胃切除及全胃切除,同时进行D2或D2+淋巴结清扫。近端胃切除术后重建方式为双通道重建或管型食管胃吻合,远端胃切除术后重建方式为Billroth Ⅰ、BillrothⅡ吻合(加或不加Braun 吻合)或胃空肠Roux-en-Y 吻合,全胃切除术后的重建方式为食管空肠Roux-en-Y吻合。
1.3 观察指标 收集患者的年龄、性别、分化程度(高-中分化和低-未分化)、肿瘤大小(<5 cm 和≥5 cm)、肿瘤部位(胃上部、胃中部、胃下部及≥2个部位)、Borrmann分型(Ⅰ—Ⅱ及Ⅲ—Ⅳ)、Lauren 分型(肠型、弥漫型及混合型)、cT 分期(cT2—3和cT4)、cN分期(cN0和cN+)、SII。术前应用腹部增强多层螺旋CT(multidetector-row computed tomography,MDCT)评估临床cT 分期及cN 分期。SII 的计算公式如下:SII=血小板计数×中性粒细胞计数/淋巴细胞计数。术前通过胃镜活检评估肿瘤分化程度及Lauren分型,肿瘤大小为胃镜测量的最长径,胃癌临床分期通过术前1个月内腹部增强CT进行评估,血小板计数、中性粒细胞计数及淋巴细胞计数则从术前7 d内血常规检查中获取。
1.4 LVI 阳性诊断标准 LVI 阳性定义为胃癌术后苏木精-伊红(HE)染色病理切片中,在淋巴管和(或)血管内存在癌细胞[9]。病理检查中血管与淋巴管的鉴别存在困难,且重复性不理想[10]。因此,本研究中未进一步区分淋巴管和血管侵犯。
1.5 统计学方法 采用SPSS 22.0软件进行数据分析。计数资料以例或例(%)表示,组间比较采用χ2检验;正态分布的计量资料采用±s表示,组间比较采用t检验;偏态资料则采用M(P25,P75)表示,组间比较采用Mann-WhitneyU检验。影响因素分析采用Logistic回归模型;R3.6.1软件建立列线图模型,绘制受试者工作特征(ROC)曲线并计算曲线下面积(AUC),通过Hosmer-Lemeshow 检验和校准曲线评估模型的拟合优度,采用Bootstrap 1 000次重复抽样法进行内部验证。以P<0.05为差异有统计学意义。
2 结果
2.1 LVI 的影响因素分析 2 组间肿瘤大小、Borrmann 分型、肿瘤分化、Lauren 分型、cT 分期、cN分期及SII 差异均有统计学意义(P<0.05),见表1。将上述变量进行多因素Logistic回归,变量赋值见表2。结果显示,肿瘤大小、Borrmann分型、cT分期、cN分期及SII 是进展期胃癌LVI 的术前独立预测因素(均P<0.05),见表3。

Tab.1 Univariate analysis of LVI positive influencing factors in gastric cancer patients with different clinical characteristics表1 不同临床特征胃癌患者LVI阳性影响因素的单因素分析

Tab.2 Variable assignment table表2 变量赋值表

Tab.3 Multivariate analysis of preoperative predictors of LVI in gastric cancer表3 胃癌LVI术前影响因素的多因素分析
2.2 列线图模型的建立 基于上述分析,建立了包含了5 个预测因素的进展期胃癌LVI 的术前列线图预测模型,见图1。结果显示肿瘤≥5 cm、Borrmann分型为Ⅲ—Ⅳ型、cT分期为cT4、cN分期为cN+和SII较高的胃癌患者更容易出现脉管侵犯。

Fig.1 Prediction model of advanced gastric cancer LVI图1 进展期胃癌LVI的列线图预测模型
2.3 列线图预测模型的内部验证 通过内部验证,列线图模型的AUC 为0.735,分别高于肿瘤大小(0.599)、Borrmann 分型(0.564)、cT 分期(0.604)、cN分期(0.582)和SII(0.615),见图2。校准曲线显示列线图模型预测LVI 的概率与实际LVI 发生的概率具有较好一致性,见图3。Hosmer-Lemeshow检验显示拟合优度良好(χ2=4.387,P=0.821)。
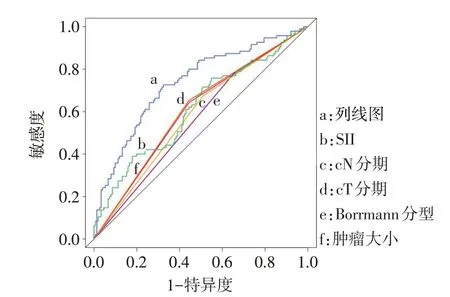
Fig.2 The prediction model and ROC curves for individual predictors图2 列线图预测模型及单个预测因素的ROC曲线

Fig.3 The calibration curve of the prediction model图3 列线图预测模型的校准曲线
3 讨论
对于可切除的进展期胃癌,根治性手术是主要的治疗方法。胃癌术后易复发是其预后差的主要原因,也是目前临床治疗面临的困境。LVI 作为胃癌侵袭性高的病理特征,LVI患者有着更差的预后。
3.1 术前预测LVI 的临床价值 美国癌症联合会(American Joint Committee on Cancer,AJCC)与国际抗癌联盟(Union for International Cancer Control,UICC)联合制定的TNM分期系统是当前指导肿瘤患者临床治疗及评估预后的主要工具[11]。探究除TNM 分期系统以外影响胃癌预后的危险因素有助于更精确地危险分层,为临床制定个体化治疗策略提供依据。目前AJCC/UICC 指南尚未将LVI 作为TNM 分期系统中胃癌的独立预后指标。然而,许多研究表明LVI 是胃癌患者生存的独立危险因素[12-13]。Li等[14]评估了LVI对中国可切除胃癌患者复发和远期生存的影响,结果显示LVI 与糖类抗原19-9(CA19-9)水平、肿瘤大小、Lauren分型、肿瘤分化程度、胃壁浸润深度、淋巴结浸润、远处转移及TNM 分期显著相关,LVI 是胃癌预后的独立危险因素。Wu 等[4]同样证实LVI 胃癌患者的预后更差,他们提出LVI状态联合淋巴结分期系统能更好地对胃癌患者预后分层。
3.2 术前预测LVI 的研究现状 在过去的十年中,胃癌的治疗已经从单纯的手术治疗发展到围手术期化疗或放化疗的多学科模式。因此,术前准确预测胃癌患者是否存在LVI对临床医生制定治疗方案及评估预后具有重要意义。然而,目前只有手术切除肿瘤才能准确评估LVI的状态。已有研究应用影像学技术及血清学指标在术前预测脉管状态。Ma等[5]分析了278 例术前接受MDCT 检查的进展期胃癌患者的影像学资料,结果提示肿瘤在平衡期和门静脉期CT值差值以及门静脉期肿瘤与脾之间CT值差值是进展期胃癌患者LVI的独立预测因素。Chen等[15]对160 例手术切除的胃癌患者进行回顾性分析,确定3个临床病理因素(T期、N期、AJCC期)和3个放射组学特征为LVI 的预测因素。此外,Xu 等[6]研究显示C反应蛋白与淋巴细胞比值是LVI的独立预测因子。
3.3 术前预测LVI模型的建立 本研究所纳入的变量均可在术前获得,变量有固定的判断标准、易获得且可重复性强,建立的模型可在术前对胃癌患者是否发生LVI 个体化预测;结果显示肿瘤≥5 cm、Borrmann分型为Ⅲ—Ⅳ型患者、cT分期为cT4、cN分期为cN+和更高的SII是进展期胃癌LVI的独立危险因素。有研究证实肿瘤≥5 cm 是胃癌神经侵犯的危险因素[16]。本研究结果提示其同样会增加LVI的风险。Borrmann Ⅲ—Ⅳ型患者更容易出现LVI,与先前研究[17]结论一致。本研究选择了术前可获取的cT及cN分期,而非术后的pT及pN分期。虽然病理分期是金标准,但是需要手术切除后才能获取,而影像学技术的进步使得术前cT 及cN 分期的准确率有了极大的提高[18]。为了提高模型的适用性,本研究将cT 分期分为cT2—3 和cT4,将cN 分期分为N0 和N+,进一步降低了影像学分期的难度。结果显示两者均是LVI 的术前预测因素。近年来,越来越多的研究表明炎症与癌症有关[19]。血清学指标SII 中综合了血小板、淋巴细胞和中性粒细胞3个参数,可更全面地反映机体的免疫和炎症状态,在胃癌预后评估中显示出了比其他炎症指标更高的价值[20]。同样,本研究中SII是胃癌术前LVI的预测因素。本研究建立列线图模型的AUC均高于单一预测因素,提示模型有较好的鉴别能力,而校准曲线提示有较好的拟合度,因此该模型有较好的临床应用价值。
综上,肿瘤≥5 cm、Borrmann分型为Ⅲ—Ⅳ型、cT分期为cT4、cN 分期为cN+和SII 越高的胃癌患者更容易出现LVI。所建立的预测模型可在术前预测进展期胃癌患者LVI 的发生风险,为临床治疗决策提供参考。
3.4 本研究的局限性 本研究为单中心、回顾性研究,未来需要多中心、前瞻性研究来评估本研究中变量在术前预测胃癌发生LVI 的可靠性。此外,需进一步外部验证本研究所建模型的预测性能。
