基于Wnt/β-catenin信号通路探究丹参素减轻滋养细胞氧化应激反应的机制
2023-12-22黄飞跃吴富菊
唐 帅,李 阳,黄飞跃,吴富菊
(吉林大学第二医院 妇产科,吉林 长春130041)
子痫前期(preeclampsia,PE) 是一种多系统共同进展的疾病,其特征为妊娠20 w后出现的高血压和尿蛋白,或高血压伴终末器官功能障碍,伴或不伴有尿蛋白,是造成孕产妇及围产儿死亡的重要原因之一[1]。目前认为子宫-胎盘循环系统的正确建立取决于滋养细胞正常浸润胎盘床。在胎盘着床的关键时刻,由于胎盘内局部的氧化应激过度增加,滋养细胞不断凋亡,侵袭作用减弱,致使胎盘浅着床,这是其发病的关键环节,此时孕妇体内出现血管内皮细胞损伤、细胞凋亡增加等一系列的氧化应激损伤[2-3]。Wnt信号通路是自然界普遍存在且非常保守的信号通路,可以调节胚胎着床、组织稳态以及其他机体机能,包括增殖、迁移、侵袭和凋亡等方面,在生命体内发挥着重大作用[3]。氧化应激是Wnt/β-catenin信号通路调控的重要生物学环节[4],PE发病过程中氧化应激反应过度激活是重要的病理特征[5-6]。近期已有实验表明,PE患者胎盘组织中GSK-3β、β-catenin和Wnt1的蛋白表达水平降低,而DKK1在PE患者胎盘组织中的蛋白表达水平则增加,这与正常妊娠组相比有显著差异[6]。因此,Wnt/β-catenin信号通路可能在PE的发病机制中起重要作用,并且可能是预防和治疗PE的前瞻性治疗目标。
丹参素是丹参中的水溶性酚酸类主要药效成分之一,是天然抗氧化物质,可以通过提高机体超氧化物歧化酶(ROS)活性,去除ROS,改善氧化应激,从而减轻ROS对细胞毒性的作用,改善细胞缺血缺氧[7]。目前丹参素已被证明可有效改善PE小鼠模型中母体综合征和胎儿综合征的预后[8]。因此本研究探讨丹参素通过经典Wnt/β-catenin信号通路改善滋养细胞氧化损伤中的作用机制,报道如下。
1 材料与方法
1.1 材料
丹参素(PubChem CID:439435)购买于北京Solarbio公司,产气厌氧袋D-07购买于日本东京AnaeroPack公司,人绒毛滋养细胞系HTR-8/SVneo购买于上海Ek-Bioscience公司,RPMI-1640培养基和青霉素-链霉素溶液购买于美国Gibco公司,胎牛血清购买于美国Clark Bio公司,活性氧检测试剂盒、Hoechst 33342活细胞染色液(100×)、Western及IP细胞裂解液、蛋白酶磷酸酶抑制剂混合物、BCA测定试剂盒和SDS-PAGE蛋白上样缓冲液(5×)购买于上海Beyotime公司,CCK-8试剂盒购买于广州cellcook公司,GADPH抗体、DKK1抗体、Wnt1抗体、GSK-3β抗体、β-catenin抗体、vinculin抗体、山羊抗兔二抗和ECL化学发光剂购买于武汉Proteintech公司。
1.2 方法
1.2.1建立HTR-8/SVneo氧化应激模型及实验组 使用含有抗坏血酸钠的 Anaeropack 诱导缺氧条件,抗坏血酸钠是通过氧化降解吸收O2和生成CO2的主要物质[9]。将HTR-8/SVneo细胞在缺氧条件下培养8 h。然后将细胞在标准培养条件下(37℃ 5% CO2)培养16 h,完成2个周期。正常对照组(NC)在标准培养条件下培养48 h。将两组HTR-8/SVneo细胞进一步分为NC组、正常培养+丹参素处理组(NC+DS)、H/R处理组(HR)和H/R+丹参素处理组(HR+DS)4个组。4组再培养48 h,各组总培养96 h。
1.2.2细胞活力测定 采用CCK-8检测细胞活力。将HTR-8/SVneo细胞(1×103个细胞/孔)在H/R条件下培养48 h,然后用不同浓度的丹参素(0.01、0.1、1、10和100 μmol·L-1)处理24 h和48 h。各组处理后,每孔细胞中加入10%的CCK-8试剂完全培养基100 μl,37℃孵育2 h。在450 nm处测量光密度来确定细胞活力。
1.2.3HTR-8/SVneo细胞中ROS的产生 DCFH-DA探针是检测细胞内ROS的主要方法。将细胞核染成蓝色的Hoechst 33342作为内参。将DCFH-DA和Hoechst 33342稀释并按说明配制成工作溶液。取1 ml工作液和细胞在37℃下孵育20 min。细胞用不含胎牛血清和双抗体的RPMI-1640培养基洗涤3次,然后立即使用荧光显微镜观察和拍照。所有实验至少重复3次。
1.2.4Western blot检测 用含蛋白酶磷酸酶抑制剂的细胞裂解液提取蛋白质。用BCA法测定蛋白质浓度。等量的总蛋白(20 μg)在10%SDS-PAGE凝胶上电泳,转移到0.45 μm PVDF膜上。用5%脱脂牛奶封闭膜2 h,然后用兔抗DKK1(1∶2 000)、Wnt1(1∶500)、GSK-3β(1∶4 000)和β-catenin(1∶6 000)抗体孵育4℃过夜。兔抗GADPH(1∶10 000)和小鼠抗vinculin(1∶10 000)抗体作为对照。用山羊抗兔(1∶4 000)和山羊抗小鼠(1∶50 000)二抗检测抗体结合情况。使用ECL试剂盒检测目的条带。结果重复3次以上,使用Image J软件对图像进行灰度值分析。
1.3 统计学方法
使用SPSS 26.0软件进行分析。所有数值均以均数±标准差表示,采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度和时间丹参素对HTR-8/SVneo细胞增殖的影响
为了检测丹参素对能否改善H/R的HTR-8/SVneo细胞生长,细胞采用不同浓度的丹参素处理(0.01、0.1、1、10、100 μmol·L-1),处理时间为24 h或48 h。研究结果表明,丹参素在上述浓度中对细胞的生长没有抑制作用,各组在处理24 h后细胞活力无明显改善(见表1)。处理48 h后,当丹参素为100 μmol·L-1和10 μmol· L-1时,滋养细胞活力均明显恢复,尤以10 μmol·L-1显著(P<0.000 1),后续实验均采用10 μmol·L-1作为丹参素的作用浓度,处理时间为48 h(见表2)。
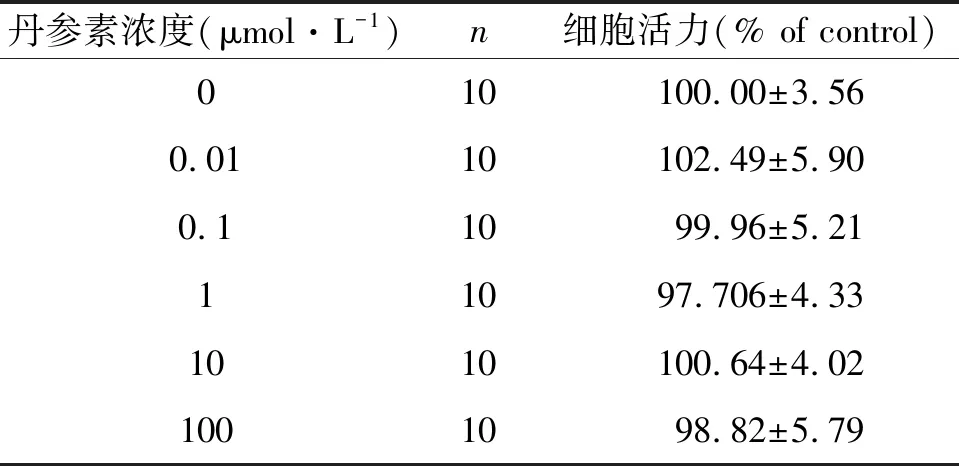
表1 不同浓度丹参素作用24 h对HTR-8/SVneo细胞增殖的影响

表2 不同浓度丹参素作用48 h对HTR-8/SVneo细胞增殖的影响
2.2 丹参素对HTR-8/SVeno氧化应激的影响
在本研究中,细胞内的 ROS 在氧化应激诱导的细胞损伤中起着关键作用;每个细胞中的 ROS 水平是通过测量 DCFH 荧光强度的变化来确定的,以 Hoechst 33342 为参照物将细胞核染成蓝色。研究结果表明,H/R处理导致HTR-8/SVneo细胞内ROS积累显著增加,而丹参素处理则有效缓解了H/R诱导的ROS产生。此外,在正常培养条件下,丹参素处理不会影响细胞内的 ROS 水平。见图1。
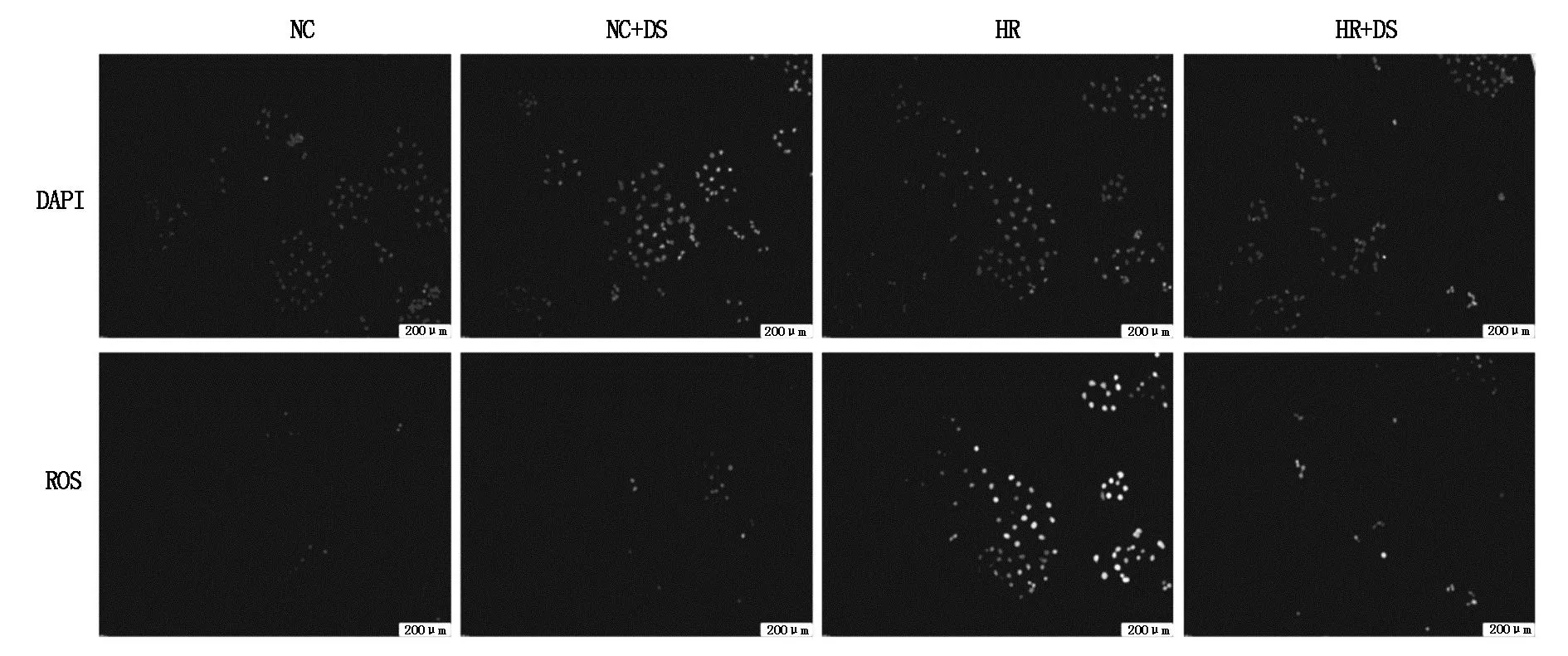
图1 各组 HTR-8/SVneo 细胞中的ROS 水平
2.3 Western Blot对Wnt信号通路中各分子变化
结果显示,HR组中的DKK1表达水平较NC组明显升高(P=0.048 0),加入丹参素处理后,NC+DS组以及HR+DS组中的DKK1表达水平较NC组无明显差别(P=0.993 2、P=0.299 8),NC+DS组以及HR+DS组中的DKK1转录水平较HR组无明显差别(P=0.101 0、P=0.608 8)。HR组中的GSK-3β转录水平较NC组、NC+DS组明显下降(P=0.009 0、P=0.040 7),加入丹参素处理后,NC+DS组以及HR+DS组中的GSK-3β表达水平较NC组无明显差别(P=0.690 7、P=0.426 5),HR+DS组中的GSK-3β表达水平较HR组无明显差别(P=0.081 4)。HR组中的β-catenin表达水平较NC组、NC+DS组以及HR+DS组中均明显下降(P=0.000 3、P=0.003 4、P=0.006 2),加入丹参素处理,NC+DS组和HR+DS组中的β-catenin表达水平较NC组无明显差别(P=0.190 7、P=0.097 5),NC+DS组中的β-catenin表达水平较NC组无明显差别(P=0.960 6)。HR组中的Wnt1表达水平较NC组和HR+DS组中均明显下降(P=0.043 6、P=0.021 9),NC+DS组和HR+DS组中的Wnt1表达水平较NC组无明显差别(P=0.954 5、P=0.957 5),HR组和HR+DS组中的Wnt1表达水平较NC+DS组无明显差别(P=0.089 4、P=0.750 4)。见图2。

图2 HTR-8/SVneo 细胞中β-catenin、DKK1、GSK-3β和Wnt1的水平
3 讨论
3.1 PE中氧化应激以及Wnt信号通路的改变
氧化与抗氧化的动态平衡调节是人体维持内环境稳定和正常生理功能的重要机制。目前认为过度的氧化应激是PE的重要发病机制,在妊娠的任何阶段包括足月妊娠都存在发生一定程度的胎盘氧化应激[10]。产生的ROS不断损伤滋养细胞,使得它们的浸润能力受损,浸润深度过浅,从而造成子宫螺旋动脉重塑不足,胎盘无法有效着床,导致胎盘缺血缺氧-再灌注损伤,氧化应激水平进一步增加[11-12]。但目前氧化应激通过何种途径使滋养细胞侵袭力降低的具体机制尚不明确。
滋养细胞浸润能力受损以及胎盘螺旋动脉重铸不足是PE的发病基础。WANG等[6]发现与正常胎盘组织相比,重度子痫前患者胎盘中DKK1的表达水平明显升高,而Wnt1、β-catenin和GSK-3β的表达水平显著降低,c-myc和cyclinD1的mRNA水平降低,这表明Wnt/β-catenin信号通路可能通过影响滋养细胞的分化、增殖和侵袭等过程在PE的发病中发挥重要作用。经过H/R处理的HTR-8/SVneo细胞显示出明显的氧化应激反应,其细胞内ROS水平显著增加,与PE患者的胎盘组织的情况相似[13]。研究证明,Wnt/β-catenin信号通路激活能够改善细胞的氧化应激状态[14]。在H/R处理组中,细胞中β-catenin蛋白的表达量显著低于正常对照组,同时ROS水平和细胞凋亡也有所增加。使用LiCl能够抑制细胞内ROS积累,改善滋养细胞的氧化应激,降低滋养细胞凋亡,在一定程度上恢复β-catenin的表达,增强滋养细胞的浸润能力[15-16]。本研究利用H/R处理的HTR-8/SVneo细胞模型,通过蛋白质印迹证实此模型组较正常培养细胞Wnt1、β-catenin和GSK-3β的表达水平显著降低,而DKK1的表达水平则显著升高,同时伴有细胞内ROS的累积。这一结果提示,氧化应激可能通过抑制滋养细胞Wnt/β-catenin信号通路,损伤滋养细胞,使得滋养细胞浸润能力受损,参与PE发病。
3.2 丹参素对滋养细胞氧化应激损伤的保护作用
丹参素是丹参中的水溶性酚酸类主要药效成分之一,性状稳定,能够被人体快速吸收。它能够抵抗氧化损伤,保护心血管系统,改善微循环,抑制炎症和抗肿瘤等广泛的药理作用。丹参素通过清除细胞内氧自由基,控制ROS水平,从而减轻细胞氧化损伤,以达到保护细胞的作用[17]。滋养细胞氧化损伤后,细胞内ROS明显增加,添加复方丹参能够明显改善,且改善程度与复方丹参浓度呈正相关[18]。丹参素已被证明在改善先兆子痫小鼠模型中母体综合征的预后方面是有效和安全的[19]。焦波等[20]观察到丹参注射液联合硫酸镁治疗PE的患者,其氧化应激水平明显降低,妊娠结局明显改善。另一方面,丹参素还能够通过增加妊娠早期胎盘滋养细胞和血管内皮细胞血管内皮生长因子的表达,促进胎盘血管网的形成、滋养细胞的浸润和母体胎盘循环的构成,减轻血管重铸障碍,从而增加胎盘血供,改善胎盘缺血缺氧状态,抑制PE的发展[19]。
本研究在H/R处理的HTR-8/SVneo细胞模型基础上,经过丹参素处理后,滋养细胞内ROS明显减少,细胞活力明显增加,证实了丹参素的抗氧化作用,改善H/R引起的滋养细胞活力下降。Western blot显示,H/R处理后HR组DKK1明显升高,而Wnt1、GSK-3β和β-catenin水平明显降低。经丹参素处理后 HR+DS组Wnt1和β-catenin明显恢复。这一情况说明,在滋养细胞内氧化应激可以抑制Wnt/β-catenin信号通路表达,经过丹参素处理后,缺氧/复氧的滋养细胞中Wnt1、β-catenin蛋白表达增加,提示氧化应激主要通过抑制Wnt1蛋白及β-catenin蛋白的表达,阻断Wnt/β-catenin信号通路,损伤滋养细胞,诱发PE。丹参素能够明显改善此过程,保护滋养细胞免受氧化应激的损伤,为治疗PE提供了新的思路和方向。
综上所述,氧化应激抑制了Wnt1和β-catenin水平,抑制了Wnt/β-catenin信号通路,从而损害滋养细胞功能,促进滋养细胞凋亡,降低滋养细胞侵袭性。丹参素能减轻滋养细胞氧化应激,恢复Wnt1和β-catenin水平,重新激活Wnt/β-catenin信号通路,为治疗PE提供了新的思路和方向。
