单精子SNP单体型在1例Ⅱ型神经纤维瘤病患者胚胎植入前遗传学检测中的应用*
2023-12-21周永红谢雨莉付志红韩婵琳焦淑静李雪梅邓天勤
周永红 谢雨莉 付志红 韩婵琳 焦淑静 李雪梅 邓天勤,*
1.南方医科大学附属深圳妇幼保健院生殖医学中心 (广东 深圳 518028)
2.南方医科大学附属深圳妇幼保健院新生儿疾病筛查中心 (广东 深圳 518028)
3.苏州亿康医学检验有限公司 (江苏 苏州 215021)
Ⅱ型神经纤维瘤病(neurofibromatosis type 2,NF2)是由于22q12染色体上的NF2基因(OMIM :607379)的突变导致的一种常染色体显性遗传疾病,其发病率为1/25000[1],约半数的新发病例是源于家族性遗传[2]。该病特征性临床表现为双侧听神经瘤,见于90%的患者,临床表现主要为耳鸣、听力下降等症状及多种神经系统肿瘤[3-4]。对有NF2的家族病史的夫妻,通过单基因病胚胎植入前遗传学检测(preimplantation genetic testing for monogenetic disease,PGT-M)来阻断致病基因的传递。为了保证结果的精确度和可靠性,防止因基因脱扣(allele dropout,ADO)和基因重组等因素造成的漏诊或误诊,临床上普遍采用致病基因变异点直接检测和基于二代测序(next-generation sequencing, NGS)的遗传多态位点构建连锁分析[5]。针对家系不全或新发突变患者,利用单精子作为连锁分析依据[6]。
在本研究中,利用基因芯片技术检测单精子(s i n g l e nucleotide polymorphism,SNP),对一例因NF2基因c.861delC新发突变引起的NF2男性患者,构建以单精子SNP单体型的连锁分析的检测策略,为该夫妇提供精确有效的PGT-M检测,研究结果如下。
1 资料与方法
1.1 研究对象先证者,男性,31岁,因双侧听神经纤维瘤术后,听力完全丧失。在行全外显子检测,结果显示NF2基因c.861delC的杂合变异,该突变是移码变异,其父母未携带突变。参考美国医学遗传学与基因组学学会的遗传变异分类标准与指南[7],此变异为可能致病(PVS1+PM2)。为了防止致病基因的遗传,患者在我院遗传咨询后,决定采用基于单精子SNP单体型的连锁分析的检测策略的PGT-M,本研究获医院伦理委员会批准(伦理号:LLYJ2022-056-030)。
1.2 方法
1.2.1 变异位点引物设计和体系建立 SNP位点选择和检测体系设计;单精子获取和WGA扩增;家系样本和单精子突变位点检测;单精子CNV建库、NGS和分析家系样本以及单精子样本的SNP的扩增,文库的制备;以及ASA基因芯片的检测、SNP连锁分析;胚胎PGT-M的检测(包括诊断与筛选)等流程,所有这些步骤均参照邓天勤[8]的实验方式进行改编。
1.2.2 产前诊断 在孕中期,抽取10毫升的羊水,按照试剂盒操作说明提取gDNA,同步进行排除母源性的污染、突变位点检测及染色体核型分析,通过Sanger测序方法检测胎儿是否携带NF2基因c.861delC的突变情况。
2 结 果
2.1 单精子的WGA检测结果一共获取50份标记为SHK1-50的单精子且进行了WGA扩展。电泳结果显示,PCR产物主要分布在200到2000bp区域,其浓度范围在13-25ng/μl之间,展示出典型的扩散状条带,这与WGA扩增的质量控制预期一致。单精子WGA扩增电泳验证的结果见图1。然而,42号泳道的SHK40单精子样本的WGA扩增并未成功,其它的7号、10号、17号、18号、24号、35号、36号、52号泳道也可能由于挑取转管等因素造成扩增失败。除此之外,其余41份的精子样本均成功进行了扩增。

图1 部分单精子WGA扩增电泳验证图。图2 夫妇及单精子突变位点检测结果。图3 SHK37、SHK48染色体拷贝数结果。图3A:SHK37。图3B:SHK48。图4 隐马尔科夫家系SNP连锁图。■:男性,携带突变;女性,不携带突变;性别未知,不携带突变;性别未知,携带突变。图5 羊水 Sanger 测序结果。
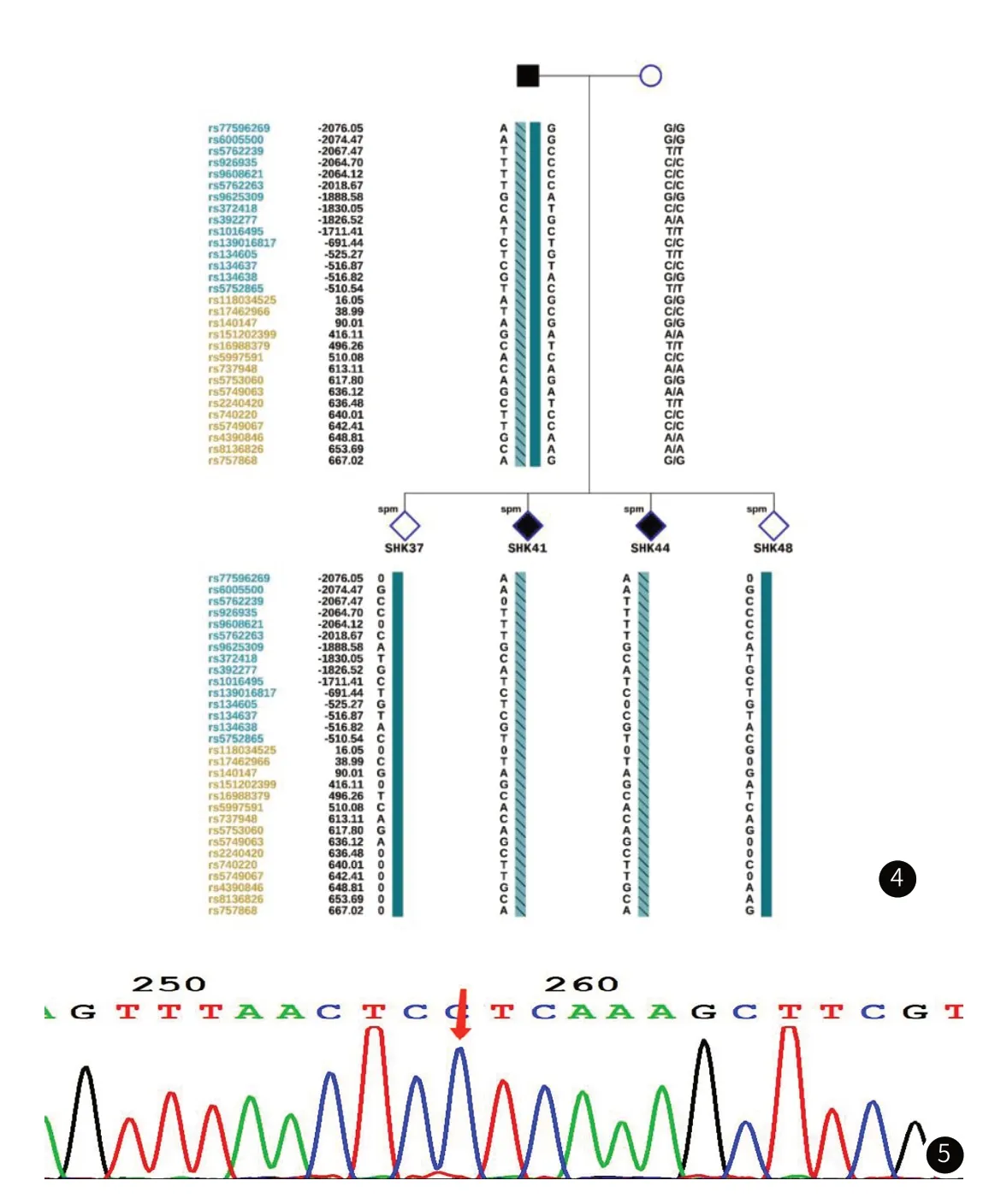
2.2 夫妇及单精子的突变位点的检测结果男方携带的是胚系突变,而女方为野生型,此外,单精子SHK41和SHK44携带NF2基因c.861delC突变;单精子SHK37和SHK48不携带NF2基因c.861delC突变。
2.3 单精子的CNV结果是基于是否为23,X或23,Y染色体,如图3可见,SHK37染色体的拷贝数显示为23,X,而在SHK48染色体的拷贝数为23,Y。
2.4 夫妻以及单精子SNP分析我们选择男方杂合和女方纯合SNP位点行连锁分析。总共有30个可利用的SNP位点,联合单精子SHK37、SHK41、SHK44、SHK48的SNP结果,选择30个SNP位点的单体型结果,对于构建单体型是足够的。分析精子携带突变位点上游2M及下游1M SNP位点,突变型单精子SNP位点共有17个位点产生ADO,ADO率为8.29%;野生型单精子SNP共有11个位点产生ADO,ADO率为5.37%,均符合PGT-M指南对于SNP位点分析要求。图4揭示了部分在隐马尔科夫SNP单体型连锁图中可应用的上游与下游位点。上游的变异位点被标示为蓝色的rs序数,而游层的变异位点被标注为黄色的rs序数。
2.5 胚胎的检测(包括诊断和筛选)总共获得5枚囊胚,检测结果表明4枚胚胎未携带父源性突变(ZT01、ZT02、ZT03、ZT04),其中的3枚胚胎为46, XN胚胎(ZT01、ZT02、ZT04),其中ZT02号胚胎出现c.868处检出C>T杂合突变,可能为新发突变或单细胞扩增引入的错配。在rs323073SNP的位置产生了ADO,G/A的分析结果为A/A,ADO的比例在0-2.13%范围内,与PGT-M的解读标准相符合。通过全面的分析,我们确定ZT01号和ZT04号的这两枚胚胎为可移植。每枚胚胎在1M范围内的平均SNP可用位点数量超过30个,而且胚胎的突变检测位点和SNP单体型的分析结果是一致的。
2.6 产前诊断及随访2022年2月22日移植ZT01胚胎,并成功妊娠。在孕期18周,在我院母胎医学中心行羊水穿刺,羊水样本用于提取DNA,行染色体核型和Sanger序列分析以判断胎儿是否存在染色体异常和携带致病基因突变。结果显示,胎儿的染色体核型及结构未见异常,且未携带NF2基因c.861delC突变(如图5所示),成功地阻断新发突变的遗传。女方于2022年11月30孕39周分娩一女婴,体重3.35Kg,身长50cm,出生时无异常。

表1 胚胎植入前遗传学检测结果
3 讨 论
NF2是一种染色体显性遗传的疾病,其遗传子代的概率为50%。NF2基因的突变不同可能会引发临床生物学行为的不同[9],而NF2基因的突变也可能会导致Merlin蛋白异常,从而引发神经系统肿瘤[10]。PGT-M误诊最常见的原因之一是ADO,ADO发生率为10%~20%[11],为降低误诊风险常规需进行连锁分析。因NF2患者50%是新发突变,这对PGT-M提出了挑战,无法进行连锁分析。
PGT-M的常规检测方案是直接致病基因突变位点检测和遗传性的多态位点(例如短串联重复序列(short tandem repeat,STR)或SNP)进行链锁分析,以避免扩增失败和ADO等因素引发的误诊。本研究单体型分析没有使用STR,而采用SNP位点构建单体型,是为了避免同源重组导致误诊及STR难于大规模检测。在PGT领域,主要运用的技术是阵列比较基因组杂交芯片(aCGH)和SNP芯片。SNP芯片的优势在于它能够检测单倍体和多倍体的变异,并为胚胎指纹识别、亲子鉴定和单亲二体的检测提供必要的数据。本研究应用ASA基因芯片技术检测精子SNP,以突变型和野生型精子的SNP数据构建SNP单体型的连锁分析,对胚胎进行筛选和诊断。分别对5枚胚胎进行了CNV、SNP单体型和突变的检测,结果显示有2枚可移植胚胎。孕中期行产前诊断明确胎儿染色体核型及结构未见异常,并未携带致病基因突变,成功地阻断NF2疾病相关的突变基因的传递。2001年报道第一例经PGT成功阻断遗传性肿瘤综合症(Li-Fraumeni综合征)垂直传递[12];2002年Abou-Sleiman等[13]首次报道PGT在NF2应用,采用突变位点直接检测和SNP的连锁分析,获4枚可以移植胚胎,ADO率为2.8%,未妊娠。同年Yury等[14]报道NF2患者通过PGT生育1个未携带NF2致病基因的小孩,其应用荧光PCR技术构建单精子SNP单体型的连锁分析,获8枚可移植胚胎,但未提供AOD。Spits等[15]对一例因NF2基因C.1612C>T突变的NF2患者,应用单细胞双重PCR构建单精子STR突变单体型的PGT检测策略,AOD率为2.0%,经历5个临床周期,胚胎未能着床成功,但患者自然妊娠,最终证实胎儿未携带C.1612C>T突变。国内基于NGS平台建立针对家系不全并单基因疾病和染色体异常的采用突变位点检测、CNV和单精子SNP单体型连锁分析的一体化PGT检测策略,应用于1例NF2基因新发突变合并染色体平衡易位NF2患者,获1枚未携带致病基因的染色体平衡易位胚胎,但夫妇放弃移植[16],而本研究采用基因芯片方法,构建精子SNP单体型。单精子SNP单体型并不仅限于新发的单基因疾病的应用,如SMN1基因纯合缺失的脊髓性肌肉萎缩症[17]、COL1A1基因杂合突变的成骨不全症[18]、FGFR3基因新发变异的软骨发育不全[19]以及常染色体显性遗传多囊肾[20]等;它还被应用于染色体结构异常对的罗伯逊易位男性患者的治疗,从而成功筛选出健康的胚胎[21]。
若无家族史或无先证者,尤其是新发突变的常染色体显性遗传单基因疾病的男性患者,可采用基因芯片技术构建单精子SNP单体型,并结合CNV和突变位点的检测策略筛选胚胎,从而提高了PGT-M的准确性,阻断致病基因的垂直传递。
