至宝三鞭丸对腺嘌呤诱导的肾阳虚证大鼠模型的改善作用研究
2023-12-20王官连刘佳霖张咏梅刘传文冉庆森杜茂波
王官连 刘佳霖 张咏梅 鲍 磊 刘传文 冉庆森 李 琦 杜茂波
(1 中国中医科学院中药研究所,北京,100700; 2 烟台中亚保健酒有限公司,烟台,264000)
肾阳虚证是一种中医诊断病证,主要病因是肾阳虚衰、温煦失职、气化失权所表现的一类虚寒证候,是一种由神经内分泌紊乱引起的代谢性疾病。男性肾阳虚证患者的主要临床表现为育龄不育、性欲降低或性冷淡、精液少、精子活性低、腰痛、夜尿多。严重者甚至可能导致生精功能障碍,导致不育和出生缺陷[1-3]。
至宝三鞭丸处方由海狗鞭、狗鞭、鹿鞭、人参、鹿茸、海马、蛤蚧、肉苁蓉、枸杞子、杜仲等40多味名贵中药材组成,多年的临床研究表明该方具有明显的延缓衰老、抗疲劳作用,是一种强力的补肾药。作用显著,疗效确切,临床上广泛用于治疗男性不育,少精,弱精,性功能低下等肾阳虚所致男性性功能障碍[4-6]。但是,目前关于至宝三鞭丸如何实现补肾壮阳功效的作用机制尚不清楚。
通过构建腺嘌呤所致肾阳虚证大鼠模型,研究至宝三鞭丸对肾阳虚大鼠的改善作用,并初步围绕下丘脑-垂体-性腺轴(Hypothalamic-Pituitary-Gonadal Axis,HPGA)为立足点,对“神经”“内分泌”“生殖”3个节点分别开展至宝三鞭丸相关的药效评价研究。为至宝三鞭丸诱发生殖功能变化的潜在机制和器官互作模式做了初步的探索,以期对至宝三鞭丸补肾壮阳功效的功效原理和科学内涵进行阐释。
1 材料与方法
1.1 材料
1.1.1 动物 选取6周龄无特定病原体(Specific Pathogen Free,SPF)SD大鼠98只,雄性,体质量(220±10)g,购自北京维通利华实验动物有限公司,动物许可证号:SCXK(京)2016-0006。饲养于中国中医科学院中药研究所药物非临床研究质量管理规范(Good Laboratory Practice,GLP)中心。饲养温度20~25 ℃,湿度65%~70%,自由饮水进食。实验通过中国中医科学院中药研究所动物伦理委员会批准(伦理审批号:2021B069)。
1.1.2 药物 至宝三鞭丸(中亚医药保健有限公司,批号:Z37021007);金匮肾气丸(北京同仁堂医药有限公司,批号:Z11020147);左卡尼汀口服液(东北制药集团沈阳第一制药有限公司,批号:H19990372)。
1.1.3 试剂与仪器 腺嘌呤(上海麦克林生化科技有限公司,批号:A800685);雌二醇(Estradiol,E2)ELISA试剂盒(上海江莱生物科技有限公司,批号:JL13135);睾酮(Testosterone,T)ELISA试剂盒(上海江莱生物科技有限公司,批号:JL13284);促卵泡素(Follicle-Stimulating Hormone,FSH)ELISA试剂盒(上海江莱生物科技有限公司,批号:JL13103),黄体生成素(Luteinizing Hormone,LH)ELISA试剂盒(上海江莱生物科技有限公司,批号:JL13135),多巴胺(Dopamine,DA)ELISA试剂盒(上海江莱生物科技有限公司,批号:JL13316),5-羟色胺(5-hydroxytryptamine,5-HT)ELISA试剂盒(上海江莱生物科技有限公司,批号:JL13048),去甲肾上腺素(Norepinephrine,NE)ELISA试剂盒(上海江莱生物科技有限公司,批号:JL13034),苏木精-伊红(Hematoxylin-Eosin,HE)染色试剂盒(北京索莱宝科技有限公司,批号:G1120),Masson三色染色试剂盒(北京雷根生物科技有限公司,批号:G1346),Nikon精子质量分析系统高倍显微镜(尼康株式会社,日本,型号:TS2),Molecular Devices酶标仪(Molecular Device科技有限公司,美国,型号:ID3)。
1.2 方法
1.2.1 分组和模型制备 将98只SD雄性大鼠按照体质量随机区组法分为7组,每组14只,正常组、模型组、三鞭丸高剂量组[0.72 g/(kg·d)]、三鞭丸中剂量组[0.36 g/(kg·d)]、三鞭丸低剂量组[0.18 g/(kg·d)]、金匮肾气丸组[中药阳性对照,10 g/(kg·d)]和左卡尼汀组[西药阳性对照,口服液,10 mL/(kg·d)]。除正常组灌胃生理盐水(25 mL/kg)外,其余各组灌胃腺嘌呤(10 mg/mL),按照200 mg/(100 g·d)剂量,1次/d,连续30 d,制备肾阳虚证大鼠模型,实验全过程中没有动物死亡。造模后,每日观察体征变化并记录体质量变化,出现体质量及活动能力下降,畏寒,体毛稀疏失去光泽等体征,可判定为造模成功。
1.2.2 给药方法 至宝三鞭丸、金匮肾气丸和左卡尼汀口服液均用蒸馏水进行溶解,按照人与大鼠药物体表换算的方式配成对应的浓度[7],放入冰箱保存,使用时混合均匀即可。
1.2.3 检测指标与方法
造模成功后最后一次给药2 h后,称定大鼠体质量,腹主动脉取血后,取出肾脏、睾丸、附睾、输精管等器官进行称重,器官指数计算采用:器官/体质量×100%[8]。
1.2.3.1 肾脏、睾丸组织病理学检测 大鼠腹主动脉取血后,取出肾脏、睾丸和附睾组织,浸入4%多聚甲醛固定液中固定,待用。肾脏、睾丸和附睾组织切片用HE染色。将肾脏和睾丸组织切片在二甲苯中脱蜡,在乙醇分级中再水化至去离子水,根据说明书进行染色,其中使用Weigert苏木精(细胞核)、比布里希猩红酸品红(细胞质/肌肉)和苯胺蓝(胶原蛋白)。然后,通过Nikon TS2显微镜观察并用数码相机记录,其中每个切片检查5个随机区域。采用Image J软件选中炎症细胞浸润区域,同一方法计算3张同一组HE图片面积,计算平均值,即为该组炎症反应强度[9]。
此外,使用Masson三色染色试剂盒检测肾脏纤维化程度。按照说明书中的操作步骤进行染色。观察拍照及计算方法同HE染色。使用Image J软件对Masson染色下肾小球纤维化程度进行评估(肾小球内蓝色胶原纤维面积)[10]。
1.2.3.2 精子计数及活力检测 腹腔注射戊巴比妥钠后,取出大鼠的附睾。将附睾放入到1 mL的37 ℃预孵育的生理盐水(精子解育液)中,用眼科剪成均匀的小碎块,200目筛过滤,加入预热生理盐水,制成精子悬液。取1滴精子悬液在Nikon TS2精子质量分析系统高倍显微镜下计数。根据世界卫生组织手册[11],精子活力分为4个等级:A级为快速向前运动;B级为缓慢向前运动;C级为非前向运动;D级为精子原地不动。计算出A+B级精子的比例。
1.2.3.3 大鼠血清中性激素和神经递质表达水平检测 收集大鼠血液10 mL,静置1 h后,1 000 g/min,离心5 min,吸取上层血清。采用酶联免疫吸附试验(Enzyme Linked Immunosorbent Assay,ELISA)检测大鼠血清中性激素(E2、T、FSH、LH)和神经递质(DA、5-HT、NE)的含量。

2 结果
2.1 至宝三鞭丸对肾阳虚型大鼠体质量和器官指数的影响 与正常组比较,模型组大鼠的体质量均有下降,差异有统计学意义(P<0.01);与模型组比较,三鞭丸中剂量组、高剂量组、金匮肾气丸组和左卡尼汀组体质量明显升高,差异均有统计学意义(均P<0.01),三鞭丸低剂量组与模型组比较差异无统计学意义(P>0.05)。
肉眼观察可见正常组大鼠双肾呈淡粉红色,未见异常;模型组双肾肿大、表面白色,有实变感,表现为“大白肾”;给予三鞭丸药物干预后,双肾逐步恢复至正常大小,白色部分逐渐转变为淡粉红色。见图1。
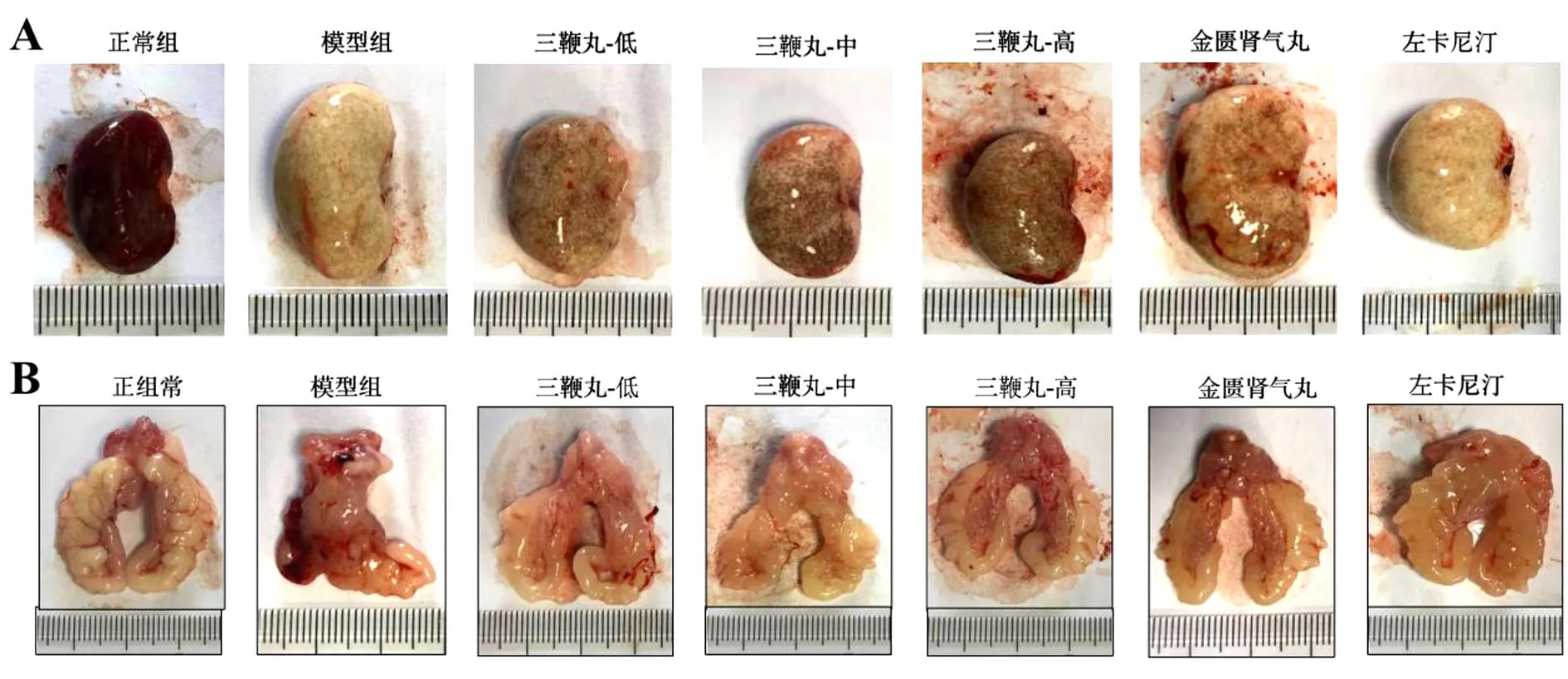
图1 大鼠肾脏(A)和输精管(B)
正常组输精管形态正常,管内部充盈,管壁表面呈淡黄色且有光泽,并且左右侧大小基本相同;模型组输精管出现皱缩,管内部不够饱满,管壁表面有红色充血,无光泽,并且左右侧大小不同;给予三鞭丸药物干预后,输精管的形态趋于正常,管内部也逐渐充盈,管壁红色充血部分减少,逐步恢复光泽,并且左右两侧也逐渐恢复至大小相同。
与正常组肾脏比较,模型组大鼠的肾脏系数明显升高,差异有统计学意义(P<0.01);与模型组比较,三鞭丸中剂量组、高剂量组、金匮肾气丸组和左卡尼汀组的肾脏系数显著下降,差异均有统计学意义(均P<0.01),三鞭丸低剂量组肾脏系数也均有所下降,但与模型组比较差异无统计学意义(P>0.05)。见图2。
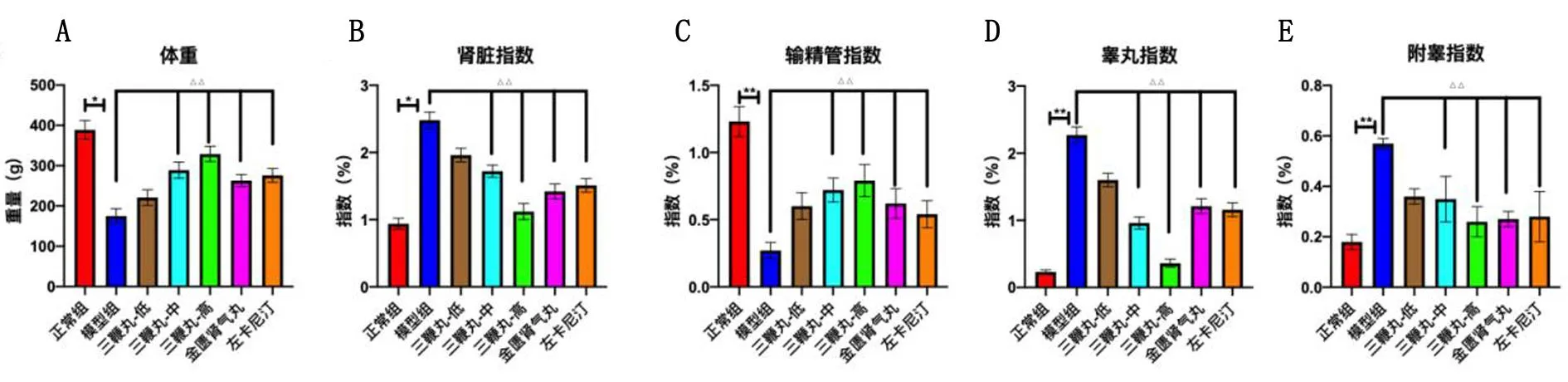
图2 大鼠体质量(A)、肾脏指数(B)、睾丸指数(C)、附睾指数(D)和输精管指数(E)变化
与正常组比较,模型组大鼠的输精管系数明显下降,差异有统计学意义(P<0.01);与模型组比较,三鞭丸中剂量组、高剂量组、金匮肾气丸组和左卡尼汀组的输精管系数显著升高,差异均有统计学意义(均P<0.05),三鞭丸低剂量组输精管系数也均有升高的趋势,但与模型组比较差异无统计学意义(P>0.05)。
与正常组比较,模型组的睾丸和附睾系数均有所升高,差异均有统计学意义(均P<0.05);与模型组比较,三鞭丸高剂量组睾丸系数下降显著(P<0.05),三鞭丸低剂量组、中剂量组、金匮肾气丸组和左卡尼汀组的睾丸系数均有所下降,但与模型组比较差异无统计学意义(P>0.05);同样,与模型组比较,三鞭丸高剂量组和金匮肾气丸组的附睾系数同样下降显著,差异均有统计学意义(均P<0.05),三鞭丸低剂量组、中剂量组和左卡尼汀组的附睾系数均有所下降,但与模型组比较差异无统计学意义(P>0.05)。
2.2 肾脏、睾丸组织病理分析 与正常组比较,模型组大鼠肾脏中,肾小球萎缩,肾小管管腔扩大,间质中炎症细胞大量聚集并且小管间质纤维化。与模型组比较,三鞭丸各给药组和金匮肾气丸组肾小管间质中炎症细胞浸润数目减少。纤维细胞减少,肾小管趋于正常。见图3A。

图3 大鼠肾(A)、睾丸(B)和附睾组织(C)组织学(HE染色,×100)
与正常组比较,模型组睾丸萎缩,生精小管管径变小,排列稀疏,管内各级生精细胞排列紊乱,管腔内精子数目减少。与模型组比较,三鞭丸低剂量组生精小管结构基本正常;三鞭丸中剂量组大鼠睾丸组织结构趋于正常,生精小管结构基本正常;三鞭丸高剂量组生精小管中各级生精细胞排列趋于规整,生精小管结构趋于正常;金匮肾气丸组大鼠睾丸组织结构趋于正常,生精小管结构基本正常;左卡尼汀组大生精小管结构趋于正常。见图3B。
与正常组比较,模型组附睾管管壁增厚,排列疏松,间质增大,腔内精子聚集成团,数量减少,排列欠规整。三鞭丸低、中、高剂量组和金匮肾气丸组附睾管管壁增厚情况明显改善,排列紧密,腔内精子量增多,分布均匀。左卡尼汀组腔内精子量增多,分布均匀,但是附睾管管壁增厚,排列疏松,管腔增生萎缩。见图3C。
大鼠肾脏Masson染色结果显示,与正常组比较,模型组大鼠肾小球和肾小管中观察到大量蓝色的胶原纤维,系膜细胞成团,与管腔壁之间的间隙增大,表明肾脏胶原纤维的表达明显升高,肾脏细胞间质纤维化程度高。与模型组比较,大鼠在三鞭丸药物干预后,尤其是三鞭丸高剂量组,肾脏的纤维化程度有明显改善,系膜细胞排列趋于正常,且与管腔壁之间的间隙缩小,表明肾脏细胞间质纤维化程度减小。金匮肾气丸组和左卡尼汀组管腔壁之间的间隙缩小。见图4。
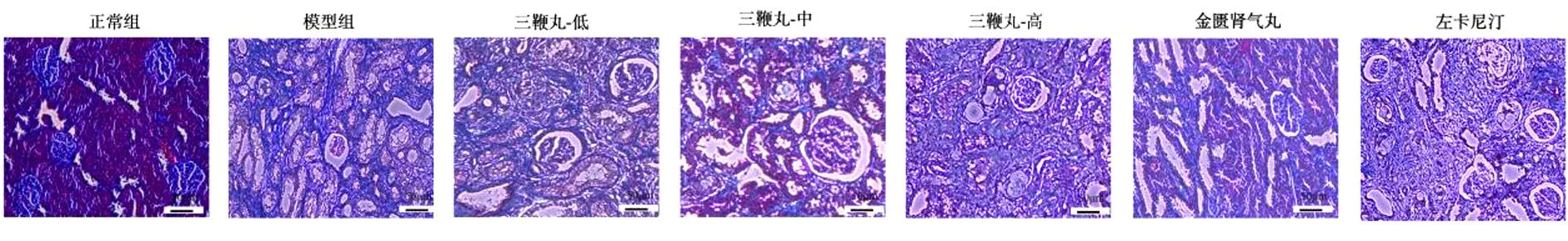
图4 大鼠肾组织学(Masson染色,×100)
2.3 至宝三鞭丸对肾阳虚型大鼠精子的影响 与正常组比较,模型组的精子数量显著减少;与模型组比较,三鞭丸低、中、高剂量组的精子数量均显著增高提示三鞭丸具有改善精子肾阳虚所致的精子数量减少问题;金匮肾气丸组和左卡尼汀组的精子数量与模型组比较也都显著升高。见图5A。
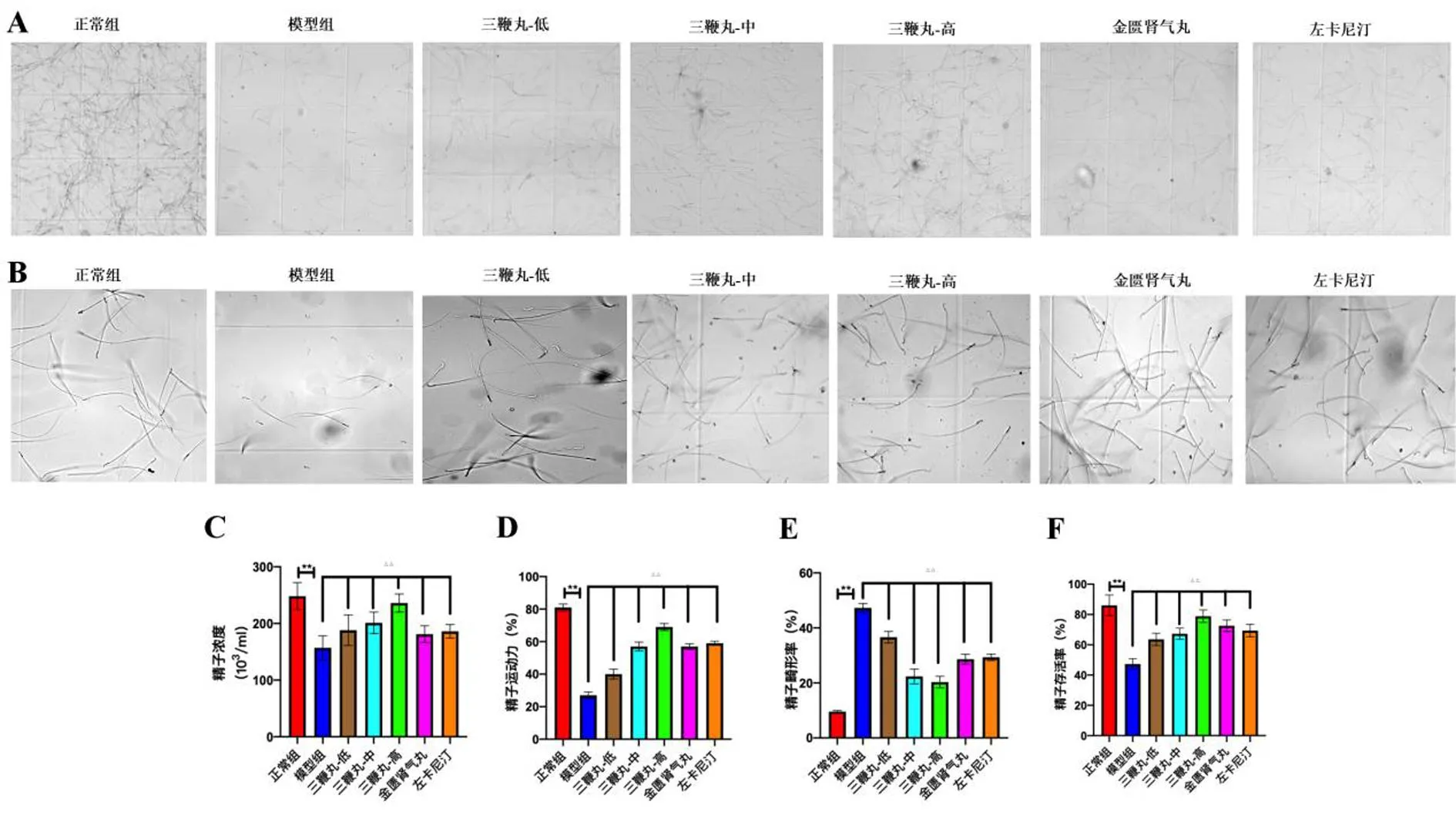
图5 大鼠精子形态和大鼠精子活力
在精子活力方面,与正常组比较,模型组的精子形态上,头部出现有双头、圆头,并且还出现有头部与身体分离,精子不呈线性运动,原地打转,并且大部分精子处于静止状态,无活力;与模型组比较,给予三鞭丸后精子活力与形态均有所改善,精子头部大部分是钩状,基本无断头心形态,精子的活力增强。见图5B。
与正常组比较,模型组的精子浓度,精子运动能力和精子存活率均显著降低,差异有统计学意义(P<0.01),而精子的畸形率则显著升高,差异有统计学意义(P<0.01);而在给予三鞭丸药物干预后,大鼠的精子浓度,精子运动能力和精子存活率均较模型组显著提升,差异有统计学意义(P<0.01),而畸形的精子也较模型组显著降低,差异有统计学意义(P<0.01),其中三鞭丸高剂量组效果最好。比较之下,金匮肾气丸组和左卡尼汀组虽均能改善精子活力,数量和形态,但效果均不如三鞭丸高剂量组。见图5C~F。
2.4 至宝三鞭丸对大鼠血清中性激素和神经递质表达的影响 与正常组比较,模型组的性激素E2、FSH、LH的含量均显著升高,差异有统计学意义(P<0.01);T含量显著下降,差异有统计学意义(P<0.01);与模型组比较,除三鞭丸低剂量和金匮肾气丸组(P>0.05),其余三鞭丸给药组和左卡尼汀组均能显著降低E2的含量,差异有统计学意义(P<0.05),且三鞭丸高剂量组效果最好;针对T的影响,三鞭丸各给药组、金匮肾气丸组和左卡尼汀组均能显著升高T的含量,差异有统计学意义(P<0.05),三鞭丸高剂量组效果最优;针对FSH和LH的含量影响,三鞭丸各给药组、金匮肾气丸组和左卡尼汀组均显著降低,且差异有统计学意义(P<0.01),三鞭丸高剂量组效果最优。见表1。
表1 大鼠血清中神经递质和内分泌激素的含量
关于对神经递质的影响,与正常组比较,模型组的神经递质DA、NE和5-HT的含量均有显著升高,差异有统计学意义(P<0.01);与模型组比较,三鞭丸各给药组金匮肾气丸和左卡尼汀组的DA、NE、5-HT含量均显著下降,差异有统计学意义(P<0.01)。
3 讨论
至宝三鞭丸是一种强力的补肾药,其作用显著,疗效确切,在临床广泛用于肾阳虚并伴有性功能低下者为宜。该方中人参、鹿茸、3种鞭药相互配伍,有效改善肾阳衰微之性欲低下、阳痿等症状[12-13]。本实验通过构建腺嘌呤诱导的肾阳虚大鼠模型,分别从大鼠整体表征,性器官指数变化,组织病理学变化以及与HPGA相关的性激素和神经递质等角度评价了至宝三鞭丸对肾阳虚大鼠的改善作用。实验结果表明了至宝三鞭丸可改善腺嘌呤致肾阳虚模型大鼠的肾阳虚症状,从不同程度地减轻腺嘌呤对大鼠HPGA的抑制作用,且对腺嘌呤造模引起的大鼠睾丸和附睾组织损伤有一定程度的保护作用,呈现出良好的补肾助阳功效。
有研究表明,在HPGA与肾虚关系中,发现男性肾阳虚证患者T较正常下降,E2较正常升高。在HPGA的调控下,垂体合成并释放LH和FSH,进而促进性腺睾丸释放T,T、LH和FSH对下丘脑有反馈抑制作用,形成健康成年男性良好的内分泌循环[14]。另外,有研究表明神经递质DA、5-HT和NE的合成与释放能够调控HPGA的功能[15]。本研究结果显示腺嘌呤会诱发大鼠的一般体征发生改变;HE染色结果说明三鞭丸可以有效缓解腺嘌呤所诱导的肾脏,睾丸,附睾等生殖器官的病理改变;大鼠肾脏Masson染色结果显示,三鞭丸能有效缓解腺嘌呤所致的肾纤维化程度;三鞭丸可以通过对相关性激素和神经递质来有效缓解腺嘌呤所致肾阳虚动物的病理状态,并且三鞭丸高剂量组效果最优,这也与以往研究结果相符。
本实验也选取了补肾药金匮肾气丸作为阳性对照药,但是,至宝三鞭丸在缓解一些肾阳虚病理状态的药效方面要优于金匮肾气丸。腺嘌呤诱导的肾阳虚主要是肾阳衰微的肾功能不全、性欲低下和阳痿,至宝三鞭丸可以通过滋补肾阳、益气活血有效地改善腺嘌呤诱发的肾阳衰微等[16-17]。而金匮肾气丸主要是针对肾阴亏损,虚火内生所致肾阳虚症状,其改善肾虚的症状主要是通过化气行水,滋补阴血的功效[4,18-19]。
研究发现,HPGA的功能障碍是肾阳虚证的基础,HPGA由3个水平组成:下丘脑、垂体、性腺(男性睾丸、女性卵巢)。更为重要的是,性腺功能直接与激素-内分泌系统功能稳态紧密关联[20-21]。一般认为,性反应过程与神经内分泌的调控相关。不同神经中枢通过接受各种激素(DA、5-HT、NE)刺激,下丘脑进一步接收信息,加工转换为神经内分泌信号,释放促性腺激素释放激素(Gonadotropin-releasing Hormone,GnRH),刺激腺垂体嗜碱性细胞释放FSH、E2、LH和T。这4种促性腺激素进一步刺激性腺,分泌性激素,促使男性生殖器官发育成熟,并作为维持正常性功能的基本条件[22-23]。上述现代医学认识形成了公认的HPGA,从生理功能整合、系统调节的角度,揭示出生殖功能改变的深层次、系统性原因,也大大拓展了人们对生殖相关疾病的认识领域和治疗策略认识[24-25]。
随着临床和科研对HPGA与肾阳虚证的深入探究,已经形成了具有科学意义且相对统一的评价标准[25],主要对血清中E2、T、LH、FSH等微观指标的检测。经至宝三鞭丸干预后,大鼠血清中LH、T的水平均得以改善,E2/T比值失衡亦得以纠正,尤以高剂量对FSH、LH、E2/T比值的改善最佳。上述研究结果表明,至宝三鞭丸可基于对HPGA的调控改善腺嘌呤致肾阳虚证模型大鼠的肾阳虚症状,呈现出良好的补肾助阳功效。
4 结论
本研究评价至宝三鞭丸对于腺嘌呤所致肾阳虚证模型动物生殖系统结构和对HPGA功能的改善作用,对于该药物针对肾阳虚证治疗有效性评价和科学内涵揭示具有积极意义。
利益冲突声明:无。
