硫酸亚铁铵制备的改进实验
2023-12-19沈凤翠王雨萍彭鑫陈刚刘倩
沈凤翠,王雨萍,彭鑫,陈刚,刘倩
硫酸亚铁铵制备的改进实验
沈凤翠,王雨萍,彭鑫,陈刚,刘倩
(安徽工程大学 化学与环境工程学院,安徽 芜湖 241000)
介绍了一个制备硫酸亚铁铵的优化实验.通过加入少量硫酸铜溶液,利用反应过程中形成的原电池反应来提高反应的产率和速率,从而解决原实验中硫酸亚铁铵产率低、等级差等问题.以探究不同浓度的硫酸铜溶液和不同温度对生成中间产物的速率和浓度影响为依据,确定了反应的最佳条件.通过对原实验的有效改进,不仅提高了产率,减少了能耗,同时让学生充分理解了催化剂对化学反应的影响和原电池理论,强化学生理论知识在具体实验中的应用,以及如何利用其提高反应效率和对实验进行综合优化的能力.
硫酸亚铁铵;硫酸铜;产率;改进实验
硫酸亚铁铵是一种具备浅蓝绿色单斜晶体外观的复盐,也被称为莫尔盐或摩尔盐[1]44.其制备与测定的反应条件相对温和,操作相对简单,仪器设备较为常用,是被各高校广泛开设的经典无机合成实验[2].实验室制备硫酸亚铁铵常用方法是使用铁屑和硫酸反应,生成中间产物硫酸亚铁,与硫酸铵复合后蒸发浓缩结晶得到浅蓝绿色硫酸亚铁铵[3].目前,该反应存在以下问题:(1)使用的铁屑原料含有有害元素硫、磷等杂质,反应过程中会产生刺激性的H2S,PH3等有毒气体,造成环境污染,不可避免地会被师生吸入而损害身体健康[4];(2)所需反应时间较长[5],导致生成的中间产物硫酸亚铁的Fe2+易被空气氧化成Fe3+,影响最终产物硫酸亚铁铵的产率和等级[6].
本文针对传统制备硫酸亚铁铵方法中存在的问题[7],通过改变原料种类以及对影响硫酸亚铁铵产率和产品级别的主要因素进行分析[8-9],本着绿色化学的原则,选用组分单一的铁粉,避免实验过程中有毒有害气体对身体的危害;同时选择加入少量硫酸铜溶液,利用铁粉和铜离子之间的原电池反应,促进反应进行,从而提高反应产率.实验过程中为精确考量反应条件的变化对硫酸亚铁铵产量的影响以及简化实验步骤,以反应过程中的中间产物Fe2+质量浓度为指标,确定硫酸铜催化剂的最佳用量,以达到对实验方法进行优化的目的.
1 实验部分
1.1 实验原理
采用铁粉与稀硫酸作用生成中间产物硫酸亚铁.由于反应中间产物硫酸亚铁的产量和被氧化程度极大地影响最终产物硫酸亚铁铵的产量和等级,因此为直观了解反应过程中硫酸亚铁的浓度变化,采用分光光度法在不同时间段测定微量铁(Fe2+)质量浓度,在pH为2~9的条件下,以1,10﹣邻二氮杂菲为显色剂,利用其与Fe2+生成稳定的橘红色配合物[Fe(phen)3]2+的显色反应特点进行测定,配合物[Fe(phen)3]2+的lg稳=21.3(20℃),摩尔吸光系数510=1.1×104L/(mol·cm).由于反应过程中少量Fe2+会被氧化,Fe3+会与邻二氮杂菲生成淡蓝色配合物[lg稳=14.1(20℃)],会对显色反应产生影响.所以需在Fe3+与邻二氮杂菲反应显色之前使用盐酸羟胺将Fe3+还原成Fe2+.测定溶液时,需要控制溶液pH约为5,如果溶液pH太低,会导致反应速率较慢;如果溶液pH太高,会导致Fe2+水解,进而影响反应的显色.对比不同浓度的硫酸铜对反应过程中生成的Fe2+质量浓度的影响,确定硫酸铜催化剂的最佳浓度.反应温度对催化剂的性质影响较大,因此在确定硫酸铜的最佳浓度后,对比不同温度对反应过程中生成的Fe2+质量浓度的影响,确定反应的最佳温度,从而确定该反应进行的最佳条件.
在中间产物硫酸亚铁溶液中加入少量硫酸铵,生成溶解度较低的硫酸亚铁铵,经过加热浓缩,冷却至室温,即可析出硫酸亚铁铵晶体:FeSO4+(NH4)2SO4+ 6H2O = FeSO4·(NH4)2·6H2O.对硫酸亚铁铵中杂质含量用目测比色法可半定量地进行判断.由Fe3+可与KSCN形成血红色络合物的原理,产物中Fe3+质量浓度越高,血红色越深,称取一定量的硫酸亚铁铵晶体,将KSCN溶液加入比色管中,制成待测溶液进行反应.将其所呈现的颜色与含一定量Fe3+配制的标准溶液的颜色进行比较:Fe3++SCN-= [Fe(SCN)]3-,以确定产品等级.
1.2 仪器与试剂
X射线衍射仪(XRD,SmartLab SE,日本理学株式会社);扫描电子显微镜(SEM,Hitachi S4800,株式会社日立制作所);分光光度计(722型,上海佑科仪器仪表有限公司);水浴锅(DF-101S,芜湖标科仪器有限公司).
硫酸铜,硫酸铵,硫酸,乙醇,盐酸羟胺,醋酸钠,邻菲罗琳试剂,铁粉,硫氰酸钾(国药集团化学试剂有限公司),以上均为分析纯.
1.3 表征方法
使用X射线衍射对产品进行X射线衍射,根据衍射图谱特征峰确定产品的成分和结构.使用扫描电子显微镜,通过电子束和产品的相互影响,使用二次电子信号成像来观察产品的表面形貌.
1.4 实验步骤与方法
1.4.1吸收曲线的绘制使用移液枪移取10 μg/mL铁标准溶液5 mL于50 mL容量瓶中,加入100 g/L盐酸羟胺溶液1 mL,摇匀,2 min后,再加入5 mL 1 mol/L的NaAc溶液和3 mL 1 g/L的邻菲罗啉溶液,使用蒸馏水稀释至50 mL,摇匀,放置10 min.在分光光度计上,用1 cm比色皿,以蒸馏水作为参比溶液,在430~570 nm之间以不同的波长每隔10 nm测定一次吸光度并记录数据,观察得出最大吸收波长.
1.4.2标准溶液曲线的绘制取6个50 mL容量瓶,分别准确移取10 μg/mL铁标准溶液0.0,2.0,4.0,6.0,8.0,10.0 mL于6个容量瓶中(其中不加铁的标准溶液作为空白溶液,用作参比溶液),然后各加入100 g/L盐酸羟胺溶液1 mL,摇匀,2 min后再依次加入5 mL 1 mol/L的NaAc溶液和3 mL 1 g/L的邻菲罗啉溶液,稀释至50 mL,摇匀,并静置10 min.以空白溶液作为参比溶液,用1 cm比色皿,在最大吸收波长处测定各溶液的吸光度并记录数据.
1.4.3硫酸亚铁的制备在硫酸亚铁的制备反应中,通过加入少量硫酸铜溶液来加快反应的进行.为探究加入硫酸铜的最佳浓度,以0.01 mol/L硫酸铜溶液为例,使用分液漏斗慢慢向盛有铁粉的锥形瓶中加入15 mL 3 mol/L的硫酸溶液和5 mL 0.01 mol/L的硫酸铜溶液,在75℃水浴中加热.在前25 min,每5 min用移液枪取30 μL上清液,稀释至250 mL,之后每隔15 min用移液枪取30 μL上清液,稀释至250 mL,取稀释后的待测液5 mL,加入100 g/L的盐酸羟胺溶液1 mL,摇匀,2 min后,再依次加入5 mL 1mol/L的NaAc和3 mL 1g/L的邻菲罗啉溶液,稀释至10 mL,放置10 min,以空白溶液为参比,用1 cm比色皿,在最大吸收波长处测定吸光度,记录数据.直至不再有大量气泡冒出,表明铁粉与硫酸反应基本完成.使用吸铁石吸附剩余铁粉并将溶液转移至蒸发皿中.计算参与反应的铁粉质量.按照同样方法,分别用0.020,0.015,0.005,0.0025 mol/L硫酸铜溶液以相同步骤进行实验,并记录数据.
1.4.4硫酸亚铁铵的制备由反应消耗铁粉的质量计算出所需硫酸铵的质量,准确称取硫酸铵固体,将其加入到已制备的硫酸亚铁溶液中,于水浴中加热,搅拌使其完全溶解,调节pH为1~2,进一步蒸发浓缩至溶液表面出现晶膜为止,从水浴锅中取出静置冷却,缓慢析出硫酸亚铁铵晶体.减压过滤得到晶体,并用少量无水乙醇洗涤,干燥称量,计算产率.
1.4.5Fe3+的限量分析称取1 g硫酸亚铁铵样品于比色管(25 mL)中,加入20 mL蒸馏水(去除氧)溶解,再加入1 mL 3 mol/L的H2SO4和1 mL 25%的KSCN溶液,最后再加入不含氧的蒸馏水至溶液25 mL,摇匀,将其与标准溶液进行目视比色,确定产品的等级.
2 结果与讨论
2.1 吸收曲线和标准曲线的绘制
以波长为横坐标,吸光度为纵坐标,绘制-吸收曲线(见图1),由吸收曲线确定Fe2+的最大吸收波长.由图1吸收曲线变化趋势可判断Fe2+的最大吸收波长在510 nm处,后续溶液吸光值均在此波长下测定.
以吸光度为横坐标,Fe2+质量浓度为纵坐标,绘制Fe2+的标准溶液曲线(-曲线,见图2).由图2可见,吸光度和质量浓度的标准曲线相关系数为0.999 96,达到精度要求.后续实验过程中待测液Fe2+质量浓度均由此标准曲线确定.

图1 Fe2+标准溶液吸收曲线

图2 Fe2+标准溶液含量曲线
2.2 催化剂对产率的影响
为确定反应过程中硫酸铜溶液的最佳用量,加入5 mL不同浓度的硫酸铜溶液,以反应时间为横坐标,Fe2+质量浓度为纵坐标,考察硫酸亚铁的制备过程中不同浓度的硫酸铜对Fe2+质量浓度的影响,将所得实验数据绘制成图3.由图3可见,加入不同浓度的硫酸铜溶液,对反应中间产物硫酸亚铁的产率有较大影响.尤其是反应20 min以后,当Cu2+浓度过低时,加入溶液后进一步稀释反应物浓度从而降低了Fe2+的质量浓度;随着Cu2+浓度的升高,产率的变化更加明显.硫酸铜浓度分别为0,0.01,0.005,0.0015 mol/L时,反应70 min时对应的反应中间体Fe2+的反应速率分别为1.99×10-4,2.27×10-4,2.36×10-4,2.13×10-4mol/(L·s).可以看出,硫酸铜浓度对反应中间体Fe2+的生成具有较大的促进作用,主要是由于浓度增加利于原电池反应,促进反应速率的提高,从而提高了硫酸亚铁的产率.而高浓度硫酸铜溶液的加入并不能加快反应速率,反而降低了反应速率.可能是浓度过高,盐效应的作用影响该反应过渡态的形成,不利于反应的进行.因此,当硫酸铜体积为5 mL,硫酸铜浓度为0.005 mol/L时,即硫酸铜的摩尔量为2.5×10-5mol时,催化反应效果最佳.
综合考虑浓度和体积对体系产率的影响,固定硫酸铜的摩尔量,进一步考察不同浓度和体积对Fe2+质量浓度的影响(见图4).由图4可见,固定硫酸铜的摩尔量为2.5×10-5mol,不同浓度的硫酸铜溶液对中间产物硫酸亚铁铵的生成仍有较大影响,在盐效应和浓度的双重影响下,当加入0.5 mL浓度为0.05 mol/L硫酸铜的时,对反应的促进效果最明显.

图3 硫酸铜摩尔浓度对反应的影响

图4 硫酸铜浓度和体积对反应的影响
2.3 温度对产率的影响
硫酸亚铁铵合成时,温度低影响反应速率,温度高造成硫酸亚铁的析出影响产率,因此为了考察温度对产率的影响,以反应时间为横坐标,Fe2+质量浓度为纵坐标,在不同温度下进行硫酸亚铁的制备过程中,将所得实验数据绘制成对比图(见图5),分析最佳温度.由图5可见,相同条件下,不同温度对反应中间产物硫酸亚铁的产率有影响.在25~40 min,温度为75℃时,Fe2+质量浓度较高,随着反应的进行,最后所得Fe2+质量浓度接近,当反应温度过高时,极易导致Fe2+的氧化反应进行,降低产物的纯度,因此综合考虑确定该反应的最佳温度为75℃,硫酸铜浓度为0.005 mol/L.

图5 不同温度下反应趋势
根据实验所得硫酸亚铁的量和化学计量式的关系计算所需的硫酸铵质量,称取定量硫酸铵加入硫酸亚铁溶液中,待其溶解,调节溶液pH,蒸发浓缩冷却后,抽滤晶体溶液得硫酸亚铁铵晶体.综合对比,采用原反应条件反应时间保持60 min时,硫酸亚铁铵产率最高,达85.83%;而采取最佳优化反应条件时,将反应时间保持40 min时,产率即高达88.67%,可见对反应条件改进后既减短了反应时间,也提高了产率.
2.4 产品组成和等级确定
2.4.1产品形貌和结构表征为进一步确认产物硫酸亚铁铵晶体的组成,对其进行XRD测试(见图6).将产物的XRD谱图与标准卡片进行比对,其衍射峰与标准XRD谱图(JCPDS-1-405)相吻合,确认其组分为硫酸亚铁铵,表明成功合成了硫酸亚铁铵晶体,且其具有较好的晶形结构.
为进一步了解硫酸亚铁铵的晶体形貌,将其进行SEM测试(见图7).由图7可见,使用硫酸铜催化剂制备的硫酸亚铁铵晶体形貌为均匀的八面体结构,边长约500 μm,颗粒大小均匀,体现了此方法的优势.
利用表征方法测定所得产品的结构和形貌,有利于提高学生对产品的组成和微观化学的了解,加深学生对实验操作的理解和认识.
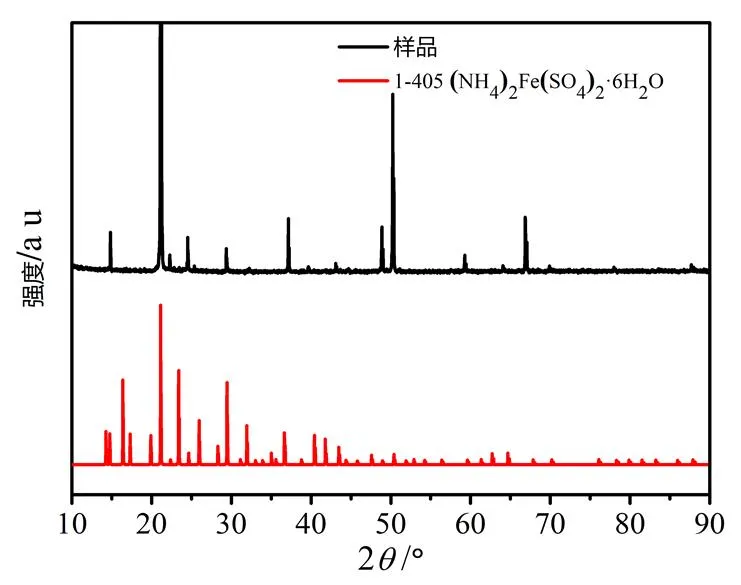
图6 硫酸亚铁铵的XRD

图7 硫酸亚铁铵扫描电镜
2.4.2催化剂对产品等级的影响取实验所得硫酸亚铁铵晶体1 g于25 mL比色管中,取15 mL不含氧的蒸馏水将其溶解,取3 mol/L H2SO41 mL和25% KSCN溶液1 mL,最后加入不含氧的蒸馏水稀释至25 mL,摇匀,使其与标准溶液进行目测比色[1]45,所得产品为一级,表明催化剂的加入可缩短反应所需的时间,减少Fe2+被氧化,体现催化剂对产品等级的有利影响.
3 结语
硫酸亚铁铵的合成实验主要面向化学相关专业大一本科生而开设的.合成过程根据以上优化条件可最终确定(1)将铁屑更改为铁粉;(2)硫酸亚铁合成过程中加入0.5 mL浓度为0.05 mol/L硫酸铜催化剂;(3)反应温度控制于75℃时产品收率最高;(4)生成硫酸亚铁后使用吸铁石吸附去除剩余铁粉,不需要减压抽滤.其中所涉及的仪器表征和分析环节可根据各学校自身条件进行适当增减.
综上所述,针对目前本科教学普遍使用的硫酸亚铁铵的制备方法中存在的问题进行一定的优化,采用铁粉代替铁屑,减少了有毒气体对环境的污染,使反应更加充分,缩短反应的时间;同时通过加入一定浓度的硫酸铜溶液,利用原电池原理提高中间产物硫酸亚铁的反应速率及产率,从而缩短反应时间,大大提高目标产物硫酸亚铁铵的产率.本实验的改进易于实验室的推广应用且通过对基础知识、技能及操作的综合运用,培养学生学以致用以及提出问题、解决问题的综合能力.本文对硫酸亚铁铵的高效绿色化合成具有一定的应用价值,对实验教学具有积极作用.
[1] 谢建梅,汤婷茜,高红艳,等.硫酸亚铁铵制备的最佳工艺研究[J].农产品加工,2019,6(12):44-46.
[2] 杜姣姣,杨国鑫,郑阿群,等.硫酸亚铁铵教学实验的改进[J].实验室研究与探索,2019,38(4):197-199,285.
[3] 王国清.无机化学[M].北京:中国医药科技出版社,2008.
[4] 董志强,吕银云,任艳平.对“硫酸亚铁铵制备”实验的再认识:批判性思维教育的最好案例之一[J].大学化学,2018,33(9):88−94.
[5] 李彩云.硫酸亚铁铵制备实验的模块化教学[J].实验室科学,2021,24(1):80-82,87.
[6] 张晔,曾云斌,李可新.硫酸亚铁铵制备材料的选择及反应时间的优化[J].赤峰学院学报,2020,36(2):48-50.
[7] 陶庭先.工科化学实验[M].北京:化学工业出版社,2015.
[8] 段辉,庄璐,陈云,等.硫酸亚铁铵制备实验教学方法的改进[J].实验室科学,2019,22(1):60-65.
[9] 蔡吉清,曾秀琼,徐孝菲,等.硫酸亚铁铵制备及测定实验的问题及对策研究[J].广东化工,2021,48(8):292-293.
Improving experiments of the preparation of ammonium ferrous sulfate
SHEN Fengcui,WANG Yuping,PENG Xin,CHEN Gang,LIU Qian
(School of Chemical and Environmental Engineering,Anhui Polytechnic University,Wuhu 241000,China)
An optimizedexperiment was introduced for the improvement of ammonium ferrous sulfate preparation.The yield and rate of the reaction are improved by adding a small amount of copper sulfate solution and utilizing the primary battery reaction formed during the reaction process solving the problems of low yield and poor grade of ammonium ferrous sulfate.The best reaction conditions were obtained on the basis of the effects of different concentrations ofcopper sulfate solution and temperatures on the rate and concentration of intermediates.Not only improves the yield and reduces the energy consumption,but also enables students to fully apprehend the influence of catalysts on chemical reactions and primary battery theory,strengthen students′ comprehensive application of theoretical knowledge,and improve students′ ability to analyze and solve problems through the effective improvement.
ammonium ferrous sulfate;copper sulphate;yield;improving experiment
1007-9831(2023)11-0101-05
O6-3∶G642.0
A
10.3969/j.issn.1007-9831.2023.11.020
2023-05-31
安徽省省级教学研究项目(2022jyxm124,2022jyxm136);安徽工程大学教学研究项目(2021jyxm13)
沈凤翠(1986-),女,安徽肥西人,副教授,博士,从事二氧化碳电还原、电解水等电极材料性能研究.Email:fcshen@ahpu.edu.cn
