高考滴定类试题的案例分析与解题思路
2023-12-19徐明利
徐明利


摘要:滴定实验是高考测试学生计算能力和解题能力的一个主要手段,是中学化学定量实验的主要内容.文章据此总结了滴定计算相关的各类题目,并对其解答方法进行了讨论.
关键词:滴定方法;高考试题;高中化学
中图分类号:G632文献标识码:A文章编号:1008-0333(2023)33-0102-04
滴定法是一种常用的化学分析手段,中学教材中对酸、碱的中和滴定法做了较多的论述,但是在目前的考试中,往往会出现其他几种形式的滴定,是对考生知识迁移能力的一种考核.近年来,通过研究高考考题类型与计算方面来看,滴定分析相关的题目比重较大,学生的失分也较多,滴定方法逐渐被教师与学生重视,是一项重要考核内容[1].为进一步加强对滴定法的理解,本文对该部分内容进行研究,为今后的考试提供参考,使学生更好地掌握知识.
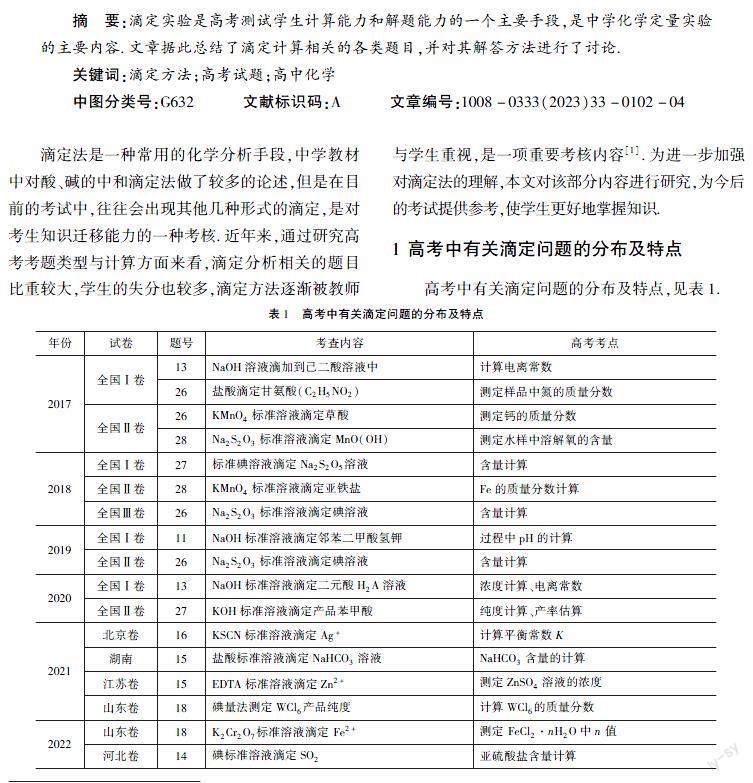
1 高考中有关滴定问题的分布及特点
高考中有关滴定问题的分布及特点,见表1.
2 滴定方法与例题解决
2.1 直接滴定
若标准溶液能与被测物质发生反应,则由测定标准液的用量来推算被测物质的量,称为直接滴定.例如,还原性物质S2-、S2O2-3、SO2-3等,可以通过滴定来实现.在滴定分析中,直接滴定法是最常见也是最基础的一种方法,其思维模式如图1所示.
例1称取混合碱(氢氧化钠和碳酸钠混合碱或碳酸钠和碳酸氢钠混合碱)试样1.2 g,用去离子水溶解后用0.5 mol/L的盐酸滴定至酚酞褪色,读取消耗的盐酸体积,即V1,V1=30.0 mL;接着添加甲基橙,持续滴加盐酸至颜色变为橙色,结束滴定并读取消耗的盐酸体积,即V2, V2=5.0 mL.问样品中的成分有哪些?计算其各自的质量分数?
分析
NaOH与NaHCO3不会同时存在,因为会发生反应.当酚酞变色时若有NaOH则已全部被中和,而Na2CO3只被滴定到NaHCO3.在此溶液中再加甲基橙指示剂,继续滴定到终点,则生成的NaHCO3进一步被反应完.设酚酞变色时,消耗HCl溶液的体积为V1,此后,至甲基变色时又用去HCl溶液的体积为V2.根据V1-V2来计算NaOH含量,再根据V2计算Na2CO3含量.
已知V1=30.0 mL,V2=5.0 mL,当滴定混合碱至酚酞变色的过程中发生的反应为:
NaOH+HClNaCl+H2O
Na2CO3+HClNaHCO3+NaCl
当继续滴定至甲基橙变色时此过程发生的反应为:
NaHCO3+HClNaCl+CO2+H2O
因此混合碱中碳酸钠的含量为22.1%,氢氧化钠的含量为41.7%.
2.2 间接滴定
间接滴定法是指待测样品无法直接与标准溶液发生反应,而能通过其他化学反应被间接测定.图2是具体的思维模式.
对于不能与待测物质直接反应的待测物质,可以采用其他化学方法进行测定.比如Ca2+在溶液中没有可变价态,不能直接用氧化还原法滴定.但若先将Ca2+沉淀为CaC2O4,过滤洗涤后用H2SO4溶解,再用KMnO4标准溶液滴定与Ca2+结合的C2O2-4,便可间接测定钙的含量.
2.3 返滴定
返回滴定法也叫“余量法”,还叫“返回滴定法”.在测定物与滴定液反应缓慢、反应物为固态或没有适当的指示物质等情况下,按一定的比例添加滴定液,也不会马上反应而结束[2],在此情况下,将多余的滴定液精确地添加到被测物质中,并与被测物质充分发生反应,在此基础上,将多余的滴定液用另外一种标准溶液进行滴定,即所謂的“返滴定法”.图3显示了思维模式.
比如,使用 EDTA标准液来对铝盐进行检测,因为Al3+与 EDTA的反应比较缓慢,需加过量的
EDTA并加热煮沸才能反应完成,将剩余EDTA用Zn2+标准液回滴,以此来确定铝含量.
3 滴定方法解题应用
通过对最近几年全国各地高考题的分析,可以看出,对于化学计量的考查,通常情况下,采用的是氧化还原滴定、酸碱中和滴定、沉淀滴定以及配位滴定的方法,在一次或多次的测量中,一次或者多次地完成测量,从而获得与之有关的数据[3].最为重要的是,要运用化学计量关系来对数据进行处理,从而获得正确的解决方案.在解决问题的时候,学生要理清实验思维,以物质的量为核心,用守恒法来确定各物质之间的测量关系,之后用化学符号来定量地将这种关系进行表达,从而得到待测物质的相关量.
3.1 氧化还原滴定题型中的应用
在中学化学的解题过程中,氧化还原反应是非常普遍的一种题型.在化学题目中,得到的电子的总数等于失去的电子的总数,这就是守恒法的运用形式和解题思路.运用守恒原理,可以对许多化学题目进行简单的解答,使学生理顺思维,从而使解题精度得到进一步的提升.
例2三草酸合铁酸钾(K3[Fe(C2O4)3]·3H2O)是一种深绿色的晶体,可作为干法蒸煮图纸的原料.测定K3[Fe(C2O4)3]·3H2O中铁含量如下:
①在锥形瓶子中称取试样,即mg,去离子水溶解,加入H2SO4酸化,用c mol·L-1的KMnO4溶液一直滴到反应结束.结束时现象为:最后一滴高锰酸钾溶液加入后,溶液呈淡红色,颜色持续30秒不褪色.
②向上述步骤中加入过量锌粉至反应完全后,过滤、洗涤,滤液加稀H2SO4酸化,用c mol·L-1的KMnO4溶液滴定至终点,读取消耗的KMnO4溶液,即V.则铁的质量分数表达式为:5cV×56m×1 000×100%.
例3如图4所示,C中盛有100 g原粮,E中盛有20.00 mL的1.13×10-3mol·L-1的KMnO4溶液(H2SO4酸化).请回答下列问题:
采集E内的吸收物,加入水,稀释到250 mL,取25.00 mL在锥形瓶中,将其余的KMnO4溶液用5.0×10-4mol·L-1的Na2SO3标准溶液进行滴定,数据见表2.
回答以下问题:①滴定终点现象是什么?
②数据处理:消耗Na2SO3标准溶液多少毫升;则该原粮中磷化物(以PH3计)的含量为多少毫克每千克?
解答①依据滴定反应:
2KMnO4+5Na2SO3+3H2SO4
2MnSO4+K2SO4+5Na2SO4+3H2O
实验无需选择指示剂,锥形瓶中溶液颜色由紫变为无色,半分钟内不变色,即为滴定终点.
②收集E中吸收液,加水稀释至250 mL,取25.00 mL于锥形瓶中用浓度为5×10-4 mol/L Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液11.00 mL;依据滴定反应:
2KMnO4+5Na2SO3+3H2SO4
2MnSO4+K2SO4+5Na2SO4+3H2O
可知2KMnO4~5Na2SO3;未反应的高锰酸钾物质的量为25×5×10-4×11.00×10-3×25025 =2.2×10-5 mol;与PH3反应的高锰酸钾物质的量为1.13×10-3×20.00×10-3-2.2×10-5 =6.0×10-7mol;根據反应
5PH3+8KMnO4+12H2SO4
5H3PO4+8MnSO4+4K2SO4+12H2O
得到定量关系为:
5PH3~8KMnO4
计算得到PH3物质量=6.0×10-7×58=3.75×10 -7mol;则PH3的含量=3.75×10-7×34×103 mg100×10-3 kg =0.127 5 mg/kg≈0.13 mg/kg,因此质量不合格.
3.2 沉淀滴定的应用
如确定生理盐水中的 NaCl含量:
在中性条件下,硝酸银盐与氯化钠发生化学反应,形成了一种砖红色的沉淀.化学方程式是:
NaCl+AgNO3AgCl↓(白色)+NaNO3
2AgNO3+K2CrO4Ag2CrO4↓(砖红色)+2KNO3
该方法需要在一种中性或弱碱(pH为6.5~10.5)条件下进行滴定,因为在酸中,铬酸银会溶解,使滴定的结果变得很高,同时在强碱中,银离子会形成深灰色的氧化银,从而对滴定及终点的判断造成很大的干扰.在滴定时,由于产生的氯化银可以吸附氯离子,会提前产生铬酸银的沉淀物,所以在滴定的时候,一定要大力摇动液体,促使吸收的氯离子发生反应,从而形成氯化银的沉淀物.
4 “滴定实验”命题相关思路
4.1 基本思路
(1)一个中心:
把“物质的量”作为中心,把“量”放在第一位,遇问设摩.
(2)两类方法:
①守恒方法:包括电子、原子、电荷等的获取;
②关系式法.
4.2 高考考查内容
(1)考仪器:
酸性滴定管、碱性滴定管、吸管、锥形瓶.
(2)考步骤:
检查渗漏、清洗、浸润、注入(驱除气泡)、调整液面、读数、滴加指示剂、滴定结束.
(3)考如何选用测验指标
①酸碱滴定:
指示剂的颜色变化范围尽可能与反应结束时的酸碱度相符合,以甲基橙为指示剂进行强酸、弱碱滴定,以酚酞为指示剂进行强碱、弱酸滴定,以酚酞或甲基橙进行强酸、强碱滴定.
②淀粉:
与碘素元素的测定有关.
③如果反应自身变色比较显著,可以不加入指示物质,例如,高锰酸钾和草酸的反应.
(4)考滴定结束的判定
即:在将一滴xx溶液放入液体中时,液体将由xx颜色变成 xx颜色,在此过程中,液体的颜色将在30秒内保持不变.
(5)考运算(困难)
思路就像图5所示一样,按照方程→寻找关系(方程度量关系/得失电子守恒/原子守恒)公式来进行计算.
特殊说明:在被测定的溶液被稀释之前,能否进行定量?单位是否换算?等
(6)考误差分析:
cB=cA·VAVB (VB为被测液体的精确计量容积, cA为被测液体的浓度),如果VA偏大, cB就会偏大;如果VA偏小,则 cB偏小.
需要说明的是:这些误差主要来自于滴定管中的液体(可以是标准液,也可以是待测液)的体积变化,要先对滴定管中的液体用量发生的变化进行分析,然后以此为基础,对误差进行分析.
参考文献:
[1] 张英锋,于浩.新高考形势下化学实验试题的分析及备考策略[J].高中数理化,2022(11):110-114.
[2] 安金利,韩晓雨.应用化学计量解决滴定实验中的实际问题[J].高中数理化,2022(16):3.
[3] 黄小斌.指向学科核心素养的生物高考试题分析与备考策略[J].基础教育研究,2021(13):87-90.
[责任编辑:季春阳]
