基于液相色谱-同位素稀释质谱法测定氨基酸的蛋白质定量方法
2023-12-15李永利高艳秋薛民杰郝玉红
李永利,高艳秋,薛民杰,郝玉红,李 杰
(上海市计量测试技术研究院,上海市在线检测与控制技术重点实验室,上海 201203)
蛋白质是生命体实现生理功能的直接参与者,因此研究生命体蛋白质表达模式和功能作用不仅局限于蛋白质的定性分析,临床检测、食品分析等领域对蛋白质的定量测量需求越来越强烈。常用的蛋白质定量测量方法主要有电泳法[1]、免疫法[2-3]、高效液相色谱[4]和液相色谱-质谱联用法[5]等,随着质谱分析技术的发展,被认为是小分子定量金标准的同位素稀释质谱法[6-7]应用于蛋白质定量测量中,展现了准确、精密、易于溯源等特点[8-9]。
基于同位素稀释质谱法的蛋白质定量技术,可以将蛋白质酶解成肽段后测定特征肽段进行定量,也可以将蛋白质完全水解成游离氨基酸后,测定各氨基酸含量,再根据蛋白质的氨基酸序列信息,由氨基酸含量计算得到蛋白质含量。基于肽段的定量方法具有更好的特异性,但需要设计酶解方案、合成标记的特征肽段,难以建立具有普适性的定量方法;基于氨基酸的定量方法,不仅需要获得准确的氨基酸序列信息,而且为了避免游离氨基酸和杂质蛋白、肽段水解产生氨基酸对测量结果的干扰,需要预先提纯蛋白质,但该方法易于建立测量结果的计量溯源性,实现对蛋白质的绝对定量,且可以建立适用于不同蛋白质的样品处理和仪器分析方法,和传统氨基酸分析法相比操作简单、准确度和精密度高[8],和基于肽段的定量方法相比通用性更强,因此应用于蛋白质含量测定国际比对[10]、蛋白质标准物质研制[11-12]和临床诊断中各种蛋白质分析的校准[13-14],建立蛋白质分析的计量溯源性。
本研究采用蛋白质水解后以同位素稀释质谱法测定氨基酸含量的方式,建立可用于多种蛋白质的高准确度定量方法,方法精密、灵敏,结果可溯源至国际基本单位,可应用于蛋白质绝对定量和蛋白质标准物质研制。
1 实验部分
1.1 仪器与试剂
超高效液相色谱-三重四极杆串联质谱仪:Acquity UPLC I-Class Plus/XEVO TQ-XS型,美国Waters公司;电子天平:XPE105型,瑞士Mettler Toledo公司;超纯水仪:Milli-Q型,德国Merck公司;水燃料氢氧机:OH200型,湖南沃克能源科技有限公司;强制对流烘箱:FD115型,德国Binder公司;冷冻干燥机:L-200型,瑞士Buchi公司。
GBW(E)100084脯氨酸纯度标准物质(Pro,99.0±1.5%,k=2)、GBW09236 L-缬氨酸纯度标准物质(Val,99.4%,Ur=0.6%,k=2)、GBW09237 L-亮氨酸纯度标准物质(Leu,99.7%,Ur=0.4%,k=2)、GBW09238 L-异亮氨酸纯度标准物质(Ile,99.7%,Ur=0.3%,k=2)、GBW(E)100061苯丙氨酸纯度标准物质(Phe,99.0±1.5,k=2)等20种天然氨基酸纯度标准物质和GBW(E)091110 新型冠状病毒核衣壳蛋白(N蛋白)人源IgG单克隆抗体溶液标准物质(85.3±8.5 μg/g):中国计量科学研究院;Pro-13C5、Val-13C5、Leu-13C615N、Ile-13C6、Phe-13C9:纯度>98%,丰度>99 atom%,美国CIL公司;甲酸、乙腈:质谱纯,德国Merck公司;全氟戊酸:纯度>97%,德国Merck公司。
1.2 标准溶液的配制
1.2.1氨基酸标准储备液 为了获得更高准确度的定量结果,采用重量法配制标准溶液。分别称取Pro、Val、Leu、Ile、Phe标准物质约10 mg至不同的10 mL容量瓶中,用水溶解并稀释至刻度,称量并记录溶液总重,得浓度约为1 000 μg/g的氨基酸标准储备液。
1.2.2氨基酸混合标准中间液 分别称取Pro、Val、Leu、Ile、Phe储备液适量至10 mL容量瓶中,用水溶解并稀释至刻度,称量并记录溶液总重,得氨基酸混合标准中间液。
1.2.3内标物标准储备液 分别称取Pro-13C5、Val-13C5、Leu-13C615N、Ile-13C6、Phe-13C9约10 mg至不同的10 mL容量瓶中,用水溶解并稀释至刻度,称量并记录溶液总重,得浓度约为1 000 μg/g的内标物标准储备液。
1.2.4内标物混合标准中间液 分别称取Pro-13C5、Val-13C5、Leu-13C615N、Ile-13C6、Phe-13C9储备液适量至10 mL容量瓶中,用水溶解并稀释至刻度,称量并记录溶液总重,得内标物混合标准中间液。
1.2.5标准工作液 分别移取氨基酸混合标准中间液、内标物混合标准中间液9 μL、10 μL至样品瓶中并准确称重,冷冻干燥至干后用0.1%甲酸水溶液500 μL复溶,得低浓度标准工作液。
分别移取氨基酸混合标准中间液、内标物混合标准中间液11 μL、10 μL至样品瓶中并准确称重,冷冻干燥至干后用0.1%甲酸水溶液500 μL复溶,得高浓度标准工作液。
1.3 仪器分析条件
1.3.1色谱条件 Hypercarb多孔石墨碳色谱柱(100×2.1 mm,3 μm);柱温40 ℃;流动相:A为0.1%(体积分数,下同)全氟戊酸水溶液,B相为乙腈;梯度洗脱:0~5 min使流动相A由100%降至90%,5~10 min使流动相A由90%降至0%后保持至11.5 min,再将流动相恢复至初始比例平衡1.5 min;流速:0.3 mL/min;进样量:2 μL。
1.3.2质谱条件 电喷雾正离子源(ESI+),毛细管电压3.0 kV,离子源温度,150 ℃,脱溶剂气流速1 000 L/h,脱溶剂气温度500 ℃,锥孔气流速150 L/h,碰撞气为氩气,多反应监测(MRM)模式。其他质谱条件列于表1,其中*为定量离子。

表1 氨基酸分析质谱参数Table 1 MS parameters for amino acids
1.4 蛋白质的水解
准确称取适量样品至清洗干净的2 mL棕色安瓿瓶,再移入内标物混合标准中间液10 μL并准确称重,加入6 mol/L的盐酸水溶液600 μL,通氮气1 min后融封,在130 ℃烘箱中水解15 h。水解后冷冻干燥至干,用0.1%甲酸水溶液500 μL复溶,进LC-MS/MS分析。
1.5 蛋白质含量计算
采用括号法测定各氨基酸含量,即以低浓度标准工作液-样品-高浓度标准工作液-样品-低浓度标准工作液进样测试,按公式(1)分别由各氨基酸含量计算蛋白质含量:
(1)
式中,Cx为由某氨基酸计算得到的蛋白质浓度,μg/g;Rs、Rl、Rh分别为样品、低浓度和高浓度标准工作液中氨基酸和内标物的峰面积比;mSTDl、mIl和mSTDh、mIh分别为低浓度和高浓度标准工作液配制时加入氨基酸混合标准中间液、内标物混合标准中间液的质量,mg;cSTD为混合标准中间液某氨基酸的浓度,μg/g;mSI为蛋白质水解前加入内标物混合标准中间液的质量,mg;ms为样品质量,mg;n为蛋白质中某氨基酸的数量;MAA、MN分别为某氨基酸、蛋白质的摩尔质量,g/mol。
各氨基酸含量计算得到的蛋白质量分数结果,经正态性检验、一致性和等精度检验后的算术平均值或加权算数平均值即为蛋白质含量结果。
2 结果与讨论
2.1 质谱条件优化
用0.1%甲酸水溶液分别配制浓度为100 ng/mL的20种天然氨基酸标准溶液和内标溶液,以连续流直接进样的方式注入质谱仪中进行全扫描,以响应最高的准分子离子峰质荷比作为母离子,优化锥孔电压等各质谱参数使母离子信号强度最高。再对母离子分别进行子离子扫描,选择信号强度最高且稳定的离子对作为定量离子对和定性离子对,优化碰撞能量使子离子信号强度最高。优选的质谱条件和特征离子对列于表1。
2.2 色谱条件优化
由于氨基酸极性较强,C18色谱柱上不易保留,分离效果不佳,常通过柱前衍生[15]降低极性或者使用亲水作用(Hilic)色谱柱[16]改善分离,但分析效率和分离效果难以满足蛋白质定量分析的要求。本研究结合多孔石墨化碳填料(Hypercarb)和挥发性离子对试剂,高效、准确、精密的实现了20种天然氨基酸的分离分析(丙氨酸、精氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酰胺、谷氨酸、甘氨酸、组氨酸、异亮氨酸、亮氨酸、赖氨酸、甲硫氨酸(蛋氨酸、苯丙氨酸、脯氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸、缬氨酸),除His、Arg、Trp外绝大多数氨基酸峰型对称、尖锐,质谱响应灵敏。
2.3 定量氨基酸选择
由单一氨基酸含量计算蛋白质含量结果,因受蛋白质纯度、水解过程、测量误差等众多因素影响,难以保证准确度。而由多个氨基酸含量统计计算的蛋白质含量,可以降低杂蛋白、氨基酸水解差异和偶然因素引入的误差,获得更为准确的蛋白质定量结果。但实验表明,经过1.4节的水解步骤后,Ser、Thr、Cys、Asn、Gln、Glu、Met、Tyr、Trp等氨基酸会发生不同程度的降解。因此综合考虑各天然氨基酸的耐酸性、热稳定性和所建立定量分析条件下的准确性、精密度,结合蛋白质中氨基酸的含量差异,选择Pro、Val、Leu、Ile、Phe作为定量蛋白质的氨基酸。
2.4 水解条件优化
水解条件优化结果示于图1。水解需要在保证氨基酸未被降解的前提下尽可能将蛋白质完全转化成游离氨基酸,而水解效率受水解试剂和浓度、水解温度、水解时间等因素影响,因此,本研究使用肌红蛋白(Mb)、人血清白蛋白(HSA)和C-反应蛋白(CRP)优化水解条件。

a——盐酸浓度; b——水解温度; c——水解时间
蛋白质水解方法主要有酸水解、碱水解、酶水解和微波消解等,碱水解容易使部分氨基酸消旋化,酶水解往往需要较长的时间,酸水解通用、高效的特点使其成为采用较多的水解方法[17]。酸水解最常用的水解试剂是盐酸和甲磺酸,因为甲磺酸难易挥发,水解后难以去除,会干扰质谱检测,因此选择盐酸作为水解试剂。通过对不同浓度的盐酸考察表明,浓度小于4 mol/L水解效率不足,浓度大于6 mol/L水解后氨基酸含量基本一致(图1a);通过对不同水解温度的考察表明,高于100 ℃的水解温度可以显著提升水解效率,130 ℃ 和150 ℃水解后氨基酸含量没有显著差异(图2a);通过对水解时间的考察表明,3种蛋白质水解15 h后氨基酸含量没有显著增加(图3a)。因此,以6 mol/L的盐酸水溶液作为水解试剂、通氮气融封后在130 ℃水解15 h是优选的水解条件。

图2 新冠病毒N蛋白测定的总离子流图Fig.2 Total ion chromatogram of COVID-19 N protein determination
2.5 线性范围和检出限
分别移取一定量的 Pro、Val、Leu、Ile、Phe和Pro-13C5、Val-13C5、Leu-13C615N、Ile-13C6、Phe-13C9储备液,配制氨基酸浓度为10、20、50、100、200、500、1 000 ng/mL,内标浓度为100 ng/mL的标准系列工作液。经LC-MS/MS分析后,以氨基酸和相应内标的浓度比为横坐标、峰面积比为纵坐标,绘制回归方程,分别以信噪比3和10计算检出限和定量限,结果列于表2。5种氨基酸在10~1 000 ng/mL范围内线性关系良好,线性相关系数均大于0.995,检出限范围为0.02~0.07 ng/mL,定量限范围为0.06~0.2 ng/mL。
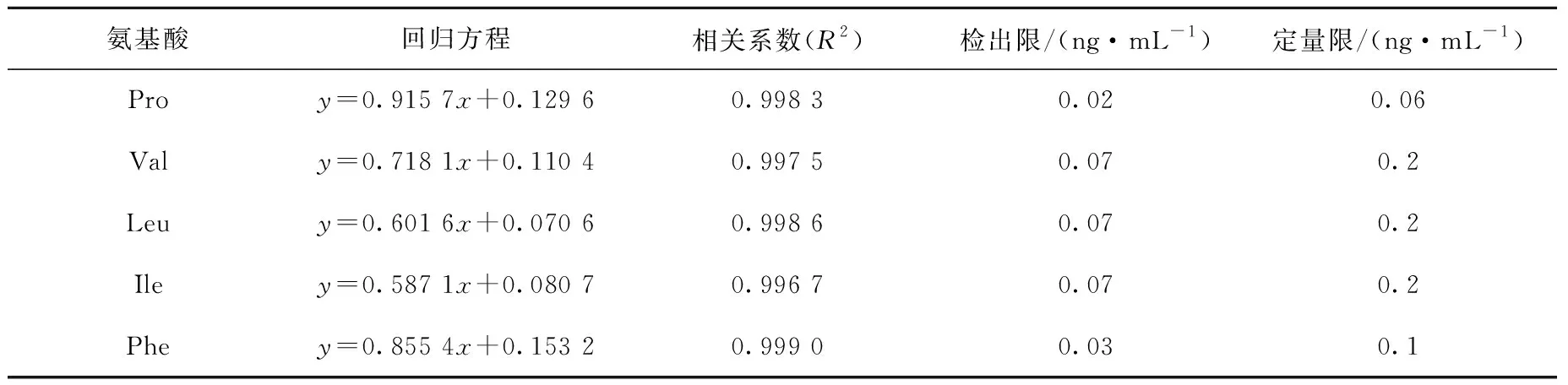
表2 5种氨基酸的回归方程、相关系数、检出限、定量限Table 2 Regression equation, correlation coefficient, LOD and LOQ of 5 amino acids
2.6 回收率和精密度
称取适量标准中间液,加入棕色安瓿瓶的5种氨基酸质量分别为25 ng、50 ng和100 ng,按1.4节步骤处理,每个水平平行处理3份。经LC-MS/MS分析后,结果表明,3个不同质量水平下5种氨基酸的回收率在97.0%~102.4%之间,相对标准偏差在1.1%~3.0%之间。
2.7 检测应用
新冠病毒N蛋白测定的总离子流图示于图2。采用本研究所建立的方法,测定GBW(E)091110 新型冠状病毒核衣壳蛋白(N蛋白)人源IgG单克隆抗体溶液标准物质的含量,由Val、Leu、Ile、Phe测得含量计算的抗体浓度分别为82.30、84.60、84.10、85.10 μg/g,4种氨基酸含量计算的抗体浓度符合正态分布,且结果一致、等精度,因此抗体浓度为84.0 μg/g。测定结果在标准物质证书给出的标准值(85.3±8.5) μg/g范围内,En值0.14<1,表明测定结果与标准物质的标准值相一致。
采用本研究所建立的方法,参加了“新冠病毒N蛋白同位素稀释质谱法测量能力”国家计量比对,测量结果与主导实验室等效一致,比对结果符合要求。
3 小结
本研究采用同位素稀释质谱法建立了20种天然氨基酸的分析方法,通过对蛋白质水解液中5种氨基酸准确、精密、灵敏的定量分析,实现了高准确度的蛋白质定量测量,测量结果可溯源至国际基本单位。该方法测量新冠病毒N蛋白人源IgG单克隆抗体有证标准物质的结果与标准值一致,采用该方法参加新冠病毒N蛋白国家计量比对的测量结果满意,证明该方法对多种不同蛋白含量测定均具有足够的准确性,可作为通用方法应用于蛋白质标准物质的研制和临床诊断、食品安全中各种蛋白质分析的校准,建立蛋白质分析的计量溯源性。
