锝[99mTc]亚甲基二膦酸盐注射液中放化纯度薄层色谱分析方法的建立
2023-12-15崔晓艳
王 勇,梁 塑,崔晓艳,姜 华,张 云,杨 柳
(原子高科股份有限公司,北京 102413)
锝[99mTc]亚甲基二膦酸盐注射液(以下简称99mTc-MDP注射液)是较理想的骨显像剂,用于早期诊断恶性转移性骨肿瘤和原发性骨肿瘤,对移植骨的存活监测、诊断外伤性骨折、骨骼炎症和代谢性骨病等均有重要价值[1-3]。放化纯度是99mTc-MDP注射液的有效性控制指标之一[4],其高低决定了临床诊断效果。影响放化纯度的主要因素是放射性化学杂质的含量。注射用亚锡亚甲基二膦酸盐(以下简称MDP药盒)的一般组成为亚甲基二膦酸、还原剂(氯化亚锡/氟化亚锡等)、抗氧化剂(维生素C等)和pH调节剂等。MDP药盒的99mTc标记原理为:高锝[99mTc]酸盐被还原剂由Ⅶ价态还原到Ⅳ价态[5],与过量的亚甲基二膦酸发生络合反应,室温静置一定时间,确保络合反应充分进行。在标记过程中,还原剂不足的情况下,高锝[99mTc]酸盐不能被完全还原,则可能存在的放射性化学杂质为游离高锝[99mTc]酸盐,可致血液本底增高,并可能在甲状腺胃黏膜等脏器中浓集;在还原剂足量的情况下,高锝[99mTc]酸盐被还原,但未完全与亚甲基二膦酸发生络合反应,则可能存在还原水解锝[99mTc](以下简称胶体锝[99mTc])放射性化学杂质,可分布在肝皮部位。另外,刘国正等[6]在1999年报道,在亚锡还原条件下,当pH<9时,维生素C与高锝[99mTc]酸盐可能会形成五价配合物。放射性化学杂质的存在影响着药物的体内分布和代谢,为了保证药物诊断的有效性以及患者用药的安全性,须严格对其放射性化学杂质高锝[99mTc]酸盐、胶体锝[99mTc]、可能存在的锝[99mTc]维生素C络合物进行控制[7-8]。因此,拟建立的放化纯度分析方法应具有较好的专属性,能实现99mTc-MDP注射液中放射性主峰锝[99mTc]亚甲基二膦酸盐与各放射性化学杂质的有效分离。
对于99mTc-MDP注射液放化纯度的控制,《中国药典》2020年版(ChP2020)、《美国药典》42-NF37版(USP42-NF37)和《欧洲药典》10.0版(EP10.0)均采用双体系的分析方法。EP10.0采用薄层色谱法,iTLC-SG色谱纸作为固定相、1 mol/L的醋酸钠溶液和2-丁酮分别为体系一和体系二的展开剂。ChP2020和USP42-NF37均采用纸色谱法,氯化钠注射液(0.90%氯化钠溶液)和85%甲醇分别为体系一和体系二的展开剂。国内外药典方法均为双体系的分析方法,并且ChP2020和USP42-NF37中的体系一要求在充氮条件下进行,导致实验过程耗时且繁琐。基于此,本研究主要从筛选固定相和展开剂入手,开发一种专属性强、操作简便的分析方法,用于测定99mTc-MDP注射液的放化纯度,并开展线性、耐用性、精密度等实验,对建立的分析方法进行验证。
1 实验设备与材料
1.1 主要仪器
AR-2000放射性薄层扫描仪:美国BIOSCAN公司;XPR205/A电子天平:梅特勒-托利多国际贸易(上海)有限公司;CRC-55tR活度计:美国CAPINTEC公司。
1.2 主要试剂和耗材
氯化钠注射液:石家庄四药有限公司;氯化钠淋洗液、高锝[99mTc]酸钠注射液、锝[99mTc]亚甲基二膦酸盐注射液:原子高科股份有限公司;醋酸钠、盐酸、氢氧化钠、氯化亚锡(SnCl2·2H2O)、甲醇、2-丁酮、维生素C:分析纯,国药集团化学试剂有限公司;水:自制二次蒸馏水。
聚酰胺-6薄层板:浙江省台州市路桥四甲生化塑料厂;Whatman No.1层析纸:英国Whatman公司;iTLC-SG色谱纸:美国Agilent公司;硅胶G薄层板:MACHEREY-NAGEL公司。
MDP标准药盒:波兰POLATOM公司。
2 实验方法
2.1 溶液的制备
2.1.1供试品溶液(99mTc-MDP注射液) 按高锝[99mTc]酸钠注射液的放射性浓度,取4~6 mL注入MDP药盒中,充分振摇,使药盒完全溶解,静置反应5 min以上,即得含锝[99mTc]亚甲基二膦酸盐的供试品溶液。
2.1.2参考溶液 向一瓶MDP标准药盒中加入2 mL含100~400 MBq的高锝[99mTc]酸钠注射液,摇匀,静置反应约15 min,即得含锝[99mTc]亚甲基二膦酸盐的参考溶液。
2.1.3测试溶液1 取高锝[99mTc]酸钠注射液适量,作为含高锝[99mTc]酸盐的测试溶液1。
2.1.4测试溶液2 准确称取10 mg的SnCl2·2H2O于西林瓶内,加入0.1 mL高锝[99mTc]酸钠注射液,摇匀,静置反应约15 min,即得含胶体锝[99mTc]的测试溶液2。
2.1.5测试溶液3 在10.0 g/L维生素C的10 mL溶液中用微量进样器加入10.0 g/L SnCl2·2H2O溶液0.010 mL,用盐酸或氢氧化钠溶液调pH为8.0。取出1 mL,用注射器加入少量高锝[99mTc]酸钠注射液,充分振摇,静置反应5 min以上,即得含维生素C与高锝[99mTc]酸盐形成的五价配合物溶液[6]。
2.2 放化纯度分析方法的建立
使用玻璃毛细管或微量进样器取供试品溶液适量,点于固定相一端原点处,晾干,将固定相放入盛有展开剂的层析缸展开,待展开至溶剂前沿10 cm时,将固定相取出,晾干。测试溶液1、测试溶液2按照上述相同的分析方法进行实验。之后置于放射性薄层扫描仪上扫描,记录色谱图,观察供试品溶液中锝[99mTc]亚甲基二膦酸盐的峰形以及与测试溶液1中高锝[99mTc]酸盐、测试溶液2中胶体锝[99mTc]之间的分离度R(计算如公式(1))。并根据锝[99mTc]亚甲基二膦酸盐峰形和R值选择合适的条件。
R=2×(d2-d1)/(W1+W2)
(1)
式中:d2为相邻两峰中后一峰与原点的距离,mm;d1为相邻两峰中前一峰与原点的距离,mm;W1和W2为相邻两峰各自的峰宽,mm。
2.2.1固定相优化
(1) 以ChP2020和USP42-NF37收录的分析方法中0.90%氯化钠溶液和85%甲醇分别作为体系一和体系二的展开剂,固定相分别为聚酰胺-6薄层板、Whatman No.1色层纸、硅胶G板和iTLC-SG色谱纸。考察不同条件下锝[99mTc]亚甲基二膦酸盐峰形和R值。
(2) 以EP10.0收录的分析方法中1 mol/L醋酸钠溶液和2-丁酮分别作为体系一和体系二的展开剂,固定相分别为聚酰胺-6薄层板、Whatman No.1色层纸、硅胶G板和iTLC-SG色谱纸。考察不同条件下锝[99mTc]亚甲基二膦酸盐峰形和R值。
2.2.2展开剂优化 ChP2020、USP42-NF37和EP10.0收录的分析方法中体系二展开剂为85%甲醇或2-丁酮,对放射性杂质高锝[99mTc]酸盐的分离效果几乎无差别。故对于展开剂的优化实验主要针对体系一(即水相)进行,分别以0.90%氯化钠溶液和1 mol/L醋酸钠溶液为展开剂初设条件,以2.2.1节中最佳固定相为该部分实验的固定相,设计以下两组实验。
(1) 展开剂分别为0.45%氯化钠溶液、0.90%氯化钠溶液、2.00%氯化钠溶液、0.90%氯化钠溶液(醋酸调pH为3.0)、0.90%氯化钠溶液(醋酸调pH为10.0),考察不同条件下锝[99mTc]亚甲基二膦酸盐峰形和R值。
(2) 展开剂分别为1 mol/L醋酸钠溶液、V(1 mol/L醋酸钠溶液)∶V(0.1 mol/L醋酸溶液)=1∶1、V(1 mol/L醋酸钠溶液)∶V(1 mol/L盐酸溶液)=1∶1、V(1 mol/L醋酸钠溶液)∶V(0.5 mol/L盐酸溶液)=1∶1、V(1 mol/L醋酸钠溶液)∶V(0.1 mol/L盐酸溶液)=1∶1、V(1 mol/L醋酸钠溶液)∶V(0.05 mol/L盐酸溶液)=1∶1,考察不同条件下锝[99mTc]亚甲基二膦酸盐峰形和R值。
2.2.3分析方法专属性 供试品溶液、参考溶液、测试溶液1、测试溶液2和测试溶液3按照2.2节中描述的分析方法进行实验。之后置于放射性薄层扫描仪上扫描,记录色谱图,观察供试品溶液和参考溶液中锝[99mTc]亚甲基二膦酸盐峰形以及与测试溶液1中高锝[99mTc]酸盐、测试溶液2中胶体锝[99mTc]、测试溶液3中锝[99mTc]维生素C络合物之间的分离度R,供试品溶液与参考溶液的锝[99mTc]亚甲基二膦酸盐放射性主峰峰形和Rf值应一致,供试品溶液的锝[99mTc]亚甲基二膦酸盐放射性主峰与各放射性化学杂质峰的分离度R应大于1.0。
2.3 放化纯度分析方法的验证
按照ChP2020收录的《9101分析方法验证指导原则》[9]以及ICH指导原则《Q2(R1):分析方法论证:正文和方法学》的相关要求,对拟定分析方法进行线性及范围、耐用性和精密度等项目的验证。
2.3.1线性及范围 取一批次99mTc-MDP注射液作为线性母液,其放射性浓度为21.2 mCi/mL,用微量注射器精密移取一定活度的99mTc-MDP注射液(放射性活度分别为1.06、2.12、5.3、10.6、15.9、21.2、31.8、42.4 μCi)作为线性点点样于固定相上;然后再精密量取一定量的线性母液,用氯化钠注射液稀释至放射性浓度为0.54 mCi/mL,用微量注射器精密移取一定活度的99mTc-MDP注射液(放射性活度分别为0.027、0.054、0.135、0.27、0.405、0.54、0.81、1.08 μCi)作为线性点点样于固定相上。晾干后,置于放射性薄层扫描仪上,测定并记录放射性计数。考察放射性计数与放射性活度成比例关系的能力,并确定分析方法的测量范围。
2.3.2耐用性 分别考察不同批次的固定相、实验室环境温度(10~30 ℃)、不同体积配比展开剂对99mTc-MDP注射液放化纯度测定的影响。在以上条件下放化纯度测定结果相对误差应≤2.0%,分析条件的微小改变应对99mTc-MDP注射液放化纯度测定无明显影响。
2.3.3中间精密度 两名实验人员对同一批次99mTc-MDP注射液进行放化纯度分析。供试品溶液展开晾干后置于放射性薄层扫描仪上测定;按照上述方法,每名实验人员各平行实验6次,共计12次放化纯度测试结果,计算相对标准偏差,得到中间精密度,合格限度应≤2.0%。
2.3.4分析方法的比对 使用拟定分析方法与EP10.0[10]、ChP2020[11]和USP42-NF37[12]收录的分析方法对至少三批次99mTc-MDP注射液的放化纯度进行比对测定,测定结果的相对误差应≤2.0%。
3 结果与讨论
3.1 放化纯度分析方法的建立
3.1.1固定相优化 以0.9%氯化钠溶液和85%甲醇分别作为展开体系一和体系二的展开剂,对固定相优化后的结果列于表1;以1 mol/L醋酸钠溶液和2-丁酮分别作为展开体系一和体系二的展开剂,对固定相优化后的结果列于表2。

表2 固定相优化实验分析结果(2)Table 2 Analysis results in optimized experiment of stationary phases (2)
从表1和表2可以看出,两组实验中固定相为iTLC-SG色谱纸、硅胶G薄层板、Whatman No.1色层纸时,展开体系一或体系二存在锝[99mTc]亚甲基二膦酸盐(简称99mTc-MDP)放射性主峰拖尾、放射性主峰与放射性化学杂质峰无法分离或分离效果差等情况;而固定相为聚酰胺-6薄层板,0.90%氯化钠溶液或1 mol/L醋酸钠溶液为展开剂时,99mTc-MDP放射性主峰均有拖尾现象,但实现了单体系展开条件下将放射性主峰与各放射性化学杂质峰的有效分离。考虑99mTc-MDP注射液为短半衰期药物,单体系展开条件可以更快得到放化纯度检验结果,更有利于产品的放行检验。故确定分析方法为单体系,固定相为聚酰胺-6薄层板。
3.1.2展开剂优化 以聚酰胺-6薄层板为固定相,对展开剂进行优化的结果列于表3。从表3的分析结果可以看出,以0.90%氯化钠溶液或1 mol/L醋酸钠溶液为展开剂,均能实现锝[99mTc]亚甲基二膦酸盐放射性主峰与各放射性化学杂质峰的分离;以0.90%氯化钠溶液为初设展开剂进行优化,改变氯化钠的质量分数、使用醋酸调节展开剂的酸碱度,对99mTc-MDP注射液中锝[99mTc]亚甲基二膦酸盐放射性主峰拖尾情况的改善程度不明显;以1 mol/L醋酸钠溶液为初设展开剂进行优化,其中展开剂为1 mol/L醋酸钠溶液与0.1 mol/L醋酸溶液等体积混合时,放射性主峰拖尾情况也未得到改善;当展开剂为1 mol/L醋酸钠溶液与不同浓度的盐酸溶液等体积混合时,放射性主峰拖尾程度变轻,得到了明显的改善;尤其是盐酸溶液浓度为0.1 mol/L时,效果最佳,放射性主峰与各放射性化学杂质的分离度>1.0,放射性主峰拖尾程度进一步得到了改善,峰形良好。

表3 展开剂优化实验分析结果Table 3 Analysis results in optimized experiment of developing solvent
3.1.3分析方法专属性 通过固定相和展开剂的优化筛选实验,拟定分析方法为:固定相为聚酰胺-6薄层板,展开剂为V(1 mol/L醋酸钠溶液)∶V(0.1 mol/L盐酸溶液)=1∶1。使用玻璃毛细管或微量进样器取供试品溶液适量,点于固定相一端原点处,晾干,将聚酰胺-6薄层板放入盛有V(1 mol/L醋酸钠溶液):V(0.1 mol/L 盐酸溶液)=1∶1的溶液的层析缸展开,待展开至溶剂前沿10 cm时,将固定相取出,晾干;参考溶液、测试溶液1、测试溶液2和测试溶液3按照上述相同的分析方法进行实验。之后置于放射性薄层扫描仪上扫描,各色谱图示于图1。图1a和图1b可以看出,供试品溶液和参考溶液色谱图中锝[99mTc]亚甲基二膦酸盐峰的峰形良好且几乎一致,Rf均约为1.0。从图1c、图1d和图1e可以看出,测试溶液1中高锝[99mTc]酸盐、测试溶液2中胶体锝[99mTc]、测试溶液3中锝[99mTc]维生素C络合物的Rf约为0。通过公式(1)计算出供试品溶液的锝[99mTc]亚甲基二膦酸盐放射性主峰与各放射性化学杂质峰的分离度R均大于1.0,满足要求。

a——供试品溶液; b——参考溶液; c——测试溶液1; d——测试溶液2; e——测试溶液3
3.2 放化纯度分析方法的验证
3.2.1线性及范围 放射性计数与放射性活度的线性关系示于图2。由图2可知,当99mTc-MDP注射液的放射性活度在0.027~42.4 μCi范围内时,99mTc-MDP注射液的放射性计数与放射性活度成线性关系,线性方程为y=8 791.451 15x+4 579.041 87,相关系数r=0.997,满足r≥0.990的要求。
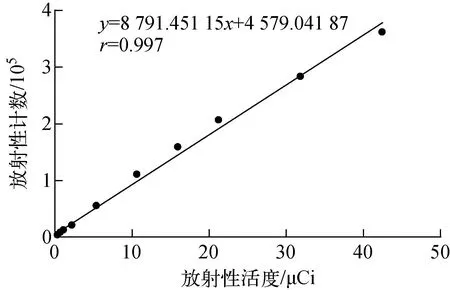
图2 放射性计数与放射性活度的线性关系Fig.2 The linear relation of the radioactivity counts to the radioactivity
3.2.2耐用性 取不同批次聚酰胺-6薄层板按照拟定分析方法进行实验,放化纯度测定结果间的相对误差为0.33%。在不同温度实验条件下,10 ℃和30 ℃展开时与室温25 ℃展开时测定的放化纯度结果的相对误差分别为0.45%和0.94%。展开剂体积配比为V(1 mol/L醋酸钠溶液)∶V(0.1 mol/L 盐酸溶液)分别为0.8∶1(V/V)、0.9∶1(V/V)、1.1∶1(V/V)、1.2∶1(V/V)时,测定的放化纯度结果与V(1 mol/L醋酸钠溶液):V(0.1 mol/L 盐酸溶液)=1.0∶1的相对误差分别为0.36%、0.38%、0.53%、1.12%。以上放化纯度测定结果的相对误差均满足≤2.0%的要求,说明分析条件的微小改变对99mTc-MDP注射液放化纯度测定无明显影响。
3.2.3中间精密度 两名实验人员对同一批次99mTc-MDP注射液进行放化纯度分析。每名实验人员各平行实验6次,共计12次放化纯度测试结果,所得Rf分别为0.973、0.974、0.974、0.929、0.943、0.966、0.982、0.980、0.981、0.937、0.973和0.973;放化纯度分别为97.13%、97.07%、96.64%、95.84%、94.56%、96.69%、97.27%、96.93%、96.58%、96.20%、96.83%和97.35%,平均值为96.60%,相对标准偏差(RSD)为0.80%(n=12),满足≤2.0%的要求,表明该方法的中间精密度良好。
3.2.4分析方法比对 使用拟定分析方法与EP10.0[9]、ChP2020[10]和USP42-NF37[11]收录的分析方法对99mTc-MDP注射液的放化纯度进行比对测定,详细结果列于表4和表5。从表4可以看出,四批次99mTc-MDP注射液,本方法测定放化纯度的平均值为97.03%,《中国药典》[10]/《美国药典》[11]测定放化纯度的平均值为97.06%,两种方法测量结果的相对误差为0.03%。从表5可以看出,四批次99mTc-MDP注射液,本方法测定放化纯度的平均值为98.17%,欧洲药典测定放化纯度的平均值为97.92%,两种方法测量结果的相对误差为0.26%。通过拟定方法与各国药典方法的比对结果看,测量结果的相对误差均满足≤2.0%的要求,说明本方法具有较好的准确性。

表4 99mTc-MDP注射液的放化纯度测量结果比对(1)Table 4 Comparison of radiochemical purity measurements of 99mTc-MDP injection (1)

表5 99mTc-MDP注射液的放化纯度测量结果比对(2)Table 5 Comparison of radiochemical purity measurements of 99mTc-MDP injection (2)
4 结论
本研究建立了一种用于99mTc-MDP注射液放化纯度检测的薄层色谱分析方法,即以聚酰胺-6薄层板为固定相,V(1 mol/L醋酸钠溶液):V(0.1 mol/L盐酸溶液)=1∶1为展开剂。并对该分析方法进行了专属性、线性、耐用性、精密度等方法学验证,验证结果均符合要求。该分析方法可实现放射性主峰与各放射性化学杂质峰的有效分离,分离度>1.0,并且明显改善了放射性主峰拖尾的情况,峰形良好。因此,该分析方法可用于99mTc-MDP注射液的放化纯度测定。
