羊毛角蛋白融合型丝素蛋白膜材料的性能分析
2023-12-15常雪宁何海波王依辰代方银a赵天福a
常雪宁, 何海波, 王依辰, 曾 頔, 代方银a,, 赵天福a,
(西南大学 a.资源昆虫高效养殖与利用全国重点实验室; b.蚕桑纺织与生物质科学学院;c.重庆市生物质纤维材料与现代纺织工程技术研究中心,重庆 400715)
蚕丝在中国已有几千年的应用历史,是自然界中唯一可以批量生产的天然长丝纤维,因其美丽的外观而成为一种古老而令人向往的材料,在纺织等行业中具有重要意义。近年来,蚕丝的衍生材料蛋白质膜的研究备受关注,被应用于抗菌敷料[1]、骨修复支架[2-4]、缓释载体[5]和生物传感器[5-6]等领域,已成为前景美好的高科技材料。尽管原生蚕丝具有优越的机械性能,再生丝素膜的强度和韧性却不尽如人意[7-8],这较大阻碍了其广泛应用。为了增强再生丝素材料的机械强度,常向丝素原液中添加壳聚糖[5]、聚乙烯醇(PVA)[9]、水溶性聚氨酯[10]、海藻酸钠[11]、甘油[12]等非蛋白成分。近年有学者将丝蛋白与羊毛角蛋白混合,成功制作强度改善的再生丝素材料[13]。甘油不仅可以增加材料的柔软度和延展性,还可以促进丝素膜分子与水分子之间的相互作用从而改善亲水性[14]。无论是添加蛋白质或非蛋白质的方法,往往都伴随着溶解复杂、过程繁琐、资源浪费和环境污染等问题。
羊毛角蛋白关联蛋白(Keratin-Associated Proteins,KAPs)是羊毛纤维的主要结构成分,它在决定羊毛纤维的物理和机械性能方面起重要作用[15]。KAP中富含的半胱氨酸(11%~17%)能够在氧化状态下形成二硫键[16-18],交叉连接角蛋白分子中多肽链的不同区域,与疏水相互作用和范德华力一起赋予角蛋白高的机械强度和结构稳定性[19]。KAP被分成三个主要家族,其中KAP4和KAP5属于超高硫角蛋白相关蛋白家族,其家族的半胱氨酸含量在所有羊毛角蛋白中最高[20]。KAP4.3中含有311个氨基酸,具有较长的半胱氨酸-丝氨酸富含区[21];KAP5.4富含甘氨酸和半胱氨酸,具有交替重复出现的长甘氨酸片段和短半胱氨酸片段[22]。
2000年首次成功将转基因技术应用于家蚕[23],通过将外源基因转入家蚕体内,可以得到具有特殊性能的优异蚕丝[24-25]。如果将外源蛋白质基因转入家蚕,利用家蚕丝腺生产混合蛋白质,就可以省略以往生产融合再生蛋白质材料时难以回避的原料分别溶解后再混合等复杂繁琐的过程。本实验选用的材料是将羊毛角蛋白KAP4.3和KAP5.4基因转入家蚕体内获得的混合蛋白蚕丝,其中的二硫键[26-27],以及大量的α-螺旋和复合螺旋结构[28]可以增强蚕丝的机械性能,良好地将羊毛纤维的优良性能与蚕丝性能相结合,得到更高性能的丝纤维材料。本文将前述混合蛋白蚕丝溶解,先制作再生丝蛋白膜材料,然后探究该材料的结构和性能。
1 实验材料与方法
1.1 材 料
普通家蚕茧(四川安泰丝绸公司)。转基因蚕茧KAP4.3和KAP5.4(KAP型蚕茧)分别转入了KAP4.3角蛋白(相对分子质量60 kDa)和KAP5.4角蛋白(相对分子质量39 kDa)[29]。
1.2 设备仪器
TG16-WS型台式高速离心机(湖南湘仪实验仪器开发有限公司),ALPHA傅里叶变换红外光谱仪(德国布鲁克),TD3500型X射线衍射仪(丹东通达科技有限公司),Phenom Pro型场发式扫描电子显微镜(荷兰飞纳公司),E44.104型电子万能试验机(美国美特斯工业系统(中国)有限公司),OCA15EC型光学接触角测量仪(德国Dataphysics公司)。
1.3 丝素膜的制备
1.3.1 蚕茧脱胶处理
将三种蚕茧分别在98 ℃、浴比1︰100的0.5 g/L Na2CO3溶液中进行脱胶30 min,用去离子水洗净,重复2次,得到脱胶蚕丝。
1.3.2 丝素膜的制备
取脱胶后的三种蚕丝以1︰10的浴比,分别放入三元溶液(三元溶液中CaCl2、H2O、C2H5OH的摩尔比为1︰8︰2)中,75 ℃加热至完全溶解。将溶解后的丝素溶液用纱布过滤去除未溶物,滤液离心取上清液灌入透析袋(8 000~14 000 D)中,用去离子水透析脱盐3 d,每隔4 h换水。将透析袋内的丝素溶液离心去除杂质后,调节质量分数为3%。
取三种丝素溶液各30 mL分别倒入90 mm塑料培养皿中,于60 ℃保温缓慢去除水分,直至丝素膜成型。将得到的普通蚕丝丝素蛋白膜和KAP混合丝素蛋白膜分别命名为SF、KAP4.3-SF、KAP5.4-SF。另取三种丝素溶液各30 mL,分别加入1%甘油搅拌均匀,按上述方法制备丝素/甘油复合丝素膜,依次命名为SF/Gly、KAP4.3-SF/Gly、KAP5.4-SF/Gly。
1.4 丝素膜的结构和性能表征
1.4.1 FTIR光谱和X射线衍射图谱分析
分别取膜样品1 g剪成粉末,与KBr以1︰100混合,用玛瑙研钵充分研磨,取适量粉末在压片机中压片,用ALPHA傅里叶变换红外光谱仪进行检测。检测参数为4 000~500 cm-1的扫描范围,32次的扫描次数,4 cm-1的分辨率。用PeakFit软件对获得红外光谱的酰胺Ⅰ带(1 700~1 600 cm-1)进行分峰拟合并定量分析,计算6种膜样品二级结构中的β-折叠、无规卷曲/α-螺旋和β-转角的含量。
将膜样品剪成2 cm×2 cm的方块,用TD3500型X射线衍射仪对蚕丝进行结构表征,扫描波长为0.154 nm,2θ角的扫描范围为5°~45°,扫描步长为0.02。
1.4.2 膜表面形貌的扫描电子显微镜观察
将样品放入烘箱中,100 ℃烘干24 h。然后按照要求修剪成适当尺寸,用导电胶粘贴在表面和截面样品台上,利用氮气吹去样品上的灰尘。在25 ℃条件下,利用真空溅射仪,在15 kV电压下,溅射纳米金90 s。在10 kV电压、标准流束条件下,用PhenomPro型场发式扫描电子显微镜对膜的表面形貌结构进行观察。通过调节扫描电镜的放大倍数,得到清晰的膜表面形态图像。
1.4.3 膜的机械性能测试
将蛋白膜剪成3 cm×1 cm的长方形,用游标卡尺检测膜的厚度。再用E44.104型电子万能试验机以5 mm/min的速度进行拉伸测试,获得5组平行数据。
1.4.4 蛋白膜的亲疏水测试
利用OCA15EC型光学接触角测量仪测量丝素蛋白膜表面的亲疏水性。在25 ℃条件下,将薄膜样品修剪成长宽为1 cm×1 cm方形样品,并固定在光学接触角测量仪的样品台上,采用去离子水为滴加液体,液滴体积为3 μL,液滴接触薄膜样品1 s后,记录接触角值,每组样品重复测试3次,取其平均值。
2 结果与分析
2.1 蛋白膜的二级结构
对6种蛋白膜分别进行红外光谱测试,结果如图1所示。在测试波长范围内,蛋白质分别在1 700~1 600 cm-1(酰胺Ⅰ带)、1 600~1 500 cm-1(酰胺Ⅱ带)、1 350~1 200 cm-1(酰胺Ⅲ带)出现酰胺基团的特征吸收,1 037 cm-1处为伯醇的C—O的对称伸缩振动,是甘油的特征吸收峰。对酰胺Ⅰ带进行分峰拟合(图2),并对各材料的二级结构含量定量分析(表1),1 610~1 640 cm-1为β-折叠,1 640~1 650 cm-1为α-螺旋和无规卷曲,1 660~1 700 cm-1为β-转角[30]。

表1 丝素膜的二级结构组成
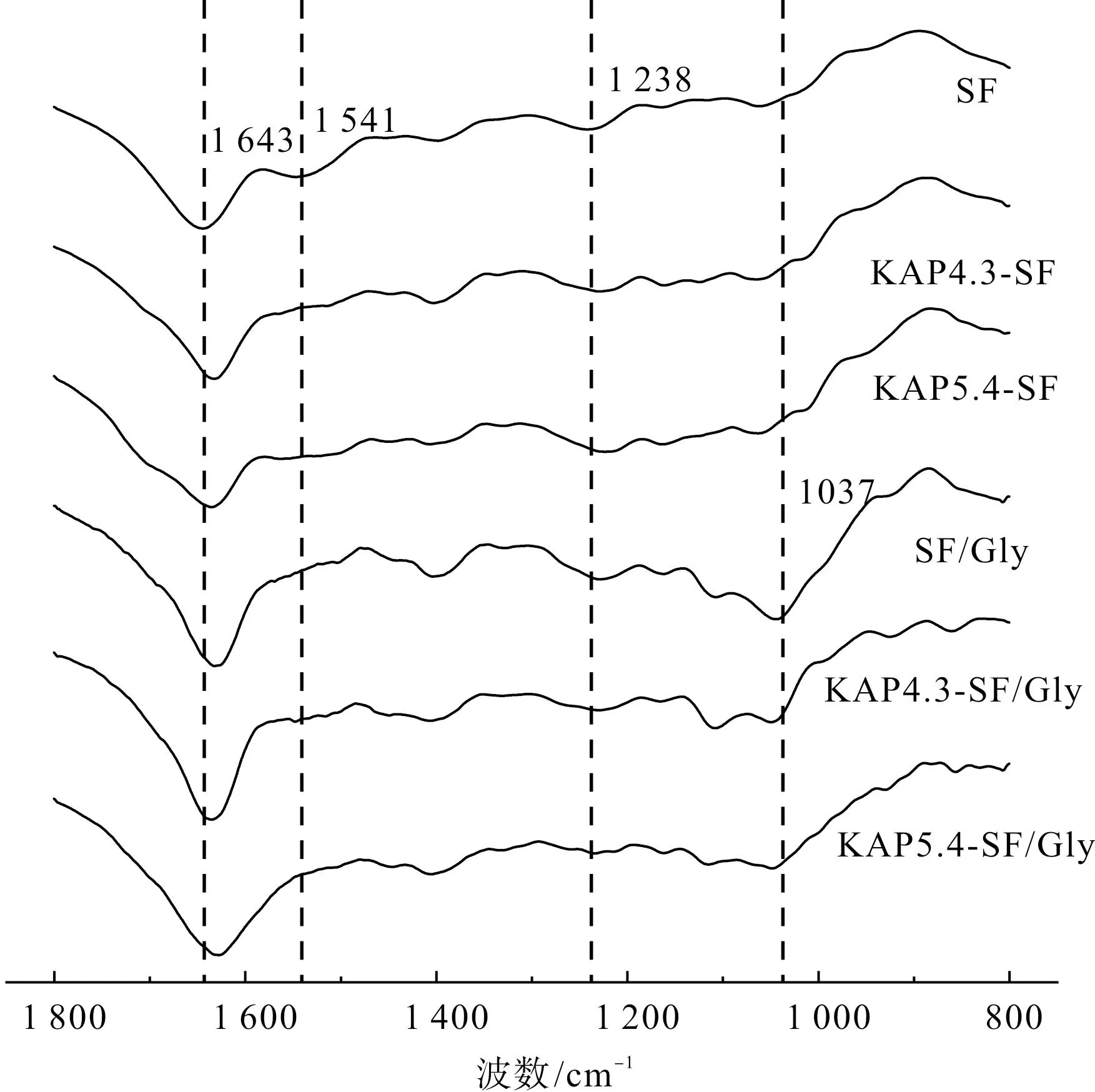
图1 丝素蛋白膜的FTIR光谱
由图2(g)和表1可以看出,KAP4.3-SF、KAP5.4-SF两种丝素膜的β-折叠较SF增加尤为明显。这是因为在蛋白溶液转变为固体膜的过程中,随着水分的蒸发,蛋白分子链间氢键减少,在链内分子运动的作用下形成链内氢键,主要为α-螺旋和β-折叠结构。而随着温度的升高,蛋白的分子运动增加,使得无规卷曲和α-螺旋结构的蛋白分子之间的相互作用力变得不稳定,从而向着稳定的β-折叠结构发生转变,β-折叠结构则能够更稳定地存在于高温环境下。羊毛角蛋白基因本身含有的α-螺旋使β-折叠的增加较为明显[31]。加入甘油后,甘油能够与蛋白分子形成氢键或水合作用,增强了丝素蛋白分子之间的相互作用,诱导了α-螺旋向稳定状态的β-折叠发生转变,使丝素膜的稳定性得到了提高、总体上表现出β-折叠含量增高、α-螺旋与无规卷曲含量降低的趋势。
图3为丝素蛋白膜的X衍射谱图,丝素蛋白SilkⅠ结晶的X射线的衍射峰主要出现在16.3°、22.5°、28.2°,SilkⅡ结晶的衍射峰主要出现在20.2°、24.8°。
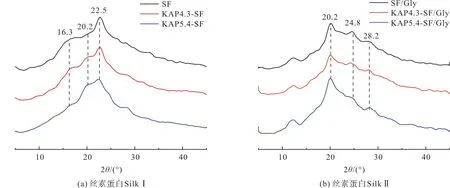
图3 丝素蛋白膜的X射线衍射图谱
由图3(a)可以看出,未加入甘油改性时,蛋白膜的衍射峰主要在16.3°和22.5°的位置,这表明此时蛋白膜中主要以SilkⅠ结晶的α-螺旋结构为主,SilkⅡ结晶较少;加入甘油后蛋白膜中的α-螺旋结构向β-折叠发生转变,衍射峰主要为20.2°、24.8°[32],此时蛋白膜中的结构主要为以β-折叠为主的SilkⅡ结晶。这是因为丝素蛋白链本身具有许多亲水性的氨基酸残基,而甘油的羟基也能提供氢键供这些残基使用。在丝素蛋白溶液中,这些氢键的形成促进了部分无规卷曲结构转变为α-螺旋结构,同时在高温作用下,另一些无规卷曲结构和α-螺旋结构也朝着更稳定的β-折叠结构方向发生转变,这与FTIR光谱的结果相似。
2.2 蛋白膜的表观结构
丝素蛋白膜及甘油增塑丝素蛋白膜表面的扫描电镜照如图4所示。

图4 丝素蛋白膜SEM照片
由图4可以看出,普通丝素膜、转基因丝素膜,以及1%甘油改性的两种丝素膜的表面形态都比较透明且均匀光滑,外源蛋白的融入并没有对丝素膜的表观形态造成明显影响。
2.3 蛋白膜的机械性能
利用E44.104型电子万能试验机在恒温恒湿条件(20 ℃、65%)下对6种丝素膜进行应力应变测试,拉伸强度和拉伸应变值的分布情况如图5所示,平均断裂强度结果如图6所示。与普通丝素膜相比,转羊毛角蛋白KAP4.3和KAP5.4丝素膜具有较高的拉伸强度与拉伸应变。未加入甘油的KAP4.3丝素膜的平均拉伸强度,相比于普通丝素膜提高了125%,平均拉伸应变提高了44%;KAP5.4丝素膜的平均拉伸强度相比于普通丝素膜提高了83%,平均拉伸应变提高了71%。KAP型丝素膜的机械强度高于普通丝素膜,分析认为其原因是KAP型丝素内的羊毛角蛋白表现出羊毛纤维特征,使丝素结构中含有更多的无规卷曲与α-螺旋结构,在经过物理化学作用后,无规卷曲与α-螺旋转变为构象较为稳定的β-折叠结构,增加了丝素膜的机械性能。对两种羊毛角蛋白融合型蚕丝和普通蚕丝材料的氨基酸组成分析显示,两种羊毛角蛋白融合型蚕丝的半胱氨酸含量较普通蚕丝有所增加(数据未发表)。半胱氨酸是一种含有硫原子的氨基酸,它具有一个硫氢基和一个侧链硫醇基。当两个半胱氨酸的硫醇基在适当条件下接近时,它们之间就会发生氧化反应,形成一个强稳定的二硫键(S—S键),并牢固地连接在一起。因此推测,半胱氨酸的增加导致了丝纤维中二硫键的数目增加,二硫键数目越多,蛋白质分子构象就越稳定,性能也就越好。两种KAP型丝素膜的机械性能增加趋势不一样,其中KAP4.3-SF的平均拉伸强度比KAP5.4-SF高,造成这种差异的原因分析认为主要是外源羊毛角蛋白的相对分子质量和表达量的不同。本实验材料转入的KAP4.3蛋白的相对分子质量为60 kDa,表达量为3%,而转入KAP5.4蛋白的相对分子质量为39 kDa,表达量只有1%。通常,外源蛋白相对分子质量越大、表达量越高,材料的机械性能越好[33]。加入甘油后,所有丝素膜的拉伸应变都得到了显著提高,还使三种材料在拉伸应变方面的差异变得更加明显,相较于SF/Gly,KAP4.3-SF/Gly的拉伸应变提高了45%,KAP5.4-SF/Gly的拉伸应变提高了75%。共混甘油以后甘油取代了丝素蛋白膜中的水,使构象从不稳定的α-螺旋和无规卷曲中间状态向稳定结构β-折叠转变[34],推测外源KAP蛋白和甘油在改进蛋白膜韧性方面有相互促进的作用。此外,KAP4.3和KAP5.4的氨基酸序列并不相同,KAP4.3蛋白具有较长的半胱氨酸-丝氨酸富含区,而KAP5.4蛋白中有交替重复出现的长甘氨酸片段和短半胱氨酸片段,这与材料的机械性能是否有关,有待更详细的实验验证。

图5 丝素蛋白膜的拉伸强度和拉伸应变值的分布情况
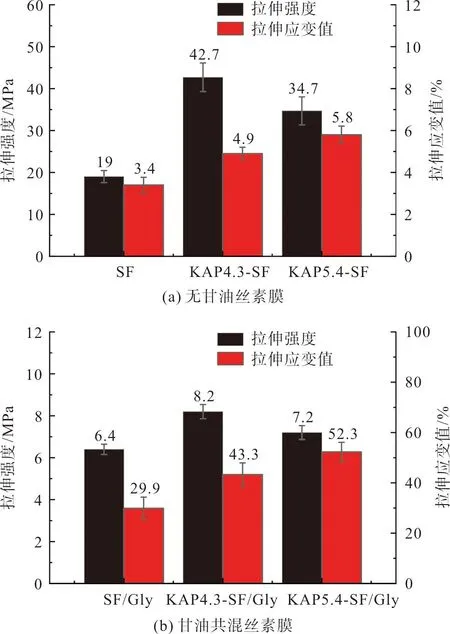
图6 丝素蛋白膜的拉伸强度和拉伸应变的平均值
此外,使用Excel软件分别对每两种材料的应力应变数据进行“方差分析:无重复双因素分析”,发现材料之间的应力应变结果都具有显著差异。
2.4 蛋白膜的亲疏水性
接触角是液体与试样表面相互作用形成的夹角,是衡量材料亲疏水性能的重要参数,角度大于90°时材料是疏水性,小于90°时则是亲水性,且角度越小材料亲水性越好。
通过接触角测试可以发现(图7),融入KAP基因的丝素膜的亲水性小于纯丝素膜,分析认为这是由于角蛋白中含有的二硫键表现出较强的稳定性使材料不易溶解[35]。转入的外源蛋白KAP4.3中的亲水性氨基酸多于KAP5.4[29],这使得KAP4.3-SF的亲水性略高于KAP5.4-SF。甘油是一种常见的亲水性多元醇增塑剂[36],含有较多的亲水性基团,加入甘油后三种材料的亲水性都明显增强。其中,KAP4.3和KAP5.4增加幅度更大,显示出羊毛角蛋白的转入更有利于甘油性能的发挥。

注:图中角度为相应样品三次测试的接触角平均值。图7 丝素蛋白膜的接触角测试
3 结 论
利用转基因技术将羊毛角蛋白关联蛋白基因(KAP)转入家蚕体内,制备得到的转基因丝素膜具有更稳定的二级结构、较高的断裂强度。甘油可以显著改善转基因丝素膜的拉伸性能和亲水性能。
运用转基因方法制作KAP融入型丝素蛋白膜,与传统方法制作混合膜时需要单独溶解蚕丝和羊毛再混合的繁琐过程相比,该方法具有相对简便且更高效的优点,为蚕丝与羊毛等天然蛋白质的研究和利用提供了新的途径和思路。
致 谢
本文中转基因蚕茧KAP4.3和KAP5.4(KAP型蚕茧)蒙西南大学资源昆虫高效养殖与利用全国重点实验室赵爱春教授研究团队惠赠,谨此致谢。

《丝绸》官网下载

中国知网下载
