维生素A缺乏调节肺泡巨噬细胞M1极化在新生大鼠ARDS中的作用及其机制
2023-12-15曾毅文龚放
曾毅文,龚放*
重庆医科大学附属永川医院儿科,重庆 402160
新生儿急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是威胁新生儿生命健康的主要疾病之一[1]。在新生儿重症监护室(neonatal intensive care unit,NICU)住院治疗的患儿中,新生儿ARDS 发病率为10%,病死率高达35%~46%[2]。ARDS临床表现为气促、呼吸窘迫、低氧血症、双肺透光度降低甚至白肺等[3]。维生素A(VA)作为人体代谢必需的微量营养素,可参与胎儿肺部早期的发育并影响肺部的免疫功能[4]。不同地区新生儿中维生素A缺乏(vitamin A deficiency,VAD)的发生率虽然不同,但总体均较高[5]。目前,有研究发现,发生ARDS的早产儿血清VA 水平较同胎龄未发生ARDS 的早产儿更低,且VAD早产儿更容易发生ARDS[6];Elfarargy等[7]发现,VAD 可加重ARDS 的严重程度,并可作为新生儿ARDS 发展和严重程度的预测指标。以上研究结果均提示VAD 与新生儿ARDS 的严重程度密切相关,但其机制尚未阐明。本课题组前期建立VAD新生大鼠ARDS 模型,检测肺泡灌洗液(BALF)时发现肺泡巨噬细胞为主要的差异细胞[8]。本研究拟检测肺泡巨噬细胞M1及M2型的极化情况,探讨VAD调节ARDS的作用及其机制,旨在改善新生儿ARDS的预后,为临床防治该疾病提供参考。
1 材料与方法
1.1 实验动物及试剂 54 只180~220 g SPF 级SD 大鼠,其中雌鼠36只,雄鼠18只,购自重庆医科大学动物中心。RNA 提取及反转录试剂盒(日本TaKaRa公司);CD206、肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)及诱导型一氧化氮合酶(iNOS)等ELISA试剂盒(美国Abcam 公司);丙二醛(MDA)测定试剂盒(南京建成科技有限公司);超氧化物歧化酶(SOD)及TUNEL 检测试剂盒(上海碧云天生物技术有限公司);F4/80 抗体(美国CST 公司);CD86 抗体(武汉三鹰生物技术有限公司);VAD 饲料及VA 正常(VAN)饲料(常州鼠一鼠二生物科技有限公司),脂多糖(LPS,美国Sigma-Aldrich公司);RNA引物(上海生物生工有限公司)。本研究已通过动物伦理委员会审查(AMUWEC20219010),并严格按照动物伦理委员会要求完成实验。
1.2 方法
1.2.1 动物模型的制备及分组 24只SD雌鼠在孕前2周给予VAD 饲料(400 U VA/kg)喂养,12只SD 雌鼠则予以VAN饲料(2300 U VA/kg)喂养;雄鼠均给予普通常规饲料。将SD 大鼠按照雌∶雄=2∶1 的比例合笼交配12 h 后取出雌鼠,随后继续分别给予VAD 及VAN 饲料喂养至新生大鼠生后7 d,分别获得VAD(n=40)及VAN(n=20)新生大鼠模型[8]。从VAD新生大鼠中选取20 只,于生后第2 天一次性给予腹腔注射VA(25 μg VA/只,相当于人体内1个月1000 U/d的剂量),获得VAD 挽救(VAD recover,VADR)新生大鼠模型。将VAD 新生大鼠分为VAD ctrl 组(n=10)与VAD组(n=10),VAN新生大鼠分为VAN ctrl组(n=10)与VAN 组(n=10),VADR 新生大鼠分为VADR ctrl 组(n=10)与VADR 组(n=10),其中,VAD ctrl 组、VAN ctrl组及VADR ctrl组新生大鼠于生后第7天给予气管内灌注磷酸盐缓冲液(phosphate buffered saline,PBS);VAD 组、VAN 组及VADR 组新生大鼠于生后第7 天给予气管内灌注LPS(5 mg/kg)4 h,分别构建各组新生大鼠ARDS模型[9]。
1.2.2 新生大鼠一般情况、BALF中细胞计数检测及病理学形态观察 记录各组新生大鼠一般情况。建模后4 h断颈处死各组新生大鼠,并以无菌PBS灌洗并收集BALF,予以过滤器过滤除去BALF 中的黏液后,在4 ℃条件下、500 r/min 离心5 min,涂片后用May-Grunwald-Giemsa 染色,用于细胞分类计数。建模后4 h取肺组织标本,观察各组新生大鼠肺组织出血、水肿等情况。取肺组织样本固定、包埋、切片、染色、封片后,在显微镜下观察肺组织病理损伤情况。肺组织湿干比(W/D)检测:取新生大鼠右上肺叶称重;随后将样本置于60 ℃烘箱中72 h烘干,取出后再次称重;肺叶湿重与烘干后重量的比值即为W/D[10]。
1.2.3 ELISA 检测血清中的VA 含量及肺组织中炎性因子的表达情况 收集各组大鼠的血液,在4 ℃条件下,3000 r/min 离心10 min,取上清液,用PBS 稀释后检测各组大鼠的VA含量。取出冻存的新生大鼠肺组织标本,按比例(1 mg组织:5 μl裂解液)加入组织裂解液,加入蛋白酶抑制剂,匀浆后于4 ℃、12 000×g离心10 min,取上清液,各炎性因子指标检测严格按照试剂盒说明书操作。
1.2.4 比色法检测各组氧化应激情况 在100 mg 肺组织中加入PBS匀浆,样本于4 ℃条件下、1000 r/min离心10 min,取上清。(1)SOD 活性检测:各组样本分别取20 μl 上清液后加入200 μl 工作液;继续加入20 μl稀释缓冲液及20 μl酶工作液,充分混合;混合后样本于37 ℃培养箱中培养20 min;用酶标仪在450 nm 处读数[11]。(2)MDA 含量检测:酶标仪预热30 min 以上,将各组待测标本分别加入MDA 检测工作液、样本、蒸馏水,立即混匀;混合液在100 ℃水浴中保温60 min 后,置于冰浴中冷却,常温10 000×g离心10 min。吸取200 μl 上清液于微量玻璃比色皿中,测定各样本在532 nm处的吸光度[12]。
1.2.5 qRT-PCR 检测肺部炎性因子水平 将肺组织样本按说明书步骤提取RNA后测定其浓度;将RNA反转录为cDNA,再以cDNA 为模板进行扩增。以GAPDH为内参照,计算目的基因的相对表达量。引物序列见表1。
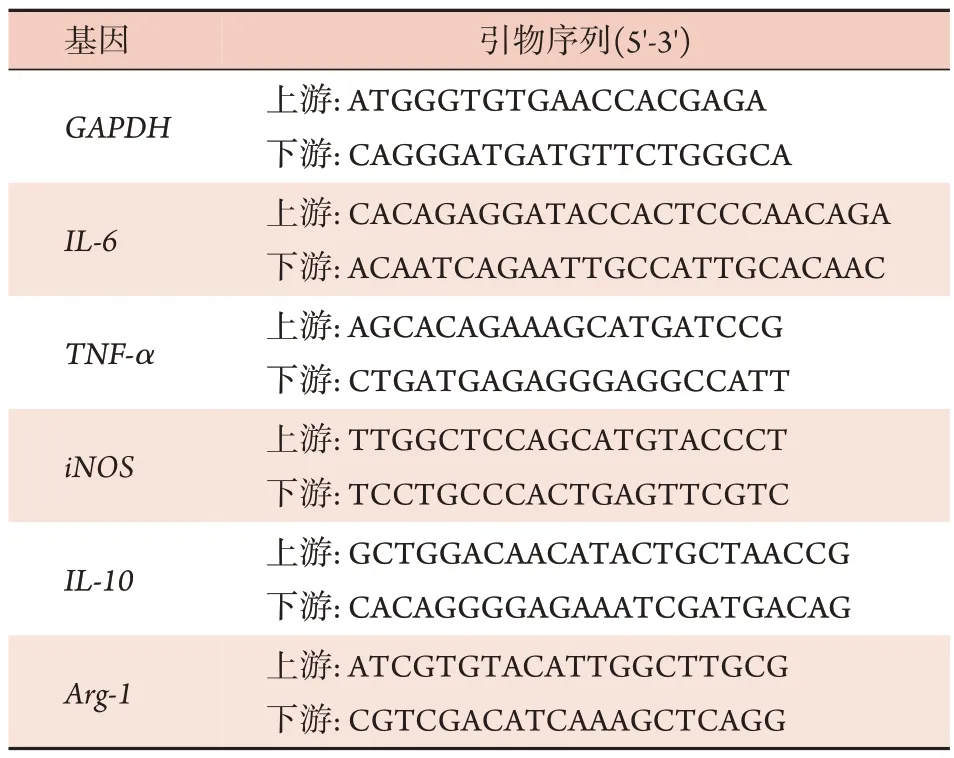
表1 PCR引物序列Tab.1 PCR primer sequence
1.2.6 TUNEL 检测各组细胞凋亡情况 肺组织标本进行包埋、切片及脱蜡后,用蛋白酶K工作液修复,破膜工作液破膜;按试剂说明书步骤加入相应试剂后将样本置于37 ℃湿盒内孵育2 h;BSA 封闭后加入TDT酶,再给予dUTP于37 ℃下避光孵育50 min;滴加DAPI 染液,避光孵育10 min,PBS洗3次;封片后置于Eclipse Ci正置荧光显微镜下观察并采集图像[13]。
1.2.7 免疫荧光染色检测肺泡巨噬细胞极化情况取肺组织样本包埋后行冷冻组织切片,冷丙酮固定10 min后,再用10%山羊血清封闭1 h;加入F4/80抗体(1:50)孵育2 h后加入CD86抗体(1:200),4 ℃孵育过夜。同时设置Isotype 组,加入抗体同种属、同来源、同型的免疫球蛋白作为对照,以排除假阳性。4 ℃孵育过夜后,加入羊抗兔二抗(1:100,FITC 标记)孵育1 h,DAPI染色后PBS洗3次,封片后置于荧光显微镜下观察[14]。
1.3 统计学处理 采用SPSS 22.0 软件进行统计分析。所有数据均为计量资料,符合正态分布且方差齐时以x±s表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验;方差不齐时以M(Q1,Q3)表示,组间比较采用Kruskal-Wallis 非参数检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组新生大鼠一般情况、血清VA 含量及肺组织损伤情况比较 取生后7 d的新生大鼠建模。建模前,VAD 新生大鼠体重较VAN 新生大鼠体重减轻、体格偏小、毛发稀疏;而VADR 组新生大鼠一般情况较好,毛发光滑,发育良好。与VAN 组比较,VAD新生大鼠血清VA含量明显降低(P<0.05)(图1A),而VADR 组无明显差异;与VAD 组比较,VADR 组血清VA含量明显增高(P<0.05)(图1A)。与VAN组比较,VAD 组新生大鼠表现为更为严重的气促、呼吸窘迫,肺部组织水肿、充血情况更为明显,W/D明显增高(P<0.05),而VADR组无明显差异;与VAD组比较,VADR 组新生大鼠肺组织水肿、充血情况明显减轻,W/D 明显降低(P<0.05)(图1B)。HE 染色结果显示,VAN ctrl组、VAD ctrl组及VADR ctrl 组肺组织屏障完整,炎性细胞浸润较少;与VAN 组比较,VAD 组新生大鼠肺组织炎性细胞浸润更严重,屏障损伤更明显;与VAD 组比较,VADR 组新生大鼠肺组织炎性细胞浸润减少,肺损伤减轻(图1C)。
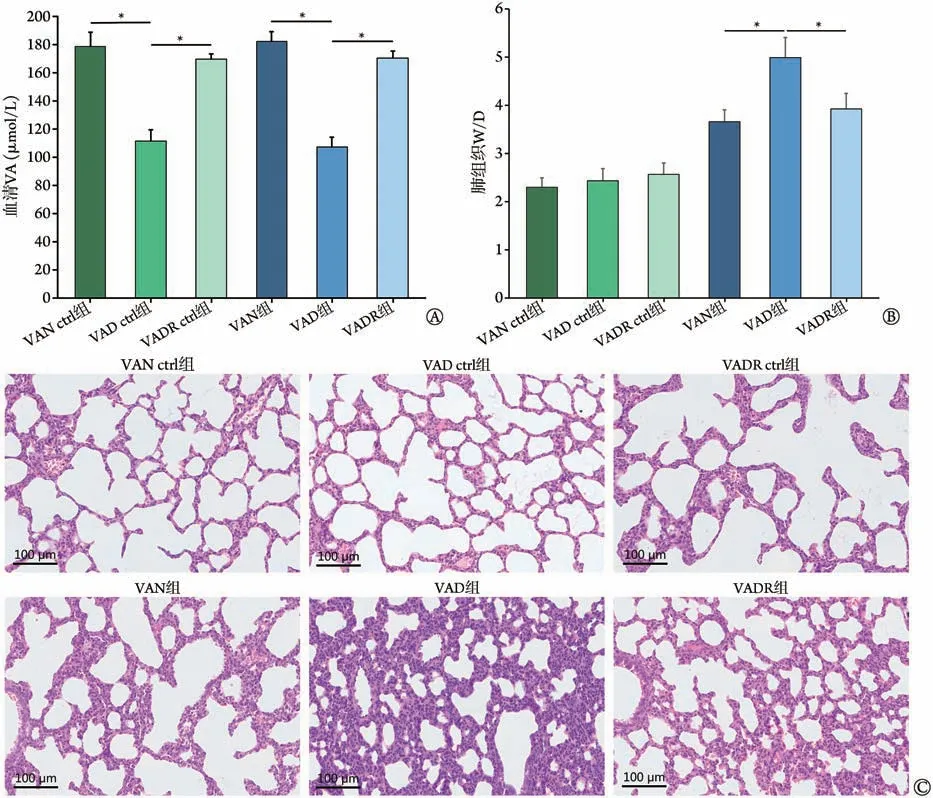
图1 各组新生大鼠VA含量及肺组织损伤情况比较Fig.1 Comparison of VA content and lung tissue damage in neonatal rats in each group
2.2 各组新生大鼠BALF中主要细胞数量比较 BALF中,肺泡巨噬细胞含量最高,且为主要的差异细胞。与VAN 组比较,VAD 组BALF 中细胞总数、中性粒细胞计数、淋巴细胞计数均明显增多(P<0.05),而VADR 组细胞总数、中性粒细胞计数、淋巴细胞计数差异无统计学意义;与VAD 组比较,VADR 组细胞总数、中性粒细胞计数、淋巴细胞计数均明显减少(P<0.05)。进一步检测BALF 中肺泡巨噬细胞数量发现,与VAN 组比较,VAD 组BALF 中巨噬细胞数增多(P<0.05),而VADR组中巨噬细胞数差异无统计学意义;与VAD 组比较,VADR 组中肺泡巨噬细胞数明显减少(P<0.05)。而VAN ctrl 组、VAD ctrl 组及VADR ctrl 组所有指标差异均无统计学意义(P>0.05)(图2)。

图2 各组新生大鼠BALF中细胞数量检测情况Fig.2 Detection of cells count in the bronchoalveolar lavage fluid of neonatal rats in each group
2.3 各组新生大鼠肺泡巨噬细胞极化及炎性因子表达情况比较 免疫荧光染色检测显示,与VAN组比较,VAD组肺泡巨噬细胞M1标志物CD86表达水平明显升高(P<0.05),而VADR 组差异无统计学意义(P>0.05);与VAD 组比较,VADR 组肺泡巨噬细胞M1标志物CD86表达水平明显降低(P<0.05)。与VAN组比较,VAD组巨噬细胞M1极化免疫荧光强度增强(P<0.05),而VADR 组差异无统计学意义(P>0.05)(图3)。三组间M2极化下游标志物IL-10、Arg-1mRNA水平差异均无统计学意义(P>0.05,图4A)。与VAN组比较,VAD组巨噬细胞M1型分泌的炎性因子iNOS、IL-6、TNF-αmRNA 及蛋白表达水平均明显升高(P<0.05),而VADR 组差异无统计学意义(P>0.05);与VAD 组比较,VADR 组新生大鼠iNOS、IL-6、TNF-αmRNA 及蛋白表达水平均明显降低(P<0.05)(图4B、C)。而VAN ctrl 组、VAD ctrl 组及VADR ctrl组所有指标差异均无统计学意义(P>0.05)(图3-4)。
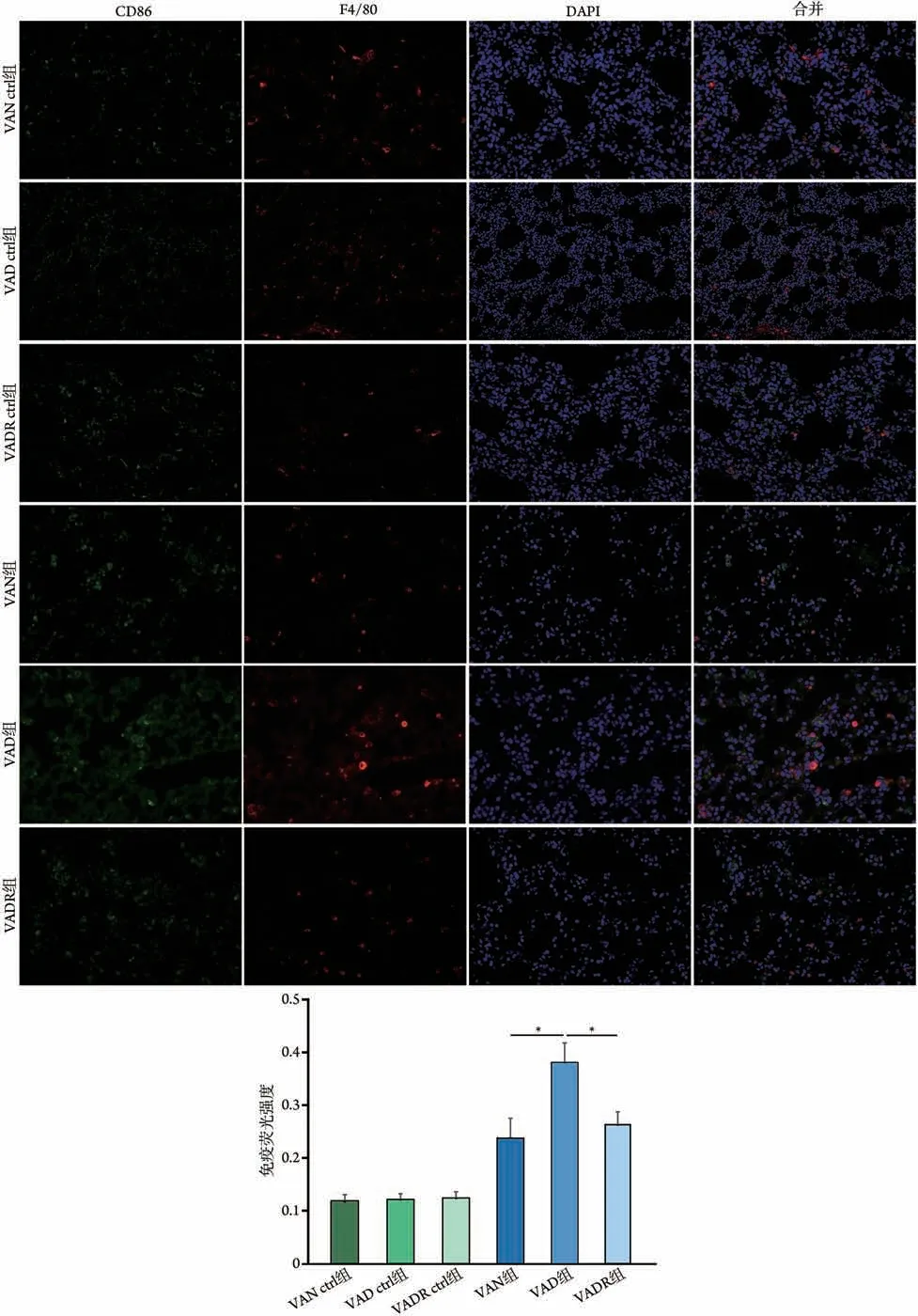
图3 免疫荧光染色检测各组新生大鼠M1型肺泡巨噬细胞标志物CD86的表达情况(×400)Fig.3 Immunofluorescence detection of M1 marker CD86 expression in four groups of rats (×400)

图4 VAD对肺泡巨噬细胞M1、M2极化标志物及炎性因子的影响Fig.4 Effect of VAD on M1 and M2 polarization markers and inflammatory factors in alveolar macrophages
2.4 各组新生大鼠肺组织细胞凋亡及氧化应激标志物比较 与VAN组比较,VAD组新生大鼠肺部组织细胞凋亡指数明显增高(P<0.05),而VADR组差异无统计学意义;与VAD 组比较,VADR 组新生大鼠肺部组织细胞凋亡指数明显降低(P<0.05)(图5A、B)。与VAN组比较,VAD组新生大鼠肺组织SOD活性降低、MDA 含量增高(P<0.05),而VADR 组差异无统计学意义;与VAD 组比较,VADR 组新生大鼠肺组织SOD 活性增强、MDA 含量降低(P<0.05)(图5C)。而VAN ctrl组、VAD ctrl组及VADR ctrl组所有指标差异均无统计学意义(P>0.05)(图5)。
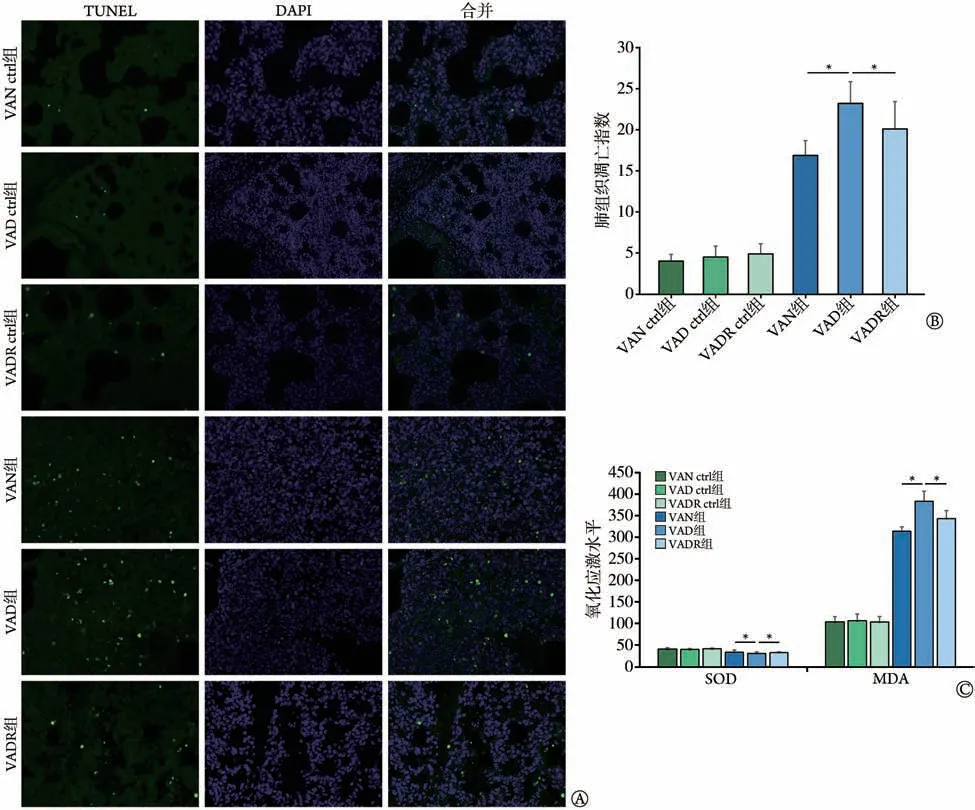
图5 各组新生大鼠肺组织细胞凋亡及氧化应激的比较Fig.5 Comparison of oxidative stress and apoptosis of lung tissue in neonatal rats in various groups
3 讨 论
ARDS是新生儿常见的临床危重症之一,早期防治对改善新生儿ARDS 预后具有重要意义[15]。因此,本研究建立VAD 及VADR 新生大鼠ARDS 模型,检测BALF中的主要细胞时发现,肺泡巨噬细胞含量最高,且为主要的差异细胞。肺泡巨噬细胞M1极化在ARDS的启动过程中发挥关键作用[16],其极化可促进下游标志物iNOS、TNF-α、IL-6等炎性因子的表达,诱导ARDS 肺部损伤[17]。Deng 等[18]发现,间充质干细胞可通过增加肺泡巨噬细胞M2极化,增强肺泡巨噬细胞的吞噬能力,促进ARDS肺损伤的修复。
VA是维持人体代谢的必需营养素,但由于其难以通过胎盘进入胎儿体内,因此新生儿血清和肝脏中的VA 含量明显低于母体。围产期发生的VAD 不仅可影响胎儿免疫器官的发育,还可增加肺部疾病的感染风险[19]。本研究采用Antoine 等[8]的方法建立VAD 大鼠模型,并参考Zhen 等[9]的方法建立VADR新生大鼠模型,结果显示,与VAN组比较,VAD组新生大鼠血清VA 含量明显降低,且一般情况较差,毛发稀疏,体格偏小,反应欠佳;与VAD 组比较,VADR 组新生大鼠血清VA 含量增加,一般情况改善,毛发光亮,反应尚可。提示VAD 及VADR 新生大鼠模型建立成功,符合现有的研究结果,且VAD可影响新生儿的生长发育及免疫功能。
VA参与了早期的肺发育、肺泡屏障形成及组织再生,在感染诱导的免疫反应中发挥重要作用。视黄酸是VA 的主要活性形式,在调节早期的肺发育、促进肺泡的形成及分支形态发生、维持细胞增殖及合成肺表面活性物质中具有重要价值,还可促进肺表面活性物质蛋白C 的表达,并预防ARDS 的发生。与健康儿童比较,VAD 患儿的呼吸道感染发病率约高2 倍;反复感染的患儿VA 水平降低,补充VA 则可缓解新生儿肺炎链球菌诱导的肺损伤[20]。程晨等[21]发现,发生ARDS 的早产儿血清VA水平较同胎龄未发生ARDS 的早产儿低。Elfarargy 等[7]发现,VAD 可加重ARDS 的严重程度,并可作为新生儿ARDS发展和严重程度的预测指标。本研究发现,与VAN 组比较,VAD 组新生大鼠表现为更为严重的肺部损伤,组织水肿、坏死、炎性细胞及免疫细胞聚集、屏障破坏,而补充VA 则可减轻VAD 新生大鼠的肺部损伤、组织水肿及炎性细胞聚集,提示VAD与儿童尤其是新生儿ARDS 的严重程度密切相关。但顾志勇[22]发现,血浆VA 浓度与ARDS 疾病的发生无明显关系,研究结果出现争议可能与ARDS 的严重程度有关,即机体存在轻度ARDS 时具有自我免疫调节功能,VAD 对ARDS 的影响较小,而存在中重度ARDS时,VAD则可诱导免疫失衡,加重ARDS肺损伤。
此外,本研究建立VAD及VADR新生大鼠ARDS模型,检测BALF中主要细胞时发现肺泡巨噬细胞为主要的差异细胞。而Zhen 等[9]发现,VAD 可通过调节巨噬细胞M1与M2的平衡来参与新生儿的肺部慢性炎症,调控支气管肺部发育不良。为进一步探讨在ARDS 中VAD 对肺泡巨噬细胞极化的影响,本研究检测了各组大鼠M1 及M2 型标志物的表达情况,结果发现,与VAN组比较,VAD组新生大鼠肺泡巨噬细胞M1 型极化增加,炎性因子TNF-α、IL-6 及iNOS 的表达水平明显升高,而VADR 组新生大鼠补充VA 后其肺部巨噬细胞M1 型极化减轻,炎性因子表达水平明显降低。与VAN组比较,VAD组新生大鼠肺泡M2 型极化及其下游标志物IL-10、Arg-1 表达水平差异均无统计学意义,提示VAD主要是通过诱导巨噬细胞M1 型极化来加重ARDS 的肺部损伤。Gundra 等[23]发现,VAD 可调节单核细胞衍生巨噬细胞在替代激活过程中转化为组织驻留巨噬细胞的过程。Erkelens 等[24]发现,肠道巨噬细胞通过VA 和β葡聚糖受体抗体(Dectin-1)介导的信号转导来平衡炎症表达谱,调节肠道的炎症反应。Esteban-Pretel等[25]则认为,VA可影响肺泡上皮细胞和内皮细胞的发育,甚至通过调控免疫细胞来抑制炎症对内皮屏障造成的损害。从以上研究结果推测,VAD 可能通过调节肺部免疫微环境,诱导巨噬细胞M1 型极化,从而加重新生儿ARDS 的肺部损伤。但VAD 对肺泡巨噬细胞M2型极化虽有下调趋势,但差异无统计学意义,可能与LPS在诱导ARDS模型时的作用时间较短、对肺泡巨噬细胞M2极化作用影响较小有关。
视黄酸可通过增强细胞活力、促进更多细胞从G1期进入S 期、抑制细胞凋亡来促进细胞增殖。在ARDS 中,肺泡巨噬细胞M1 极化可激活下游的炎症反应,并诱导氧化应激及细胞凋亡。Petiz等[26]发现,VA能够减轻氧化锌诱导的肝脏氧化应激,从而减轻肝脏损伤。本研究进一步检测各组新生大鼠肺组织的氧化应激及细胞凋亡情况发现,与VAN 组比较,VAD 组新生大鼠肺部损伤标志物MDA 含量增多、SOD 活性降低,且细胞凋亡增加;而VADR 组新生大鼠补充VA 后其肺部损伤标志物MDA 含量降低、SOD活性增强,细胞凋亡减少,提示VAD可增加肺部氧化应激、炎症反应及细胞凋亡,从而加重新生大鼠ARDS肺部损伤。
综上所述,本研究发现,VAD与新生大鼠ARDS的严重程度有关,并可调节肺泡巨噬细胞M1型极化及其标志物iNOS、CD86 的表达,增加肺部MDA 含量,并下调SOD 活性,上调炎性因子IL-6、TNF-α的表达及细胞凋亡,最终加重新生大鼠ARDS 的肺部损伤。因此,在新生儿尤其是早产儿中,早期VA干预可改善新生儿ARDS 的肺损伤严重程度及预后。但在复杂的机体免疫微环境中,VAD 如何调节巨噬细胞M1 型极化及具体分子信号通路仍有待进一步阐明。
