雨生红球藻新型抗氧化肽的制备纯化、鉴定筛选及其对秀丽线虫抗氧化能力的影响
2023-12-14何宛诗郑钦生陈小艳夏增慧刘晓娟
何宛诗,郑钦生,陈小艳,夏增慧,曹 庸,刘晓娟
(华南农业大学食品学院,广东省功能食品活性物重点实验室,广东 广州 510642)
人体长时间处于不良环境或随着年龄增长,抗氧化抵御系统会衰弱,且因自由基形成过多或消除过慢,氧化还原稳态被打破,从而在机体内造成氧化应激,引起不可逆的细胞破坏。氧化应激可诱发心血管疾病、阿尔茨海默症及癌症等多种慢性疾病[1-3]。为降低这些疾病风险,人们越来越倾向于服用抗氧化剂,以辅助协调身体的氧化还原平衡。一些食源性生物活性肽具有结构简单、易吸收、稳定性好、无免疫反应等优势,在抗氧化剂领域备受青睐,利用自然资源筛选和获得抗氧化效用的肽产品,正在成为食品和医疗行业研究的动力[4-5]。
作为新食品原料,雨生红球藻(Haematococcus pluvialis)是一种营养价值极高的海洋微藻[6]。为提取藻中的“超级抗氧化剂”虾青素,全球范围内雨生红球藻的年产量达545 t,我国是世界雨生红球藻虾青素市场的产能大国之一[7]。然而,大规模生产虾青素的同时也留下了大量工业藻渣,应用局限于动物饲料或被直接丢弃。雨生红球藻渣含有丰富的营养价值,其中蛋白质含量达20.8%~22.2%,仍存在值得探究的高附加值[8-9]。本团队前期通过生物酶解法从雨生红球藻渣蛋白中获得抗氧化酶解物,并显示较好的体外抗氧化能力[10]。微藻蛋白酶解物是生物活性肽的优质来源,可经过进一步的纯化提高其利用价值。Hu Xiao等[11]利用超滤、凝胶层析色谱和反相液相色谱技术分离裂壶藻蛋白酶解物,并通过电喷雾电离质谱法鉴定多肽结构,获得裂壶藻抗氧化肽PYK,相比纯化前的蛋白酶解物,抗氧化肽PYK显示出更强的羟自由基清除能力和还原力。因此,分离纯化是强化微藻多肽功能活性的关键技术,可进一步加强对藻渣的综合利用。截止目前,关于雨生红球藻生物活性肽的研究还有待完善。
近几年,为了克服传统多肽分离法的耗资大、周期长等缺点,计算机辅助建模技术已被广泛应用于多肽构效关系评估和活性筛选[12-13]。分子模拟对接技术常用于预测和筛选生物活性肽,其中融合多学科领域的专业知识,具有高效准确的特点[14]。基于几何配体和能量配体原则,分子对接可以利用化学计量学方法,模拟蛋白质或多肽与配体之间的结合模式和结合自由能,实现对二者间作用方式、作用力类型、相互作用位置及其他结合信息的预测[15]。一般而言,分子对接的结合自由能与活性之间显著相关,二者线性R2可达0.974 3,表示对接最小结合能与功能活性之间具有较强的线性关系[16-19]。Wen Chaoting等[20]采用分子对接对比5 条西瓜籽抗氧化肽P1~P5与1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、2,2′-联氮双(3-乙基苯并噻唑啉-6-磺酸)(2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)阳离子自由基的结合情况,结果显示P1(RDPEER)与两个自由基的最小结合自由能最低,预测P1与配体之间形成了较强的氢键和疏水性互作用,意味着其抗氧化活性最强。该预测结果在Wen Chaoting等[21]的其他实验中得到证实,P1的自由基清除能力和抑制活性氧(reactive oxygen species,ROS)和丙二醛(malondialdehyde,MDA)的能力最强,与分子对接结果对应。
因此,本实验在前期研究的基础上,将雨生红球藻蛋白酶解物作为原料,以ABTS阳离子自由基清除力为活性跟踪指标,采用超滤、制备型和分析型液相色谱进行分离纯化,制备抗氧化效果最佳的多肽组分;然后,经液相色谱-质谱串联法鉴定多肽组分的氨基酸序列,并利用分子对接技术研究多肽清除ABTS阳离子自由基的能力,以揭示雨生红球藻抗氧化肽的一级结构,阐明抗氧化肽的作用机理;基于秀丽隐杆线虫模型研究藻多肽的体内抗氧化活性。为雨生红球藻渣的高值化利用提供依据,并为食源性抗氧化剂的生产提供开发思路。
1 材料与方法
1.1 材料与试剂
雨生红球藻渣由荆州市天然虾青素有限公司提供。野生型N2线虫购买于Caenorhabditis Genetics Center。大肠杆菌(Escherichia coli)OP50由华南农业大学资源环境学院惠赠。
碱性蛋白酶(200 000 U/g)、ABTS(98%)、链霉素硫酸盐(分析纯,98%)上海源叶生物科技有限公司;技术琼脂粉、胰蛋白胨 广东环凯微生物科技有限公司;胆固醇、次氯酸钠溶液(分析纯)上海易恩化学技术有限公司;MDA试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、过氧化氢酶(catalase,CAT)试剂盒、二奎啉甲酸(bicinchoninic acid,BAC)总蛋白定量试剂盒 南京建成生物工程研究所;纯化鉴定中的试剂均为色谱纯,其他试剂均为分析纯。
1.2 仪器与设备
AL104天平 瑞士梅特勒-托利多公司;PB-10 pH计赛多利斯科学仪器(北京)有限公司;HSJ-2A磁力水浴锅 常州澳华仪器有限公司;超滤管(3、10 kDa)美国Millipore公司;PREP 150LC制备型液相色谱分析仪美国Waters公司;LC-10AT VP Plus分析型液相色谱仪日本Shimadzu公司;ALPHA 2-4 LDplus冷冻干燥机德国Marin Christ公司;JXFSTPR-32全自动样品快速研磨仪 上海净信实业发展有限公司;EnSpire多功能酶标仪 美国PerkinElmer公司;生化培养箱 宁波莱福科技有限公司。
1.3 方法
1.3.1 雨生红球藻酶解物制备
参考前期研究的方法[10],用碱溶酸沉法从雨生红球藻渣中提取蛋白质,然后在底物质量浓度9 g/100 mL、加酶量质量分数0.7%、温度40 ℃、pH 11.5和3 h的条件下,加入碱性蛋白酶进行酶解,酶解结束后以6 000 r/min转速离心20 min,将上清液进行冷冻干燥,获得雨生红球藻酶解物。
1.3.2 分离纯化
1.3.2.1 超滤[22]
利用分子质量为10 kDa和3 kDa的超滤膜依次对雨生红球藻酶解物进行纯化,得到3 个分子质量不同的组分,收集各组分并进行冻干,以评价各组的ABTS阳离子自由基清除活性,并选出最优组分进一步分离纯化。
1.3.2.2 制备型液相色谱
参考Kim等[23]方法,利用SunFire Prep C18OBD色谱柱(19 mm×250 mm,5 μm),在制备型高效液相色谱系统上对超滤组分进行分离纯化。色谱条件:流动相A为体积分数0.1%三氟乙酸溶液,流动相B为乙腈;线性梯度洗脱程序:0~18 min,90%~67.5% A、10%~32.5% B,流速5 mL/min,检测波长214 nm,重复多次进样收集各分离峰,冷冻干燥后测量各峰组分的ABTS阳离子自由基清除活性,选出活性最强的组分进行下一步分离。
1.3.2.3 分析型液相色谱
根据Agrawal等[24]方法,利用Diamonsil C18分析液相色谱柱(4.6 mm×250 mm,5 μm),在分析型高效液相色谱系统上对一次分离所得组分进行分离纯化。色谱条件:流动相A为体积分数0.1%三氟乙酸溶液,流动相B为乙腈;线性梯度洗脱程序:0~10 min,90% A、10% B;10~20 min,90%~80% A、10%~20% B;20~22 min,80%~90% A、20%~10% B,流速0.5 mL/min,检测波长214 nm,富集各分离峰,冷冻干燥后测量各峰组分的ABTS阳离子自由基清除活性,选出活性最强的多肽组分。
1.3.3 结构鉴定
参考Xia Zhen 等[25]方法,采用高效液相色谱-串联质谱(high performance liquid chromatographytandem mass spectrometry,HPLC-MS/MS)法对多肽组分进行氨基酸序列测定。色谱条件:C18反相色谱柱(Acclaim PepMap RSLC,75 μm×25 cm,2 μm,100 Å);流动相A为0.1%甲酸-水,流动相B为80%乙腈溶液(含0.1%甲酸);梯度洗脱程序:0~60 min,95%~62% A、5%~38% B。质谱条件:采用ThermoFisher Q Exactive系统结合纳升喷雾Nano Flex离子源,喷雾电压为1.9 kV,离子传输管加热温度为275 ℃。采用PEAKS Studio 8.5(Bioinformatics Solutions Inc.Waterloo,加拿大)软件对原始文件进行分析,并根据样本种类对目标蛋白数据库在Uniprot中进行检索。
1.3.4 分子对接筛选
参考Agrawal等[24]方法,利用Chemdraw 19.0绘制多肽的三维结构,并从PubChem(https://pubchem.ncbi.nlm.nih.gov/)中下载ABTS阳离子自由基配体分子的结构(CID号:6301202)。对多肽结构进行优化后,在Autodock 4.2.6软件进行多肽与ABTS阳离子自由基的分子对接,对接结果的二维与三维结构可在Ligplot 2.1和PyMOL软件查看。
1.3.5 ABTS阳离子自由基清除活性的测定
参照贾晓燕等[26]方法测定ABTS阳离子自由基清除率,并稍作修改。配制ABTS阳离子自由基储备液(终浓度为7 mmol/L ABTS和2.45 mmol/L过硫酸钾),并在室温黑暗环境中静置过夜。测定前用0.01 mol/L磷酸缓冲液(pH 7.4)稀释成ABTS阳离子自由基工作液,使溶液在734 nm波长处的吸光度为0.70±0.05。测定时,在96 孔板中加入100 μL ABTS阳离子自由基工作液和100 μL待测样品,于室温黑暗处放置10 min,测定波长734 nm处的吸光度;同时空白组数值由100 μL ABTS阳离子自由基工作液与100 μL三级水反应获得,对照组由100 μL磷酸缓冲液混合100 μL待测样品获得。
式中:A0为空白的吸光度;A1为样品的吸光度;A2为对照的吸光度。
1.3.6 利用秀丽线虫测定抗氧化活性[27]
秀丽线虫在含有线虫生长培养基(nematode growth medium,NGM)琼脂的培养皿上生长,并置于20 ℃的培养箱中培育。为保证样品纯度,通过固相合成法制得雨生红球藻抗氧化肽(Haematococcus pluvialisantioxidant peptide,HPp,纯度99.21%)。将多肽样品溶解在蒸馏水中,并以体积比5∶95与大肠杆菌OP50混合,配制最终浓度分别为0、50、100 μmol/L和200 μmol/L的菌液,接种在NGM板中作为秀丽线虫的食物。使用裂解法获得同一时期的虫卵,待秀丽线虫的受精卵发育至L4期,完成同期化。
在秀丽线虫完成同期化后喂食药物,当处理4 d时,用M9缓冲液冲洗,低温研磨,除去沉淀后得到线虫研磨液,5 000 r/min离心10 min,取线虫研磨物的上清液。用BCA试剂盒测定各组秀丽线虫研磨液的蛋白含量,并使用相应试剂盒测定MDA含量和SOD、CAT活力。
1.4 数据处理
2 结果与分析
2.1 雨生红球藻抗氧化肽的分离纯化
2.1.1 抗氧化肽的超滤分离纯化
通过碱性蛋白酶水解得到的产物需要进一步纯化和富集,以获得特定生物活性的多肽。以分子质量为纯化标准,酶解物经超滤分离得到3 种分子质量不同的组分,分别为F1(>10 kDa),F2(3~10 kDa)和F3(<3 kDa),结果见图1所示。结果表明,F3在3 个组分里的ABTS阳离子自由基清除能力最强,在0.25 mg/mL的清除率达(38.11±1.11)%(P<0.05)。研究表明分子质量是影响多肽抗氧化活性的关键因素[2]。小分子肽因体积小更容易被人体吸收,或更易与目标自由基相互作用,能更好地发挥活性,从而具有更强的抗氧化效果[5]。据报道,抗氧化肽的分子质量通常在200~2 000 Da范围内,超滤组分F3在该分子质量范围[28]。因此,确定组分F3为进一步分离对象。

图1 超滤组分F1、F2和F3的ABTS阳离子自由基清除能力Fig.1 ABTS radical cation scavenging capacity of ultrafiltration fractions F1,F2 and F3
2.1.2 抗氧化肽的制备型液相色谱分离纯化
反相液相色谱技术通过连续相和流动相将物质从混合物中分离出来,现已被广泛应用于多肽纯化中[29]。使用制备型液相色谱仪对组分F3进一步纯化,在不同保留时间下依次收集组分I~VI,如图2A所示,分离得到6 个组分I、II、III、IV、V和VI。
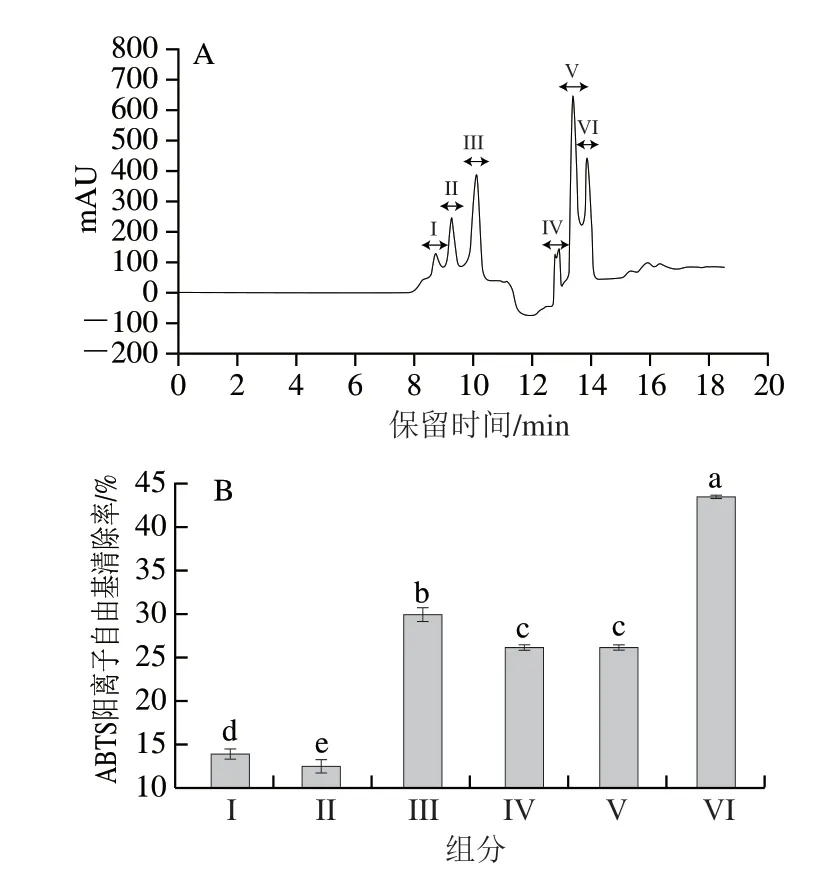
图2 组分I、II、III、IV、V和VI的HPLC图(A)和ABTS阳离子自由基清除率(B)Fig.2 Chromatograms (A) and ABTS radical cation scavenging capacity (B) of six subfractions purified by preparative HPLC
由图2B可知,组分VI在0.25 mg/mL的ABTS阳离子自由基清除率达(43.37±0.19)%,显著高于其他组分(P<0.05)。多肽的疏水性质与抗氧化活性密切相关,色氨酸、脯氨酸等疏水性氨基酸能够促进肽在脂质-水界面处溶解,从而更高效地清除自由基[2]。根据C18色谱柱的分离原理,最后一个响应峰对应的极性最小,其疏水性很大概率比其他组分大,这也可能是VI抗氧化活性强于其他组分的原因。因此,选择VI组分参与下一步纯化。
2.1.3 抗氧化肽的分析型液相色谱分离纯化
为达到精密度更高的纯化效果,使用分析型液相色谱进一步对组分VI分离,得到3 个组分i、ii和iii。如图3所示,组分i的ABTS阳离子自由基清除活性显著高于组分ii和iii(P<0.05),在0.25 mg/mL质量浓度下清除率达(96.97±2.00)%。
汇总后可知(表1),经过3 个分离步骤的纯化,雨生红球藻蛋白酶解物的ABTS阳离子自由基清除率逐步增强(P<0.05),超滤组分F3、制备液相组分VI和分析液相组分i的清除活性分别是蛋白酶解物的1.16、1.33 倍和2.96 倍,这也充分说明分离纯化可有效筛选活性组分。因此,富集组分i进行结构鉴定,以探明雨生红球藻抗氧化肽的一级结构。

表1 雨生红球藻源不同纯化多肽组分的ABTS阳离子自由基清除活性Table 1 ABTS radical cation scavenging capacity of protein hydrolysate from H.pluvialis and its peptide fractions
2.2 雨生红球藻抗氧化肽的结构鉴定
目前常用的多肽结构鉴定方法有蛋白质/肽序列分析仪法、质谱法和核磁共振等方法,其中质谱法具有高灵敏度和高效率等优点,适用于肽类物质的一级结构检测[11]。因此,本研究采用HPLC-MS/MS法检测雨生红球藻抗氧化多肽组分i的组成及序列。检测方法的扫描范围为m/z100~1 500,通过PEAKS Studio软件进行数据处理和De novo分析。经过Uniprot数据库检索,得到10 个多肽序列,命名为i-1~i-10,其肽段信息见表2所示,肽链质谱图见图4。

表2 雨生红球藻多肽的结构鉴定Table 2 Structural characterization of H.pluvialis peptide fractions
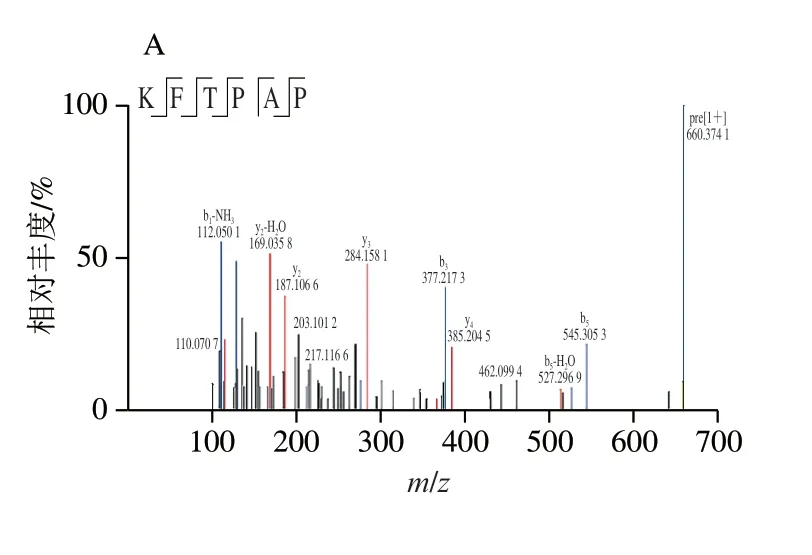

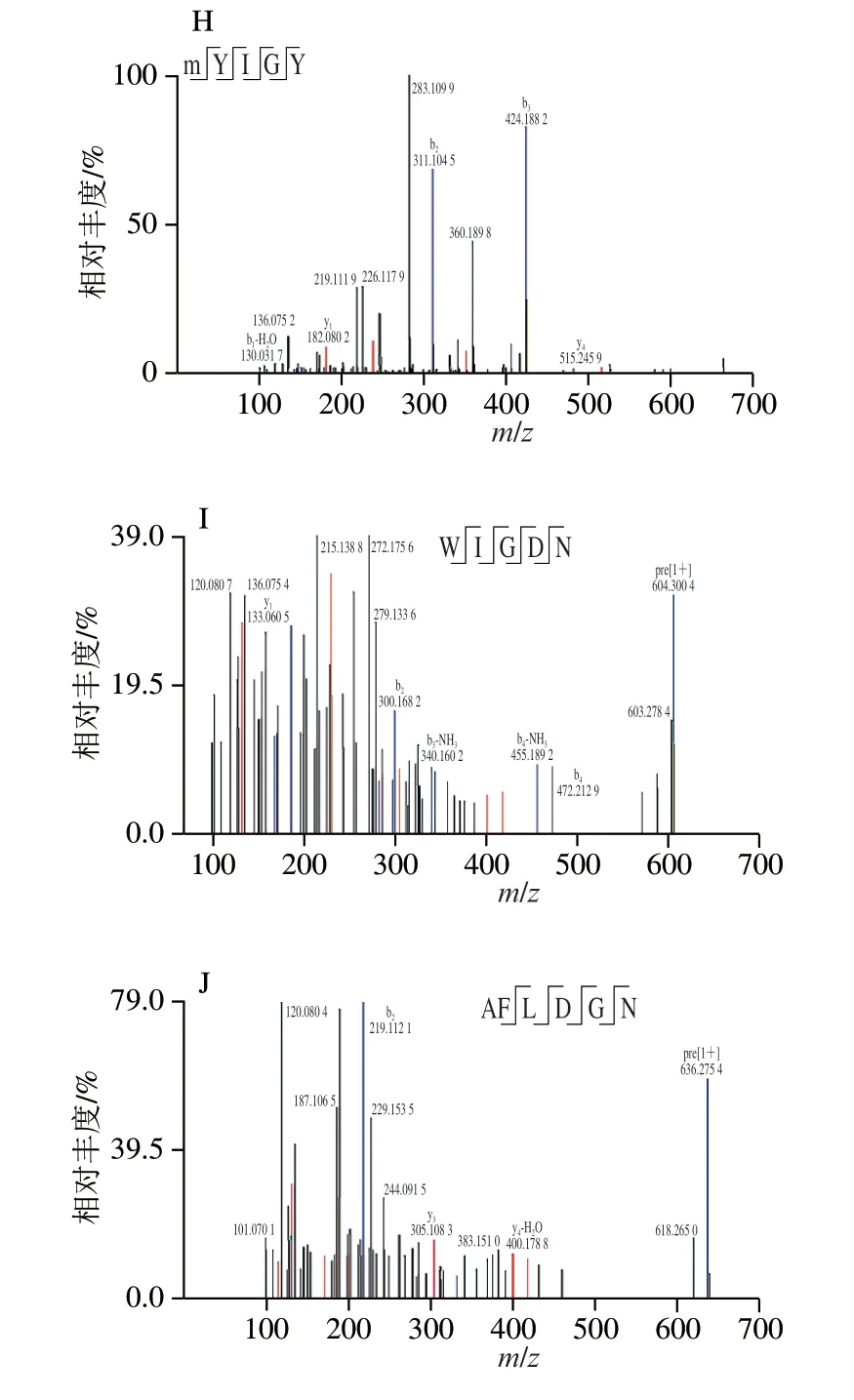
图4 雨生红球藻多肽i-1~i-10的二级质谱图Fig.4 Secondary mass spectra of H.pluvialis peptides i-1 to i-10
由表2可知,i-1~i-10的肽链长度均在5~10以内,分子质量在576.29~736.35 Da范围内,这些肽链的尺寸符合大部分抗氧化肽的结构特征[28]。另外,所有多肽序列的疏水性氨基酸含量均在60%以上,其电离性质具有一定优势,可能增强多肽的抗氧化能力[30]。结果表明部分肽链序列来自叶绿素,而叶绿素已被证明是生产生物活性肽的良好蛋白原料[31]。作为光合作用的位点,叶绿体是细胞中自由基的主要来源,因此需要强大的防御系统以保护自身的完整性[32]。面对氧化应激、强光胁迫等极端信号时,叶绿体会促进细胞器内蛋白酶的运作,以叶绿素结合蛋白等为底物,产生相应活性的多肽作出抗逆响应,进而促进防御基因表达和相应次级代谢物合成[33]。因此推断来源于叶绿素的多肽具有强抗氧化能力的原因,可能与叶绿体应对氧化应激的机制有关。曾有学者发现在极大螺旋藻中,来源于叶绿素蛋白的多肽RALGFDFRR比来源于其他蛋白的多肽,具有更大发挥抗氧化活性的潜力[34]。综上所述,本研究推测雨生红球藻抗氧化肽具备分子质量小、疏水性氨基酸含量高、来源于叶绿素蛋白等特点。
2.3 利用分子对接技术筛选雨生红球藻抗氧化肽
一般而言,分子模拟对接预测的结合能越低,意味着蛋白与配体的相互作用越强、结合越稳定。目前,分子对接技术主要用于抗高血压肽、抗高血糖肽的机制研究,在抗氧化肽的筛选和机理研究方面具有极大潜力。因此,为了高效筛选及精准确定目标多肽,在结构鉴定的基础上,结合利用分子对接技术对雨生红球藻多肽与ABTS阳离子自由基的相互作用展开研究[31,35]。
在进行分子对接之前,采用PeptideRanker系统(http://distilldeep.ucd.ie/PeptideRanker/)对10 条多肽进行初步的生物活性预测[36]。表3显示,i-1~i-10的活性预测得分均高于50 分,表示这些多肽均有大于50%的概率存在生理活性,达到初步筛选的标准。然后,设置ABTS阳离子自由基为配体,通过Autodock软件模拟多肽和配体间的结合情况,比较各肽之间的最小结合自由能(表3)。结果显示i-1~i-8与ABTS阳离子自由基的结合自由能小于0 kcal/mol,表示其能在一般情况下自发地与配体发生相互作用,其中i-1与ABTS阳离子自由基的最小结合能最低,为-5.01 kcal/mol,表示该肽最容易与ABTS阳离子自由基结合,并发挥清除作用,意味着i-1的抗氧化能力最强。

表3 雨生红球藻抗氧化肽的计算机预测结果Table 3 In silico prediction of H.pluvialis antioxidant peptides
借助Ligplot和PyMOL工具,观察i-1与ABTS阳离子自由基在二维与三维空间的具体结合情况,深入解析多肽发挥活性的机理。如图5所示,i-1的氨基酸残基Lys-1、Thr-3与ABTS阳离子自由基形成2 个氢键,长度分别为2.74 Å和3.08 Å;肽链上氨基酸残基Phe-2、Pro-4和Ala-5与配体的苯环产生3 个的疏水作用,这2 种作用力对复合物的形成和稳定十分重要[38]。此外,从对接结合的三维图像图6可知,多肽i-1中Pro-4的五元环与ABTS阳离子自由基的苯环形成类似偏移堆积的结构,这种π-π共轭作用有利于体系的稳定,协助多肽更高效地清除自由基[35,38]。

图5 KFTPAP与ABTS阳离子自由基之间的二维对接结果图Fig.5 Two-dimensional model of KFTPAP binding with ABTS radical cation

图6 KFTPAP与ABTS阳离子自由基之间的三维对接结果图Fig.6 Three-dimensional model of KFTPAP binding with ABTS radical cation
上述结果表明,在10 条多肽中,i-1最有可能具备清除ABTS阳离子自由基的能力,具有最强的抗氧化活性。i-1更易清除自由基的原因,可能不只是高疏水氨基酸含量和低分子质量的单独作用,还综合了其他结构特点的作用,如上述提到的蛋白来源于强抗氧化的叶绿素蛋白,或序列上C端聚集较多疏水性氨基酸等[30-31]。据报道,序列中C端的氨基酸性质对活性物质的生理活性有较大影响[30]。研究表明,C端聚集较多疏水性氨基酸的结构特点有助于提高肽链的trolox等价抗氧化能力、氧化自由基吸收能力和超氧阴离子自由基清除能力,从而提高多肽对机体的抗氧化能力[39]。例如,金乌贼多肽DVEDLEAGLAK通过增强SOD-3的表达,改善秀丽线虫的抗氧化性能,其中原因可能与其序列C端含有大量疏水性氨基酸有关[40]。通过数据库全面检索,目前未有文献报道过此肽,故最终确定i-1为新型HPp,氨基酸序列为KFTPAP。
2.4 HPp的抗氧化能力测定
在执行分子对接程序后,为进一步验证预测结果的准确性,通常会测定目标多肽的功能活性,并结合对接情况解释其作用机理[13]。因此,本实验采用固相合成方法制备HPp KFTPAP,进一步利用秀丽隐杆线虫模型评价多肽的抗氧化能力。机体通过抗氧化酶系统使体内具有抗氧化能力,维持体内氧化还原稳态,如果氧化还原稳态被打破,机体可能会发生氧化损伤,MDA等标志物的含量会相应增加[41-42]。
抗氧化酶系统包括SOD和CAT等,其酶活是评价活性物抗氧化能力的重要指标[43]。对比摄入50、100、200 μmol/L浓度HPp线虫与未摄入HPp线虫的体内抗氧化酶活力,结果如图7、8所示。使用3 个浓度的HPp处理后,线虫的SOD、CAT活力均显示出增强的趋势。其中,100 μmol/L HPp处理组的线虫SOD活力显著高于对照组,酶活增加了8.04%(P<0.05),100 μmol/L和200 μmol/L HPp处理组的线虫体内CAT活力显著高于对照组,酶活分别增加了1.56 倍和1.13 倍(P<0.05)。结果表明HPp能有效改善秀丽线虫的抗氧化酶系统,发挥抗氧化作用。

图7 HPp浓度对秀丽线虫SOD活力的影响Fig.7 Effect of HPp at various concentrations on SOD activity of C.elegans
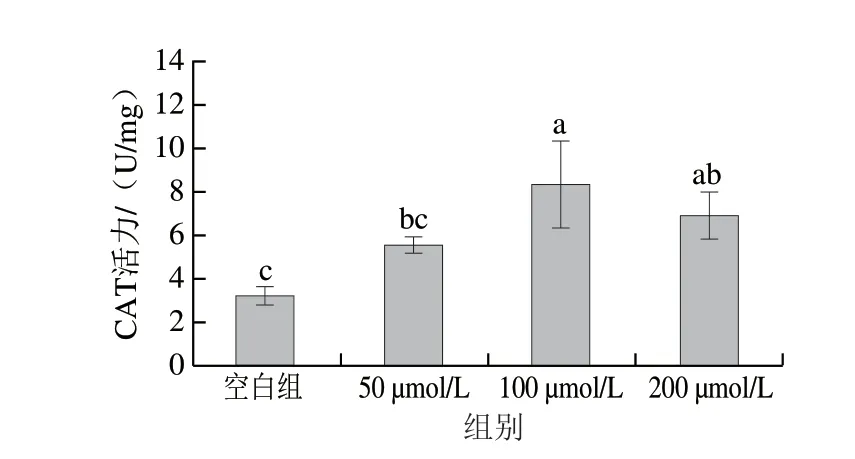
图8 HPp浓度对秀丽线虫CAT活力的影响Fig.8 Effect of HPp at various concentrations on CAT activity of C.elegans
体内自由基含量过多会引发脂质过氧化,生成大量MDA,从而加剧机体的氧化损伤[42]。HPp对线虫体内MDA含量的影响如图9所示。低、中浓度HPp的摄入能有效降低线虫的MDA水平。用100 μmol/L HPp培养线虫后,其体内MDA含量显著下降了38.8%(P<0.05)。结果表明HPp能有效降低秀丽线虫体内MDA含量。

图9 HPp浓度对秀丽线虫MDA含量的影响Fig.9 Effect of HPp at various concentrations on MDA content in C.elegans
与Wang Yali等[44]研究的牦牛骨胶原蛋白肽UU1(GASGPMGPR)相比,HPp能更大程度地提高秀丽线虫的抗氧化性能,包括CAT活力和MDA含量。原因可能是多方面的,除了比UU1分子质量小,具有更易被机体吸收作用的优势外,HPp的结构中还含有苯丙氨酸,其中的芳香环和酚羟基可通过电子共振或电子离域,将ROS转化为更稳定的苯氧基,从而抑制自由基介导的过氧化链式反应。此外,芳香环还能与羟自由基发生反应,增强抗氧化功效[4]。研究发现,米糠肽KHNRGF和大豆多肽FDPAL在序列上同样含有苯丙氨酸,这些多肽均有效地改善线虫的抗氧化性能,包括增强SOD活力、减少ROS含量等,进一步验证苯丙氨酸能提高HPp抗氧化能力[45-46]。由此可见,HPp可显著改善秀丽线虫体内的抗氧化能力,其浓度为100 μmol/L时效果最佳。
3 结论
本研究利用分离纯化、结构鉴定和分子对接技术,从藻渣酶解物中制备获得具有较强活性的HPp,并评价体内抗氧化活性。基于抗氧化活性的全程跟踪,经超滤、制备型和分析型液相色谱三级分离后,纯化多肽组分ABTS阳离子自由基清除能力比蛋白酶解物分别高1.16、1.33 倍和2.96 倍。分析液相组分i具有最强的抗氧化能力,0.25 mg/mL组分i的ABTS阳离子自由基清除率达(96.97±2.00)%。对组分i进行HPLC-MS/MS鉴定,获得10 条多肽序列(i-1~i-10),这些多肽的肽链长度均在5~10以内,分子质量在576.29~736.35 Da范围内,且疏水性氨基酸含量均在60%以上,符合抗氧化肽的结构特点。运用分子对接技术对10 条多肽进行筛选预测,结果显示i-1与ABTS阳离子自由基之间最小结合能最低,氨基酸残基跟配体产生2 个氢键、3 个疏水作用,并在三维空间形成π-π共轭作用。这意味着i-1的抗氧化能力最强,因此确定KFTPAP为HPp的序列。体内实验进一步表明,HPp能有效提高秀丽线虫的抗氧化能力,体现在SOD、CAT活力及MDA含量。HPp在100 μmol/L时抗氧化作用效果最优,增强SOD活力8.04%,提高CAT活力1.56 倍,并降低MDA水平38.8%。本团队推测HPp的C端聚集疏水性氨基酸、含有苯丙氨酸和来源于叶绿素蛋白,可能是HPp具有较强抗氧化能力的原因。研究结果可为雨生红球藻渣的高值化利用提供依据,并为食源性抗氧化剂的开发提供思路。
