Bifidobacterium pseudolongum JNFEN6低聚木糖利用效率评价及转录组学分析
2023-12-14章洁瑜仝艳军杨瑞金
章洁瑜,仝艳军,杨瑞金
(江南大学食品学院,江苏 无锡 214122)
双歧杆菌是一种杆状、不产气的革兰氏阳性厌氧菌,它可以通过产生有机酸和抗菌肽抑制肠道病原体,是一类公认安全的益生菌[1]。双歧杆菌可以利用各种在上消化道中不被降解的膳食纤维,其中大部分是植物来源的多糖和低聚糖[2]。低聚木糖(xylooligosaccharide,XOS)是由D-木糖通过β-1,4糖苷键连接而成的线性低聚糖,其聚合度为2~12[3]。XOS是益生元的一种,存在于蜂蜜、水果、蔬菜和麦麸中[4],具有调节肠道菌群、调节血糖和改善脂质代谢等生理功能[5-7]。研究表明,益生元可以促进益生菌在人体中增殖、抑制有害菌生长,从而改善人体肠道微生态、提高人体免疫力[8-9]。
XOS可以使部分双歧杆菌增殖,具有很强的双歧特性,且不同的双歧杆菌对XOS的利用也存在差异。Mäkeläinen等[10]对双歧杆菌和乳杆菌在XOS、木聚糖、低聚半乳糖等唯一碳源培养基上的生长特性进行测定,结果表明,Bifidobacterium animalissubsp.lactisHN019、B.animalissubsp.lactisBB12、B.animalissubsp.lactisBi-07等乳双歧杆菌能够利用不同聚合度的XOS,而B.breveBb-03、B.longumsubsp.longumKC-1、B.longumsubsp.infantisDSM20088等双歧杆菌不能有效利用XOS。Palframan等[11]对不同双歧杆菌碳水化合物偏好性进行探究,结果表明,B.bifidum能在XOS唯一碳源培养基中生长且生长趋势优于在木糖唯一碳源培养基,这种生长优势与体内发酵及特殊的寡糖转运机制有关。在细胞生理学方面,通过XOS增殖的双歧杆菌具有木糖苷酶活性并可以产生大量的短链脂肪酸。Hyun等[12]从B.breveK-110中分离出一种木糖苷酶,其Km和Vmax分别为1.45 mmol/L和10.75 μmol/(min·mg)。Usta-Gorgun等[13]发现,用含兰花块茎粉末的培养液对不同种类的双歧杆菌进行发酵后,其发酵液中含有乙酸、丙酸、丁酸等短链脂肪酸。在转录组学方面,Song Angxin等[14]探究长双歧杆菌在阿拉伯木聚糖唯一碳源培养基上的摄取机制,结果表明,长双歧杆菌对阿拉伯木聚糖的摄取过程分为特定结构被细胞表面的结合蛋白识别及通过ABC(ATP binding cassette)转运蛋白直接转运至细胞中两部分。Yang Jian等[15]研究B.adolescentis15703代谢XOS的机制,结果表明,XOS可以增强ABC转运蛋白、半乳糖苷酶、木糖苷酶、葡萄糖苷酶、淀粉酶等参与碳水化合物转运代谢的基因的表达。基于双歧杆菌选择性利用XOS的详细机制仍存在研究空白,本研究通过转录组学分析,对筛得的一株高效利用XOS的假长双歧杆菌进行研究,旨在为双歧杆菌高效利用XOS的机制提供新思路。
1 材料与方法
1.1 材料与试剂
B.breveJNFE6、B.breveJNFE8、B.pseudolongumJNFE5、B.pseudolongumJNFE6、B.adolescentJNFE4、B.adolescentJNFE5、B.longumsubsp.longumJNFE2、B.longumsubsp.longumJNFE3、B.pseudocatenulatumJNFE15、B.bifidumJNFE3、B.longumsubsp.infantisJNFE3均为实验室在前期研究中分离并保存的菌株。
MRS培养基 北京陆桥技术股份有限公司;XOS河南益常青生物科技有限公司;乙酸、丙酸(均为色谱级)上海麦克林生化科技有限公司;对硝基苯酚-β-D-木糖苷 生工生物工程(上海)股份有限公司;溶菌酶(20 kU/mg)、反转录试剂盒 翌圣生物科技(上海)有限公司;实时荧光定量聚合酶链式反应(real-time polymerase chain reaction,real-time PCR)试剂盒 日本Takara公司。
1.2 仪器与设备
AW200SG厌氧工作站 英国Electrotek公司;LDZX-50KBS立式压力蒸汽灭菌器 上海申安医疗器械厂;酶标仪 南京拜尔沃克公司;GC-2010PLUS气相色谱仪 日本岛津公司;H-7000FA透射电子显微镜 日本日立公司;LightCycler 480 II全自动荧光定量PCR系统美国罗氏公司。
1.3 方法
1.3.1 不同菌株利用XOS生长特性的测定
将不同菌株的菌悬液以3%的接种量接种于改良MRS培养基(2% XOS)中,并于37 ℃恒温厌氧培养,在培养24 h时测定不同菌株的OD600nm和pH值。分别以普通MRS液体培养基和无碳源MRS培养基为阳性对照和阴性对照,分析不同菌株利用XOS的差异性[16]。
1.3.2B.pseudolongumJNFE6生长曲线的测定
将菌悬液以3%的接种量接种于改良MRS液体培养基中,于37 ℃恒温厌氧培养,每间隔4 h测定培养基的OD600nm和pH值。分别以普通MRS液体培养基和不添加葡萄糖的MRS培养基作为阳性对照和阴性对照,绘制生长曲线。
1.3.3 短链脂肪酸测定
取500 μL发酵液置于离心管中,加入40 μL体积分数10%H2SO4溶液振荡30 s,提取发酵液中的短链脂肪酸。随后加入1 mL乙醚,振荡30 s,4 ℃、3 000×g离心5 min。向样品中加入0.25 g无水Na2SO4,静置15 min后取200 μL上清液用于气相色谱分析[17]。
1.3.4 胞形态观察
参考Booyens等[18]的方法,取1 mL菌液以3 000×g离心5 min。将离心得到的沉淀用磷酸盐缓冲液(0.01 mol/L)洗涤两次,并缓慢加入4 ℃固定液进行保存。用蒸馏水漂洗样品,并将其置于不同梯度体积分数(50%、70%、90%和100%)乙醇溶液中脱水,每个梯度处理15 min,最后用丙醇处理20 min,包埋剂处理后在70 ℃加热过夜。将样品切片后染色,用于透射电子显微镜观察。
1.3.5β-木糖苷酶的活性测定
胞内粗酶提取物的制备:称取1 g菌泥,加入110 μL磷酸盐缓冲液和70 μL 50 mg/mL溶菌酶溶液,37 ℃水浴30 min,获得粗酶提取物。
对硝基苯酚标准曲线绘制[19]:配制浓度为1 mmol/L的对硝基苯酚溶液,用水稀释制备系列浓度梯度的标准溶液。在200 μL标准溶液中加入600 μL 1 mol/L Na2CO3溶液终止显色,在405 nm波长处测定吸光度。以A405nm为纵坐标,对硝基苯酚浓度为横坐标,绘制标准曲线。
菌体胞内β-木糖苷酶活力测定:反应体系包含10 μL 20 mmol/L的对硝基苯酚-β-D-木糖苷、185 μL 100 mmol/L的邻苯二甲酸氢钾和5 μL粗酶提取物。将混合物在65 ℃中水浴5 min后加入600 μL 1 mol/L Na2CO3溶液终止反应。测定405 nm波长处的吸光度,计算对硝基苯酚产量。一个酶活力单位定义为在该反应条件下,1 min内催化产生1 μmol对硝基苯酚所需要的酶量。
1.3.6 总RNA的提取与测序文库构建
选取以葡萄糖为碳源的对照组和以XOS为碳源的实验组进行转录组的数据测定。将B.pseudolongumJNFE6在37 ℃厌氧条件下培养21 h。在4 ℃、8 000×g离心10 min收集细胞。收集沉淀并使用AxygenTM总mRNA提取试剂盒提取总细菌mRNA。采用TruSeqTMStranded Total RNA Library Prep Kit试剂构建文库。
1.3.7 转录组测序和功能注释
使用Illumina HiSeq平台进行测序。使用DESeq2软件对raw counts进行统计分析,基于差异倍数(fold change,FC)≥2且P<0.05的条件筛选比较组间差异表达基因[20]。将差异表达基因映射到基因本体论(Gene Ontology,GO)数据库和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)数据库以分析其功能和途径。
1.3.8 real-time PCR验证
基于转录组学结果,对关键差异表达基因进行验证。通过MEGA软件比对NCBI数据库中双歧杆菌共有序列并采用oligo软件设计引物。引物序列如表1所示。取不同发酵时间的RNA样本,采用反转录试剂盒进行cDNA合成并用于real-time PCR验证。采用2-ΔΔCt法计算基因相对表达量。
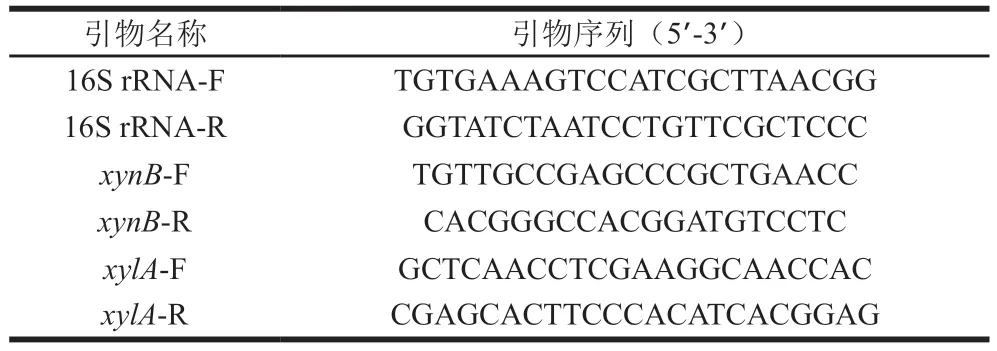
表1 基因引物序列Table 1 Primer sequences used for real-time PCR analysis of gene expression
1.4 数据处理与分析
采用GraphPad Prism 8.0软件进行数据分析和作图。采用单因素方差分析比较组间差异,采用t检验进行显著性分析,P<0.05表示差异显著,P<0.01表示差异极显著,P<0.001表示差异高度显著。
2 结果与分析
2.1 不同双歧杆菌在XOS唯一碳源培养基上的生长特性
通过体外厌氧发酵探究XOS作为唯一碳源对7 种双歧杆菌增殖的影响。以XOS为唯一碳源组作为实验组,葡萄糖为唯一碳源组作为对照组。通过发酵24 h时pH值和OD600nm的变化评价菌株利用XOS的能力。如图1所示,不同双歧杆菌对XOS的利用能力不同。B.breve、B.adolescent、B.longumsubsp.longum几乎不能直接利用XOS生长,这种菌株利用XOS能力的差异可能与糖苷酶有关[21]。实验组中B.longumsubsp.infantisJNFE3在24 h时的OD600nm为0.517,对照组B.infantisJNFE3在24 h时的OD600nm为2.417,是实验组的4.68 倍。实验组中B.pseudolongumJNFE6在24 h时的OD600nm为0.44,对照组B.pseudolongumJNFE6在24 h时的OD600nm为0.59,是实验组的1.1 倍,与实验组差异较小。B.pseudolongumJNFE6在24 h时pH值最低,为4.93;B.pseudolongumJNFE5在24 h时pH值为5.45,均低于其他菌株。B.pseudocatenulatum和B.bifidum均能利用XOS,但其OD600nm均小于0.4。由此可知,假长双歧菌株对于XOS的利用具有特异性,其中B.pseudolongumJNFE6对XOS有较好的利用能力。Hopkins等[22]研究表明,B.adolescentisNCFB 2230、B.bifidumDSM 20082、B.longumsubsp.longumNCFB 2259对XOS利用率很低,仅B.pseudolongumNCFB 2244有明显生长现象,该结果与本实验结果一致。
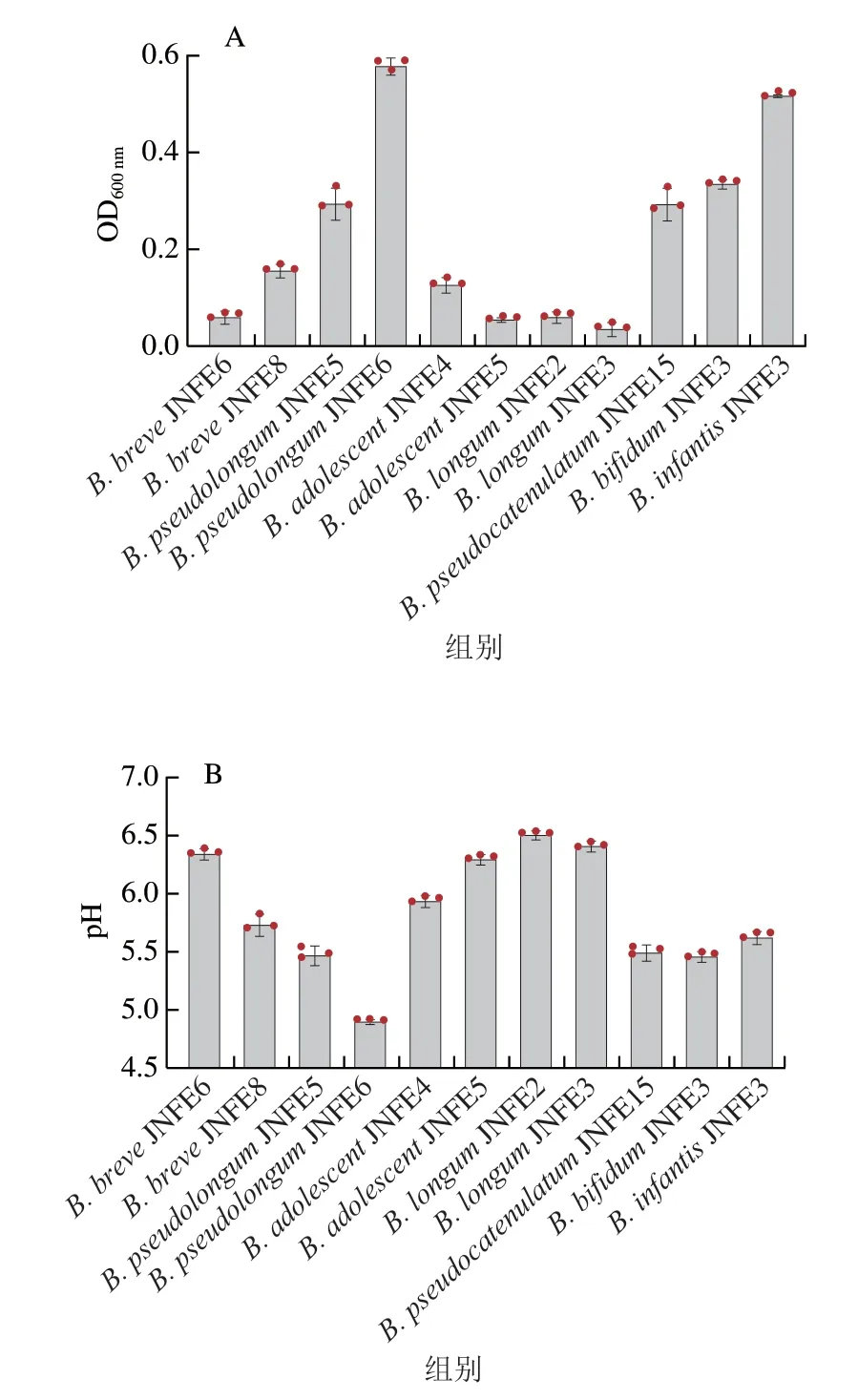
图1 XOS碳源培养基中不同双歧杆菌的OD600nm(A)和pH值变化(B)Fig.1 Changes in OD600nm (A) and pH (B) after 24 h culture of different Bifidobacteria strains using XOS as carbon source
2.2 B.pseudolongum JNFE6生长动力学及发酵液中短链脂肪酸分析
为进一步探索B.pseudolongumJNFE6菌株利用XOS的能力,分析该菌株的生长动力学。如图2A所示,B.pseudolongumJNFE6在葡萄糖培养基和XOS培养基中的生长过程相似,菌体均在发酵培养44 h时达到生长稳定期,其OD600nm分别为0.59和0.46,且发酵体系的pH值分别为4.61和4.7。实验组和对照组的OD600nm相差较大,而pH值却较为接近。XOS进入细胞后,pH值的改变与菌株代谢XOS产生小分子酸相关,间接说明B.pseudolongumJNFE6对XOS的代谢能力很强[23]。
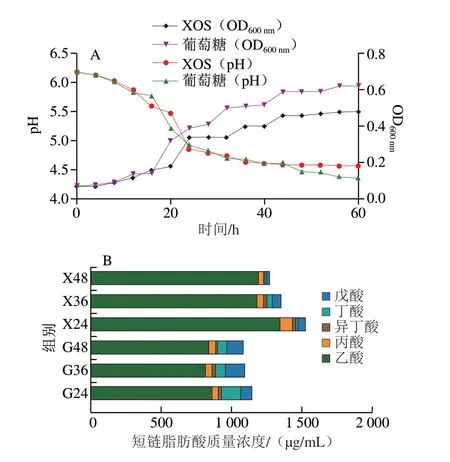
图2 B.pseudolongum JNFE6生长曲线(A)及其在不同底物中产生的总短链脂肪酸含量(B)Fig.2 Growth curve of B.pseudolongum JNFE6 (A) and amounts of total short-chain fatty acids produced by B.pseudolongum JNFE6 utilizing different substrates (B)
如图2B所示,在以XOS为碳源时,其发酵液中短链脂肪酸的总含量明显高于以葡萄糖为碳源时;在XOS培养基中发酵培养24 h时,发酵液中的短链脂肪酸总质量浓度为1 531.87 μg/mL,是葡萄糖碳源培养基的1.29 倍。并且在以XOS和葡萄糖为碳源发酵时,乙酸在短链脂肪酸中含量最高,24 h时其质量浓度分别为1 351.12 μg/mL和867.24 μg/mL。同时,以XOS为碳源时可产生大量的丙酸,24 h时其质量浓度为85.26 μg/mL,是以葡萄糖为碳源时的1.93 倍。乙酸含量的升高与双歧杆菌独特的代谢途径有关[24],该代谢能够产生乙酸而不产生气体,以此提高碳的转化率[25]。
2.3 细胞形态及木糖苷酶活性分析
通过透射电子显微镜对不同碳源培养条件下菌体形态进行观察,如图3所示,在XOS碳源培养基和葡萄糖碳源培养基上生长的菌株细胞膜、细胞壁均保持完整。细胞为椭圆状,边缘光滑完整,无运动性,表明XOS对于B.pseudolongumJNFE6不会造成损害。
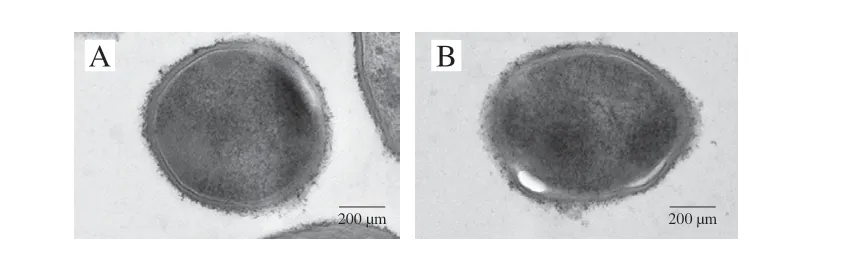
图3 B.pseudolongum JNFEN6在葡萄糖碳源(A)和XOS碳源(B)培养基生长后的形态Fig.3 Morphology of B.pseudolongum JNFEN6 cultured on glucose (A) or XOS (B) as carbon source
β-木糖苷酶是XOS降解的关键酶之一,XOS进入细胞后被β-木糖苷酶水解为木糖[26]。B.pseudolongumJNFE6在XOS培养基中的β-木糖苷酶活力在24~36 h逐渐升高,然后随发酵时间延长而降低(图4),在36 h时β-木糖苷酶活力最高,为0.97 U/mL,是对照组的4.85 倍。葡萄糖培养基中的β-木糖苷酶活力较低。因此,XOS的存在可能对β-木糖苷酶活力的提高有诱导效应。
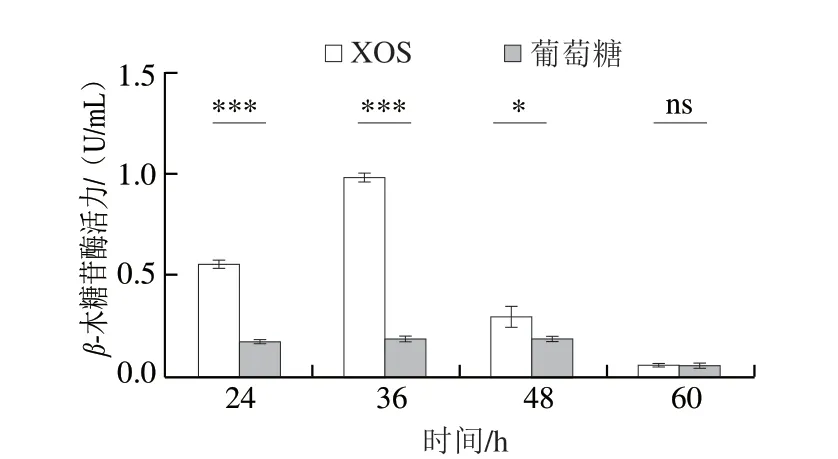
图4 B.pseudolongum JNFE6中β-木糖苷酶活力在葡萄糖碳源和XOS碳源培养基生长期间的变化Fig.4 Changes in β-xylosidase activity during the growth of B.pseudolongum JNFE6 on glucose or XOS as carbon source
2.4 Illumina HiSeq mRNA测序及质量评估
将Illumina HiSeq测序得到的原始图像转化为序列数据。经过数据过滤后,结果如表2所示。原始碱基错误率均小于0.1%,Q20和Q30均高于90%,表明该文库碱基质量良好,可用于后续分析。
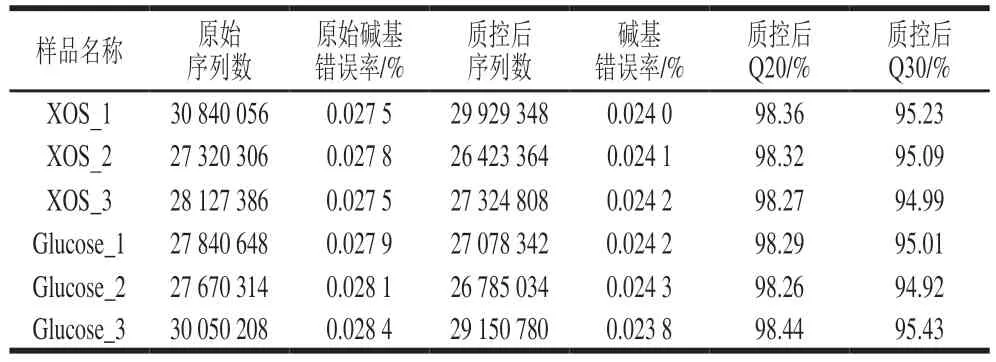
表2 转录组测序数据质控Table 2 Quality control of transcriptome sequencing data
饱和度曲线表示绝大多数表达基因的覆盖量,基因覆盖率分析评估所得序列的基因分布程度。如图5所示,饱和度总体质量较高,测序能覆盖绝大多数的表达基因。由图6可知,测序所得序列在基因上均匀分布,无偏向性。
图5 XOS组(A~C)及葡萄糖组(D~F)的测序饱和度曲线Fig.5 Sequencing saturation curves of XOS (A-C) and glucose groups (D-F)
图6 测序覆盖度Fig.6 Sequencing coverage analysis
2.5 差异表达基因分析
菌体在对数生长中期产生的多糖及次级代谢物较少,因此选择培养时间为21 h的总RNA构建cDNA文库。如图7所示,对照组有1 832 个表达基因,实验组有1 840 个表达基因。两组表达基因共有数为1 831,表现出99.57%的相似性。使用DESeq2进行基因表达差异分析。如图7所示,共有297 个差异表达基因,其中有136 个上调基因,占总差异表达基因的45.79%;161 个下调基因,占总差异表达基因的54.21%。
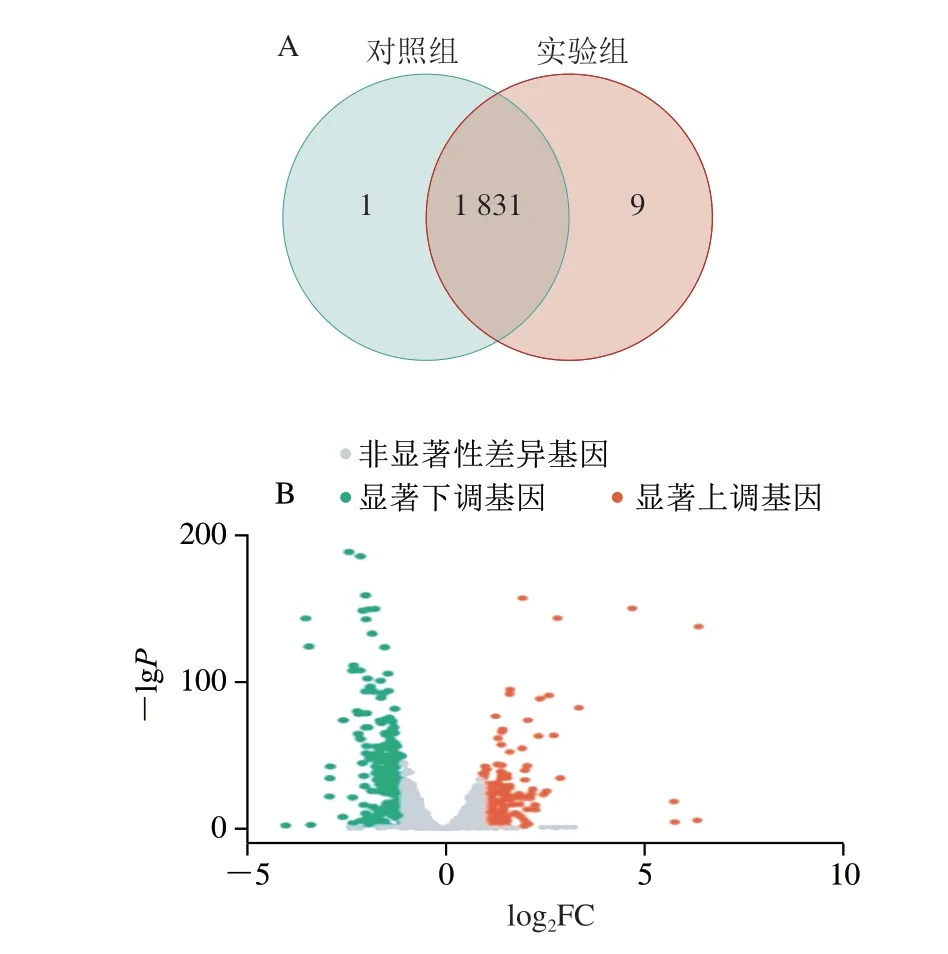
图7 差异表达基因样本间Venn图(A)及火山图(B)Fig.7 Venn diagram (A) and volcano map (B) of differentially expressed genes between samples
2.6 转录组反应全局分析
通过GO注释分析对差异表达基因进行功能注释。如图8所示,差异表达基因分别属于生物过程、细胞成分、分子功能3 个部分。在生物过程中,主要包括碳水化物代谢、翻译、跨膜运输、糖酵解过程,其占比分别为0.033、0.026、0.020、0.013。在细胞成分中,主要包括膜组成、细胞质膜、细胞质、核糖体,其占比分别为0.157、0.057、0.046、0.020。在分子功能中,主要包括ATP结合、DNA结合、水解酶活性、金属离子结合等功能,其占比分别为0.067、0.043、0.036、0.023。其中,基因占比前3的功能分别是细胞膜组成(15.7%)、ATP结合(6.7%)和细胞质膜(5.7%)。其中,细胞膜组成中上调倍数最多的5 个基因包含2 个ABC转运蛋白渗透酶相关基因(msmG、msmF)、2 个结构蛋白相关基因(comEA、comEC)和1 个系统内膜组分家族蛋白相关基因(lplB)。下调倍数最多的5 个基因分别编码ABC转运渗透酶蛋白(gguB)、ATP结合蛋白(ecfTA)、膜反应蛋白(yeaQ)、DUF1295结构域蛋白(ymgE)和FtsX渗透酶蛋白(lolE)。
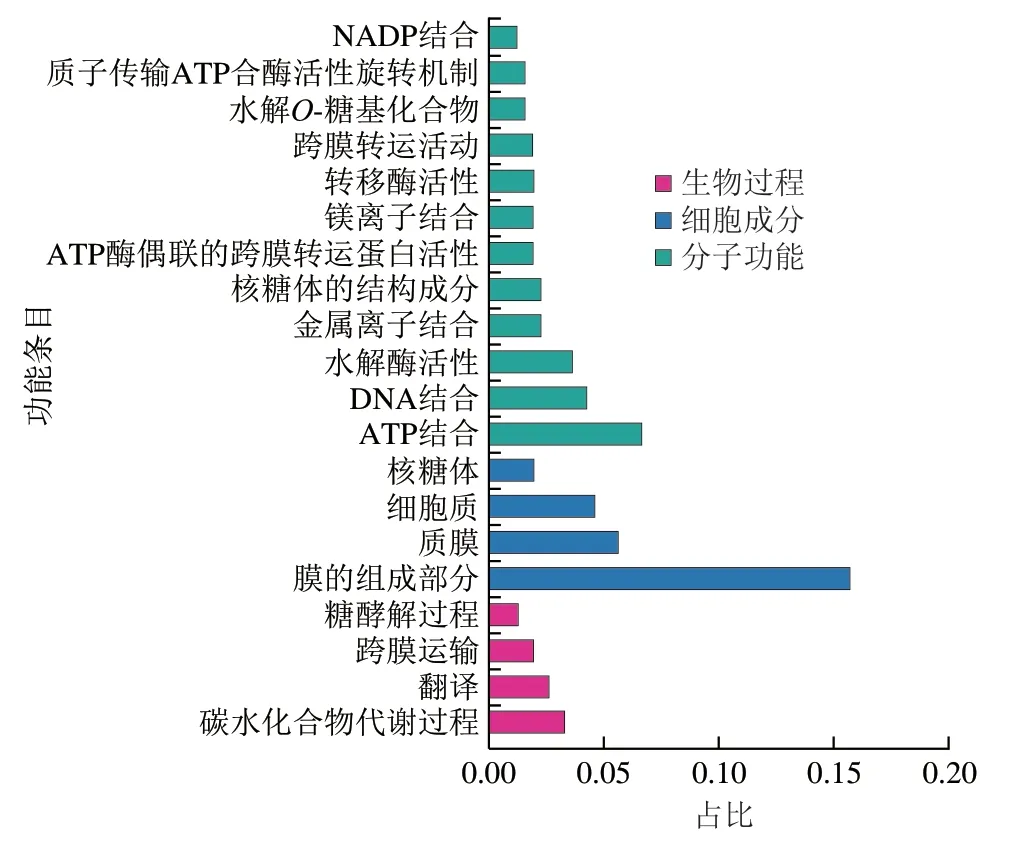
图8 GO注释分析Fig.8 GO annotation analysis
通过KEGG显著性富集进一步探究差异表达基因参与的途径。与葡萄糖利用途径相比,差异表达基因主要富集在ABC转运系统、半胱氨酸和蛋氨酸代谢、糖酵解、甘氨酸、丝氨酸及苏氨酸代谢及戊糖磷酸途径等过程,分别富集到16、9、7、12、5 个差异表达基因(图9)。ABC转运系统中,13 个基因表达存在显著性差异:msmE(编码胞外溶质结合蛋白),lplB(编码转运系统依赖结合蛋白),lplA(编码ABC转运蛋白底物结合蛋白),efrB(编码ATP结合蛋白),znuA(编码金属结合蛋白),msmG、msmF、lplC、ssuC、lplB(编码ABC转运渗透酶蛋白)显著上调;同时,3 个编码ABC转运相关蛋白的基因在XOS干预后显著下调。
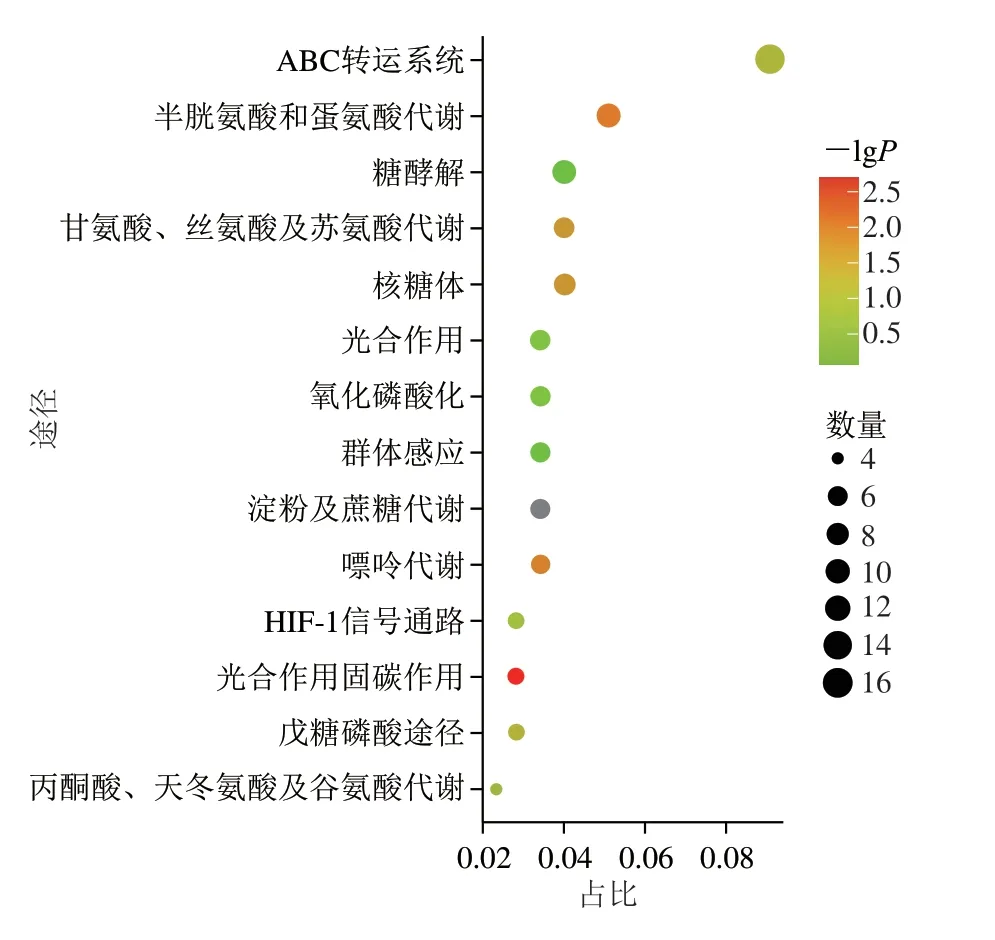
图9 KEGG富集分析Fig.9 KEGG enrichment analysis
2.7 XOS转运和代谢相关差异表达基因
转录组中涉及XOS转运主要差异表达基因如表3所示。双歧杆菌主要通过ABC转运系统、PEP-PTS转运系统、MFS转运系统摄取碳水化合物。ABC转运系统主要包括糖特异性溶质结合蛋白、渗透酶和ATP酶[27]。B.pseudolongumJNFEN6经过XOS培养后,多个ABC转运渗透酶基因上调。其中,msmG、msmF、lplC、ssuC显著表达,FC值分别为26.884、16.746、4.302和3.596。同时,底物结合蛋白基因msmE、lplA(FC值分别为37.685和2.92)和ATP结合蛋白基因lnrL、efrB、msmX(FC值分别为2.834、2.086、1.771)均有不同程度的上调趋势。Webb等[28]报道,多糖代谢转运蛋白MsmEFGK属于ABC超家族,其中msmK编码ATP酶,msmE编码溶质结合蛋白,msmF和msmG为膜蛋白。因此,多糖代谢转运蛋白MsmEFGK可能参与了XOS的转运过程。在其他转运系统中,编码MFS转运体的相关基因araJ、lacY、mef、ydjE(FC值分别为2.1、1.365、1.268、1.22)表达上调而PTS代谢系统相关基因bglF下调,FC值为0.917。戚家明等[29]报道,P.acidilacticiBCC-1和B.lactisB1-04仅通过ABC转运系统转运XOS,而在W.confusaXU1菌株中MFS转运蛋白参与XOS运输,且MFS转运蛋白利用质子动力驱动转运过程。因此,B.pseudolongumJNFEN6可能主要通过ABC转运系统和MFS转运系统摄取XOS。
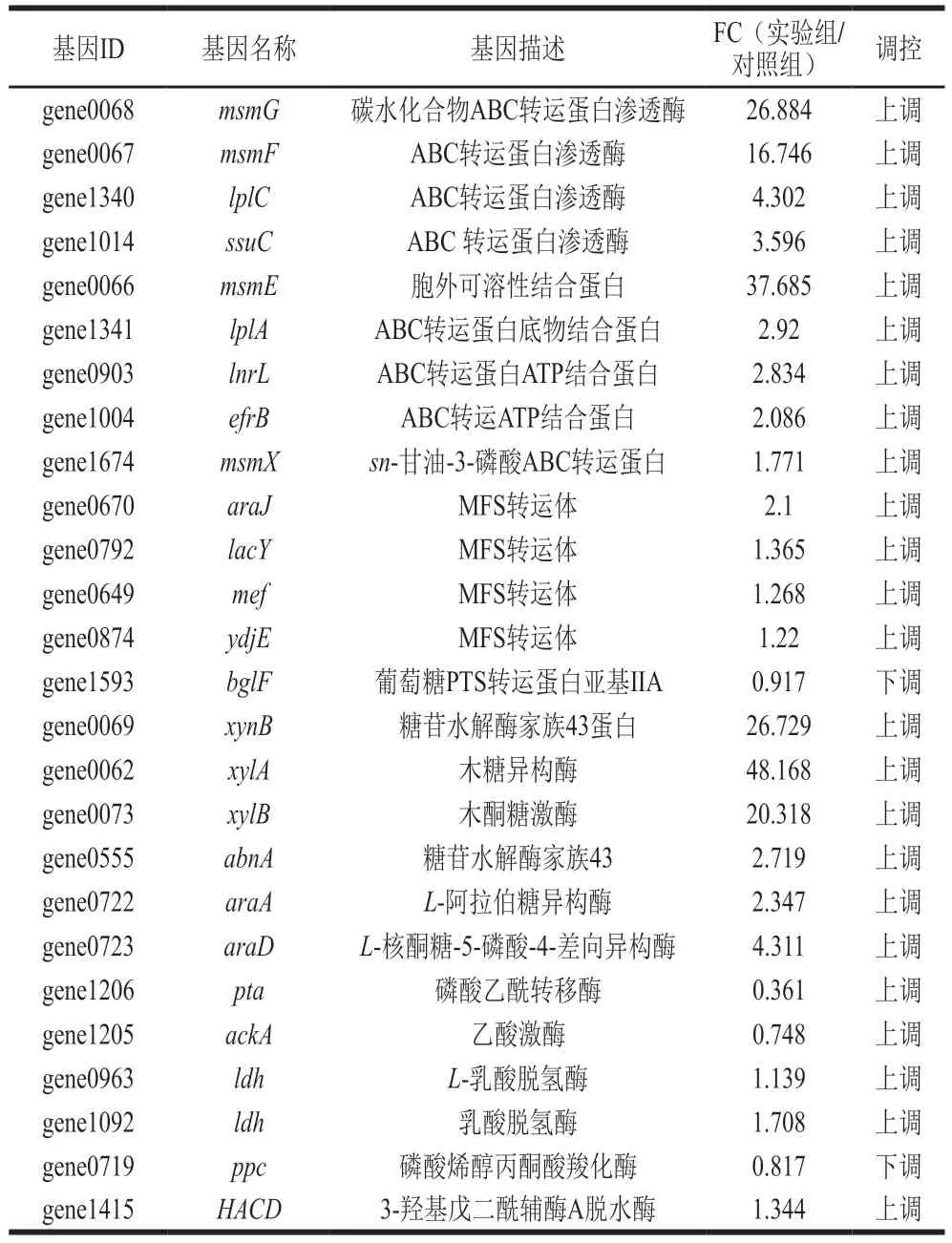
表3 XOS转运及代谢相关基因Table 3 XOS transport and metabolism-related genes
XOS是由木糖基通过β-1,4糖苷键连接组成的低聚物。糖苷水解酶(EC 3.2.1.x)是一组广泛的酶,可以水解两种或多种碳水化合物之间的糖苷键[30]。转录组中涉及碳水化合物代谢主要差异表达基因如表3所示。与对照组相比,实验组中编码GH43糖苷水解酶家族的基因(xynB)显著上调,其FC值为26.729。同时,XOS代谢相关水解酶xylA、xylB、abnA基因表达显著上调,其FC值分别为48.168、20.318和2.719。通过KEGG数据库查询,XOS在GH43家族水解酶(xynB)的作用下水解为木糖,随后在木糖异构酶(xylA)和木酮糖激酶(xylB)作用下转化为5-磷酸-木酮糖。Zhao Lei等[31]对Pediococcus acidilacticiBCC-1进行转录组学分析发现,XOS利用相关酶包括木聚糖酶、木糖苷酶、木糖异构酶和木酮糖激酶。因此,水解酶在XOS代谢过程中具有比较重要的作用。
araA和araD基因的FC值分别为2.347和4.311,它们促进了D-木酮糖-5-磷酸的生成。同时,D-木酮糖-5-磷酸被进一步代谢为乳酸和乙酸。Pontonio等[32]研究L.rossiaeDSM 15814利用XOS、木聚糖、D-木糖等的能力发现,L.rossiaeDSM 15814中存在与XOS代谢相关的ara基因簇。其中,araA编码L-阿拉伯糖异构酶,araD编码磷酸核酮糖差向异构酶。这两个基因共同参与L-阿拉伯糖转化为D-木酮糖-5-磷酸的代谢途径,与本研究结果趋势一致。
双歧杆菌采用“双歧分流”的方式进行代谢。在该种代谢途径中,XOS被转化为己糖发酵途径的中间体,并最终转化为短链脂肪酸和其他有机化合物[33]。转录组中涉及短链脂肪酸生成的主要差异表达基因如表3所示。许多肠道细菌可以通过乙酰辅酶A由丙酮酸生成乙酸,同时也可以通过乳酸由丙酮酸生成乙酸[34]。转录组数据显示,乙酸转移酶(pta)和乙酸激酶(ackA)参与乙酰辅酶A和乙酸的转化并显著下调,而参与乳酸和乙酸转化的乳酸脱氢酶(ldh)显著上调。乳酸脱氢酶的较高表达说明B.pseudolongumJNFE6可能更加倾向于通过乳酸产生乙酸。细菌主要通过琥珀酸途径产生丙酸。磷酸烯醇丙酮酸羧化酶(ppc)在XOS干预后下调,FC值为0.817。磷酸烯醇丙酮酸羧化酶受磷酸烯醇丙酮酸羧激酶控制。琥珀酸盐是丙酸盐的前体,在磷酸烯醇式丙酮酸激酶被抑制的条件下积累。因此,磷酸烯醇丙酮酸羧化酶相关基因的下调有利于丙酸的生成[35]。在丁酸转化过程中,3-羟基丁酰辅酶A脱水酶(HACD)上调,FC值为1.344。丁酸由丁酰辅酶A转化而来,3-羟基丁酰辅酶A脱水酶促进了3-羟基丁酰辅酶A转化为巴豆酰辅酶A,从而进一步生成丁酰辅酶A,有利于丁酸的生成。
2.8 real-time PCR验证
在B.pseudolongumJNFE6发酵培养24、36、48 h后,对FC值分别为48.168和26.729的xylA和xynB基因进行real-time PCR验证。结果表明,扩增曲线仅有一个尖峰,反应产物单一。
如图10所示,xylA基因在不同发酵时间的相对表达量分别为8.15、18.6和13.2。xynB基因在不同发酵时间的相对表达量分别为7.8、13.1和10.8。基因表达显著上调,与转录组结果一致。因此,转录组差异基因表达量具有可靠性。
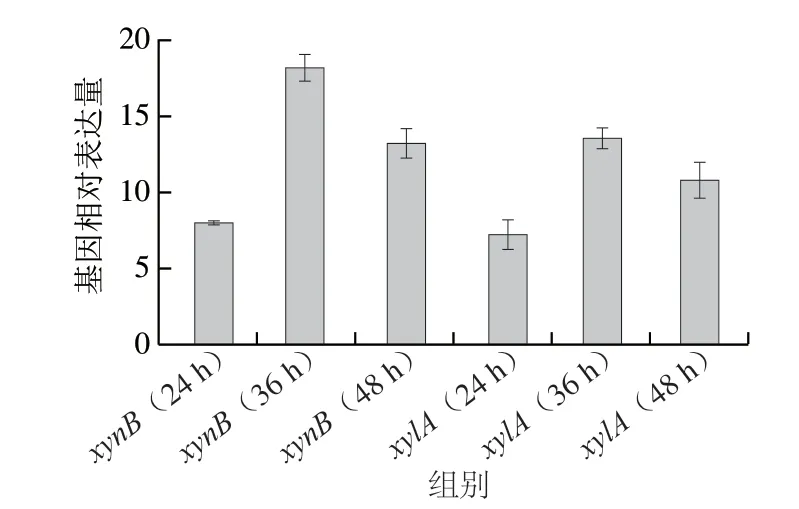
图10 real-time PCR验证Fig.10 Real-time PCR verification
3 结论
首先,基于生长动力学、木糖苷酶活力、短链脂肪酸、透射电子显微镜等从多维度探究B.pseudolongumJNFE6高效利用XOS的机制。其次,基于转录组学对XOS干预后B.pseudolongumJNFE6差异表达基因进行分析,有136 个上调基因和161 个下调基因。这些基因主要集中在XOS的转运和代谢过程中。XOS转运过程中,ABC转运系统和MFS转运系统相关基因显著上调;XOS代谢过程中,水解酶相关基因和乙酸、丙酸、丁酸代谢相关基因表达显著变化。最后,通过real-time PCR验证了转录组学数据的可靠性。
