小鼠慢性酒精中毒性脑损伤模型的建立
2023-12-13瑜王璐婉谢冬琳高大鹏
蔡 瑜王璐婉谢冬琳高大鹏*
(1.浙江药科职业大学,浙江 宁波 315500;2.宁波大学,浙江 宁波 315211;3.宁波大学附属第一医院,浙江 宁波 315020)
酒是人类社会流传下来最古老的饮料之一。无论庆典、社交还是日常生活,酒都是必不可少之物。 但长期过量饮酒会造成酒精滥用及依赖,严重影响学习、记忆和认知等神经功能,是世界范围内最严重的公共卫生问题之一[1]。 据世界卫生组织发表的全球酒精与健康报告指出,全球所有死亡人数的5.9%和全球疾病经济负担的5.1%可归因于过量饮酒[1]。 我国是一个酒类生产和消费的大国,到2030 年中国成人的人均饮酒量将超过美国,成为世界上最大的饮酒国家[1]。 酒精依赖患者由于长期大量饮酒造成的中枢神经系统营养代谢紊乱、神经损伤及神经退行性病变,被称为慢性酒精中毒性脑病[2-3]。 该病临床主要表现有认知功能障碍,包括注意力不集中、记忆力下降和思维能力受损等,后期可出现酒精性痴呆、酒精性谵妄等[4-5]。 临床病例研究发现,长期饮酒造成脑内海马和额叶区域的灰质和白质体积异常减少,提示这些区域有显著的神经元丢失[6]。 过量饮酒对个体、家庭及社会造成了沉重的负担,因此,为探究慢性酒精中毒性脑损伤的发病机制和治疗药物而构建有效稳定的动物研究模型十分重要。
目前,国内外文献报道的常见的动物模型给酒方式包括口服、灌胃、腹腔注射和吸入。 通常,腹腔注射和灌胃方式用于急性饮酒模型,而口服和吸入方式用于慢性的酒精暴露方案[7]。 但是,以上任何一种单一的给酒方式均存在不足,无法满足方便经济、稳定可靠和尽可能模拟人类饮酒的造模要求。因此探索多种给酒方式结合的造模方法可能是解决单一给酒方式局限性的有效途径。 此外,已报道的慢性酒精中毒性脑损伤小鼠模型的评价尚有很多不足。 因此,探索建立多种给酒方式结合的慢性酒精中毒的动物模型,并全面、客观评价脑损伤动物模型具有重要意义。 本实验通过小鼠长期饮用水中添加酒精结合酒精灌胃法,观察小鼠的认知和运动行为学改变以及检测脑组织的形态学变化,构建慢性小鼠酒精中毒性脑损伤模型,为后续慢性酒精中毒性脑病机制的研究和治疗药物的评价建立有效稳定的动物模型。
1 材料和方法
1.1 实验动物
40 只SPF 级C57BL/6J 雄性小鼠,体重(19±1.5)g,7 周龄,购自浙江维通利华实验动物技术有限公司[SCXK(浙)2019-0001]。 实验动物饲养于宁波大学实验动物中心[SYXK(浙)2019-0005]。本实验经宁波大学实验动物中心实验动物伦理委员会审查批准(IACUC-NBU20230138),并在动物饲养和实验过程严格遵循实验动物3R 原则。 所有小鼠适应性喂养1 周后,随机分成对照组20 只和模型组20 只,开始正式实验。
1.2 主要试剂与仪器
北京56°二锅头酒(北京京极酒业有限公司,生产批号:20210827);苏木素-伊红(hematoxylin eosin,HE)染色试剂盒(Solarbio 北京索莱宝科技有限公司,G1120,生产批号:20230217)和尼氏染色试剂盒(焦油紫法)(Solarbio 北京索莱宝科技有限公司,G1430,生产批号:20220214)。 ANY-maze 行为学分析系统(美国stoelting 公司);徕卡RM2235 轮转式切片机(徕卡显微系统(上海)有限公司);光学显微镜(日本Nikon 公司)。
1.3 实验方法
1.3.1 动物模型的建立
根据美国国家酒精滥用与酒精中毒研究所(National Institute on Alcohol Abuse and Alcoholism,NIAAA)的定义,危险饮酒(risky use)是指65 岁以下的男性,每天饮用超过4 个标准杯乙醇。 为了模拟人类酗酒者的每日酒精饮用量,经过体表面积折算,每只小鼠每天的酒精使用量需达到10 g/kg 及以上。 造模过程使用的酒精浓度和实验时长基于预实验的结果,具体动物模型建立过程如下:将56°白酒稀释成5%(v/v)和28%(v/v)两个浓度,模型组小鼠除基础饮用水中含终浓度为5%(v/v)的酒精外,同时灌胃28%(v/v)酒精,前两周灌胃剂量呈梯度增长(从0 逐渐增加至6 g/kg 体重),随后4 周灌胃剂量维持在6 g/kg 体重,对照组饮用水中不添加酒精同时灌胃等量生理盐水。 继6 周的建模过程后,所有小鼠接受认知和运动行为学实验包括Y 迷宫、Morris 水迷宫、爬杆实验和平衡木实验,每个实验之间间隔1 ~3 d,使得动物获得充分的休息。 具体慢性酒精中毒性脑损伤的建模过程和行为学实验时间表见图1。
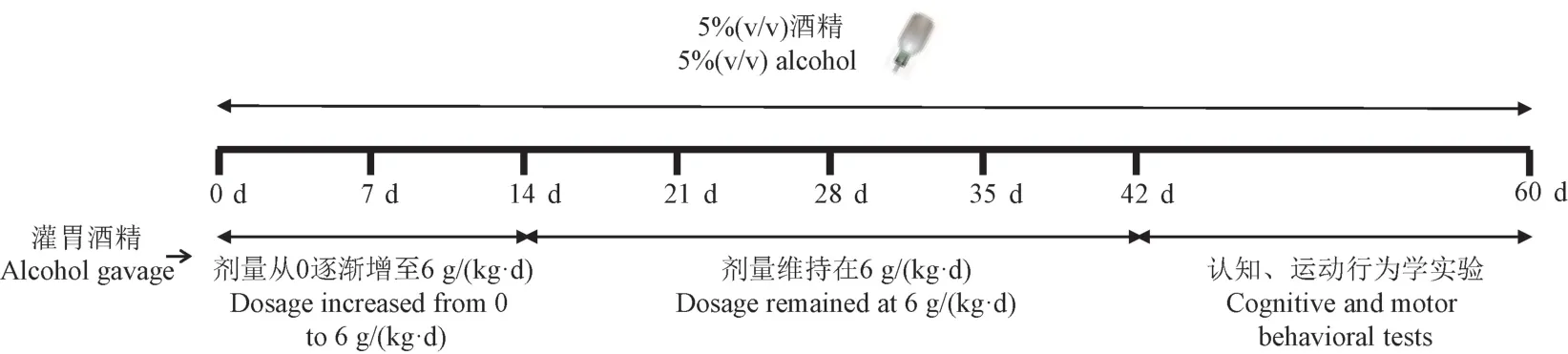
图1 慢性酒精中毒性脑损伤的建模过程和行为学实验时间表Figure 1 Modeling process of chronic alcoholic brain injury and timeline for behavior experiments
1.3.2 行为学测试方法
(1)Y 迷宫实验
Y 迷宫实验参照文献[8]进行并稍有改进。 Y 迷宫装置由三个等长水平臂组成(每个臂长40 cm,宽10 cm,高20 cm),彼此成120°角,从一个中心点向外辐射。 简要步骤如下:小鼠被放置在三个臂的中心,在8 min 的时间里,它们可以自由地出入所有的三个臂。 记录进入三个臂的总次数和进入顺序。交替百分比被定义为连续进入三个不同臂的次数/(总次数-2)。 交替百分比可以作为动物空间工作记忆的指标,而进入三个臂的总次数可以作为动物自发运动的指标。
(2)Morris 水迷宫实验
Morris 水迷宫实验参照文献[9-10]进行并稍有改进。 水迷宫宫体直径125 cm,高75 cm。 内壁涂黑,宫体内充满自来水,水温保持在(23±2)℃。 逃生平台直径9 cm,距离圆周30 cm,置于宫体内坐标位置的第一象限。 简要步骤如下:整个水迷宫实验包括1 d 的适应环境,1 d 的寻找可见平台定位航行,5 d的寻找隐藏平台(平台低于水面0.7 cm)定位航行和去除平台后1 d 的空间探索。 在定位航行过程中,将自由活动的小鼠分别从四个象限随机放入水中,让其在逃生中寻找平台,若90 s 后,小鼠仍未找到平台,则引导小鼠找到平台上,并在平台上待15 s,每天训练3 次;在空间探索过程中,将小鼠从迷宫的固定位置放入水中,让其自由探索60 s。 小鼠活动通过水池上方固定的摄像头进行图像采集并用ANY-mazeTM软件进行处理。 主要观察指标有:定位航行实验中小鼠找到平台的平均逃避潜伏期和平均游泳速度,空间探索实验中小鼠穿越平台的次数、在平台象限的停留时间和搜索路径。 动物在最后1 d 空间探索实验中的表现可以用来全面评估小鼠的空间记忆能力。
(3)平衡木实验
参照Drucker-Colín 等[11]报道的平衡木实验方法并稍有改进,简要步骤如下:取100 cm 长、直径1.8 cm 的圆木棒作为平衡木,平放于地面,两端各一木架支撑(高60 cm)。 其中一端置一黑色塑料笼,为每次实验小鼠的终点。 实验前,训练小鼠从平衡木一端爬行至另一端的塑料笼里,并在笼里待15 s,每只小鼠训练6 次。 训练完毕进行平衡木爬行时间测定,记录每只小鼠在整根平衡木爬行的总时间,作为动物运动和平衡能力的指标。
(4)爬杆实验
参照Arai 等[12]报道的爬杆实验方法并稍有改进。 简要步骤如下:将小鼠放在长50 cm,直径1.2 cm,45°固定的圆木棒上,使肌肉处于静力紧张状态。 先引导动物在15 s 内由杆顶爬至杆底,每只训练4 次,训练完毕进行爬杆时间测定,记录每只小鼠的爬杆时间,作为动物运动协调能力的指标。
1.3.3 脑组织形态学检测方法
将小鼠麻醉后,开胸,左心室插入灌注针头,先灌注生理盐水50 mL,再灌注4%多聚甲醛溶液50 mL,待小鼠全身僵直后,断头处死,冰上取全脑,4%多聚甲醛溶液固定18 h,石蜡包埋,磷酸盐缓冲溶液(phosphate buffered solution, PBS)漂洗,梯度乙醇脱水,石蜡包埋,切片,片厚8 μm,HE 及尼氏染色,光镜观察皮层及海马神经元形态学变化。
1.4 统计学方法
所有数据均以平均数±标准误差(x¯±sx¯)表示,组间比较采用两独立样本t检验进行分析,Morris水迷宫隐藏平台测试期采用two-way ANOVA 进行分析。 所有统计分析及作图均使用GraphPad Prism 9.5.0 软件进行。P<0.05 为差异具有统计学意义。
2 结果
2.1 两组小鼠认知功能比较
在建立慢性酒精中毒性脑损伤模型小鼠的过程中,模型组小鼠体重增长显著低于对照组,从第2周开始直至第6 周,模型组小鼠的体重明显低于同龄的对照组小鼠(图2)。 为了揭示酒精暴露小鼠的空间学习和记忆缺陷,每只小鼠都接受了Y 迷宫测试和Morris 水迷宫测试。 在Y 迷宫测试中,对照组和模型组小鼠进入三臂的总次数没有差异,这表明动物自发活动不受长期酒精暴露的影响。 在Y 迷宫测试中,模型组小鼠的自发交替率低于对照组(P<0.01),提示慢性乙醇处理可诱发小鼠短期空间工作记忆障碍(图2)。
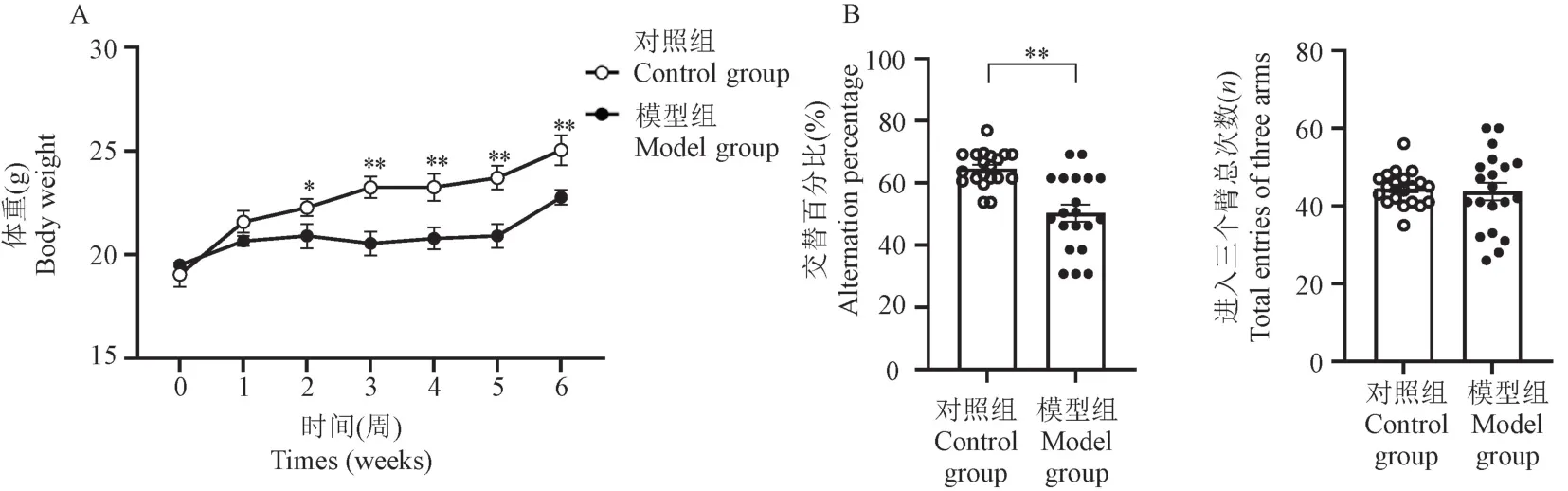
注:A:小鼠体重变化;B:Y 迷宫实验。 与对照组相比, *P<0.05, **P<0.01。图2 小鼠体重和Y 迷宫实验结果比较Note.A, Body weight changes of mice.B, Y maze test.Compared with the control group, *P<0.05, **P<0.01.Figure 2 Comparison of body weights and the performance in Y maze between two groups
在Morris 水迷宫实验结果中,平台测试中两组的逃避潜伏期和平均游泳速度均无显著差异(图3)。 在隐藏平台试验测试中,对于两组小鼠在连续4 d 训练的逃避潜伏期数据进行two-way ANOVA 分析(针对组别和训练天数这两个因素),所得的分析结果说明,无论是组别因素,还是训练天数因素,均对最终的逃避潜伏期有显著影响(分别是P<0.05 和P<0.001),但上述两个因素没有交叉影响(P=0.9313)。

注:A:可见平台测试;B:隐藏平台测试;C:空间探索测试。 与对照组相比, *P<0.05。图3 水迷宫实验结果比较Note.A, Visible platform trial.B, Hidden platform trial.C, Probe trial.Compared with the control group, *P<0.05.Figure 3 Comparison of the results of water maze between two groups
这些分析结果表明,在隐藏平台试验测试中,两组小鼠随训练天数的增加,逃避潜伏期逐渐降低,结果有显著性差异;并且相对于对照组,模型组的逃避潜伏期维持较长时间,结果有显著性差异。此外,对于隐藏平台试验测试的数据进行t检验发现,两组小鼠隐藏平台测试第1 天逃避潜伏期差异无统计学意义。 与对照组相比,模型组在第2 ~4 天逃避潜伏期显著增加(P<0.05)。 在空间探索测试中,长期暴露于酒精的小鼠与对照组小鼠相比,穿越平台次数显著减少(P<0.05)以及在平台象限停留时间百分比显著降低(P<0.05)。 在搜索策略方面,模型组小鼠的路径轨迹不太集中于平台所在象限。 综上,与对照组相比,长期酒精暴露导致小鼠的空间学习和记忆缺陷。
2.2 两组小鼠运动功能比较
在平衡木实验中,模型组小鼠通过平衡木的总时间显著大于对照组(P<0.01),见图4。 在爬杆实验中,模型组小鼠的爬杆时间与对照组相比显著延长(P<0.05),见图4。 综上,与对照组相比,慢性酒精暴露导致小鼠的运动协调能力明显降低。

注:A:平衡木实验;B:爬杆实验。 与对照组相比, *P <0.05, **P<0.01。图4 平衡木和爬杆实验结果比较Note.A, beam balance experiment.B, pole test.Compared with the control group, *P<0.05, **P<0.01.Figure 4 Comparison of the results of beam balance experiment and pole test between two groups
2.3 两组小鼠脑组织形态学比较
HE 染色显示对照组小鼠海马区神经元排列清晰,细胞结构完整、轮廓清晰,而模型组小鼠神经元表型明显收缩变形(图5A),并且,在长期乙醇暴露后,小鼠海马组织CA1 区神经元数量显著减少。 尼氏染色结果进一步证实了两组神经元的这些病理改变(图5B)。 即对照组海马区神经元结构轮廓清晰,而模型组小鼠神经元萎缩,形态破坏。 并且,经长期乙醇暴露后,小鼠海马组织CA1 区神经元数量显著减少。 两组小鼠脑组织病理染色结果表明,与对照组相比,长期乙醇暴露导致小鼠海马区形态损伤和细胞坏死。

注:A:海马组织HE 染色;B:海马组织尼氏染色。图5 海马组织HE 和尼氏染色结果比较Note.A, HE staining of hippocampus.B, Nissl staining of hippocampus.Figure 5 Comparison of the results of HE staining and Nissl staining of hippocampus
3 讨论
酒精使用障碍是发达国家最常见的神经和精神疾病之一,影响全球数百万人[13]。 随着我国社会经济发展,慢性酒精中毒性脑病的发病率逐年上升,但目前尚未得到足够的重视。 为了进一步对长期过量酗酒所致的脑损伤的病理变化和发病机制有更好的研究,探索建立合适的动物模型至关重要。
国内外文献报道的慢性酒精中毒性肝损伤模型和慢性饮酒成瘾/戒断模型及评价已较成熟,而慢性酒精诱导的脑损伤动物模型及评价尚未完善。对于建立慢性酒精中毒性脑损伤动物模型,有一些重要的造模因素需考虑并优化,包括选取的动物种类品系、给予动物酒精的方式、给予酒精的浓度、动物酒精暴露的时间和剂量等。 本研究均通过文献调研结合预实验对上述各因素进行确定并优化,以期得到一种尽可能模拟人类慢性饮酒过程、稳定可靠且造模时间短的脑损伤模型,这也是本研究对于目前已有造模方法的改进创新之处。 具体模型建立过程中,首先,本实验选取了C57BL/6J 品系的小鼠作为建立模型的对象,这向该品系小鼠有较高的自愿饮酒量以及对酒精的生理反应与人类非常相似等特征有关[14]。 尽管国内外文献也选用过BALB/c、ICR 及昆明小鼠作为造模对象[15-17],但总体而言,C57BL/6J 小鼠是目前研究酒精诱导的器官损伤最常用的动物之一。 此外,建立模型过程中,如何给予动物酒精的方式也是需要考虑并优化的。国内外文献报道常见的给酒方式包括口服(含酒精的流质饮食或饮用水)、灌胃、腹腔注射和吸入(暴露于酒精蒸气)。 通常,急性饮酒模型采用的是腹腔注射和灌胃方式,而慢性的动物酒精暴露方案采用口服和吸入方式[7]。 含酒精的流质饮食最早是由Lieber 和DeCarli 开发的,在造模过程中,该饮食作为实验动物唯一的食物和水来源[18-19]。 Lieber-DeCarli 模型虽然造模简便但未模仿人类饮酒。 并且,还存在造模耗时长、饮食种类受限、营养情况与正常饮食时不同等不足。 Tsukamoto-French 模型是通过动物胃内植入导管的方式给予酒精[20],造模过程需要特殊的设备技术和持续的动物监测、成本高,不便于广泛应用。 饮用水中添加酒精的模型是长期乙醇暴露的更实用的解决方案,该模型已用于多种物种,包括小鼠、大鼠和豚鼠[21-22]。 该模型优点是模拟人类饮酒的生理过程、建模方便便宜,可长期给酒(8 个月以上),但存在造模时间长,并且可能无法模拟人类酒精疾病的晚期阶段等不足[23]。de Witte 等[24]开发了一种称为“肺酒精化”的酒精吸入模型,可以长期达到较高的(200 mg/dL)血液酒精水平,适合酒精成瘾方面的研究,但吸入酒精毕竟不同于饮用酒精,不能完全模拟真实情况。 综合考量上述给酒方式的优缺点,此次模型采用饮水中添加酒精+灌胃法,避免单一给酒方式的局限性,使动物模型尽可能模拟人类慢性饮酒过程并缩短造模时间。 更值得一提的是,通过预实验发现,小鼠灌胃时能耐受的酒精浓度需低于30%(v/v),因此56°的白酒原液需稀释1 倍后使用并1 d 中分两次灌胃。 陈翠桃等[16]采用白酒原液灌胃前30 min给予小鼠灌胃蒸馏水的方法,这些都是为了减少高度酒精灌胃引起的小鼠中毒症状甚至死亡。 并且,造模前两周采用酒精剂量梯度提升,提高小鼠耐受性和存活率。 最后,动物暴露酒精的时间长短也是建立模型时需要考虑的问题。 通常研究人员会将1个月或更长时间地给予酒精视为慢性酒精暴露[23]。酒精引起的慢性疾病,如慢性酒精中毒性脑病,是一个多步骤的疾病过程,研究者感兴趣的多步骤多进程的哪个阶段将决定酒精的给药持续时间[23]。 本研究对慢性酒精中毒性脑病的早期症状尤其是认知功能障碍和运动功能障碍最为关注,结合前期的预实验结果,最终将小鼠慢性酒精暴露的时间优化为6 周,相比目前报道的造模方法,既缩短了造模时间,又可以获得稳定的慢性酒精中毒性脑损伤模型。
采用动物模型效度对本研究所建立的小鼠动物模型进行评价。 动物模型效度是动物模型的综合评价标准,即评价所建立的动物模型在多大程度上模拟了临床该种疾病。 动物模型效度主要由表面效度、结构效度和预测效度组成,其中表面效度指动物模型与临床疾病症状和体征的相似性,结构效度指动物造模过程与临床疾病的致病过程和病理机制的相似性,预测效度指动物模型与临床患者对治疗药物反应的相似性。 首先,从表面效度看,本实验结果发现,与对照组比较,模型组体重增长幅度显著降低,日常活动易被噪声惊吓、动作刻板;在认知行为学实验中,模型组在Y 迷宫测试中的自发交替率显著降低,在水迷宫空间探索阶段的穿越平台次数和在平台象限停留时间百分比显著降低;在运动行为学实验中,长期酒精暴露会导致小鼠通过平衡木的总时间和爬杆时间显著延长;并且,模型组小鼠脑组织HE 染色和尼氏染色均显示出海马区形态损伤和细胞坏死。 这些与临床上观察到的患者在病理及病理生理方面的变化极为相似。 例如,慢性酒精中毒性脑病的患者早期常有焦虑不安、头痛、失眠、乏力、注意力不集中等,逐渐出现智能障碍和精神异常,表现反应迟钝、注意力不集中、记忆力下降,常伴有虚构、思维能力受损,有的出现眼肌麻痹、共济失调和影像学改变等。 与国内文献已报道的慢性酒精中毒性脑损伤模型评价相比,本研究对模型小鼠的认识功能、运动功能以及海马区病理损伤都采用两种经典实验方法进行评价,结果相互佐证。 其次,从结构效度看,慢性饮酒是酒精中毒性脑病的重要诱因,据此,建立小鼠长时间酒精暴露可以认为是一种具有良好效度的疾病模型。最后,从预测维度看,目前临床尚无药物治疗该疾病,因此无从验证模型的预测效度。 综上所述,本实验所建立的小鼠慢性酒精中毒性脑损伤模型在动物模型的表面和结构效度上是非常有优势的,基本模拟了人类长期饮酒导致的早期神经病理和行为学改变。 此外,本实验造模方法简单方便、饲养成本较低、动物存活率高、时间短,在6 周内可初步建立小鼠慢性酒精中毒性脑损伤模型。 本研究的局限性在于,仅从动物行为学和脑组织形态学两方面评价了慢性酒精对小鼠脑组织所造成的损伤。在接下来的研究工作中,我们将进一步探讨慢性酒精所致的认知功能障碍的分子机制以及潜在药物的治疗作用。
