多花黄精致病真菌筛选及致病力鉴定
2023-12-13马菁华刘芳任启飞范志伟欧明烛陈云飞
马菁华 刘芳 任启飞 范志伟 欧明烛 陈云飞






摘要: 根腐病、炭疽病、叶斑病等多种病害会造成黄精产量减少、品质下降。本研究从多花黄精根际及块茎中分离得到37株菌株,并接种于无菌组培苗进行致病鉴定,从中筛选出12株致病菌。结合菌株致病特征和菌落形态,从12株致病菌中选择7株致病菌进行进一步观察。通过测定rDNA-ITS、TEF-1α基因序列,鉴定出这7株致病菌中2株为尖孢镰刀菌、2株为腐皮镰刀菌、1株为芬芳镰刀菌、1株为卵形孢球托霉、1株为裂褶菌。其中,叶片上尖孢镰刀菌QB-ed-1致病力最强,尖孢镰刀菌E-rz-7次之;块茎中尖孢镰刀菌QB-ed-1致病力最强,芬芳镰刀菌E-ed-2次之。菌株QB-ed-1对黄精叶片和块茎都有较强的致病力。本研究提供了一种主动筛选多花黄精致病真菌的方法,可在病害发生前预先筛选可能的致病菌,为黄精病害检测和防控提供了有效的检测手段。
关键词: 多花黄精;真菌病害;致病性;镰刀菌属真菌;卵形孢球托霉;裂褶菌
中图分类号: S432.1 文献标识码: A 文章编号: 1000-4440(2023)07-1472-11
Screening and pathogenicity analysis of pathogenic fungi causing diseases on Polygonatum cyrtonema
MA Jing-hua, LIU Fang, REN Qi-fei, FAN Zhi-wei, OU Ming-zhu, CHEN Yun-fei
(Guizhou Botanical Garden, Guiyang 550004, China)
Abstract: Various diseases such as root rot, anthracnose, and leaf spot can cause a decrease in yield and quality of Polygonatum. In this study, 37 fungal strains were isolated from the rhizosphere and tubers of Polygonatum cyrtonema. Pathogenic identification was carried out using sterile tissue culture seedlings, and 12 fungal strains were selected. Based on the pathogenic characteristics and colony morphology of the strains, seven fungal strains were selected from 12 fungal strains for further observation. By sequencing rDNA-ITS, TEF-1 α gene, these seven pathogenic fungi were identified as two strains of Fusarium oxysporum, two trains of Fusarium solani, one strain of Fusarium redolens, one strain of Gongronella butleri and one strains of Schizophyllum commune. Among them, the pathogenicity of Fusarium oxysporum QB-ed-1 on the leaves was the strongest, followed by Fusarium oxysporum E-rz-7. The pathogenicity of Fusarium oxysporum QB-ed-1 in tubers was the strongest, followed by Fusarium redolens E-ed-2. The strain QB-ed-1 had strong pathogenicity to the leaves and tubers of Polygonatum. This study provides a method for actively screening pathogenic fungi of Polygonatum cyrtonema, which can pre-screen potential pathogenic fungi before the occurrence of the disease,providing an effective detection method for Polygonatum disease detection and prevention.
Key words: Polygonatum cyrtonema;fungal diseases;pathogenicity;Fusarium graminearum;Gongronella butleri;Schizophyllum commune
黃精是百合科黄精属多年生草本植物,其中多花黄精(Polygonatum cyrtonema)、黄精(Polygonatum sibiricum)、滇黄精(Polygonatum kingianum)列入《中国药典》[1],为中国重要的药食同源植物。随着其经济价值的开发利用,黄精种植面积不断增加,茎腐病、叶枯病、炭疽病等多种病害也随之发生,给药农造成严重损失[2]。目前针对黄精病害及其致病菌已有较多研究,主要有两种研究方向,其一针对病害部位进行组织分离以筛选病原菌,其二以黄精根际土壤或药用部位为对象研究其寄生的真菌群落。前者详细阐述了黄精各病害发生的时间、过程、危害程度及各发病阶段叶片、块茎以及整个植株的症状,有针对性地分离到对应致病菌并进行形态和致病性的检测分析。如茎腐病引起滇黄精茎部褐色病斑最终导致植株茎部干枯倒伏,严重可致70%的植株发病,从滇黄精茎部分离出致病菌滇黄精刺盘孢[3]。根腐病引起多花黄精叶片变黄、根状茎腐烂、植株枯萎等,从多花黄精根部分离出致病菌尖孢镰刀菌和腐皮镰刀菌[4]。叶枯病首先在叶部形成水浸状病斑,后叶缘变黄褐色,最终整个叶片枯死,从多花黄精叶片分离出致病菌尖孢镰刀菌[5]。炭疽病在叶面形成褐色病斑并着生黑色菌丝颗粒,至茎秆枯死,植株发病率达20%以上,致病菌为Colletotrichum circinans (Berk.) Vogl [6]。褐斑病为褐色病斑,着生黑色子实体,可使叶片组织坏死、穿孔,导致植株地上部分枯死,致病菌为棕榈拟盘多毛孢[7]。后者采用平板培养法培养黄精内生或根际真菌进行寄生真菌种类的统计和分析,或采用高通量测序技术全面描述微生物群落环境。分离滇黄精寄生真菌,得到37株可培养真菌,包含21株镰刀菌属真菌、12株黑绿木霉及其他真菌[8]。从泰山黄精根茎叶和果实中共分离32株可培养真菌,其中镰刀菌属占比最大,其次为不产孢真菌(Sterile mycelia)和链格孢属真菌(Alternaria sp.)[9]。黄精(种)根茎内生真菌群落的优势真菌依次为Setophoma、肉座菌目的未鉴定属、新赤壳属、棘壳孢属和Cutaneotrichosporon等真菌,根际和内生共有的真菌相对丰度较大的依次为Setophoma、篮状菌属、肉座菌目的未鉴定属、新赤壳属、角担菌科的未鉴定属、镰刀菌属等真菌[10];多花黄精根际真菌群落中镰刀菌属为优势菌属之一,且患根腐病的病株根际中的相对丰度高于健康植株根际[11]。不同研究方向和手段展示出黄精不同的寄生真菌类群,而许多致病菌并非优势菌属,却导致了病害发生。鉴于此,我们以多花黄精为材料主动筛选其根际及内生真菌,研究其致病性,可在病害发生前发现可能的致病菌,为病害防控研究提供参考。
1 材料与方法
1.1 试验材料
供试植株1:多花黄精多年龄植株,采自贵州省植物园黄精苗圃,圃内黄精引种自贵州省内外多地,包括湖北(E)、贵州毕节(QB)、贵州水城(QS)、贵州铜仁(QT)、贵州遵义(QZ),取黄精块茎及根进行真菌筛选。
供试植株2:多花黄精无根组培苗,由团队研究人员扩繁,用于快速鉴定致病真菌。
供试植株3:2年生多花黄精块茎繁殖植株,植株高大,茎叶繁盛,长势健康,用于对所筛致病真菌进行叶片致病力测定。
供试植株4:2年生多花黄精种子繁殖植株,植株健康,长势整齐,用于对所筛致病真菌进行块茎致病力测定。
培养基:PDA培养基用于真菌培养;MS培养基含蔗糖25 g,琼脂粉6 g,不添加激素,用于黄精无根组培苗培养。
1.2 菌株分离纯化
1.2.1 根际真菌分离 采集新鲜黄精植株,抖落根部松散土壤后附着于根上的为根际土,按照1 g土添加10 ml水的比例添加无菌水于根际中,室温下160 r/min振荡2 h,静置10 min后将上清液用无菌水稀释1×102~1×104倍,每种稀释液分别取20 μl涂布于PDA平板。另在无菌操作台用无菌剪刀将黄精根系沿块茎处剪断,伤口在酒精灯下灼烧2 s,用无菌水冲洗3次,晾干后平铺于PDA培养基表面。每种处理3次重复,置于28 ℃恒温培养。
1.2.2 块茎内生真菌分离 取多花黄精新鲜块茎在自来水下冲洗10 min,之后在无菌操作台内操作。切取3段块茎,每段厚2 cm,依次用75%乙醇浸泡5 min,无菌水漂洗3次,5%次氯酸钠浸泡5 min,无菌水漂洗5次,置于灭菌滤纸晾干,用手术刀削去表皮,剩余块茎切成薄片置于PDA培养基表面,削去的表皮将切面在酒精灯下灼烧2 s,同最后一次的洗涤水一起作为对照,平铺或涂布于PDA培养基,以验证消毒是否彻底。每种处理3次重复,置于28 ℃恒温培养。
1.2.3 菌株纯化 培养3~5 d后,平板上长出较多真菌菌落,挑取菌落边缘菌丝至新鲜PDA培养基,反复纯化至菌落单一,观察并记录各菌株菌落形态,保存于试管斜面备用。
1.3 致病真菌筛选
挑选形态差异较大的菌株转接到新鲜PDA培养基培养3 d,在菌落边缘切取直径0.5 cm的菌饼,接种于多花黄精无菌组培苗茎基部,置于25 ℃光下继续培养,观察菌株及植株生长情况,30 d后统计植株发病情况,记录可导致多花黄精发病的菌株及发病症状,筛选致病真菌。
1.4 致病真菌形态鉴定
根据菌株引起的植株病症及菌落形态,挑选致病能力强的菌株进行形态鉴定。在平板边缘切取直径0.5 cm的圆形菌饼,转入新鲜PDA培养基,28 ℃暗培养7 d,挑取少量菌丝用水浸法制片,在尼康 ECLIPSE Ni-E正置显微镜下观察菌丝及孢子形态并拍照。
1.5 致病真菌分子生物学鉴定
待鉴定致病菌委托深圳微科盟科技集团有限公司提取真菌DNA并扩增相关基因序列,进行真菌分子生物学鉴定。首先对真菌目的基因rDNA-ITS测序,初步结果显示较多菌株为镰刀菌,由于rDNA-ITS对镰刀菌属种间鉴别能力较弱[12],进一步对真菌目的基因TEF-1α测序,引物序列如表1所示。
PCR扩增反应体系(50.0 μl):基因组DNA(20 ng/ml)1.0 μl,10×Buffer(含2.5 mmol/L Mg2+)5.0 μl,Taq聚合酶(5 U/μl)1.0 μl,10 mmol/L dNTP 1.0 μl,引物1(10 μmol/L)1.5 μl,引物2(10 μmol/L)1.5 μl,ddH2O 39.0 μl。PCR扩增反应程序:95 ℃预变性5 min;95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min,循环35次;72 ℃延伸7 min。反应完成后,取3 μl PCR产物进行1%琼脂糖凝胶电泳检测,确认PCR扩增片段。用AxyPrep DNA凝胶回收试剂盒回收PCR产物,取纯化后的PCR产物使用测序仪ABI3730-XL进行测序。
用NCBI Blast程序将拼接后的序列文件与NCBI核酸数据库中的数据进行同源序列比对,使用MEGA11.0软件,采用最大似然法(Maximum Likelihood Estimate)构建系统发育树,bootstrap值设置为1 000。
1.6 致病真菌致病力测定
选择健康生长的盆栽多花黄精,采用创伤接种法,将各菌株分别接种至多花黄精活体叶片或块茎上。用75%的酒精对叶片背面和块茎接种部位进行表面消毒,2 min后用无菌手术刀轻轻划伤叶脉和块茎,取直径0.5 cm的菌饼,菌丝面贴于伤口部位,对照使用相同大小的PDA培养基。各处理3次重复,置于温室培养,2 d后取下菌饼或培养基,15 d后測定病斑大小。
1.7 数据分析
利用Microsoft Excel 2010整理原始数据并作图,应用SPSS 17.0统计软件进行方差分析,Duncan’s法进行显著性检验。
2 结果与分析
2.1 根际真菌与内生真菌菌落形态
从苗圃内的多花黄精植株中共分离到37株真菌,包括根际真菌24株,块茎内生真菌13株。其中从引种自湖北省的多花黄精植株中分离到真菌20株,包括根际真菌12株,内生真菌8株;从引种自贵州省毕节市的多花黄精植株中分离到7株,包括根际真菌4株,内生真菌3株;从引种自贵州省六盘水市水城区的多花黄精植株中分离到2株,均为根际真菌;从引种自贵州省铜仁市的多花黄精植株中分离到3株,均为根际真菌;从引种自贵州省遵义市的多花黄精植株中分离到5株,包括根际真菌3株,内生真菌2株。各菌株菌落形态如表2所述。
所分离的真菌菌株菌落形状多数为圆形,菌丝呈白色絮状,蓬松或绵密;部分真菌菌株产生色素,在培养基上呈现紫色、粉色或土黄色等颜色,少数真菌菌株形成色素环;少数真菌菌株菌落形状不规则。根据形态初步推断大部分真菌菌株为镰刀菌属。
2.2 致病真菌确定及其致病过程
选取16株真菌菌株接种于无菌培养的黄精茎基部,用于研究其致病性,30 d后观察各菌株及植株生长状态,结果统计如表3所示。从真菌菌株生长状态来看,各菌株在接种至MS培养基后能够在培养基上正常生长,多数真菌菌丝接触植株后会缠绕茎叶生长,少数菌株则仅在培养基表面生长,不会攀附植株。从植株生长状态来看,少数植株正常生长,多数植株则表现出不同程度的染病状态,受菌丝侵染的植株茎叶绿色褪去,呈现水浸状,部分植株受侵染部位出现红色或红褐色。
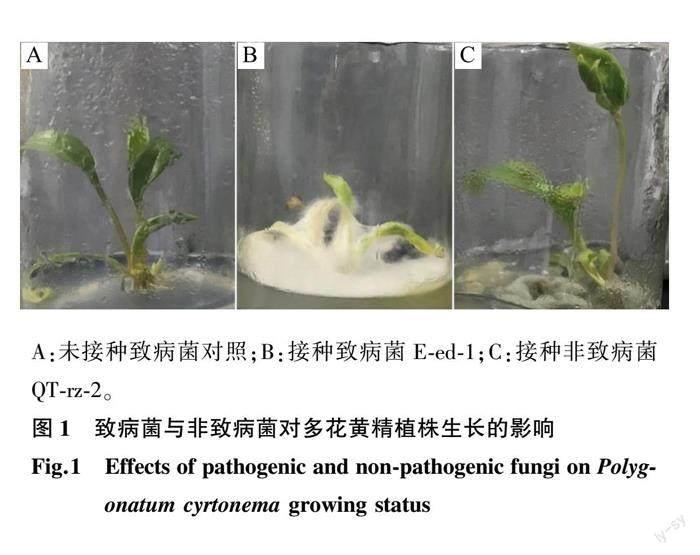
可见不同菌株对多花黄精生长的影响不同,部分菌株对多花黄精无致病危险,而有些菌株则会导致多花黄精感病死亡。如图1所示,瓶A不接种菌株,叶片鲜绿,植株挺拔,长势良好;瓶B接种菌株E-ed-1,菌丝长满培养基并缠绕植株导致茎叶失绿、萎蔫、腐烂,植株接近死亡;瓶C接种菌株QT-rz-2,菌丝铺满培养基,但植株叶片鲜绿,长势良好。根据植株生长状态,将各真菌菌株分为致病菌和非致病菌。接种E-rz-3、QS-rz-2、QT-rz-2,植株正常生长,E-rz-6侵染能力较弱,植株基本正常生长,将这4株菌株定义为非致病菌,其余12株引起植株感病,定义为致病菌。
致病菌中E-rz-1、QZ-rz-3、E-ed-2、E-ed-7致病症状相同,植株均出现水浸状,产生红褐色,并最终死亡。E-rz-5、E-ed-6致病症状相同,植株受菌丝侵染部分发红,并最终死亡。E-rz-7、QB-rz-3、QB-rz-4、E-ed-1致病症状相同,植株茎叶失绿,呈现水浸状,并最终死亡。QS-rz-1使植株受侵染部分失绿,植株不产生水浸状和色素,最终依然死亡。QB-ed-1使植株受侵染部分呈水浸状并易折断,最终导致植株死亡。各致病菌侵染黄精致病过程相同,图2以E-ed-1为例展示了植株发病过程。
2.3 致病菌形态鉴定
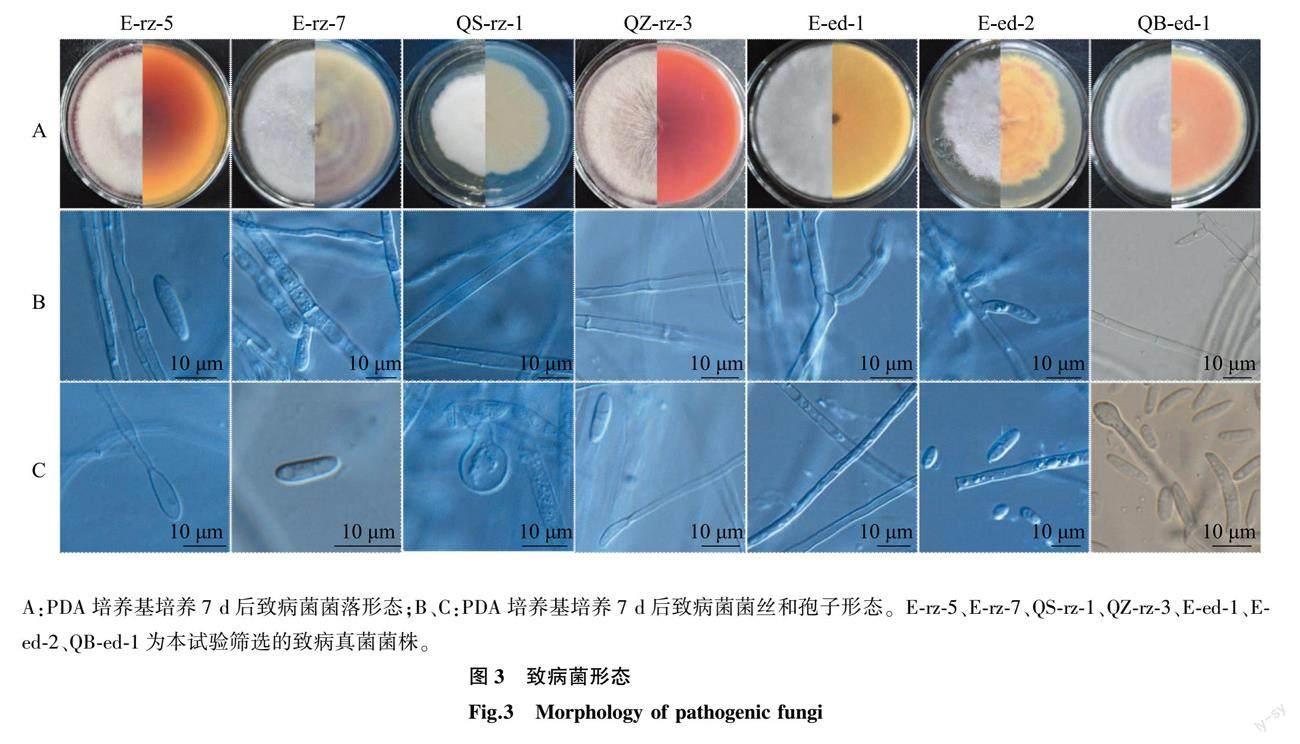
结合各菌株致病特征和菌落形态,选择E-rz-5、E-rz-7、QS-rz-1、QZ-rz-3、E-ed-1、E-ed-2、QB-ed-1共7株真菌菌株进行进一步的观察。各菌株菌落形态为圆形或接近圆形,菌丝均为白色,部分菌株在培养基表面产生特定色素引起菌落正面或背面呈不同的颜色。其中E-rz-5、QZ-rz-3形态相似,菌落圆形,菌丝白色,呈辐射状,不同之处在于二者菌落背面的颜色,E-rz-5为橙黄色,QZ-rz-3为姜红色。E-rz-7、QB-ed-1形态相似,菌落圆形,菌丝白色,菌落正面略见浅紫色,不同之处在于二者菌落背面,E-rz-7呈现紫色同心圆环,QB-ed-1呈现粉色同心圆环。QS-rz-1菌落形状接近圆形,但不规则,菌丝白色而绵密,菌落背面为白色。E-ed-1菌落圆形,菌丝白色,菌落背面土黄色。E-ed-2菌落形状接近圆形,但不规则,菌丝白色絮状,菌落正面和背面都呈现粉色同心圆环(图3A)。从显微镜中观察到,在试验所用培养基上,E-rz-5、E-rz-7、QZ-rz-3、E-ed-2、QB-ed-1 5株真菌菌株的菌丝有不同程度分节,均具有分生孢子梗,产生大小不同的椭圆或镰刀状孢子,具备镰刀菌属特征。QS-rz-1、E-ed-1 2株真菌菌株的菌丝不分节,其中QS-rz-1孢子球形,与菌丝相连,无游离孢子,E-ed-1无孢子(图3B、图3C)。
2.4 致病真菌分子生物学鉴定
利用真菌通用引物ITS1、ITS4对各致病菌基因组进行扩增和测序,分别获得对应基因片段。将序列提交至NCBI比对,得到与待测物种序列相似性最大的物种信息,并将结果提交至国家微生物科学数据中心(NMDC)。如表4所示,对各致病菌rDNA-ITS基因进行扩增和测序,从各菌株中都获得长度500 bp以上的片段,分别与Fusarium、Gongronella、Schizophyllum 3个属5个种的同源性高,相似度达98.70%以上。
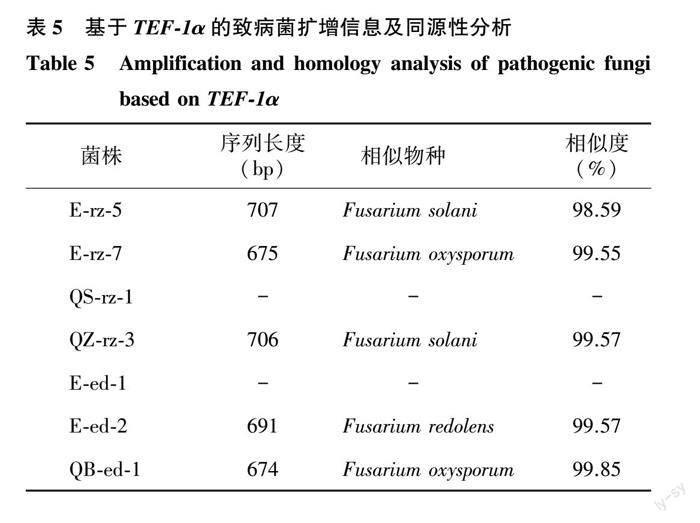
对各致病菌TEF-1α基因进行扩增和测序,分别获得对应基因片段,将序列提交至NCBI比对,得到与待测物种序列相似性最大的物种信息。如表5所示,QS-rz-1、E-ed-1未检测到扩增序列,其他菌株均获得长度670 bp以上的片段,同表4结果一致,均属于Fusarium,5个种的同源性高,相似度均达98.59%以上。
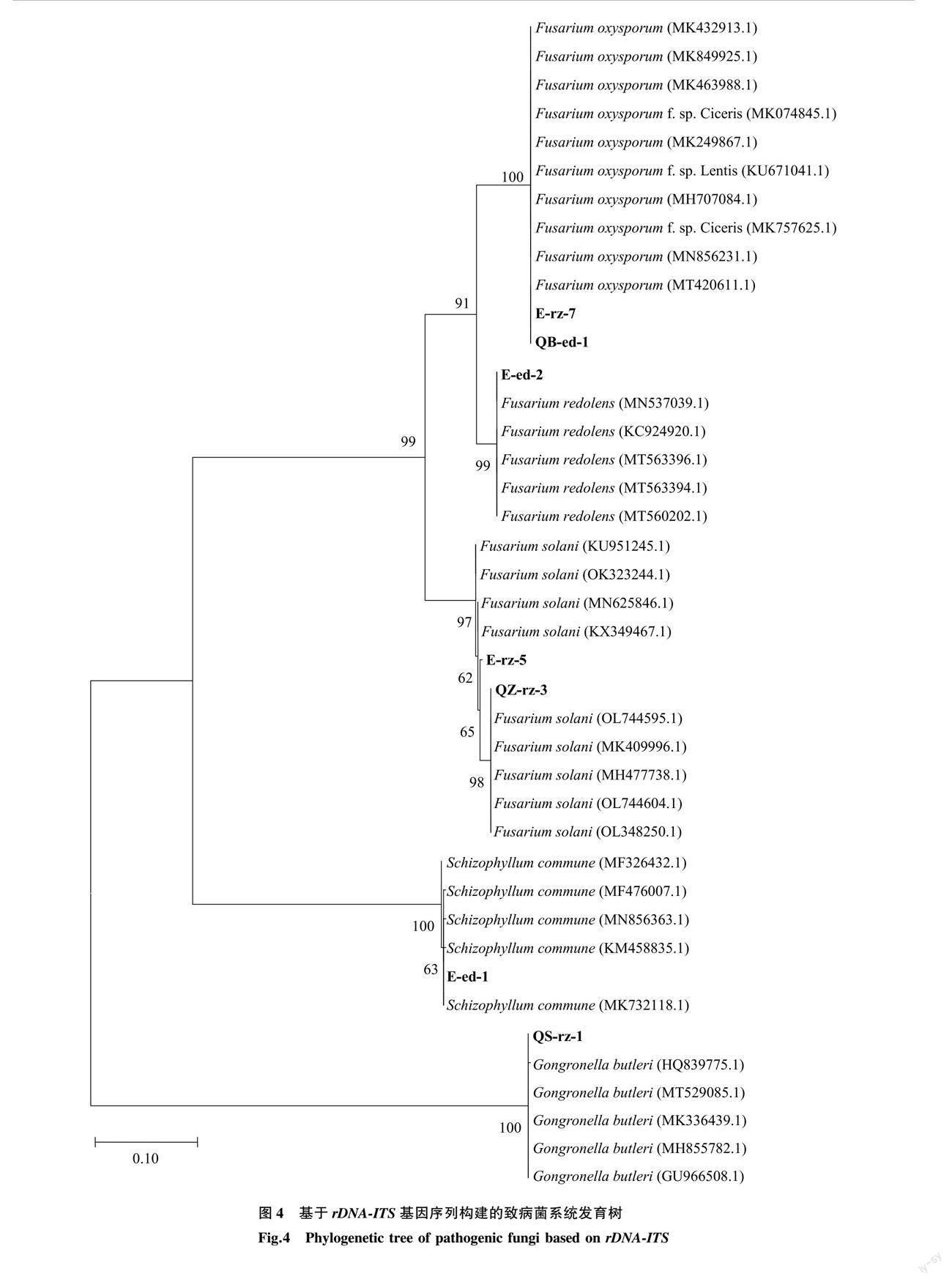
下载各菌株rDNA-ITS基因扩增序列,比对结果中相似性最大的5个物种DNA序列,采用最大似然法对各菌株及其相似序列构建系统发育树,得到各菌株的进化信息,如图4所示。7株菌株分属于3个属5个种,分别为Fusarium oxysporum (E-rz-7、QB-ed-1)、Fusarium redolens (E-ed-2)、Fusarium solani (E-rz-5、QZ-rz-3)、Schizophyllum commune (E-ed-1)、Gongronella butleri(QS-rz-1)。分枝上的數据表示Bootstrap检验的支持百分率,各分枝Bootstrap检验的支持率都在60%以上,计算结果可信。
综上,致病菌株E-rz-5、E-rz-7、QS-rz-1、QZ-rz-3、E-ed-1、E-ed-2、QB-ed-1依次鉴定为腐皮镰刀菌(Fusarium solani)、尖孢镰刀菌(Fusarium oxysporum)、卵形孢球托霉(Gongronella butleri)、腐皮镰刀菌(Fusarium solani)、裂褶菌(Schizophyllum commune)、芬芳镰刀菌(Fusarium redolens)和尖孢镰刀菌(Fusarium oxysporum)。
2.5 致病真菌致病力測定
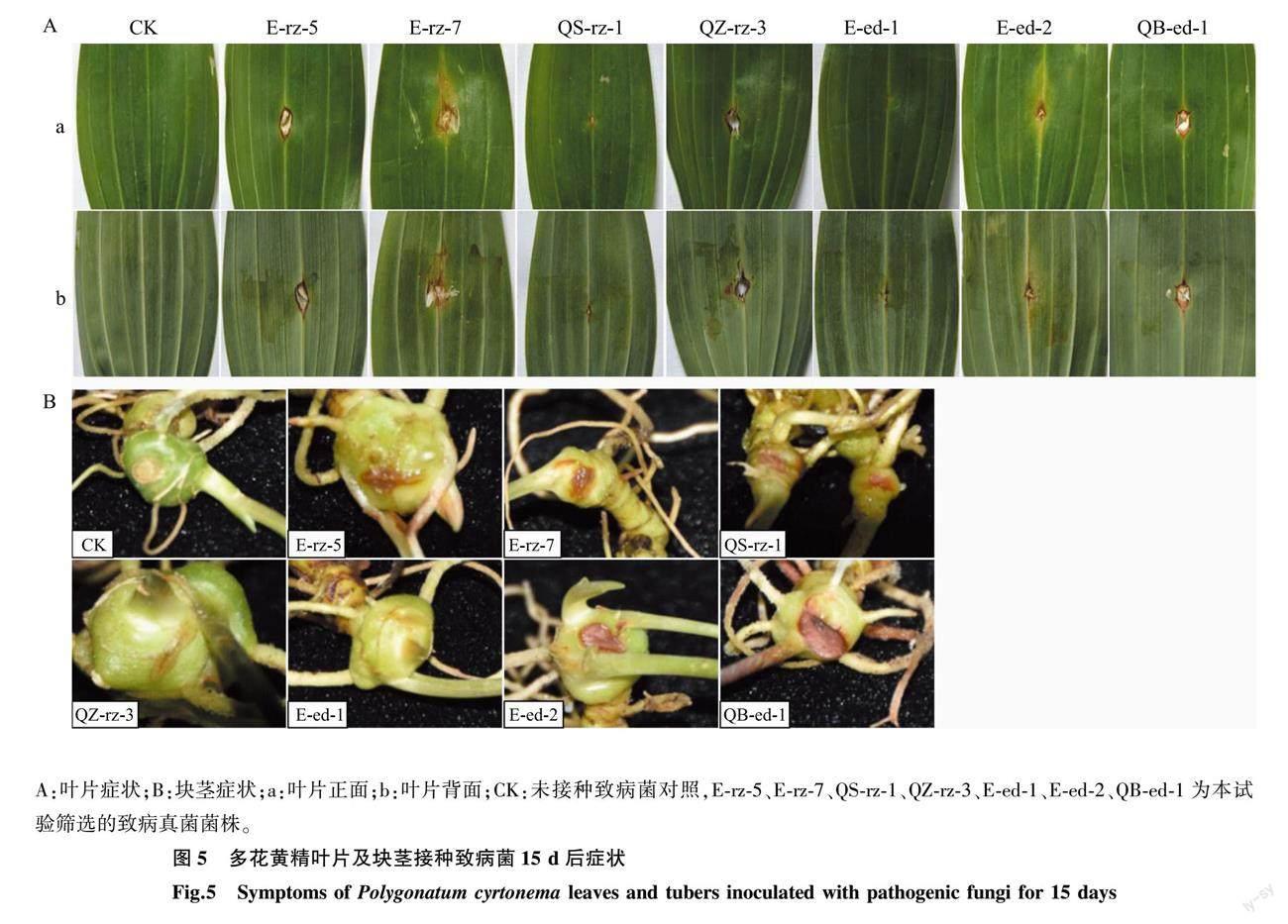
采用创伤接种法在健康多花黄精叶片分别接种不同致病菌15 d后,接种部位呈现大小不同的病斑(图5A)。未接种致病菌对照,叶片划痕已不明显且没有病斑,接种QS-rz-1、E-ed-1、E-ed-2的叶片在划痕处的正面和背面呈现黄色至褐色干枯病斑,接种E-rz-5、E-rz-7、QZ-rz-3、QB-ed-1的叶片在划痕处有较大病斑,已透穿叶片呈现孔洞。对叶片病斑大小统计,并与对照相比发现,E-rz-5、E-rz-7、QB-ed-1菌株的致病力强(表6)。
在块茎接种致病菌15 d后,接种部位呈现不同程度的病症(图5B)。未接种致病菌对照,刀片伤口细小且已干燥,接种QZ-rz-3、E-ed-1的块茎划痕处变褐,呈现轻微水浸状,接种E-rz-5、E-rz-7、QS-rz-1、E-ed-2、QB-ed-1的块茎划痕处变褐,呈现水浸状且腐烂、凹陷。对块茎病斑大小统计,并与对照相比,结果表明,E-rz-5、E-rz-7、QS-rz-1、E-ed-2、QB-ed-1菌株的致病力强(表6)。
通过病菌致病力测定,发现致病菌对叶片和块茎均有一定的致病能力,但症状和速度不同。叶片的病斑较为干燥,而块茎的病斑则呈现水浸状,且有不同程度的凹陷和腐烂。从适应能力来看, 菌株E-rz-5、E-rz-7和QB-ed-1在叶片和块茎均能生存并侵染使之感病。从致病力来看,叶片中QB-ed-1致病力最强, E-rz-7次之;块茎中QB-ed-1致病力最强, E-ed-2次之。综合来看,菌株QB-ed-1对黄精叶片和块茎的致病力都最强。
3 讨论与结论
对贵州省植物园黄精种质资源圃内不同引种地的多花黄精根际真菌及内生真菌进行筛选和纯化,共分离出37株真菌菌株。根际的真菌数量较块茎内部多,且多数呈现辐射状菌丝,内生菌则很少,与樊锐锋等 [10]研究结果相同。目前暂无研究讨论菌丝形态及其影响因素,不确定是否由于菌丝在植株体内缺乏足够空间导致无法自由伸展。从湖北省多花黄精分离的真菌菌株菌落多为圆形或不规则圆形,菌丝多白色絮状带少许粉色、紫色或土黄色,而从贵州省多花黄精分离的真菌菌株菌落不规则形状更多,且菌丝为粉末状,呈现墨绿色或黑色,由于样点和样本数量较少,其规律和原因需进一步研究分析。根据前期菌落形态特征分析及后期分子生物鉴定都发现镰刀菌占了很大比例,这与谭伟等[8]研究结果类似。但致病菌的种属及致病力与宿主采集地和分离部位没有明显关联,且同种致病菌的致病力也有强有弱,说明致病菌的危害与菌株自身特性关系更密切。
黄精属植物病害已引起科研人员的广泛关注,诸多病害的病原菌被分离出来。从滇黄精、黄精、多花黄精等根茎腐烂病病斑部位分离并鉴定的病原菌有滇黄精刺盘孢[3]、尖孢镰刀菌 [4,13-14 ]、腐皮镰刀菌[4, 14 ]、F. foetens[15]和F. hostae [15]。从炭疽病病斑部位分离并鉴定的病原菌有果生炭疽菌[16]、胶孢炭疽菌[16]、尖孢炭疽菌[16]、C. spaethianum[17]、松针炭疽菌[18]、博宁炭疽菌[18]。从叶枯病、褐斑病、黑斑病等病斑部位鉴定出的病原菌依次为尖孢镰刀菌[5]、棕榈拟盘多毛孢[7]、链格孢属真菌[19]。本研究分离鉴定出2株尖孢镰刀菌、2株腐皮镰刀菌、1株芬芳镰刀菌、1株卵形孢球托霉和1株裂褶菌,其中同一株尖孢镰刀菌能同时危害叶片和块茎。本研究首次发现腐皮镰刀菌对黄精叶片致病,也首次发现卵形孢球托霉、裂褶菌对作物致病。
镰刀菌属真菌可导致多种经济作物土传病害的发生,是主要的致病真菌之一[20-25]。有针对西瓜专化型尖孢镰刀菌的研究结果表明,该菌在室内平板培养中通过营养竞争抑制土壤中较多细菌和放线菌,通过营养竞争及次生代谢产物抑制部分真菌生长,且其数量在西瓜多年连作后急剧上升[26]。因而作者大胆推测相对于其他属真菌,镰刀菌对环境的适应性更强,有更强的可培养性,无论在土壤、植株体内、人工培养基上都能很好地适应并进行繁殖。且镰刀菌可分泌果胶酶、纤维素酶等细胞壁降解酶[27],还会分泌镰刀菌酸、脱氢镰刀菌酸等毒素[28]对植物造成毒害,导致作物病害发生。有研究结果表明,从岩石表面分离到1株卵形孢球托霉,其能够产生有机酸松化岩石使菌丝能够插入岩石内部,从而达到侵蚀石灰岩释放金属离子的效果[29]。本研究发现卵形孢球托霉菌丝绵密不易切段,且其菌丝能够缠绕植株茎叶并导致茎叶绿色褪去而死亡,推测其菌丝深入植物组织阻断了植株水分和养分的运输而导致病害的发生。裂褶菌多作为营养美味的食用菌,寄生于腐烂木材,但其同样能够寄生于宿主并通过菌丝缠绕等将宿主杀死[30]。
通过试验结果和有关文献报道的结果对比发现,土壤和植物体内长期大量存在多种微生物,随着作物种植年限增加,有害微生物及其代谢产物逐渐在土壤积累,当温度、湿度等环境条件适宜或植物受到外力损伤时,可能引发病害[31]。本研究筛选出多花黄精致病菌,下一步将筛选拮抗、促生菌,并检测黄精根际微生物群落结构的建立与致病菌、拮抗菌数量和种类之间的关系,以期能够在致病菌引起病害之前及时预测其发生,并利用拮抗菌遏制致病菌生长和繁殖,对作物的田间病害预防起到积极作用。
参考文献:
[1] 国家药典委员会. 中华人民共和国药典[M]. 北京:中国医药科技出版社,2020:319.
[2] 周先治,苏海兰,陈 阳,等. 多花黄精主要病害发生规律调查[J].福建农业科技,2017(10):25-27.
[3] 马维思,郭兰萍,王 馨,等. 滇黄精根状茎腐烂病致病新种的分离鉴定[J].中国中药杂志,2021,46(21):5606-5613.
[4] 韩 凤,李巧玲,韩如刚,等. 渝产多花黄精根腐病病原菌的分离与鉴定[J].分子植物育种,2020,18(11):3693-3698.
[5] 迟惠荣.多花黄精叶枯病病原菌鉴定及贝莱斯芽胞杆菌防病促生效果研究[D].杭州:浙江大学,2019.
[6] 桑维钧,宋宝安,练启仙,等. 黄精炭疽病病原鉴定及药剂筛选[J].植物保护,2006(3):91-93.
[7] 刘思睿,宋莉莎,任 静,等. 黄精褐斑病的病原生物学特性[J].菌物学报,2019,38(6):768-777.
[8] 谭 伟,浦仕彪. 药用植物滇黄精寄生真菌的分离与鉴定[J].中国农学通报,2021,37(19):90-94.
[9] 李艳玲,王德才,史仁玖,等. 泰山黄精内生真菌的分离鉴定及抑菌活性研究[J].中草药,2013, 44(11):1490-1494.
[10]樊锐锋,王若凡,杜艳秋,等. 黄精根际及药用部位内生真菌群落组成和生态功能分析[J].广西植物,2021,41(5):799-807.
[11]韩 凤,林茂祥,章文伟,等. 多花黄精根腐病对根际土壤酶活性及真菌群落变化的影响[J]. 西南大学学报(自然科学版),2021, 43(4):53-61.
[12]杨 红,李 颖,关国华,等.尖孢镰刀菌异核体及其不同核型分离子rDNA ITS区序列分析[J].农业生物技术学报,2002(4):381-384.
[13]吴依婷,姚传威,邓波侠,等.黄精根腐病分离菌及其拮抗内生细菌的鉴定[J].浙江农业学报,2018, 30(12):2087-2093.
[14]张 磊,李辉山,杨枝中,等. 云南滇黄精根茎腐病病原鉴定[J].植物病理学报,2021,51(6):1000-1004.
[15]梁忠厚,李静纳. 湖南多花黄精根腐病病原菌的分离与鉴定[J].南方农业学报,2021,52(7):1923-1930.
[16]马云云,吴 灿,王兰芬,等. 滇黄精炭疽病菌的初步鉴定及其对3种杀菌剂的敏感性[J].农药学学报,2020,22(5):742-751.
[17]MA J, XIAO X, WANG X Y, et al. Colletotrichum spaethianum causing anthracnose on Polygonatum cyrtonema in Anhui Province, China [J]. Plant Disease, 2021, 105(2):509.
[18]但雨柔,刘 铭,崔馨燕,等.多花黄精炭疽病病原菌鉴定[J].植物保护,2023,49(2):6.
[19]孙楚强. 黄精黑斑病生防菌的分离鉴定及防治药剂筛选[D].长沙:湖南农业大学,2020.
[20]李风顺,乔俊卿,张荣胜,等.防治水稻恶苗病拮抗细菌的筛选、鉴定和评价[J].江苏农业学报,2022,38(4):907-914.
[21]梁忠厚,李静纳.湖南多花黄精根腐病病原菌的分离与鉴定[J]. 南方农业学报,2021,52(7):1923-1930.
[22]张 瑶,高 弢,马桂珍,等.基于转录组测序技术分析愈创木酚对禾谷镰刀菌的抑菌机制[J].江苏农业学报,2022,38(2):343-351.
[23]張 强,张艳茹,霍云凤,等.禾谷镰刀菌拮抗菌ZQT-31的分离与鉴定[J].江苏农业科学,2021,49(9):80-85.
[24]范江龙,李欣蕊,席雪冬.小麦赤霉病生物防治研究进展[J].生物加工过程,2021,19(4):420-431.
[25]樊炳君,姚 丽,段 娇,等.镰刀菌根腐病拮抗菌的筛选及鉴定[J].江苏农业科学,2021,49(20):132-137.
[26]吴洪生. 西瓜连作土传枯萎病微生物生态学机理及其生物防治[D].南京:南京农业大学, 2008.
[27]高 芬,岳换弟,秦雪梅,等.植物致病镰刀菌细胞壁降解酶的研究进展[J].江苏农业学报, 2018, 34(4):955-960.
[28]高晓敏,王琚钢,马立国,等.尖孢镰刀菌致病机理和化感作用研究进展[J].微生物学通报, 2014, 41(10):2143-2148.
[29]王广林,邓 辉,聂 丽,等. 卵形孢球托霉Gongronella butleri NL-15对石灰岩的侵蚀机制[J].应用与环境生物学报,2018,24(2):374-378.
[30]TZEAN S S,ESTEY R H. Schizophyllum commune Fr. as a destructive mycoparasite[J]. Canadian Journal of Microbiology, 1978, 24(7):780-784.
[31]郑 琦,毕 扬,云晓敏,等.西瓜枯萎病的研究进展及其防治[J]. 中国植保导刊, 2007(2):11-13.
(责任编辑:成纾寒)
