不同品种绵羊肌内脂肪沉积相关miRNA的筛选与功能预测
2023-12-13孟科赵薇郭晨浩聂伟陶毛孩袁晓春孙昊然冯登侦
孟科 赵薇 郭晨浩 聂伟 陶毛孩 袁晓春 孙昊然 冯登侦




摘要: 为明确不同品种绵羊(Ovis aries)肌肉组织miRNA的表达情况,筛选影响绵羊肌内脂肪沉积的关键miRNA,以滩羊、杜泊羊和小尾寒羊为研究对象,测定背最长肌肌内脂肪含量并对其进行转录组测序(RNA-Seq),筛选绵羊脂肪沉积相关的差异表达miRNA。结果表明,滩羊肌内脂肪含量显著高于杜泊羊,极显著高于小尾寒羊;杜泊羊肌内脂肪含量显著高于小尾寒羊。转录组测序质量良好。3个品种绵羊共鉴定到134个已知miRNA和153个预测miRNA,这些 miRNA的长度主要介于21~23 nt,且首位碱基对U碱基具有明显偏好性。以P ≤0.05和|log2FC|>1(FC为差异倍数)為筛选条件,3个比较组共获得42个差异表达miRNA;杜泊羊与滩羊比较组中筛选出22个差异表达miRNA;小尾寒羊与杜泊羊比较组中筛选出21个差异表达 miRNA;小尾寒羊与滩羊比较组中筛选出12个差异表达miRNA。筛选出的42个miRNA靶向到326个靶基因,显著富集到减数分裂I、肌肽-寡糖1,2-α-甘露糖苷酶活性和甘露寡糖甘露糖苷酶活性等303个基因本体(GO)条目,以及富集到α-亚麻酸代谢、亚油酸代谢、多巴胺能突触、胰岛素信号传导途径及N-聚糖生物合成等320个京都基因与基因组百科全书(KEGG)代谢通路。根据GO和KEGG的功能描述进一步筛选出23个miRNA及其靶向的119个靶基因可能参与脂肪沉积。进一步构建miRNA靶向调控网络,最终筛选到oar-miR-133、oar-miR-485-5p、novel_6、novel_85和novel_103等绵羊肌内脂肪沉积的关键miRNA。随机选择的8个差异表达miRNA的实时荧光定量PCR结果与转录组测序结果一致,表明转录组测序结果可靠。本研究为深入开展绵羊肌内脂肪沉积的分子调控机理、高品质绵羊品种的选育提供理论依据。
关键词: 绵羊;肌内脂肪沉积;转录组;miRNA
中图分类号: S826 文献标识码: A 文章编号: 1000-4440(2023)07-1554-13
Screening and functional prediction of miRNA related to intramuscular fat deposition in different sheep breeds
MENG Ke1,2, ZHAO Wei1, GUO Chen-hao1, NIE Wei1, TAO Mao-hai1, YUAN Xiao-chun1, SUN Hao-ran1,FENG Deng-zhen1
(1.School of Agriculture, Ningxia University, Yinchuan 750021, China;2.Animal Husbandry and Fishery Technology Extension and Service Center, Shapotou District, Zhongwei City, Zhongwei 755000, China)
Abstract: In order to clarify the expression of miRNAs in muscle tissues of different breeds of sheep (Ovis aries) and screen the key miRNAs affecting intramuscular fat deposition in sheep, Tan sheep, Dorper sheep and Small Tail Han sheep were used as experimental materials. The intramuscular fat content of longissimus dorsi muscle was measured and transcriptome sequencing (RNA-Seq) was performed to screen the differentially expressed miRNAs related to fat deposition in sheep. The results showed that the intramuscular fat content of Tan sheep was significantly higher than that of Dorper sheep, and extremely significantly higher than that of Small Tail Han sheep, and the intramuscular fat content of Dorper sheep was significantly higher than that of Small Tail Han sheep. The quality of transcriptome sequencing was good. A total of 134 known miRNAs and 153 predicted miRNAs were identified in three breeds of sheep. The length of these miRNAs mainly ranged from 21 nt to 23 nt, and the first base had obvious preference for U base. With P≤0.05 and |log2FC|>1 (FC was the fold change)as the screening conditions, a total of 42 differentially expressed miRNAs were obtained from the three comparison groups. Twenty-two differentially expressed miRNAs were screened in the comparison group of Dorper sheep and Tan sheep, 21 differentially expressed miRNAs were screened in the comparison group of Small Tail Han sheep and Dorper sheep, and 12 differentially expressed miRNAs were screened in the comparison group of Small Tail Han sheep and Tan sheep. The screened 42 miRNAs targeted to 326 target genes, which were significantly enriched into 303 gene ontology(GO) entries such as meiosis I, mannosyl-oligosaccharide 1,2-α-mannosidase activity and mannosyl-oligosaccharide mannosidase activity, and 320 Kyoto Encyclopedia of Genes and Genomes (KEGG) metabolic pathways such as α-linolenic acid metabolism, linoleic acid metabolism, dopaminergic synapses, insulin signaling pathway and N-glycan biosynthesis. According to the functional description of GO and KEGG, 23 miRNAs and 119 target genes might be involved in fat deposition. The miRNA targeted regulatory network was further constructed, and finally the key miRNAs for fat deposition in sheep such as oar-miR-133, oar-miR-485-5p, novel_6, novel_85 and novel_103 were screened. The qRT-PCR results of the eight randomly selected differentially expressed miRNAs were consistent with transcriptome sequencing results, indicating that the transcriptome sequencing results were reliable. This study provides a theoretical basis for further research on the molecular regulation mechanism of intramuscular fat deposition in sheep and the breeding of high-quality sheep breeds.
Key words: sheep;intramuscular fat deposition;transcriptome;miRNA
随着生活质量的提升,人们对羊肉的需求不仅仅满足于数量,羊肉的品质更加成为人们关注的焦点。羊肉的品质主要由肉质性状决定,而肌内脂肪(IMF)含量是评价肉品质的重要指标。IMF含量的高低影响到羊肉的风味、嫩度、适口性及多汁性[1-2]。肌内脂肪的形成以及含量受到遗传、环境、营养等多种因素的共同影响[3]。已有研究结果表明肌内脂肪含量具有较高的遗传力;在相同的环境和营养条件下,遗传背景成为影响羊肉肌内脂肪的重要因素[4]。探究不同品种绵羊IMF含量差异及其分子调控机制对绵羊肉质性状改善具有重要意义。
MicroRNA(miRNA) 作为一类不编码的小分子RNA,主要通过与mRNA的3′UTR区结合来抑制靶基因的表达而发挥作用[5]。近年来,国内外许多学者研究报道miRNA在动物脂肪的形成过程中发挥重要的调控作用。邵静等[6]研究发现,miR-17-3p通过靶向调控KCTD15基因的表达从而影响延边黄牛前体脂肪细胞分化;Ma等[7]研究结果表明, miR-26b-5p通过靶向调控FGF21基因促进脂肪生成,参与调控山羊肌内脂肪细胞的分化。Chen等[8]研究发现miR-376a靶向调控KLF15基因,参与秦川牛的脂肪细胞增殖分化过程;Deng等[9]发现miR-27a 通过特异性结合視黄醇X受体α(RXRα) 抑制绵羊前脂肪细胞的分化。随着测序技术不断发展,应用转录组测序(RNA-Seq)技术探究影响IMF沉积的研究也越来越多。Cheng等[10]通过RNA-Seq技术比较了不同肌内脂肪含量猪背最长肌的miRNA表达情况,筛选到18个差异miRNA可能参与调控脂肪酸合成和脂质代谢;喻世刚等[11]通过比较高和低肌内脂肪含量鸡胸中miRNA的表达差异,筛选到5个miRNA参与到脂肪生成过程;Huang等[12]通过比较中国沼泽水牛肌肉和脂肪组织之间的差异miRNA,筛选到8个miRNA在水牛肌内脂肪沉积过程中发挥重要作用。上述研究结果表明,应用RNA-Seq技术探究IMF沉积相关miRNA表达谱的研究较为成熟且已取得一定成果。但目前有关不同品种绵羊肌内脂肪沉积相关miRNA的研究较少。本研究基于杜泊羊、滩羊和小尾寒羊3个品种绵羊的肌内脂肪含量差异,通过RNA-Seq技术鉴定并筛选绵羊 IMF 沉积过程中差异表达的miRNA,探索miRNA调节绵羊肌内脂肪沉积的分子机制。旨在为探究分子水平调控绵羊肉质性状提供参考,为高品质绵羊品种的选育提供科学依据。
1 材料与方法
1.1 试验材料
从宁夏宇泊科技有限公司石嘴山威震肉羊繁育场选择饲养条件一致的8月龄健康绵羊品种杜泊羊、滩羊和小尾寒羊各8只(公母各4只)为试验材料。对绵羊进行屠宰后,取第3肋骨到第12肋骨之间的背最长肌组织作为样品,放置于液氮中冷藏备用。
1.2 绵羊肌内脂肪含量的测定
采用索氏脂肪抽提法对试验绵羊的肌内脂肪含量进行测定。具体测定方法是:(1)取适量冷藏样品,剔除肉样筋膜后,绞为肉糜,65 ℃烘干,测定100 g样品中水分含量记为A;(2)取测试样称质量记为W(g),用滤纸包好;(3)在102 ℃烘箱中烘干至恒质量,记为W1(g);(4) 将滤纸包好的样品放入索氏抽提器的抽提筒内,倒入2/3体积的乙醚后接上冷凝装置,在55 ℃恒温水浴中抽提6~8 h。抽提结束后,在102 ℃烘箱中烘干至恒质量,记为W2(g)。每品种3个重复。肌内脂肪含量(IMFC)计算公式为:
IMFC=(W1-W2)/[(100-A)×W]。
1.3 总RNA提取与质量控制
选择上述3个绵羊品种母羊各3只,采用Trizol法提取样品背最长肌组织的总RNA,利用琼脂糖凝胶电泳、Nanodrop分光光度计(Therom公司产品,美国)和Agilent 2100 生物分析仪(Agilent公司产品,美国)检测RNA样品的浓度、纯度以及完整性。
1.4 cDNA文库的构建与测序
RNA样品检测合格后,使用小RNA样品制备试剂盒(Small RNA Sample Pre Kit)进行cDNA文库的构建。构建方法为:首先利用小RNA的3′和 5′端的特殊结构,以总RNA为起始样品在小RNA两端加上接头,进行反转录合成cDNA,随后经过PCR扩增和PAGE胶电泳对目标DNA片段进行分离,切胶回收后得到cDNA文库。对构建好的文库进行检验,检验合格后在Illumina平台进行测序。
1.5 miRNA鉴定与表达分析
获得原始序列后经过数据质量控制得到有效序列,对有效序列进行小RNA的种类和长度筛选。使用Bowtie_0.12.9软件将筛选得到的长度为18~35 nt的小RNA对比到绵羊基因组(Oar_rambouillet_v1.0)参考序列上。将对比到参考序列的数据与miRBase数据库进行比对,注释分析已知的miRNA;在miRBase数据库未比对到的数据,通过miREvo_v1.1软件预测新的miRNA,并利用mirdeep2_0_0_5软件进行分析。对鉴定到的miRNA利用Stringtie v1.3.3软件进行表达量计算,采用TPM(transcript per million)值作归一化处理。利用DESeq_1.2.10软件分析样本间miRNA的表达差异,以P≤0.05且|log2 FC|≥1(FC为差异位数)作为标准筛选表达差异miRNA。
1.6 差异miRNA靶基因预测及功能注释和富集分析
使用miRanda-3.3a和RNAhybrid v2.0软件预测表达差异miRNA的靶基因,取交集作为预测结果。miRanda-3.3a软件参数设置为:-sc 140 -en -10 -scale 4-strict -out;RNAhybrid v2.0软件参数设置为:-e 10 -p 0.05。以P≤0.05为显著阈值,分别对表达差异miRNA的靶基因进行基因本体(GO)功能注释及京都基因与基因组百科全书(KEGG)富集分析。
1.7 候选miRNA与其靶基因的互作网络分析
利用Cytoscape 3.9.1软件对筛选到的靶基因绘制互作网络图。
1.8 测序结果可靠性分析
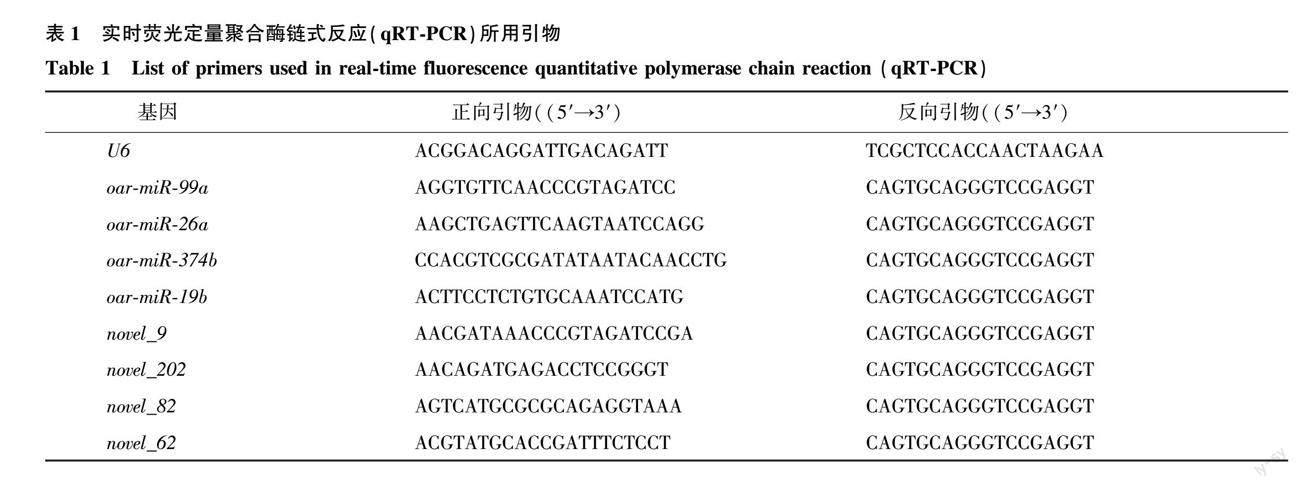
为验证测序数据的准确性,利用实时荧光定量聚合酶链式反应(qRT-PCR)技术,测定不同绵羊品种8个差异表达miRNA的相对表达量,与RNA-seq测序表达量进行一致性比较。利用Primer Premier 6.0软件并采用颈环法设计miRNA引物,以U6作为内参基因(表1)。荧光染料为TB Green Premix Ex Taq TMⅡ(TaKaBa,大连),所用的引物由生工生物工程(上海)股份有限公司合成。PCR反应体系为:2×TB Green Premix Ex Taq II 10.0 μl,正向引物0.8 μl,反向引物0.8 μl,cDNA模板2.0 μl,RNase-free双蒸水6.4 μl。qPCR扩增程序为:95 ℃预变性2 min;95 ℃变性5 s,58 ℃退火30 s,39个循环;95 ℃延伸5 s,60 ℃维持1 min。每个样品设置3次重复。
1.9 统计分析
以2-△△Ct方法进行miRNA相对表达量的计算,利用SPSS 26.0软件对3个品种绵羊的肌内脂肪含量和miRNA的表达量进行单因素方差分析。以P<0.05表示差異显著,P<0.01表示差异极显著。实时荧光定量结果图片由GraphPad Prism V8.0软件绘制。
2 结果与分析
2.1 绵羊肌内脂肪含量差异分析
3个绵羊品种肌内脂肪含量如表2所示。滩羊肌内脂肪含量最高,达5.42%,而小尾寒羊肌内脂肪含量最低,2.10%。滩羊肌内脂肪含量显著高于杜泊羊,且极显著高于小尾寒羊;杜泊羊肌内脂肪含量显著高于小尾寒羊。
2.2 RNA-seq数据分析
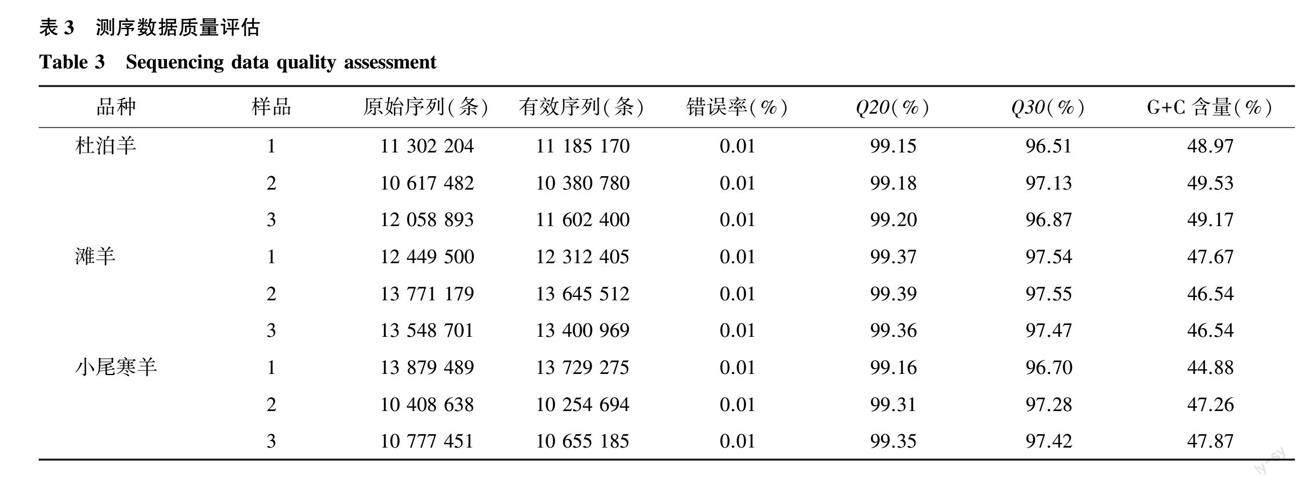
本研究建立3个品种绵羊的9个背最长肌组织样品文库,通过llumina平台进行深度测序后,获得原始序列共108 813 537条,质控后获得有效序列共107 166 390条。每个样本的Q20在99%以上,Q30在96%以上,错误率均为0.01%,碱基组成稳定均衡(表3)。上述结果表明测序质量良好,可用于进一步分析。
2.3 miRNA的注释与鉴定
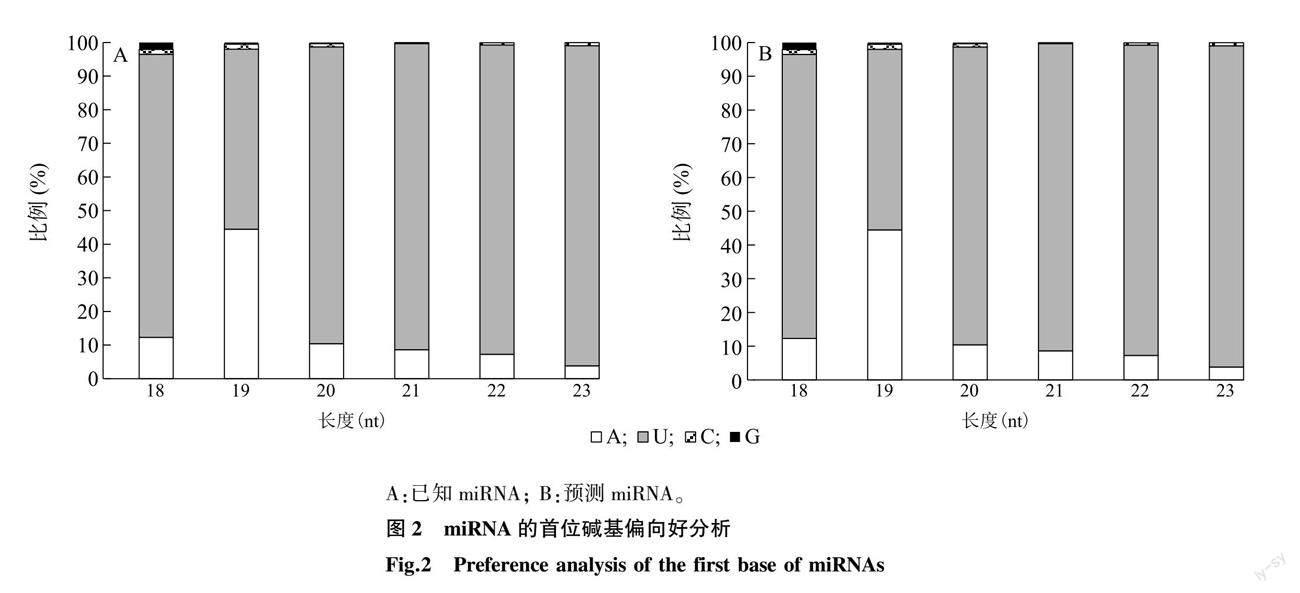
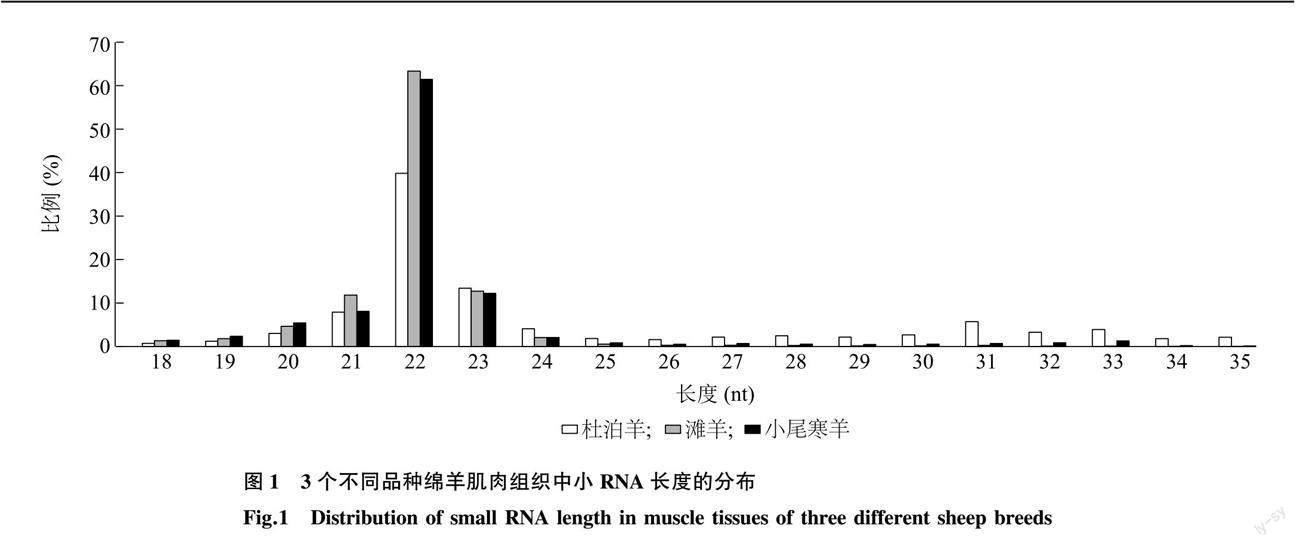
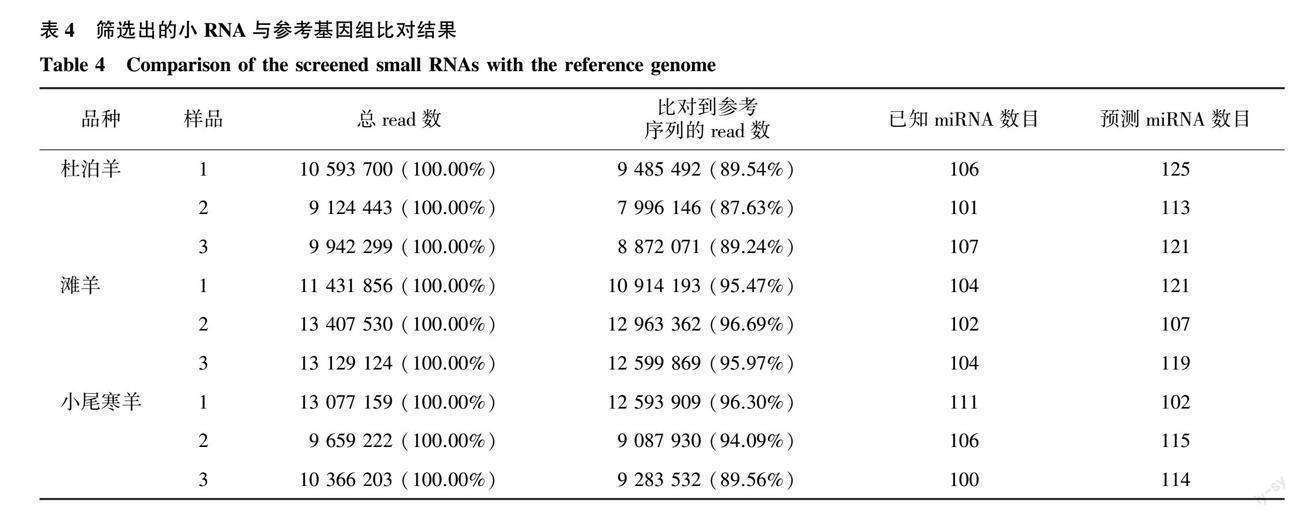
在18~35 nt范围内,筛选各样品中的有效序列[13]。筛选到的有效序列长度在22 nt的序列所占比例最高,滩羊和小尾寒羊22 nt的read所占比例高于杜泊羊(图1)。每个样本至少有87%以上的小RNA序列比对到了绵羊基因参考序列上(表4)。在3种绵羊肌肉组织中共鉴定到134个已知miRNA和153个预测miRNA。对鉴定到的miRNA进行首位碱基偏好性分析发现,已知miRNA和预测miRNA的首位碱基均对U碱基具有明显偏好性(图2)。
2.4 差异表达miRNA的筛选与分析
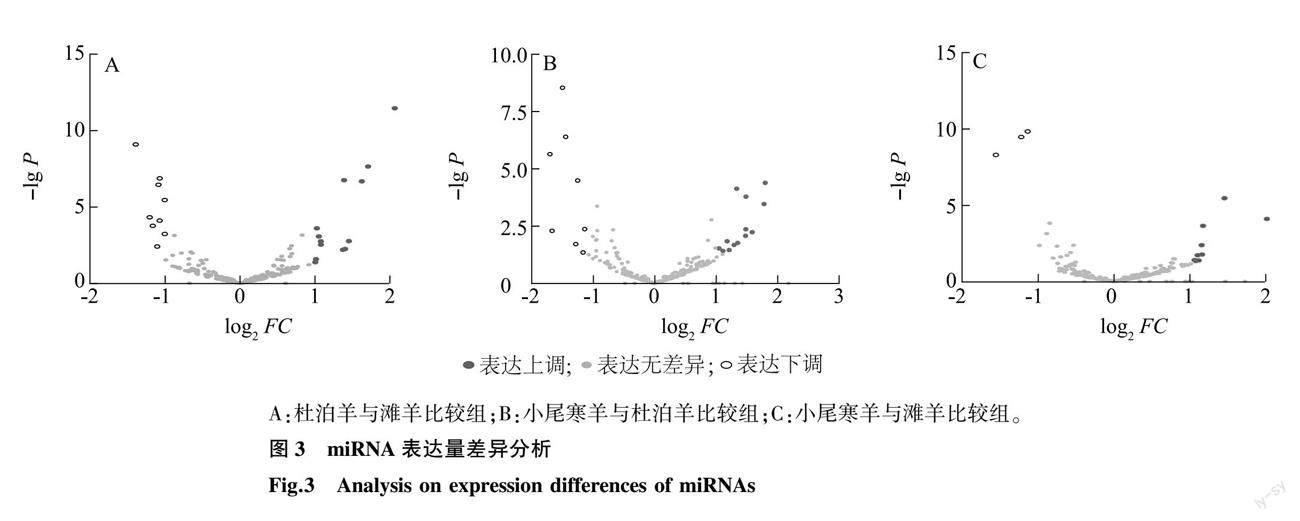
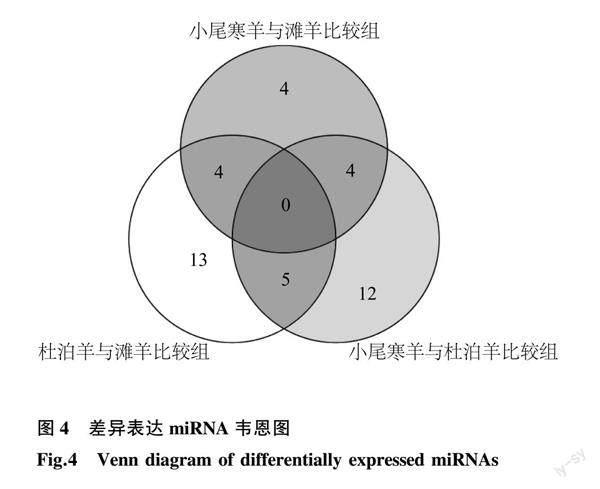
对3个绵羊品种miRNA 的表达量进行两两比较分析。 杜泊羊与滩羊比较组中筛选出差异表达miRNA 22个,其中上调表达13个,下调表达9个;小尾寒羊与杜泊羊比较组中筛选出21个差异表达miRNA,其中上调表达13个,下调表达8个;小尾寒羊与滩羊比较组中筛选出12个差异表达 miRNA,其中上调表达9个,下调表达3个(图3)。3个比较组中没有共表达的差异表达miRNA,小尾寒羊与滩羊比较组与杜泊羊与滩羊比较组,小尾寒羊与杜泊羊比较组之间均有4个共表达的差异表达miRNA,杜泊羊与滩羊比较组与小尾寒羊与杜泊羊比较组之间有5个共表达的差异表达miRNA。3个比较组中共筛选出42个差异表达miRNA(图4)。筛选出的miRNA包括23个已知miRNA和19个新预测的miRNA。筛选出的已知miRNA的差异表达信息如表5所示。
2.5 差异表达miRNA靶基因预测及功能分析
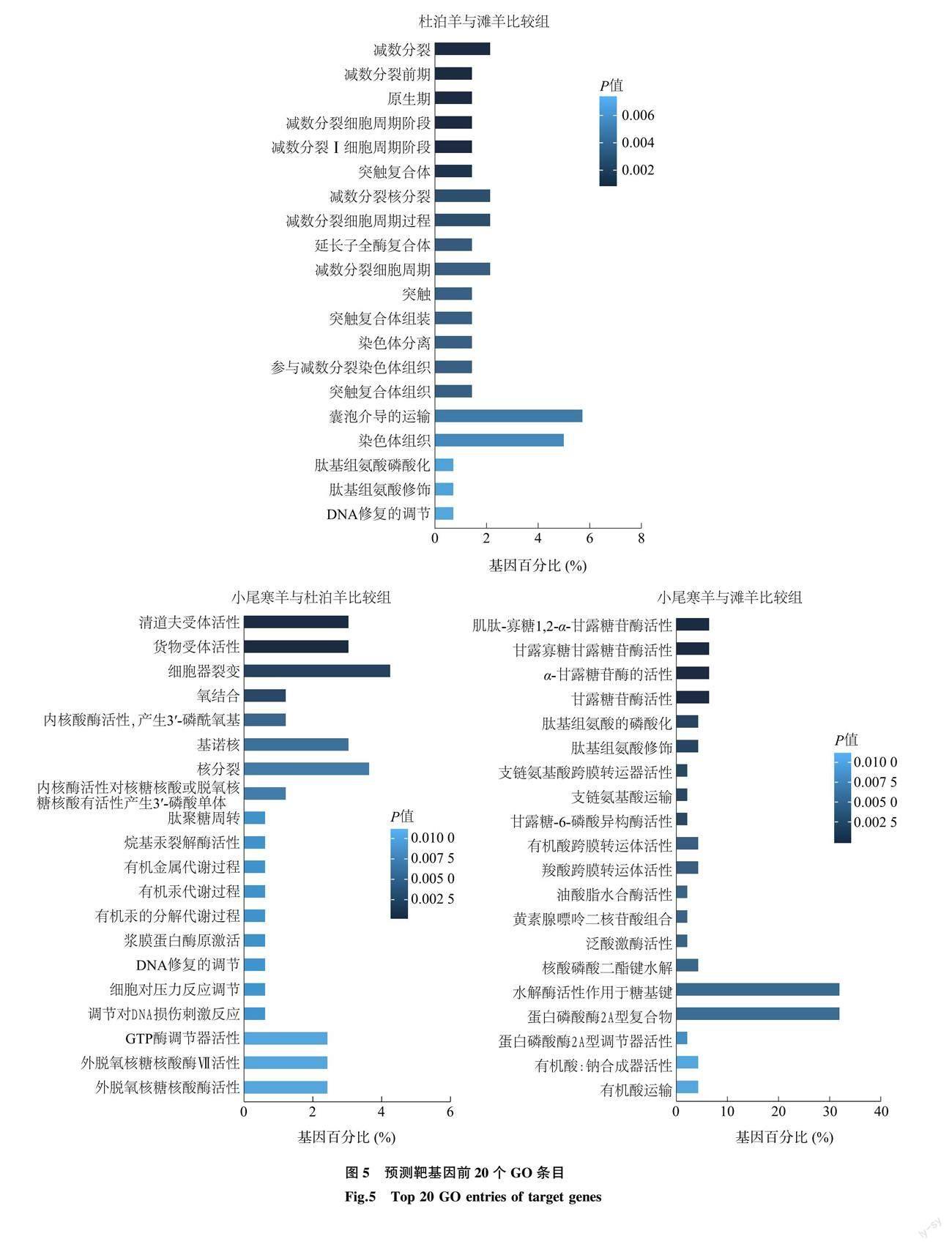
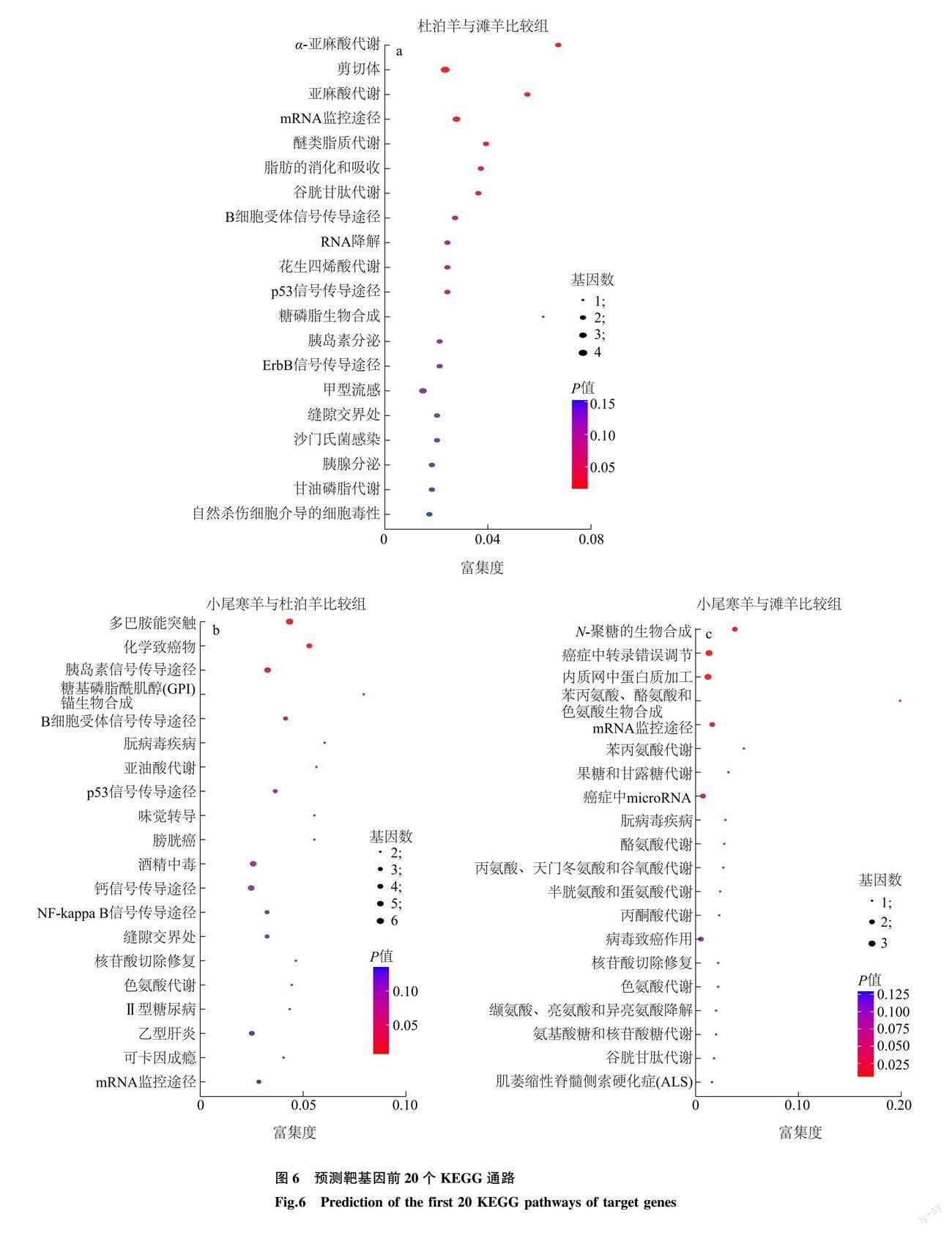
筛选出的42个差异表达 miRNA预测到326个靶基因,形成411个靶向关系对。其中,novel_85、oar-miR-133和oar-miR-485-5p预测到的靶基因数量较多。novel_85预测到99个靶基因,包括糖原合酶基因(GYS1)、组蛋白脱乙酰酶3基因(HDAC3)、胰岛素样生长因子II基因(IGF2)等;oar-miR-133预测到55个靶基因,包括肌球蛋白 IA基因(MYO1A)、鸟氨酸脱羧酶1基因(ODC1)、磷脂酶 A2基因(PLA2)等;oar-miR-485-5p预测到29个靶基因,包括甘露糖-6-磷酸异构酶基因(MPI)、羟酰基谷胱甘肽水解酶基因(HAGH)、跨膜丝氨酸蛋白酶2基因(TMPRSS2)等。对每组预测到的靶基因进行功能分析。 GO功能富集分析发现,杜泊羊与滩羊比较组显著富集到111个GO条目,其中生物学过程51个,细胞组分24个,分子功能36个;小尾寒羊与杜泊羊比较组显著富集到97个GO条目,其中生物学过程51个,细胞组分11个,分子功能35个;小尾寒羊与滩羊比较组显著富集到95个GO条目,其中生物学过程41个,细胞组分6个,分子功能48个。根据P值大小每组前20的GO条目如图5所示,显著富集在减数分裂、减数分裂前期、清道夫受体活性、货物受体活性、肌肽-寡糖1,2-α-甘露糖苷酶活性和甘露寡糖甘露糖苷酶活性等GO条目。KEGG信号通路富集分析发现,杜泊羊与滩羊比较组富集到106个通路,7个通路显著富集;小尾寒羊与杜泊羊比较组富集到168个通路,4个通路显著富集;小尾寒羊与滩羊比较组富集到46个通路,5个通路显著富集。根据P值大小每组前20个信号富集通路如图6所示,显著富集的通路主要有α-亚麻酸代谢、亚油酸代谢、多巴胺能突触、胰岛素信号传导途径、N-聚糖的生物合成和苯丙氨酸、酪氨酸和色氨酸的生物合成等代谢通路。根据GO和KEGG的功能描述筛选出23个差异表达miRNA及其靶向的119个基因可能参与脂肪沉积。
2.6 miRNA靶向调控网络
筛选出的119个可能参与脂肪沉积的靶基因与23个差异表达miRNA构成129个靶向关系对,其调控网络如图7所示。通过调控网络图发现,oar-miR-133、oar-miR-485-5p、novel_6、novel_85和novel_103靶向到较多的靶基因且构成了完整的调控网络,故推测其可能是调控绵羊脂肪沉积的关键miRNA。
2.7 miRNA表达验证
利用qRT-PCR得到3个绵羊品种8个差异表达miRNA(oar-miRNA-99a、oar-miR-26a、oar-miR-374b、oar-miR-19b、novel_9、novel_202、 novel_82、novel_62)的相对表达量与RNA-seq测序得到的这8个miRNA表达趋势基本保持一致(图8),说明测序结果真实可靠。
3 讨论
3.1 3个品种绵羊肌内脂肪含量差异
肉质性状是绵羊关键的经济性状,也是育种者关注的重要问题。IMF含量的高低影响羊肉的食用价值。滩羊作为中国特有的裘皮绵羊品种,其肉质细嫩、无膻味;杜泊羊原产自南非国家,产肉性能高,是育肥生产中优质品种;而小尾寒羊具有繁殖率高的特点,是一产多羔的代表性品种[14]。3个品种中,滩羊的肌内脂肪含量最高,而小尾寒羊最低。滩羊和杜泊羊作为优质的肉羊品种,肌内脂肪含量均高于小尾寒羊。
3.2 3个品种绵羊背最长肌miRNA的鉴定及特征
微小核糖核酸(miRNA)是由20~24个核苷酸碱基组成的非编码内源性小分子RNA[15]。本研究从3个品种绵羊背最长肌中共鉴定到134个已知miRNA和153个预测miRNA,其长度主要分布在21~23 nt,且长度为22 nt的miRNA占比最高,符合miRNA的长度分布特征。对鉴定到的miRNA进行首位碱基偏向性分析,发现首位碱基偏向于U碱基。这与Liu等[16]在绵羊骨骼肌中鉴定到miRNA的首碱基偏向性和付雪峰等[17]在藏绒山羊皮肤组织中鉴定出的miRNA的首位碱基偏向性一致。miRNA的首位碱基对U碱基的偏好性可能与miRNA的形成以及其对靶基因的沉默机制有关[18]。
3.3 绵羊肌内脂肪含量相关miRNA的筛选
本研究在杜泊羊、滩羊和小尾寒羊的背最长肌中筛选获得42个差异表达miRNA,包括23个已知的miRNA和19个预测的miRNA。进一步通过表达量差异筛选出23个可能与绵羊背最长肌脂肪沉积相关的miRNA。筛选出的这些已知miRNA已有部分被证实参与调节脂肪沉积和脂质代谢。例如,miR-433-3p对支链酮酸脱氢酶β(BCKDHB)有负调控作用,影响绵羊前体脂肪细胞分化从而参与调节绵羊的脂肪代谢[19]; miR-27a 通过调节靶基因RXRα的表达来增强绵羊前脂肪细胞增殖并抑制绵羊前脂肪细胞分化,在调节绵羊肌肉脂肪和皮下脂肪组织之间的差异脂肪积累中起重要作用[9];miR-143是与脂质代谢密切相关的miRNA之一,通过调节靶基因的表达来调节奶牛脂肪细胞分化和甘油三酯合成[20]。Wang等[21]研究发现miR-26a 和miR-143在成年肉牛肌内脂肪中的表达量显著高于皮下脂肪; 汪海洋等[22]研究发现miR-143在西门塔尔牛肌内脂肪组织中表达量高于皮下脂肪。本研究中,miR-26a作为杜泊羊与滩羊比较组和小尾寒羊与滩羊比较组中筛选出共有的差异表达miRNA,在滩羊肌肉组织中表达量显著高于杜泊羊和小尾寒羊,且杜泊羊的表达量略高于小尾寒羊;同样,miR-143在杜泊羊与滩羊比较组中被筛选出来,该miRNA在滩羊肌肉组织中表达量高于杜泊羊。在3个品种绵羊肌内脂肪含量分析中,滩羊IMF含量最高而小尾寒羊最低,上述2个miRNA表达量的研究结果也符合该特征。同样,let-7b是小尾寒羊与杜泊羊比较组和小尾寒羊与滩羊比较组中筛选出共有的差异表达miRNA,且与miR-26a在3个品种绵羊肌肉组织中的表达趋势一致,即高肌内脂肪含量的组织中let-7b表达量亦高。这个结果与喻世刚等[11]发现的鸡胸肌内脂肪含量与let-7b表达量的关系一致。上述结果也进一步说明本研究筛选出的miRNA作为与绵羊肌内脂肪含量相关的候选miRNA的可靠性。但这些miRNA对绵羊肌肉脂肪含量的影响机制还需进一步研究。
3.4 差异miRNA的靶基因预测及功能分析
筛选出的42个差异表达miRNA预测到326个靶基因,形成411个靶向关系对。值得注意的是novel_85预测到99个靶基因,为差异表达miRNA中靶向到最多候选基因的miRNA。这些候选的靶向基因可以参与脂肪沉积。GYS1基因与糖原代谢相关,其突变影响到肌糖原的沉积[23];HDAC3蛋白的复合物使过氧化物酶体增殖物激活受体γ2(Peroxisome proliferator-activated receptor γ2)基因(PPARG2)转录失活,从而参与到脂肪生成过程[24];IGF2基因的突变造成猪肌内脂肪和脂肪酸含量存在差异,可以参与到脂肪组织中脂肪酸的形成。上述研究结果表明,novel_85可能是参与绵羊脂肪沉积及脂肪代谢的关键miRNA。另外也有一些差异表达miRNA靶向的基因与脂肪沉积和脂肪代谢相关的研究。如oar-miR-133和oar-miR-485-5p同时靶向的谷胱甘肽硫转移酶基因(P1GSTP1)可以参与到脂质代谢过程[25];novel_103靶向的丙酮酸脱氢酶激酶4基因(PDK4),在中国草原红牛的研究中发现该基因的多态性与其肌内脂肪含量相关[26];oar-miR-433-3p靶向的色氨酸3基因(SESN3)参与调节前脂肪细胞脂肪生成[27]。为了进一步了解筛选出的差异miRNA的功能,对其预测的靶基因进行功能分析。GO功能富集分析发现,富集显著的条目包括糖原代谢过程、油酸酯水合酶活性、三羧酸循环过程、低密度脂蛋白颗粒受体结合等与糖代谢及脂质代谢相关的条目。KEGG信号通路富集分析发现,可以富集到α-亚麻酸代谢、亞油酸代谢、多巴胺能突触、胰岛素信号传导途径以及脂肪的消化和吸收通路。已有研究结果表明,α-亚麻酸会影响奶牛乳腺中的脂肪酸代谢[28],亚油酸可以增加呼吸链解偶联蛋白1(UCP1)和肉碱-棕榈油转移酶1 (CPT1)的表达,促进脂肪降解[29],并且不同共轭亚油酸对小鼠的脂肪沉积具有显著差异 [30]。上述研究结果表明,筛选出差异表达miRNA的靶基因可能参与脂肪沉积。根据GO和KEGG的功能描述筛选出可能参与绵羊脂肪沉积的119个靶基因,并对靶向关系进行调控网络构建。研究认为,oar-miR-133、oar-miR-485-5p、novel_6、novel_85和novel_103可能是参与绵羊肌内脂肪沉积的关键miRNA。但miRNA 对靶基因和 IMF 沉积的影响和调控机制尚需进行进一步阐明。
4 结论
杜泊羊,滩羊和小尾寒羊这3个品种绵羊IMF含量存在差异,滩羊肌内脂肪含量最高而小尾寒羊最低。筛选出23个已知的和19个未知的差异表达miRNA可能参与绵羊肌内脂肪沉积,oar-miR-133、oar-miR-485-5p、novel_6、novel_85和novel_103可能是綿羊肌内脂肪沉积的关键调控miRNA。
参考文献:
[1] FRANK D, WATKINS P, BALL A, et al. Impact of brassica and lucerne finishing feeds and intramuscular fat on lamb eating quality and flavor. a cross-cultural study using Chinese and non-Chinese Australian consumers [J]. J Agric Food Chem,2016, 64(36): 6856-6868.
[2] 闫 伟,王玉涛,张永浩,等. 绵羊肌内前体脂肪细胞CNR1和FABP4基因表达研究[J]. 中国农业科技导报, 2022, 24(3): 95-102.
[3] LIANG C, QIAO L, HAN Y, et al. Regulatory roles of SREBF1 and SREBF2 in lipid metabolism and deposition in two Chinese representative fat-tailed sheep breeds[J]. Animals, 2020, 10(8): 1317.
[4] MOHSEN A, HOSEIN M S, MOHAMMAD M S, et al. Association of the calpastatin genotypes, haplotypes, and SNPs with meat quality and fatty acid composition in two Iranian fat- and thin-tailed sheep breeds[J]. Small Ruminant Research,2016, 149: 40-51.
[5] HORAK M, NOVAK J, BIENERTOVA-VASKU J. Muscle-specific microRNAs in skeletal muscle development[J]. Dev Biol, 2016, 410(1): 1-13.
[6] 邵 静,张珈溯,尹宝珍,等. miR-17-3p靶向KCTD15调控延边黄牛前体脂肪细胞分化[J].畜牧兽医学报, 2020, 51(11): 2689-2698.
[7] MA J Q, LIN Y Q, ZHU J J, et al. MiR-26b-5p regulates the preadipocyte differentiation by targeting FGF21 in goats[J]. In Vitro Cellular & Developmental Biology-Animal, 2021,57: 257-263.
[8] CHEN X Y, SAYED H A R, CHENG G, et al. Bta-miR-376a targeting KLF15 interferes with adipogenesis signaling pathway to promote differentiation of Qinchuan beef cattle preadipocytes[J]. Animals, 2020, 10(12): 2362.
[9] DENG K, REN C, FAN Y, et al. miR-27a is an important adipogenesis regulator associated with differential lipid accumulation between intramuscular and subcutaneous adipose tissues of sheep[J]. Domest Anim Endocrinol,2020,71: 106393.
[10]CHENG F, LIANG J, YANG L, et al. Systematic identification and comparison of the expressed profiles of lncRNAs, miRNAs, circRNAs, and mRNAs with associated co-expression networks in pigs with low and high intramuscular fat[J]. Animals, 2021,11(11):3212.
[11]喻世刚,王 钢,廖 娟,等. 沐川乌骨黑鸡肌内脂肪沉积相关microRNAs的筛查与鉴定[J].中国畜牧兽医, 2021, 48(8): 2713-2726.
[12]HUANG J P, WANG S Z, FENG X, et al. miRNA transcriptome comparison between muscle and adipose tissues indicates potential miRNAs associated with intramuscular fat in Chinese swamp buffalo[J]. Genome, 2019, 62(11): 729-738.
[13]BARTEL D P. Metazoan MicroRNAs[J]. Cell,2018, 173(1): 20-51.
[14]孟 科,张天闻,梁 鹏,等. 绵羊MYF5基因多態性及其与生长性状的关联分析[J]. 农业生物技术学报, 2022, 30(3): 496-505.
[15]BUSHATI N, COHEN S M. microRNA functions[J]. Annu Rev Cell Dev Biol, 2007, 23: 175-205.
[16]LIU Z J, LI C Y, LI X Y, et al. Expression profiles of microRNAs in skeletal muscle of sheep by deep sequencing[J]. Asian-Australasian Journal of Animal Sciences, 2019, 32(6): 757-766.
[17]付雪峰,赵冰茹,索朗达,等. 不同绒细度的西藏绒山羊皮肤组织miRNA分析与鉴定[J].农业生物技术学报,2021, 29(11): 2118-2128.
[18]袁钰洁,周婧雯,殷 实,等.不同发育阶段牦牛睾丸组织miRNA的分析及鉴定[J].中国兽医学报,2022,42(1):165-174.
[19]闫晓茹,师 涛,潘洋洋,等. MiR-433-3p靶向调节绵羊BCKDHB表达[J].中国农业科学, 2017, 50(22): 4389-4397.
[20]ZHANG L, WU Z Q, WANG Y J, et al. MiR-143 regulates milk fat synthesis by targeting smad3 in bovine mammary epithelial cells[J]. Animals, 2020, 10(9): 1453.
[21]WANG H Y, ZHENG Y, WANG G L, et al. Identification of microRNA and bioinformatics target gene analysis in beef cattle intramuscular fat and subcutaneous fat[J]. Molecular Biosystems,2013, 9(8): 2154-2162.
[22]汪海洋,郑 月,李惠侠,等. 西门塔尔牛肌内和皮下脂肪miRNA表达谱及miR-27b靶基因分析[J]. 中国农业科学,2013, 46(18): 3894-3900.
[23]FANG L, SHEN B, IRWIN D M, et al. Parallel evolution of the glycogen synthase 1 (muscle) gene Gys1 between old world and new world fruit bats (order: chiroptera)[J]. Biochem Genet, 2014, 52: 443-458.
[24]LAI P H, WANG W L, KO C Y, et al. HDAC1/HDAC3 modulates PPARG2 transcription through the sumoylated CEBPD in hepatic lipogenesis[J]. Biochimica et Biophysica Acta,2008, 1783(10): 1803-1814.
[25]王 晶.延黄牛GSTP1基因遗传变异分析及其对脂代谢的影响[D].延吉:延边大学,2021.
[26]马彦茹,于永生,曹 阳,等. 中国草原红牛PDK4基因多态性及其与肉质性状的关联分析[J]. 中国畜牧兽医, 2022, 49(6): 2186-2194.
[27]LIN W, ZHAO J, YAN M, et al. SESN3 inhibited SMAD3 to relieve its suppression for MiR-124, thus regulating pre-adipocyte adipogenesis[J]. Genes,2021,12(12):1852.
[28]YAMG G, BU D P, WAMG J Q, et al. Duodenal infusion of α-linolenic acid affects fatty acid metabolism in the mammary gland of lactating dairy cows[J]. Journal of Dairy Science,2012,95(10):5821-5830.
[29]伏春燕,张 燕,魏祥法,等. 共轭亚油酸降低脂肪沉积的分子机制研究进展[J]. 动物营养学报,2019,31(8): 3456-3462.
[30]陈 林,赵伟杰,张枫琳,等. 不同共轭亚油酸异构体对小鼠脂肪沉积、能量代谢和肠道微生物的影响[J]. 华南农业大学学报, 2022, 43(3): 1-8.
(责任编辑:石春林)
