苍术素对牙周炎大鼠牙周组织炎性损伤和牙槽骨丢失的影响及机制Δ
2023-12-13苏娟娟陈洪婷翟远坤河南大学第一附属医院口腔科河南开封475000河南大学口腔医学院河南开封475000
苏娟娟 ,王 旭 ,陈洪婷 ,翟远坤 ,靳 强 ,王 琳 (1.河南大学第一附属医院口腔科,河南 开封 475000;.河南大学口腔医学院,河南 开封 475000)
牙周炎是一种流行的慢性炎症性疾病,其特征是牙周组织持续发炎和不可逆的牙槽骨丢失,最终导致牙齿脱落[1]。流行病学调查显示,牙周炎与其他慢性炎症驱动的疾病有关,例如糖尿病、阿尔茨海默病和某些癌症等[2]。目前可用于牙周炎的措施包括非手术治疗(如洗牙、牙周袋冲洗和牙根整平)和再生手术,从而再生牙周组织。此外,含有抗生素和抗微生物剂的辅助药物被应用于牙周的局部治疗。然而上述方法的治疗结果并不尽如人意[3]。因此,开发新的药物抑制牙周炎过程中的牙周组织炎性损伤和牙槽骨丢失具有重要意义。
苍术素是从植物苍术的根茎中提取的一种活性成分,据报道,其可通过抑制炎症反应减轻小鼠结肠炎[4],通过抑制炎症改善大鼠膝骨关节炎[5]。以上研究提示,苍术素可通过抑制炎症延缓多种疾病的进展。但关于苍术素能否改善牙周炎的研究鲜有报道。相关研究显示,激活基质细胞衍生因子1(stromal cell-derived factor-1,SDF-1)/CXC 型趋化因子受体4(CXC chemokine receptor-4,CXCR4)通路可促进牙周炎模型大鼠牙周修复[6]。但苍术素能否调控SDF-1/CXCR4 信号通路影响牙周炎模型大鼠牙周组织炎性损伤和牙槽骨丢失尚不明确。基于此,本研究主要探究苍术素对牙周炎模型大鼠牙周组织炎性损伤和牙槽骨丢失的影响,并从SDF-1/CXCR4 信号通路着手探索其可能的作用机制,为牙周炎的治疗提供参考。
1 材料
1.1 主要仪器
本研究所用的主要仪器有:7696 型牙周探针(德国Kohler牙科器械有限公司)、ST-360型酶标仪(上海科华实验系统有限公司)、CX53 型光学显微镜(日本Olympus公司)、165-8001型蛋白电泳仪(美国Bio-Rad公司)。
1.2 主要药品与试剂
本研究所用的主要药品与试剂有:苍术素对照品(上海晅科生物科技有限公司,批号20221223,纯度≥98%);甲硝唑(亚宝药业集团股份有限公司,批号20221001,规格0.2 g);白细胞介素6(interleukin-6,IL-6)、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)酶联免疫吸附检测(ELISA)试剂盒(上海广锐生物科技有限公司,批号分别为20220506、20220816);SDF-1/CXCR4 通路抑制剂AMD3100(北京索莱宝科技有限公司,批号20221123,纯度≥97%);亚甲蓝染色液(上海源叶生物科技有限公司,批号20220928);抗酒石酸磷酸酶(tartrate resistant acid phosphatase,TRAP)染色试剂盒(上海雅吉生物科技有限公司,批号20220830);骨保护素(osteoprotegerin,OPG)、核因子κB受体活化因子配基(receptor activator of NF-κB ligand,RANKL)、SDF-1、CXCR4、甘油醛-3-磷酸脱氢酶(GAPDH)兔单克隆抗体及辣根过氧化物酶(HRP)标记的羊抗兔二抗(英国Abcam 公司,批号分别为ab183910、ab239607、ab25117、ab124824、ab8245、ab205718)。
1.3 动物与细菌
本研究所用动物为SPF级雄性SD大鼠,共144只,7周龄,体重250~260 g,购自郑州大学实验动物中心,动物生产许可证号为SCXK(豫)2022-0001。实验动物饲养于温度22~24 ℃、相对湿度50%~60%、光照12 h/黑暗12 h 交替的环境中。本研究获得了河南大学第一附属医院动物伦理委员会的批准,伦理编号为2022-03-016。
本研究所用细菌为牙龈卟啉单胞菌(上海名劲生物科技有限公司)。
2 方法
2.1 牙周炎大鼠模型的构建
采用牙龈内接种牙龈卟啉单胞菌法构建牙周炎大鼠模型。具体操作为:用2%戊巴比妥钠麻醉大鼠,用棉线双侧结扎大鼠上颌第一磨牙牙龈下部,并于磨牙区接种1×1010CFU牙龈卟啉单胞菌液,隔日接种1次,7 d后移除棉线[7]。当观察到大鼠牙龈红肿、探诊出血、有深牙周袋形成则认为牙周炎大鼠模型构建成功[8]。
2.2 动物分组与给药
按照随机数字表法将144 只大鼠随机分为对照组,模型组,苍术素低、中、高剂量组,甲硝唑组(阳性对照组),AMD3100(SDF-1/CXCR4通路抑制剂)组和苍术素高剂量+AMD3100组,每组18只。对照组大鼠用棉线双侧结扎大鼠上颌第一磨牙牙龈下部,并于磨牙区注射等量的生理盐水代替牙龈卟啉单胞菌液,隔日注射1次,7 d 后移除棉线。其余各组大鼠均按照“2.1”项下方法构建牙周炎模型。建模成功后,进行给药处理:苍术素低、中、高剂量组大鼠分别腹腔注射6.665、13.33、26.66 mg/kg 苍术素[9],且同时灌胃等体积的生理盐水;甲硝唑组大鼠灌胃0.05 g/kg甲硝唑[10],且同时腹腔注射等体积的生理盐水;AMD3100组大鼠灌胃1 mg/kg AMD3100[11],且同时腹腔注射等体积的生理盐水;苍术素高剂量+AMD3100 组大鼠腹腔注射26.66 mg/kg 苍术素,且同时灌胃1 mg/kg AMD3100;对照组、模型组大鼠均需灌胃且腹腔注射等量的生理盐水。各组大鼠每天给药(或生理盐水)1次,持续4周。
2.3 大鼠牙龈指数评定
末次给药(或生理盐水)24 h后,全部大鼠均进行牙龈指数评定。利用牙周探针探测牙龈边缘,根据大鼠牙龈出血、水肿、溃疡形成等情况来评定牙龈指数。评定标准如下[12]:牙龈正常,记0 分;牙龈轻微水肿但探针滑动后无出血现象,记1分;探针滑动后牙龈出血,记2分;牙龈自发出血或有溃疡形成,记3分。
2.4 标本收集与处理
牙龈指数评定结束后,麻醉所有大鼠(每组18 只),腹主动脉取血,经离心后得血清,用于ELISA 实验。血液收集完成后,每组随机选取6只大鼠,处死,收集大鼠上颌骨组织用于亚甲蓝染色。处死各组剩余的12 只大鼠,收集大鼠的牙周组织,分为两部分(每部分包含各组6 只大鼠的牙周组织),一部分固定于4%多聚甲醛中用于HE 染色和TRAP 染色,另一部分冻存于-80 ℃冰箱中用于Western blot实验。
2.5 大鼠血清中IL-6、TNF-α水平检测
采用ELISA 法进行检测。取“2.4”项下血清,冰上解冻后,严格按照试剂盒说明书操作步骤检测大鼠血清中IL-6、TNF-α水平。
2.6 大鼠牙槽骨吸收检测
采用亚甲蓝染色法进行检测。将“2.4”项下的大鼠上颌骨组织煮沸后剥离软组织,然后加入0.1%亚甲蓝孵育2 min,通过光学显微镜观察并记录第一磨牙到第三磨牙处釉-牙骨质界到牙槽嵴顶的距离,将该距离作为牙槽骨吸收值。
2.7 大鼠牙周组织病理损伤观察
采用HE 染色法进行观察。将“2.4”项下固定于4%多聚甲醛的牙周组织脱钙后包埋在石蜡中,用切片机切成4 μm厚的切片,经HE染色、磷酸盐缓冲液冲洗切片、梯度乙醇和二甲苯脱水、中性树脂封片并晾干后,通过光学显微镜观察牙周组织的病理变化。
2.8 大鼠牙周组织中破骨细胞数检测
采用TRAP染色法进行检测。取“2.7”项下切片,按照TRAP 染色试剂盒操作步骤进行染色、吹干后,利用中性明胶封片,通过光学显微镜观察牙周组织中破骨细胞并统计细胞数。
2.9 大鼠牙周组织中OPG、RANKL、SDF-1、CXCR4蛋白表达的检测
采用Western blot法进行检测。利用RIPA裂解缓冲液提取“2.4”项下牙周组织总蛋白。经BCA法对蛋白进行定量后,将蛋白进行煮沸变性。取40 μg 蛋白样品进行12%聚丙烯酰胺凝胶电泳(电压100 V,电泳时间2 h)分离,转移(电流250 mA,转膜时间1.5 h)到聚偏二氟乙烯膜上,以5%脱脂牛奶进行封闭;加入一抗OPG(稀释比例1∶3 000)、RANKL(稀释比例1∶2 000)、SDF-1(稀释比例1∶3 000)、CXCR4(稀释比例1∶2 000)、GAPDH(稀释比例1∶4 000),4 °C 孵育过夜;洗膜后,加入二抗(稀释比例1∶2 000),室温孵育1 h;加入ECL试剂显色,利用Image J软件评估蛋白灰度值。目的蛋白的相对表达水平用目的蛋白条带灰度值与内参蛋白(GAPDH)条带灰度值的比值表示。
2.10 统计学方法
利用SPSS 25.0软件进行统计分析。符合正态分布且方差齐性的数据以±s表示。多组数据间的比较采用单因素方差分析,进一步两组数据间的比较采用SNK-q检验。检验水准α=0.05。
3 结果
3.1 苍术素对大鼠牙龈指数的影响
与对照组比较,模型组大鼠牙龈指数显著升高(P<0.05);与模型组比较,苍术素低、中、高剂量组和甲硝唑组大鼠牙龈指数显著降低(P<0.05),AMD3100 组大鼠牙龈指数显著升高(P<0.05);与苍术素高剂量组比较,苍术素高剂量+AMD3100 组大鼠牙龈指数显著升高(P<0.05)。结果见表1。
表1 各组大鼠牙龈指数及血清中IL-6、TNF-α 水平比较(±s,n=18)

表1 各组大鼠牙龈指数及血清中IL-6、TNF-α 水平比较(±s,n=18)
a:与对照组比较,P<0.05;b:与模型组比较,P<0.05;c:与苍术素高剂量组比较,P<0.05。
分组对照组模型组苍术素低剂量组苍术素中剂量组苍术素高剂量组甲硝唑组AMD3100组苍术素高剂量+AMD3100组牙龈指数/分0.00±0.00 2.15±0.13a 1.78±0.12b 1.29±0.12b 0.28±0.02b 0.26±0.01b 2.58±0.10b 1.51±0.13c IL-6/(pg/mL)65.53±3.15 132.27±7.34a 115.58±5.36b 98.85±4.23b 77.64±3.15b 78.86±4.03b 179.93±6.58b 107.72±4.87 c TNF-α/(pg/mL)128.65±5.74 259.45±11.73a 214.43±10.05b 179.94±9.03b 149.25±7.05b 148.87±7.11b 301.45±13.39b 193.36±8.72 c
3.2 苍术素对大鼠血清中IL-6、TNF-α水平的影响
与对照组比较,模型组大鼠血清中IL-6、TNF-α 水平显著升高(P<0.05);与模型组比较,苍术素低、中、高剂量组和甲硝唑组大鼠血清中IL-6、TNF-α水平均显著降低(P<0.05),AMD3100组大鼠血清中IL-6、TNF-α水平显著升高(P<0.05);与苍术素高剂量组比较,苍术素高剂量+AMD3100 组大鼠血清中IL-6、TNF-α 水平显著升高(P<0.05)。结果见表1。
3.3 苍术素对大鼠牙槽骨吸收值的影响
与对照组[(0.09±0.01)mm,n=6]比较,模型组大鼠牙槽骨吸收值[(0.94±0.08)mm,n=6]显著升高(P<0.05);与模型组比较,苍术素低、中、高剂量组和甲硝唑组大鼠牙槽骨吸收值[分别为(0.76±0.07)、(0.52±0.04)、(0.21±0.02)、(0.19±0.02)mm,n=6]均显著降低(P<0.05),AMD3100组大鼠牙槽骨吸收值[(1.20±0.11)mm,n=6]显著升高(P<0.05);与苍术素高剂量组比较,苍术素高剂量+AMD3100组大鼠牙槽骨吸收值[(0.67±0.06)mm,n=6]显著升高(P<0.05)。亚甲蓝染色结果见图1。
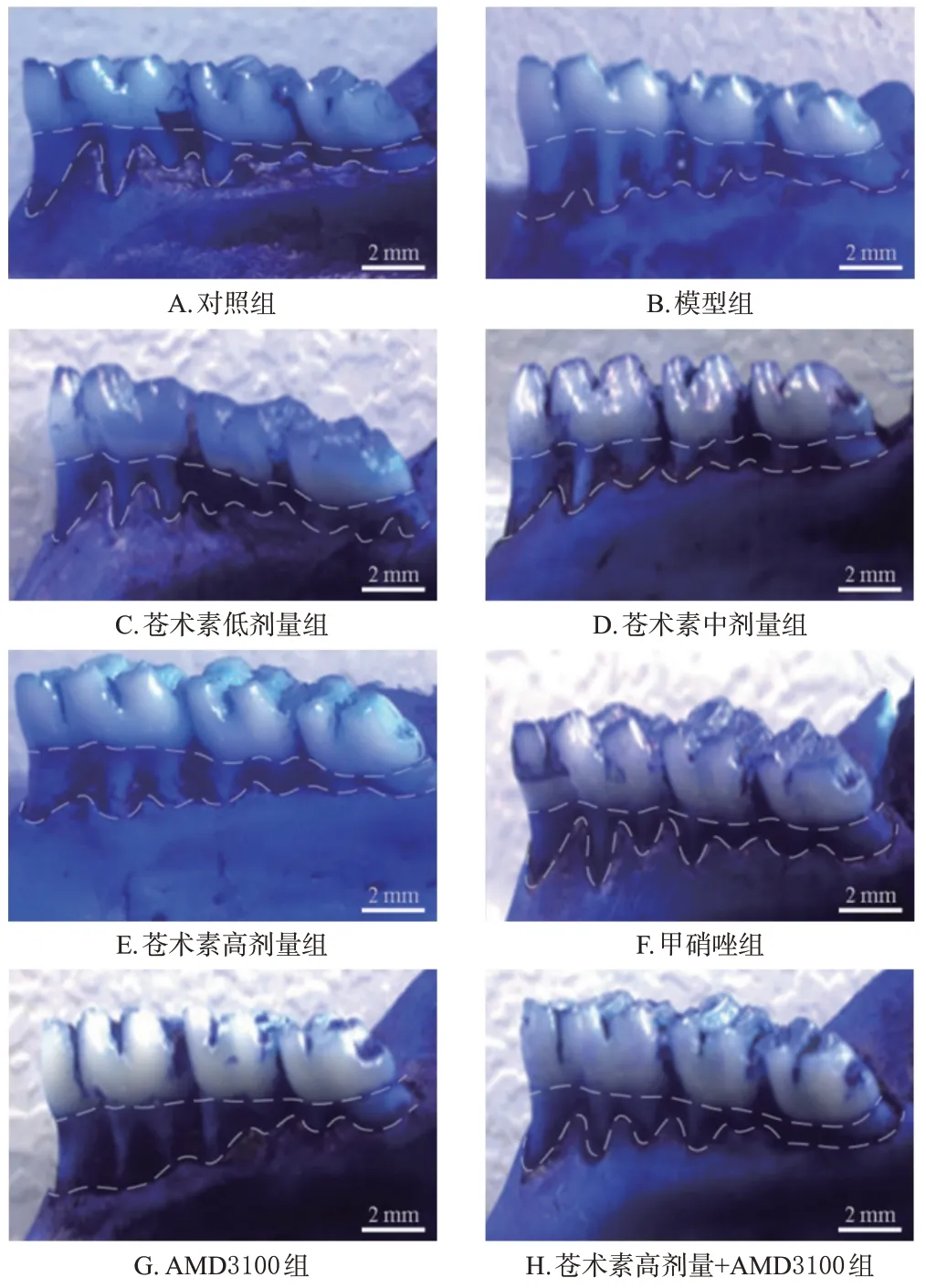
图1 各组大鼠牙槽骨吸收检测的亚甲蓝染色图(×5)
3.4 苍术素对大鼠牙周组织病理损伤的影响
对照组大鼠牙周组织结构正常,几乎无炎症细胞浸润;模型组大鼠牙周组织中有大量炎症细胞浸润;与模型组比较,苍术素低、中、高剂量组和甲硝唑组大鼠牙周组织病理损伤减轻,AMD3100 组大鼠牙周组织病理损伤加重;与苍术素高剂量组比较,苍术素高剂量+AMD3100组大鼠牙周组织病理损伤严重。结果见图2。
3.5 苍术素对大鼠牙周组织中破骨细胞数的影响
与对照组[(1.78±0.13)个,n=6]比较,模型组大鼠牙周组织中破骨细胞数[(15.56±0.44)个,n=6]显著增加(P<0.05);与模型组比较,苍术素低、中、高剂量组和甲硝唑组大鼠牙周组织中破骨细胞数[分别为(11.78±0.29)、(8.68±0.23)、(3.77±0.15)、(3.81±0.17)个,n=6]显著减少(P<0.05),AMD3100 组大鼠牙周组织中破骨细胞数[(19.06±0.61)个,n=6]显著增加(P<0.05);与苍术素高剂量组比较,苍术素高剂量+AMD3100组大鼠牙周组织中破骨细胞数[(9.88±0.34)个,n=6]显著增加(P<0.05)。结果见图3。
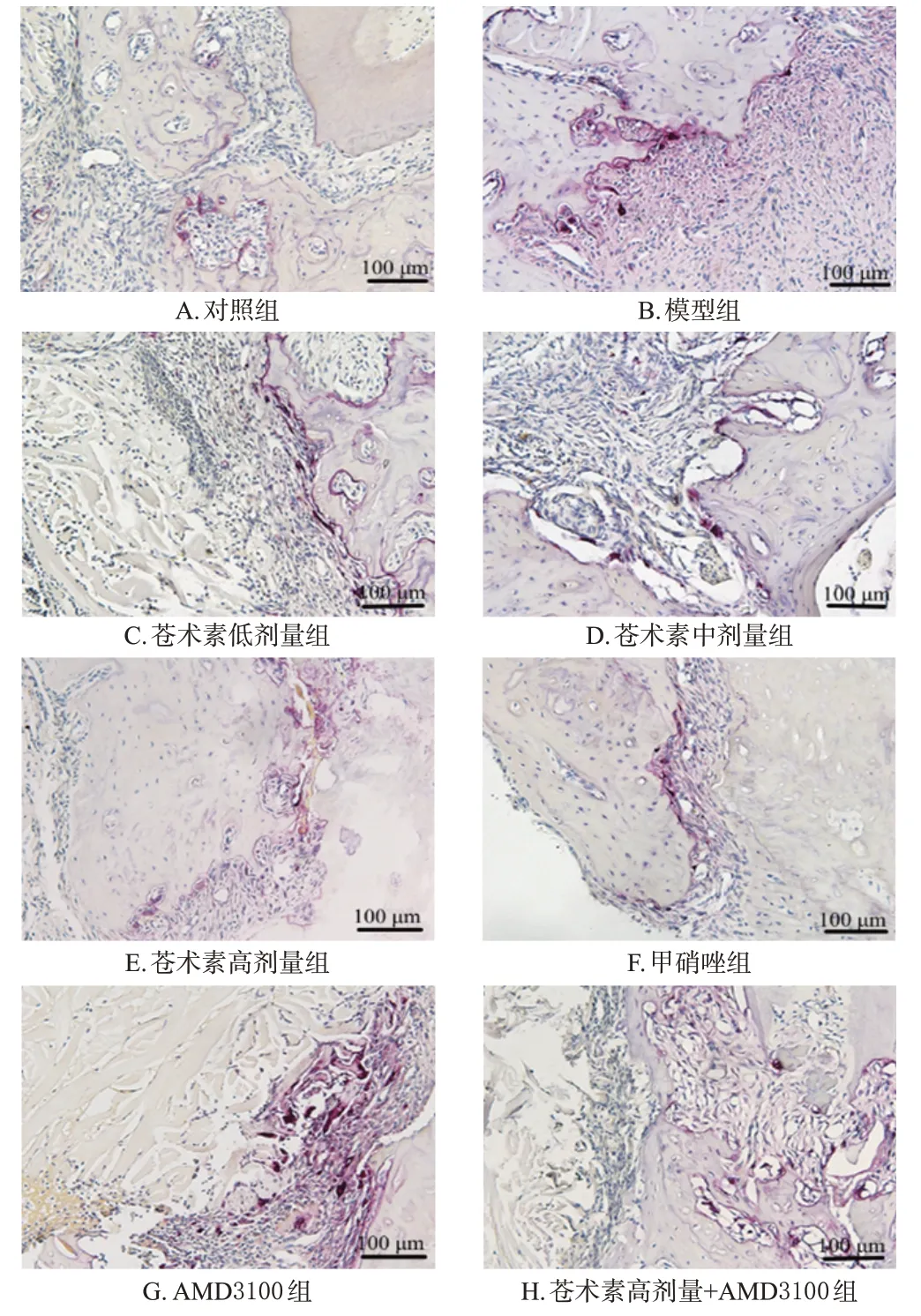
图3 各组大鼠牙周组织中破骨细胞数测定的TRAP染色图
3.6 苍术素对大鼠牙周组织中OPG、RANKL、SDF-1、CXCR4蛋白表达的影响
与对照组比较,模型组大鼠牙周组织中OPG、SDF-1、CXCR4蛋白表达水平显著降低(P<0.05),RANKL蛋白表达水平显著升高(P<0.05)。与模型组比较,苍术素低、中、高剂量组和甲硝唑组大鼠牙周组织中OPG、SDF-1、CXCR4 蛋白表达水平均显著升高(P<0.05),RANKL蛋白表达水平均显著降低(P<0.05);AMD3100组大鼠牙周组织中OPG、SDF-1、CXCR4蛋白表达水平显著降低(P<0.05),RANKL 蛋白表达水平显著升高(P<0.05)。与苍术素高剂量组比较,苍术素高剂量+AMD3100组大鼠牙周组织中OPG、SDF-1、CXCR4蛋白表达水平显著降低(P<0.05),RANKL蛋白表达水平显著升高(P<0.05)。结果见图4和表2。
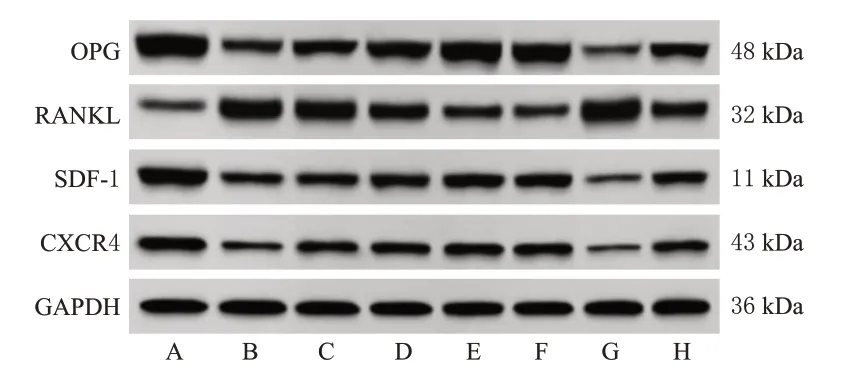
图4 各组大鼠牙周组织中OPG、RANKL、SDF-1、CXCR4蛋白表达的电泳图
表2 各组大鼠牙周组织中OPG、RANKL、SDF-1、CXCR4蛋白表达水平比较(±s,n=6)
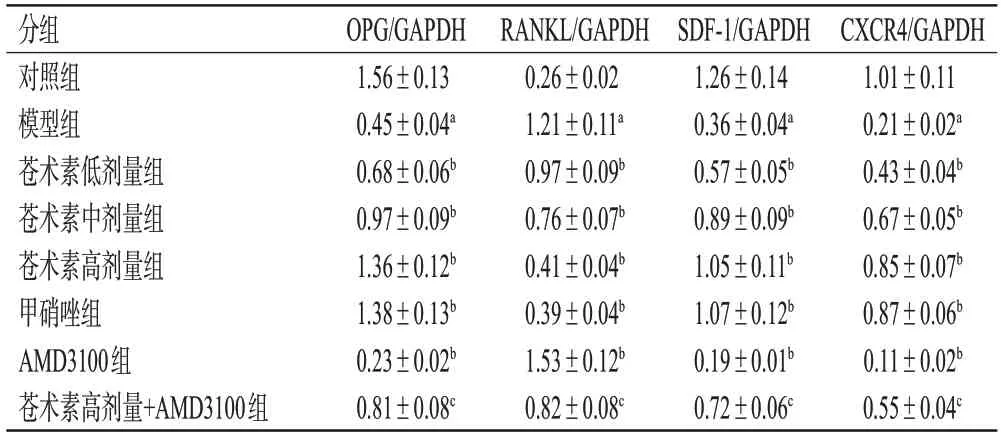
表2 各组大鼠牙周组织中OPG、RANKL、SDF-1、CXCR4蛋白表达水平比较(±s,n=6)
a:与对照组比较,P<0.05;b:与模型组比较,P<0.05;c:与苍术素高剂量组比较,P<0.05。
分组对照组模型组苍术素低剂量组苍术素中剂量组苍术素高剂量组甲硝唑组AMD3100组苍术素高剂量+AMD3100组OPG/GAPDH 1.56±0.13 0.45±0.04a 0.68±0.06b 0.97±0.09b 1.36±0.12b 1.38±0.13b 0.23±0.02b 0.81±0.08c RANKL/GAPDH 0.26±0.02 1.21±0.11a 0.97±0.09b 0.76±0.07b 0.41±0.04b 0.39±0.04b 1.53±0.12b 0.82±0.08c SDF-1/GAPDH 1.26±0.14 0.36±0.04a 0.57±0.05b 0.89±0.09b 1.05±0.11b 1.07±0.12b 0.19±0.01b 0.72±0.06c CXCR4/GAPDH 1.01±0.11 0.21±0.02a 0.43±0.04b 0.67±0.05b 0.85±0.07b 0.87±0.06b 0.11±0.02b 0.55±0.04c
4 讨论
牙龈卟啉单胞菌被认为是一种典型的致病菌,其在口腔群落中的定植会导致炎症免疫反应失调,并最终对牙周组织造成不可逆的损伤[13]。本研究采用牙龈内接种牙龈卟啉单胞菌的方式构建牙周炎大鼠模型,结果显示,与对照组比较,模型组大鼠牙龈指数、牙槽骨吸收值升高,牙周组织中出现大量炎症细胞浸润,这提示牙周炎大鼠模型构建成功。而使用低、中、高剂量苍术素及甲硝唑干预后,模型大鼠牙龈指数、牙槽骨吸收值降低,牙周组织中炎症细胞浸润减少,这表明苍术素可改善牙周炎引起的牙周组织损伤。
IL-6、TNF-α是常见的促炎细胞因子,可加重机体的炎症反应[14]。破骨细胞的分化和活性受RANKL和OPG调节。RANKL 可通过激活破骨细胞促进骨吸收;而OPG 作为RANKL 的受体,可与RANKL 结合抑制RANKL 的功能,进而促进破骨细胞的凋亡[15]。本研究结果显示,与对照组比较,模型组大鼠的IL-6、TNF-α水平和破骨细胞数、RANKL蛋白表达水平升高,OPG蛋白表达水平降低,这表明牙龈卟啉单胞菌诱导的牙周炎模型大鼠存在炎症反应及牙槽骨丢失。而经低、中、高剂量苍术素及甲硝唑干预后,给药大鼠的IL-6、TNF-α 水平和破骨细胞数、RANKL 蛋白表达水平均低于模型大鼠,OPG 蛋白表达水平高于模型大鼠,这提示苍术素可抑制牙周炎大鼠炎症反应及牙槽骨丢失。
SDF-1 属于CXC 趋化因子家族成员,其与CXCR4结合后可在干细胞成骨分化中起到重要的促进作用[16]。据报道,激活SDF-1/CXCR4 信号通路募集内源性干细胞可促进牙髓再生[17];激活SDF-1/CXCR4信号通路能够抑制急性心肌梗死大鼠体内炎症反应[18]。上述研究表明,SDF-1/CXCR4信号通路在牙周组织修复及抑制炎症反应中具有重要作用。本研究结果与上述研究结果是一致的——本研究显示,与模型组比较,AMD3100组大鼠牙周组织中SDF-1、CXCR4 蛋白表达下调,大鼠炎症反应及牙槽骨丢失现象进一步增强,这表明在牙周炎大鼠炎症反应及牙槽骨丢失过程中SDF-1/CXCR4信号通路处于抑制状态。此外,本研究还发现,苍术素可上调牙周炎大鼠牙周组织中SDF-1、CXCR4 蛋白表达。因此,笔者推测苍术素可能是通过激活SDF-1/CXCR4 信号通路来改善牙周炎大鼠炎症反应及牙槽骨丢失的。为了验证该推测,本研究在高剂量苍术素作用的基础上再加上SDF-1/CXCR4 信号通路抑制剂AMD3100 来干预牙周炎大鼠,结果显示,AMD3100减弱了高剂量苍术素对牙周炎大鼠炎症反应及牙槽骨丢失的抑制作用。这一结果证实了苍术素可能是通过激活SDF-1/CXCR4信号通路来改善牙周炎大鼠炎症反应及牙槽骨丢失的。
综上所述,苍术素可能通过激活SDF-1/CXCR4 信号通路来改善牙周炎大鼠炎症反应及牙槽骨丢失,但苍术素对牙周炎大鼠炎症反应及牙槽骨丢失的抑制作用涉及的机制较为复杂,具体通过SDF-1/CXCR4 信号通路下游的哪些蛋白来发挥作用有待进一步实验探究。
