贵州中三叠世混形黔鳄(爬行纲:主龙类)海生适应性的再研究
2023-12-12CindySU周敏顾书纶RyosukeMotani江大勇
Cindy X. SU 周敏,† 顾书纶 Ryosuke Motani 江大勇
北京大学学报(自然科学版) 第59卷 第6期 2023年11月
Acta Scientiarum Naturalium Universitatis Pekinensis, Vol. 59, No. 6 (Nov. 2023)
10.13209/j.0479-8023.2023.079
国家自然科学基金(41920104001)、安徽省自然资源厅科技项目(2021-k-13)和安徽省公益性地质工作项目(2021-g-2-16)资助
2022‒11‒22;
2023‒05‒26
贵州中三叠世混形黔鳄(爬行纲:主龙类)海生适应性的再研究
Cindy X. SU1,2周敏1,2,†顾书纶1,2Ryosuke Motani3江大勇1,2
1.北京大学地球与空间科学学院, 北京 100871; 2.北京大学地质博物馆, 北京 100871; 3.Department of Earth and Planetary Sciences, University of California Davis, Davis, CA 95616-8605; †通信作者, E-mail: minzhou@pku.edu.cn
基于对混形黔鳄()新标本的观察和测量, 对其海生适应性进行再研究。按照非鸟类四足动物的海生适应性的 5 个阶段(M1~M5), 将混形黔鳄的测量数据与其他类群进行对比, 判断混形黔鳄处于对海洋生活适应的 M2-3 阶段, 尚不能将其归为真正的海生动物。对新标本形态的观察表明, 虽然混形黔鳄的四肢未显示适应海生的形态特征变化, 但在身体的总体形态结构和尾部特征上表现出明显适应波动式或半波动式游泳的变化, 说明其可能具有与现生鳄类和海鬣蜥相似的适应海生生活的演化趋势。与现生鳄类等类群相比较显示, 即使混形黔鳄发育特化的尾部, 也无法进行快速或长距离的游泳。综合上述信息, 结合盘县动物群四足动物的习性, 推测混形黔鳄可能生活于存在岛屿的台内盆地, 混形黔鳄等较高营养层级捕食者具有复杂的生态。
混形黔鳄; 中三叠世; 海生适应性; 生态
混形黔鳄()产自贵州省中三叠统海相地层, 其模式标本保存完整, 腰带及后肢特征与陆生主龙类(Archosauria)相似, 但同时发育明显侧向扁平的尾部、薄板状肩胛骨和乌喙骨以及具细长颈肋的长颈等常见于海生爬行动物的形态特征, 为已知的首个在三叠纪适应海洋环境的主龙类属种[1]。然而, Li 等[1]认为主龙类的早期类群槽齿类(thecodonts, 生存于 250~205Ma, 过去用于指代除鳄类、鸟类、恐龙和翼龙以外的主龙类, 后被废弃[2–3])不发育海生适应性特征, 为陆生类群。Nes-bitt[4]对混形黔鳄的生态提出质疑, 认为长颈这一形态特征也存在于亚利桑那龙()、灵鳄()和敏捷黄昏鳄()等完全陆生的主龙类中, 而薄板状的肩胛骨和乌喙骨似乎是缺乏明确生态学功能的独征。
近期, Motani 等[5]通过对比大量现生非鸟类四足动物的生态生理学特征, 总结了四足动物适应海洋生活不同阶段的形态学特征, 以便更准确、更定量化地描述相应生物的海生适应性, 并据此对多个已绝灭类群的海生适应性进行分析, 其中包括对混形黔鳄的简单讨论, 但未列出测量数据, 也未探讨其生活习性。Motani 等[5]认为, 非鸟类四足动物对海洋环境的适应可以粗略地分为对水体的适应和对高盐度的适应两个部分, 所有类群(蛇类除外)的适应性演化均遵循一系列步骤, 据此将海生适应性划分为 5 个阶段(记为 M1~M5)。每个阶段均建立在前一阶段的基础之上, 每个类群的适应性演化都是按照 M1 至 M5 的顺序逐步进行的。
M1 阶段, 初步利用海洋资源: 1)在海水中进行游泳, 但是不捕食海生生物; 2)在潮间带利用潮汐捕食; 3)在半咸水(介于淡水与海水之间)中游泳和捕食。
M2 阶段, 直接在海水中捕食(摄入含盐量高的食物以及捕食时附带的海水)。
M3 阶段, 不利用陆源淡水仍可维持自身的渗透压平衡。
M4 阶段, 几乎不在陆地上行动, 且不摄入陆源食物。
M5 阶段, 不借助陆地环境进行体温调节, 失去体表毛发或羽毛; 除繁殖外, 所有生命活动均在海水中完成。
通常, 已灭绝的四足动物只有骨骼以化石形式保留下来。为了更好地对四足动物的化石类群进行讨论, Motani 等[5]根据现生四足动物的测量数据, 归纳出可用于区分 M1-3, M4 和 M5 阶段的形态特征, 并指出化石的埋藏环境也可作为参考依据。
1)如果肱骨长度大于股骨长度, 则该类群属于M4 或 M5, 反之则属于 M1-3。
2)如果前臂无法前旋和后旋, 则该类群属于M5, 反之则属于 M1-4。
3)如果前臂‒腕部或胫部‒踝部的关节面扁平(充分但非必要条件), 则该类群属于 M5。
4)如果肘部或膝部的关节面扁平(充分但非必要条件), 则该类群属于 M5。
5)如果腕骨或跗骨呈扁平状且紧密堆积(充分但非必要条件), 则该类群属于 M5。
6)对属于 M1-3 的类群, 如果只有海相的化石记录, 则该类群属于 M2-3, 反之则属于 M1-2。
虽然从 M1 到 M5是一个逐渐变化的过程, 但只有处于 M4 及 M5 阶段的非鸟类四足动物才能几乎完全脱离陆地环境和资源, 成为真正的海生动物, 而肱骨与股骨的长度之比, 可作为是否发生这一质变的重要判断标准。对此, Motani 等[5]认为, 陆生四足动物的后肢通过硬组织直接与脊柱相连, 能在陆地上提供主要支撑力, 但在水体中并不需要支撑身体; 由于肺的存在, 动物的浮力中心位于身体前部, 而前肢发达、后肢退化的形态可以使动物的质心前移, 质心靠近浮力中心有利于动物在水体中保持身体平衡。肢体远端的灵活性有利于生物在陆地上调整姿势, 而四肢关节扁平化、丧失灵活性可以使肢体在水中更有效地发挥舵的功能, 也说明生物放弃在陆地上运动, 因此也可作为判断生物进入 M5 阶段的辅助证据。
根据上述判断标准, Motani 等[5]认为混形黔鳄只发现于海相地层, 四肢不具备海生适应性特征, 因而属于 M2-3。
本文参考 Motani 等[5]对四足动物海生适应性 5个阶段的定义和判断方法, 基于对混形黔鳄标本GMPKU-P-1531 的测量和分析, 结合文献资料, 对混形黔鳄的海生适应性进行讨论, 并结合古环境分析其生活习性。
1 材料与方法
本文研究的混形黔鳄标本GMPUK-P-1531保存于北京大学地质博物馆, 产出于贵州省盘州市新民镇羊圈村关岭组上段, 地层时代为中三叠世安尼期。利用游标卡尺及分度值为 1mm 的软尺, 对标本进行观察和测量。使用 Canon EOS 80D 数码单反相机, 对整个标本以及取下的牙齿分区拍照。利用Adobe Photoshop CC 2018, 将各个部分合成为完整照片。数据的处理以及图表的绘制使用 Excel 和Origin 2022。
2 系统古生物学描述
爬行纲 Class Reptilia Linnaeus, 1758
双孔下纲 Infraclass Diapsida Osborn, 1903
主龙巨目 Magnorder Archosauria Cope, 1869
假鳄超目 Superorder Pseudosuchia Zittel, 1887‒1890
坡坡龙大目 Grandorder Poposauroidea Nopsca, 1923
黔鳄属 GenusLi et al., 2006
混形黔鳄Li et al., 2006
正型模式标本 IVPP V13899, 一具蜷曲状保存的骨架, 前肢远端和尾部末端缺失。
归入材料标本 GMPKU-P-1531, 见图 1。
产地及层位 贵州省盘州市新民镇羊圈村关岭组上段, 牙形石带, 时代属中三叠世安尼期。
描述 标本 GMPKU-P-1531 为蜷曲状保存, 头骨骨块分离, 尾部末端缺失, 保存长度为 2.56m, 估计全长超过 3m。
头骨沿矢状面散开, 可辨认出沿纵轴中线分离的左右齿骨、左右上颌骨和左右前颌骨。最上方的齿骨为背视保存, 其上着生的牙齿均已脱落, 仅保留齿窝。中间的齿骨和上颌骨为舌侧视保存, 均着生匕首状牙齿, 上颌齿在下颌齿的外侧, 部分齿窝中可见替换齿。最下方为唇侧视保存的右前颌骨和上颌骨以及大部分被上颌骨覆盖的舌侧视保存的左前颌骨。前颌骨也着生匕首状牙齿。牙齿为同型齿, 侧向扁平, 向后弯曲; 前后缘均发育锯齿, 锯齿由齿尖延伸至齿冠底部(图 2); 齿冠长度差异大, 最长的牙齿位于上颌骨, 由于被覆盖无法精确测量, 推测长度大于 3.2cm。部分牙齿齿尖断裂, 或边缘锯齿磨损。
脊椎可分为颈椎、背椎、荐椎和尾椎。颈椎共保存 7 节, 第 1 和第 2 节缺失, 第 3~9 节颈椎的椎体和神经棘前后向的长度较长, 约为其高度的 1.5~2倍(如第 5 节颈椎的椎体前后向长度为 7.6cm, 椎体高度为 4.0cm), 且每节顶端有 5 片真皮骨甲。颈肋细长, 长度可达颈椎椎体长度的 4 倍以上(颈肋长度最大值为 35.5cm, 颈椎椎体长度最大值为 8.3cm), 宽度从近端向远端迅速减小, 近端宽度最大值为1.7cm, 远端宽度最小值小于 1mm。背椎每节椎体及神经棘的前后向长度约为颈椎的 2/3, 神经棘高度约为宽度的 1.5 倍, 且顶端也有一排真皮骨甲。背椎肋骨较粗, 近端通过两个关节突与椎体相关节, 中段宽度较小, 至远端稍膨大。肩带与腰带之间有腹膜肋散落, 腹膜肋宽度从中部向两端减小, 每个单元的长度约为背肋长度的 1/2 至 1/3。荐椎 2 节, 由于被腰带掩盖, 难以确认形态特征。尾椎保存的长度为 133cm, 中间有部分被覆盖, 可见 28 节, 根据 Li 等[1]描述的模式标本和副模标本的尾椎形态, 判断尾部末端缺失约 20 节尾椎骨。尾椎神经棘很高, 且从前向后呈增高的趋势, 如第 7 节处神经棘高度为 9.4cm, 约为椎体高度的 3 倍、椎体前后向长度的 2 倍; 至保存的最后一节尾椎, 神经棘高度为 10.4cm, 约为椎体高度的 5 倍、椎体前后向长度的 3 倍。人字骨均已脱落, 散落在尾椎前段的较长, 在后段的长度减小。尾椎的神经棘顶端无真皮骨甲覆盖。
部分附肢骨骼的照片和线描图见图 3。肩带处可见两侧乌喙骨, 呈椭圆形, 其余骨块破损。前肢保存肱骨、桡骨和尺骨, 且左侧保留 5 块掌骨和 2 块指骨, 补充了部分模式标本中未保存的前肢特征。肱骨呈棒状, 中段收缩, 前缘较为平直, 后缘明显内凹, 近端呈外凸的弧形。桡骨和尺骨同样为棒状, 边缘均较为平直, 桡骨远端膨大, 尺骨近端膨大, 二者长度基本上相同, 且长度接近肱骨, 但整体更纤细。掌骨和指骨呈短棒状, 两端略微膨大, 掌骨长于对应的指骨, 但差异明显小于跖骨与趾骨的长度差。构成腰带的骨骼比较破碎, 只有两块坐骨较完整, 坐骨上缘明显弯曲, 呈近似“J”形, 下缘平直, 近端扁平且扩展为扇形。股骨为棒状, 长度和宽度均大于肱骨, 近端略微向后弯曲, 远端向前弯曲, 整体呈“S”型, 远端前缘和后缘有沿长轴的凹陷, 中间形成三角形突起, 内侧髁和外侧髁发育。胫骨和腓骨也呈棒状, 长度相近, 但胫骨比腓骨粗壮, 且两端较宽, 腓骨宽度基本上均匀。跗骨保存3 块, 包括跟骨、距骨和一块较小的远端跗骨。跖骨为细长棒状, 长度可达对应掌骨的 2 倍, 第 5 块跖骨近端呈弧形, 且宽度明显增大, 内缘弯曲, 其余 4 块跖骨内外边缘均平直, 轮廓近似矩形。趾骨为短棒状, 长度远小于对应的跖骨, 从第二趾的第二趾节来看, 末端的趾节为尖爪形, 这是与模式标本一致但过去未曾描述过的特征。保存的趾骨数目为 2-2-1-2-1, 根据趾骨末端的形状并结合模式标本的趾骨判断, 第三、四、五趾末端有骨块缺失。

(a) 左前肢; (b) 左前肢线描图; (c) 左后肢及坐骨; (d) 左后肢及坐骨线描图。dt: distal tarsal, 远端跗骨
该标本具备下列混形黔鳄的鉴定特征[1]: 颈椎神经棘前后向宽广, 且每节顶部有 5 片真皮骨甲, 颈肋细长, 尾椎神经棘纵向极高, 前颌骨着生匕首状牙齿。本文依此将其归入混形黔鳄。
3 观察及测量结果
依据 Li 等[1]的测量数据, 混形黔鳄模式标本IVPP V13899 肱骨与股骨的长度比为 0.721, 该比值的常用对数值为−0.142。测得新标本 GMPKU-P-1531 的左侧和右侧肱骨长度均为 23.1 cm, 右侧股骨长度为 29.0cm (左侧股骨近端部分缺失), 肱骨长度小于股骨长度, 二者的比值为 0.796, 该比值的常用对数值为−0.099。将上述数据添加到Motani等[5]的数据集合中, 与部分四足动物类群进行比较, 结果见图 4和 5, 其中 M0 为完全陆生的类群。
与现生四足动物相比(图 4), 两件标本的数据符合鬣蜥亚目(Iguania)和鳄目(Crocodylia)的数据范围, 但与 M2 差距较大, 并且标本 GMPKU-P-1531的数据与 M3 接近。但是, 在 Motani 等[5]的研究中, M3 只有一个数据的支持(来自北极熊()), 因此分析结果能否指示混形黔鳄对海水生活的生态适应性与北极熊相似, 值得商榷。
与已绝灭的四足动物相比(图 5), 两件标本与M2-3 最相符, 且与兽脚亚目(Theropoda)、蜥脚亚目(Sauropoda)和海龙科(Thalattosauridae)的数据相近。由于研究的样本数量太少, 用于比较的数据中也有部分类群的样本量不足, 因此结果可能存在误差, 但可以确定的是, 混形黔鳄肱骨和股骨的相对长度更符合陆生动物的特征。
此外, 从形态功能的角度看, 混形黔鳄膝部关节面并未扁平化, 其前臂‒腕部关节、胫部‒踝部关节和肘部关节仍然具有一定的灵活性, 对应的肢体可以弯曲旋转。腕骨缺失, 跗骨并未扁平化或紧密堆积, 前肢和后肢相对于身体也较长。上述形态特征表明, 混形黔鳄仍然适于在陆地上运动, 未达到M4 或 M5 阶段, 这与前面的形态数据分析结果相符。虽然 Motani 等[5]在对不同类群进行讨论时, 指出处于 M4 和 M5 阶段的类群中也存在肱骨长度小于股骨的特例, 但可能是其后肢具有特殊作用, 或其仍然使用鳃呼吸等原因造成的。如某些长颈型的蛇颈龙(Plesiosauria), 它们极长的颈部同样可以使得质心前移, 且在水中可能是用后肢提供推动力。然而, 混形黔鳄并不符合这些例外情况, 虽然其较长的颈部在一定程度上可以使质心前移, 但其尾部长度大于全身长度的一半, 且尾椎神经棘极高(为对应椎体高度的 3~5 倍), 说明其尾部因附着大量肌肉而十分粗壮, 使得质心后移, 并且相比于形态上并不发育海生适应性特征的后肢, 其尾部更适于在水中提供推动力。
根据埋藏环境, 目前发现的混形黔鳄标本均产自海相地层, 且保存较完整, 基本上排除经历长距离搬运的情况。此外, 混形黔鳄与高度适应海生生活的盘县混鱼龙伴生[6]。综合上述依据, 进一步证实混形黔鳄处于 M2-3 阶段。
4 讨论: 混形黔鳄的生态习性
Motani 等[5]认为属于 M2 阶段的现生爬行动物有圆鼻巨蜥()、锈色巨蜥()、美洲鳄()、湾鳄()和钻纹龟(), 这些动物能直接捕食高盐度水体中的猎物, 但仍然需要陆地的淡水来调节渗透压和维持体温, 往往也会摄入陆源性食物; 属于 M3 阶段的爬行动物只有海鬣蜥(), 这些动物不再依赖陆源的淡水来调节自身的渗透压, 主要取食海水中的生物(藻类), 但依旧需要在陆地上晒太阳来维持体温。M2 与 M3 阶段的主要区别在于动物对盐分的适应, M3 阶段调节渗透压的能力更强, 往往体现在动物的肾脏和盐腺, 或者其具备特殊的调节方法(如利用新陈代谢产生的水分等)。但是, 这些生理特征在通常只有骨骼保存的化石类群中难以识别, 所以此前的研究中无法明确地判断混形黔鳄属于哪一阶段。不过, 在确定为 M2 和 M3阶段的现生类群中, 美洲鳄和湾鳄与混形黔鳄的体型和形态相似, 且鳄类在演化过程中也与混形黔鳄具有较近的关系, 因此可将现生鳄类作为推断混形黔鳄生态习性的参照。需要注意的是, M2 或 M3 只是对动物生态适应性阶段的划分, 并不能一一对应到生存环境, 如处于 M2 阶段的圆鼻巨蜥和湾鳄, 在沼泽湿地、海湾和岛屿等环境中均可生存。因此, 应结合骨骼形态特征、古环境信息及参照类群, 对混形黔鳄海生适应性阶段的生态进行综合分析。
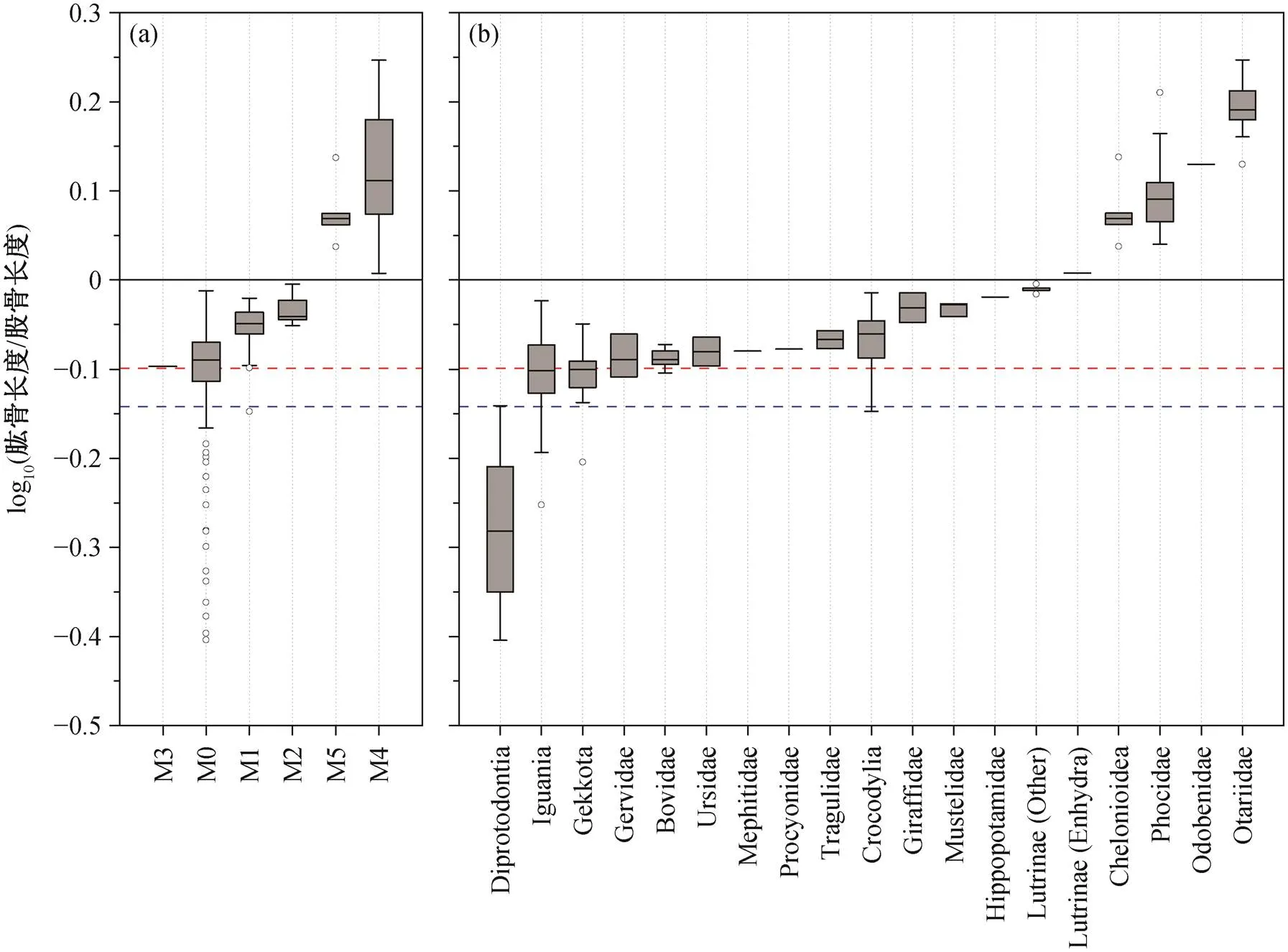
仿照Motani等[5]绘制。(a)根据M0~M5分组, 其中完全陆生的动物归为M0; (b)根据分类学分组。红色虚线代表GMPKU-P-1531的数据, 蓝色虚线代表模式标本的数据; 箱体表示中间的两个四分位数, 向外延伸的两条线段达到的上边缘和下边缘分别代表最大值和最小值, 框内的粗线表示中值, 上下边缘外的圆圈是异常值; 根据中位数进行沿x轴的排序。下同
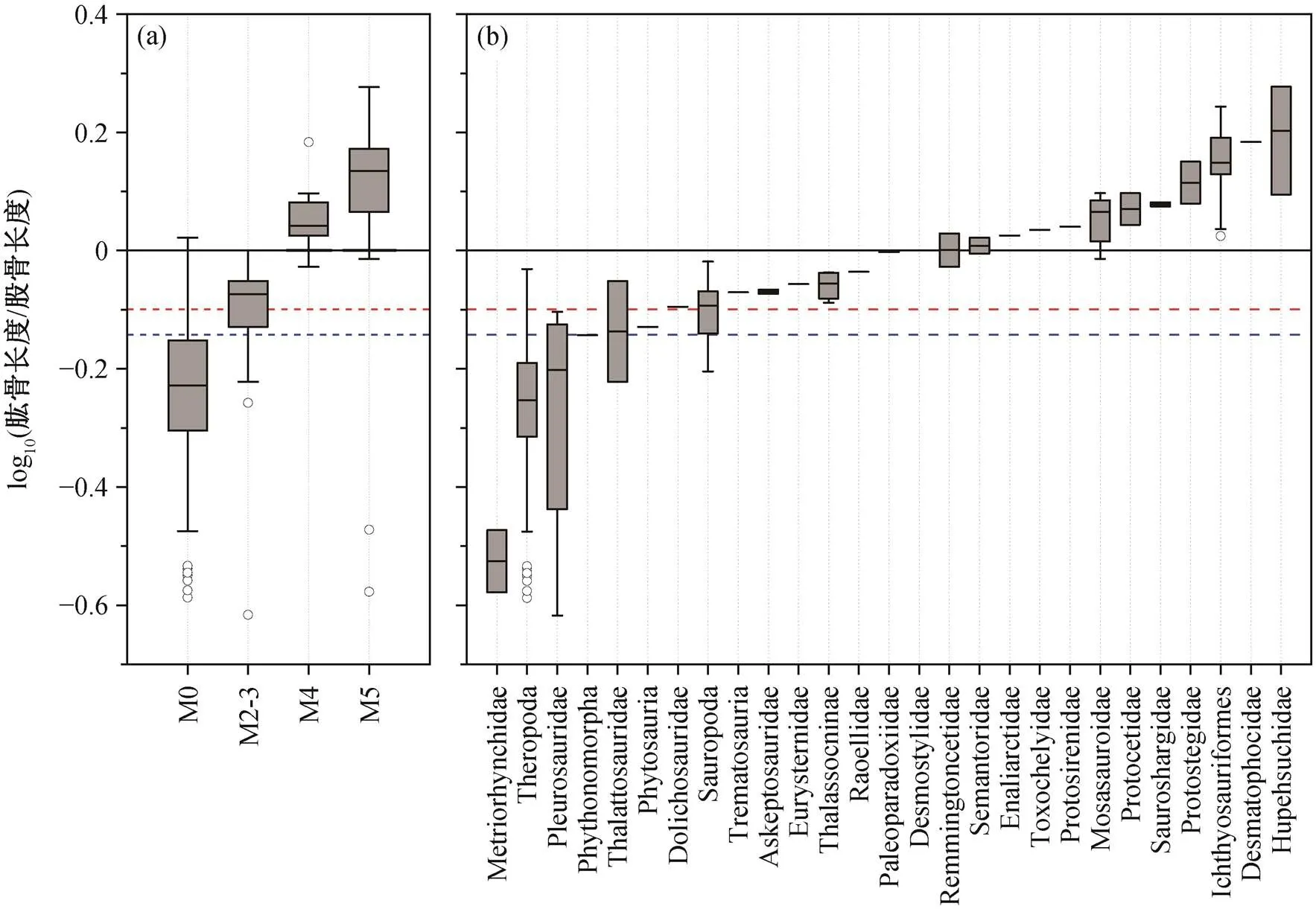
图5 混形黔鳄的肱骨长度与股骨长度之比跟已绝灭类群比较的箱线图
海生动物在水中可以通过躯干或四肢的运动来提供推动力, 主要依靠躯干提供推动力的类型又分为波动型(undulatory)、半波动型(subundulatory)、半摆动型(suboscillatory)和摆动型(oscillatory)[7–8]。采用波动型游泳方式的动物通过全身摆动来提供推动力, 通常拥有狭长的身体和灵活的脊椎; 采用摆动型游泳方式的动物则只依靠尾部的摆动, 通常拥有较僵硬的梭形身体和纵横比较大的尾鳍[9]; 半波动型和半摆动型则为过渡形态。混形黔鳄的身体形态与现生鳄类相似, 相对于身体, 四肢较长, 且未特化为桨状, 躯体狭长而灵活, 尾部长而侧扁, 因此推断其与现生鳄类一样, 适于半波动型的游泳方式[8−9], 即在水中通过后半身, 特别是尾部的左右摆动来提供推动力。混形黔鳄的脊椎体现了适应半波动型游泳方式的特化, 其尾部长度大于全身长度的一半, 且神经棘高度达到椎体高度的 3~5 倍, 与颈椎处的 1 倍以及背椎处的 1.5~2 倍相比, 明显增加。这样长而极端侧扁的尾部不便于在陆地上爬行, 更适合在水中运动。虽然其发达的尾部和后肢使得质心后移, 但其粗壮且较长的脖颈在一定程度上可起到平衡的作用。混形黔鳄脖颈的延长是由于每节椎体前后向的延长, 而非椎体数目的增加, 且椎体上的神经棘排列较为紧密, 后关节突发达, 使相邻椎体紧密嵌合, 并发育极为细长的颈肋, 这些特征降低了颈椎整体的灵活性[10], 有利于其在游泳时保持稳定。Li 等[1]提出, 与四肢同样未特化的湾鳄和海鬣蜥相比, 混形黔鳄的尾部特化程度更高, 因此其游泳能力应该与这两者相同, 甚至比它们更强。但是, 海鬣蜥的游泳方式属于波动型, 游泳速度较慢, 耐力也不足[11]。科学家通过观察现生鳄类或对已灭绝的鳄类进行建模计算, 发现无论现生鳄类还是其化石类群, 与鱼龙等类群具备的梭形身体相比, 其身体形态在水中阻力更大, 且其采用的半波动型游泳方式难以在快速游泳时提供有效的推动力[8−9,12]。因此总体来看, 混形黔鳄具备高度适应半波动型游泳方式的形态特征, 比现生的鳄类和海鬣蜥更适合在水中运动, 但无法像鱼龙和沧龙等充分适应海洋的爬行动物那样高速地长距离游泳, 而是仍然有较多的时间在陆地上或浅水中靠发达的四肢运动。根据混形黔鳄颈椎及颈部神经棘的形态判断, 其颈部在向上抬起时可能受到神经棘的限制, 但侧向的摆动则较灵活, 推测其捕食方式很可能是与现生鳄类相似的“伏击式”, 即等猎物靠近时, 通过尾部的摆动和后肢的推动瞬间突进, 将其咬住, 对于较小的猎物则通过头部的快速侧向甩动将其捕获[12–13]。混形黔鳄的上、下颌齿均唇侧‒舌侧向扁平, 向后弯曲, 前、后发育锯齿状边缘, 这种齿型适于从较大的猎物上把肉切割下来[14−15]。对现生鳄类的研究表明, 主要捕食鱼类的长吻鳄类牙齿的大小基本上一致, 而捕食较大猎物的短吻鳄类牙齿的大小差异明显[13], 混形黔鳄的牙齿形态及排布方式也与后者更相似。
根据通过岩相分析对古环境的恢复[6,16–17], 混形黔鳄的生存环境为水动力较弱的台内盆地。Li 等[1,18–19]对多个发现于中三叠世海相地层的“半水生”主龙类进行研究, 认为它们生存于近岸或岛屿环境。结合处于 M2 和 M3阶段爬行动物的生态, 推测混形黔鳄生存的环境中可能存在较多礁石形成的岛屿, 其主要在岛上或浅水中爬行, 也可以在海水中短距离地游泳; 混形黔鳄主要捕食较大的猎物, 与之伴生的幻龙和混鱼龙等爬行动物可能成为其目标[6], 同时也捕食鱼类。位于 M2-3 阶段的混形黔鳄仍然较大程度地利用陆地环境和资源, 因此并非完全海生。
混形黔鳄所属的中三叠世安尼期盘县动物群中, 保存有完整丰富的海生爬行类化石, 并且伴生鳞齿鱼类、龙鱼类、牙形石以及丰富的海生无脊椎动物(如头足类、瓣鳃类和腕足类等), 已形成较完整的捕食与被捕食关系的海洋生态系统[20]。根据 Mo-tani 等[5]的判别标准, 在盘县动物群中, 鱼龙类的盘县混鱼龙()和卡塔克新民龙()处于充分适应海生生活的M5 阶段, 可以在开阔的海域通过跃捕式(ram-fee-ding)[21]捕食, 极大程度地利用海洋资源; 鳍龙类的意外楯齿龙()和黔大头龙()以及原龙类的东方恐头龙()等处于 M4 阶段, 游泳速度逊色于鱼龙, 通过吸食式(suction-feeding)捕食小型的鱼类和贝类; 鳍龙类的纤颌乌蒙龙()和红果鸥龙()则与混形黔鳄一样属于 M2-3 阶段, 在浅水和陆地上活动, 但纤颌乌蒙龙和红果鸥龙的四肢相对于身体较短且纤细, 在陆地上的运动能力有限。处于每个阶段的类群之间也有生态分异, 如混鱼龙主要食肉或食鱼, 而卡塔克新民龙是壳食性的[22]; 纤颌乌蒙龙具有独特的纤长吻部, 适于通过横向咬合固定猎物[23], 与通过吸食式捕食的红果鸥龙不同; 相对于纤颌乌蒙龙和红果鸥龙, 混形黔鳄拥有更大的体型和更强的运动能力, 属于更高级的捕食者。由此可见, 盘县动物群中处于较高营养层级的海生爬行动物拥有复杂和多样的生态分化, 说明此时已经出现多层级的完善的食物网, 也反映在中三叠世时期, 海洋生态系统已经恢复到正常的状态。
5 结论
本研究通过对混形黔鳄新标本的观察和测量, 结合非鸟类四足动物海生适应性 5 个阶段的判断方法, 并参考现生鳄类等类群, 进一步证实混形黔鳄处于M2-3 阶段。此外, 结合混形黔鳄的身体形态及古环境分析, 对混形黔鳄的生态作出如下推测: 1)混形黔鳄并非完全海生, 其形态特征更适于在陆地上运动, 不适合快速的长距离游泳; 2)混形黔鳄可能生活于存在岛屿的台内盆地, 主要捕食较大型的猎物; 3)盘县生物群中海生四足动物类群的生态多样性表明, 海洋生态系统在中三叠世已恢复到正常状态。
致谢 安徽省地质博物馆修复技师黄发尧先生和北京大学地质博物馆化石修复技师胡田芬女士帮助修理标本, 北京大学化学与分子工程学院博士研究生于浩在软件使用方面提供帮助, 北京大学地球与空间科学学院孙元林教授和孙作玉副教授提出宝贵意见, 北京大学地球与空间科学学院博士研究生柴珺、李家春、姚明涛和王一诺以及硕士研究生冶小军在研究过程中参与讨论并提供帮助, 谨致谢忱。
[1] Li Chun, Wu Xiaochun, Cheng Yennien, et al. An un-usual archosaurian from the marine Triassic of China. Naturwissenschaften, 2006, 93(4): 200–206
[2] Gauthier J, Padian K. The origin of birds and the evo-lution of flight. Short Courses in Paleontology, 1989, 2: 121–133
[3] 李锦玲, 吴肖春, 汪筱林. 中国古脊椎动物志第二卷第四册(总第八册). 北京: 科学出版社, 2017
[4] Nesbitt S J. The early evolution of archosaurs: rela-tionships and the origin of major clades [D]. New York: Columbia University, 2009
[5] Motani R, Vermeij G J. Ecophysiological steps of ma-rine adaptation in extant and extinct non-avian tetra-pods. Biological Reviews, 2021, 96(5): 1769–1798
[6] Jiang Dayong, Motani R, Hao Weicheng, et al. Bio-diversity and sequence of the Middle Triassic Panxian marine reptile fauna, Guizhou Province, China. Acta Geologica Sinica (English Edition), 2009, 83(3): 451–459
[7] Ringma J L, Salisbury S W. Aquatic locomotor kine-matics of the eastern water dragon (). Journal of Herpetology, 2014, 48(2): 240–248
[8] Massare J A. Swimming capabilities of Mesozoic marine reptiles: implications for method of predation. Paleobiology, 1988, 14(2): 187–205
[9] Gutarra S, Rahman I A. The locomotion of extinct se-condarily aquatic tetrapods. Biological Reviews, 2022, 97(1): 67–98
[10] Noè L F, Taylor M A, Gómez-Pérez M. An integrated approach to understanding the role of the long neck in plesiosaurs. Acta Palaeontologica Polonica, 2017, 62 (1): 137–162
[11] Dawson W R, Bartholomew G A, Bennett A F. A reap-praisal of the aquatic specializations of the Galapagos marine iguana (). Evolution, 1977, 31(4): 891–897
[12] Fish F E. Kinematics of undulatory swimming in the American alligator. Copeia, 1984(4): 839–843
[13] Grigg G, Gans C. Morphology and physiology of the Crocodylia. Fauna of Australia, 1993, 2: 326–336
[14] Massare J A. Tooth morphology and prey preference of Mesozoic marine reptiles. Journal of Vertebrate Pa-leontology, 1987, 7(2): 121–137
[15] Ciampaglio C N, Wray G A, Corliss B H. A toothy tale of evolution: convergence in tooth morphology among marine Mesozoic-Cenozoic sharks, reptiles, and mam-mals. The Sedimentary Record, 2005, 3(4): 4–8
[16] 李美铮, 刘楚雄, 江大勇, 等. 贵州盘县新民地区关岭组中三叠世盘县动物群产出层段碳酸盐岩微相分析和古环境恢复. 地学前缘, 2011, 18(6): 329–340
[17] 马会珍, 谭靖. 贵州盘县新民地区中三叠世关岭组盘县生物群埋藏环境分析. 贵州地质, 2018, 35(2): 138–144
[18] Li Chun, Wu Xiaochun, Zhao Lijun, et al. A new ar-mored archosauriform (Diapsida: Archosauromorpha) from the marine Middle Triassic of China, with im-plications for the diverse life styles of archosauri forms prior to the diversification of Archosauria. The Science of Nature, 2016, 103(11): 1–23
[19] Li Chun, Wu Xiaochun, Zhao Lijun, et al. A new archosaur (Diapsida, Archosauriformes) from the ma-rine Triassic of China. Journal of Vertebrate Paleon-tology, 2012, 32(5): 1064–1081
[20] 郝维城, 孙元林, 江大勇, 等. 盘县动物群研究进展. 北京大学学报(自然科学版), 2006, 42(6): 817–823
[21] Motani R, Ji Cheng, Tomita T, et al. Absence of suction feeding ichthyosaurs and its implications for Triassic mesopelagic paleoecology. PLOS ONE, 2013, 8(12): e66075
[22] Jiang Dayong, Motani R, Hao Weicheng, et al. New primitive ichthyosaurian (Reptilia, Diapsida) from the Middle Triassic of Panxian, Guizhou, southwestern China and its position in the Triassic biotic recovery. Progress in Natural Science, 2008, 18(10): 1315–1319
[23] Jiang Dayong, Rieppel O, Motani R, et al. A new middle Triassic eosauropterygian (Reptilia, Sauropter-ygia) from southwestern China. Journal of Vertebrate Paleontology, 2008, 28(4): 1055–1062
Reanalysis of the Marine Adaptation of the Archosaurianfrom the Middle Triassic of Guizhou, China
Cindy X. SU1,2, ZHOU Min1,2,†, GU Shulun1,2, Ryosuke Motani3, JIANG Dayong1,2
1. School of Earth and Space Sciences, Peking University, Beijing 100871; 2. Geological Museum of Peking University, Beijing 100871; 3. Department of Earth and Planetary Sciences, University of California Davis, Davis, CA 95616-8605; † Corresponding author, E-mail: minzhou@pku.edu.cn
A reanalysis of marine adaptation ofis given by observing and making measure-ments to a new specimen. The marine adaptation in non-avian tetrapods follows a pattern of five steps (M1-M5).Comparation of the statistics ofand other clades leads to the result thatis placed in M2-3 and not considered to be completely marine. Observation and analysis of the morphology of the new specimen shows that its limbs do not exhibit characters of marine adaptation, yet its body shape and tail are morphologically adapted to undulatory or subundulatory swimming, similar to extant crocodiles and marine iguanas. Comparison with extant crocodiles and other clades suggest that despite having a specialized tail,is not capable of swimming at high speed or for long distances. With the information above and reference to the habits of tetrapods in the Panxian Fauna, it is assumed thatpossibly inhabits an intraplatform with islands, and thatand other upper trophic level predators exhibit complex ecology.
; Middle Triassic; marine adaptation; ecology
