CCN5基因敲降对MCF-7乳腺癌细胞增殖的影响及其作用机制
2023-12-12吕艳郑旭韩燕燕高珊李翀耿强
吕艳 郑旭 韩燕燕 高珊 李翀 耿强
天津中医药大学第一附属医院、国家中医针灸临床医学研究中心(天津 300381)
乳腺癌是全球范围内最常见的女性恶性肿瘤,在我国乳腺癌发病率已居女性恶性肿瘤首位[1],探索乳腺癌发生机制对实现个体化治疗乳腺癌具有非常重大的意义。CCN5 又称WISP-2(Wnt-1 induced secreted proteins-2, Wnt 诱导分泌蛋白2)因子,在诱导肿瘤细胞凋亡、抑制肿瘤细胞粘附和转移等方面具有重要作用[2-4]。有关CCN5 调控乳腺癌细胞增殖机制尚未明确。本研究拟构建CCN5siRNA慢病毒载体,转染人乳腺癌细胞MCF-7,观察乳腺癌细胞增殖能力变化,检测CCN5、Skp2和p27Kip1 mRNA 和蛋白表达,探索乳腺癌发生的相关机制。
1 材料与方法
1.1 材料人乳腺癌细胞株MCF-7 购于江苏凯基生物技术股份有限公司。MTT 细胞增殖及毒性检测试剂盒、Western blot 相关试剂盒购于北京索莱宝生物科技有限公司。RNA prep pure 培养细胞总RNA 提取试剂盒(离心柱型)、Fast King cDNA第一链合成试剂盒以及SYBR Green PCR 试剂盒购于天根生化科技(北京)有限公司。CCN5siRNA慢病毒载体由北京合生基因生物技术有限公司提供。
1.2 方法
1.2.1 细胞培养高糖DMEM 不全培基、1 ×105U/L 青霉素 、100 mg/L 链霉素及l0 %灭活胎牛血清,组成完全培养基,培养MCF-7 细胞。将MCF-7 细胞置于5 % CO2、37℃细胞培养箱内,每3 天传代1 次。取对数生长期的MCF-7 细胞用于实验研究。
1.2.2 构建CCN5 基因敲降细胞用完全培养基稀释MCF-7 为3 × 104~ 5 × 104个/mL,接种2 mL 细胞悬液至6 孔板中。保持细胞状态良好,形态清晰、生长正常、无任何污染。细胞接种24 h 后,更换1 mL 转染液,含有15 μL CCN5siRNA 慢病毒质粒(浓度1.38 × 108U/ml, MOI = 10),200 μL Poly-Brene(助转染剂,浓度50 μg/mL),785 μL 高糖DMEM 完全培养基。更换转染液8 h 后,再次更换为高糖DMEM 完全培养基,继续在5% CO2、37 ℃细胞培养箱内培养48 h 后,荧光显微镜下观察慢病毒转染后MCF-7 细胞形态,计算转染效率。
1.2.3 MTT 实验收集对数生长期MCF-7 细胞,调整细胞浓度为2 × 104个/mL,分于96 孔板,每孔100 μL,共9 孔。将MCF-7 细胞置于37 ℃,5% CO2孵育箱中培养24 h 后,分为3 组细胞,每组3 孔,即空白对照组,空载组和转染组,分别给予3 组细胞不同的处理。空白对照组:加入100 μL DMEM 培养基;空载组:加入1 μL 空质粒(未携带CCN5 siRNA的慢病毒载体,病毒滴度3.73 × 108TU/mL),10 μL Polybrene 助转染剂,89 μL DMEM 培养基;转染组:加入1 μL 携带CCN5siRNA 的质粒(携带CCN5siRNA 的慢病毒载体,病毒滴度1.34 × 108TU/mL),10 μL Polybrene助转染剂,89 μL DMEM培养基。37 ℃,5% CO2孵育箱培养细胞12 h 后换液,加入100 μL DMEM培基,孵育72 h,弃上清,每孔加入90 μL 新鲜培养基,10 μL MTT,37 ℃孵育4 h,弃上清,每孔加入100 μL Formazan 溶液,摇床低速震荡10 min,酶联免疫检测仪测量吸光度值(OD)。
1.2.4 qRT-PCR 实验从MCF-7 细胞中提取总RNA,核酸测定仪确认其OD(260)/OD(280)比值在1.8 ~ 2.0 之间,测定总RNA 浓度,计算gDNA反应体系中所需的RNA 总量。gDNA 去除反应,反应体系如下:5×gDNA Buffer 2 μL,Total RNA,RNase-Free ddH2O 补足反应体系至10 μL,反应条件:42 ℃,3 min,置于冰上。RT 反应逆转为cDNA,反应体系如下: 10×King RT Buffer 2 μL, Fast King RT Enzyme Mix 1 μL,FQ-RT Primer Mix 2 μL,RNase-Free ddH2O 补足反应体系至10 μL,并与gDNA 去除反应体系混合,形成20 μL 反应体系。以β-actin检测作为内对照。
引物序列及反应条件见表1。
1.2.5 Western blot实验Western blot检测CCN5、Skp2、P27Kip1 蛋白,分组同RT-PCR。 慢病毒转染MCF-7 细胞48 h 后,以含0.25% 胰蛋白酶消化收集细胞,计数细胞浓度,加入1 mL PMSF/107个细胞,裂解20 ~ 30 min。在4 ℃,12 000 r/min,离心15 min,取上清液,测蛋白浓度后,每个样品蛋白终浓度均调整为2 μg/μL,-80 ℃ 保存备用。将定量后的蛋白质100 ℃加热5 min,上样、电泳,12% SDS-PAGE 电泳,转PVDF 膜 90 min,1 mL 一抗(1∶4 000稀释)4 ℃孵育过夜,弃一抗后加入1 mL辣根过氧化物酶标记二抗(1∶500 稀释),室温孵育2 h,漂洗、显影、成像。以GDPDH 检测作为内参。
1.3 统计学处理采用SPSS 18.0 软件,计量资料采用Shapiro-Wilktest 正态性检验方法,呈正态分布以±s表示,多组间比较采用方差分析,组间比较采用t检验和SNK 法;非正态分布以M(P25,P75)表示,组间比较采用秩和检验。以P< 0.05 为差异有统计学意义。
2 结果
2.1 慢病毒载体转染MCF-7 细胞见图1,CCN5 siRNA 慢病毒转染MCF-7 细胞,被转染细胞达到80%以上,荧光强度适中。观察细胞形态良好:细胞平铺,舒展,融合度达到70%以上。

图1 荧光标记的慢病毒载体转染MCF-7 细胞Fig.1 Fluorescencly labeled lentiviral vector were transfected into MCF-7 cells

图2 CCN5siRNA 转染组与空载组MCF-7 细胞增殖抑制率对比Fig.2 Comparison of MCF-7 cell proliferation inhibition rate between CCN5siRNA transfection group and negative vector group
2.2 CCN5 基因敲降对MCF-7 细胞增殖活性的影响MTT 法检测MCF-7 细胞增殖活性的变化。以细胞增殖抑制率显示细胞增殖活性,细胞增殖抑制率=(1-干预组OD值/对照组OD值)× 100%。MTT 结果显示:与空白对照组相比,转染组细胞增殖能力受到抑制(P< 0.05)。空载组细胞增殖能力与空白对照组差异无统计学意义(P>0.05),空白对照组细胞增殖抑制率为0。实验结果见2。
2.3 CCN5 基因敲降对Skp2、p27Kip1mRNA 水平的影响与对照组和空载组相比,转染组CCN5 mRNA 水平下降(P< 0.05),转染组Skp2mRNA 水平高于对照组和空载组(P< 0.05),而转染组P27Kip1mRNA水平低于空载组和对照组(P< 0.05)。以上结果提示,CCN5抑制Skp2mRNA 表达,Skp2对P27Kip1mRNA 表达也存在抑制作用,即CCN5mRNA表达水平下降,失去对Skp2mRNA表达抑制,高表达Skp2mRNA 抑制P27Kip1mRNA 表达。具体数据见表2。
表2 RT-PCR 法检测各组CCN5、Skp2p 及27Kip1 mRNA 表达水平Tab.2 mRNA expression levels of CCN5, Skp2p and 27Kip1 by RT-PCR ±s
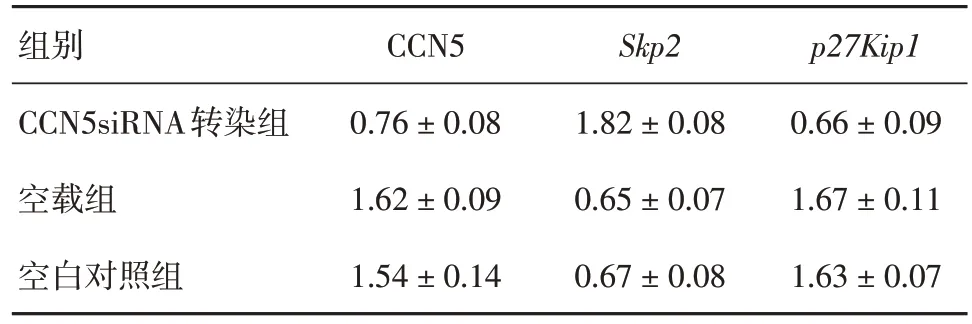
表2 RT-PCR 法检测各组CCN5、Skp2p 及27Kip1 mRNA 表达水平Tab.2 mRNA expression levels of CCN5, Skp2p and 27Kip1 by RT-PCR ±s
组别CCN5siRNA转染组空载组空白对照组CCN5 0.76 ± 0.08 1.62 ± 0.09 1.54 ± 0.14 Skp2 1.82 ± 0.08 0.65 ± 0.07 0.67 ± 0.08 p27Kip1 0.66 ± 0.09 1.67 ± 0.11 1.63 ± 0.07
2.4 CCN5 基因“敲降”对Skp2、p27Kip1 蛋白水平的影响见图3,在转染组、空载组和空白对照组之间CCN5、Skp2 和p27Kip1 蛋白电泳条带深浅不同。蛋白电泳条带的灰度数据分析结果见图4,结果显示:与空载组和对照组相比,转染组CCN5蛋白水平降低(P< 0.05),转染组Skp2 蛋白水平则呈现上升(P< 0.05),转染组p27Kip1 蛋白水平下降(P< 0.05)。

图3 Western blot 检测MCF-7 细胞CCN5、Skp2 和p27Kip1蛋白表达电泳图Fig.3 Western blot analysis of CCN5, Skp2, and p27Kip1 protein expression in MCF-7 cells

图4 CCN5 基因敲降对Skp2、p27Kip1 蛋白表达的影响Fig.4 Influence of CCN5 gene knock down on Skp2 and p27Kip1 protein expression
3 讨论
CCN 家族是最近发现的一个基因家族,CCN5又称WISP-2(Wnt-1 induced secreted proteins-2,Wnt-1 诱导分泌蛋白2)因子,是CCN 家族的6 种基质蛋白之一,分子量为29KD 的抑癌基因,在诱导细胞凋亡、抑制肿瘤细胞粘附和转移等方面有重要作用[5-7]。
文献研究表明:CCN5 与乳腺癌细胞侵袭能力之间存在线性调控关系,即CCN5 蛋白表达增加,乳腺癌细胞侵袭性减弱[8],相反,CCN5 蛋白表达降低,乳腺癌细胞侵袭能力增强[9],这些研究结果提示:CCN5 表达水平异常在恶性肿瘤发生和进展中扮演着重要角色。然而,目前还不清楚CCN5 是通过怎样的分子机制调控肿瘤细胞的增殖、侵袭性和转移。Skp2 通过对多种靶蛋白的泛素化降解而与细胞周期调控及肿瘤的发生、发展和预后密切相关[10-12]。Skp2 调控的靶点包括周期素依赖性激酶抑制物p27Kip1[13]。
本研究正是通过siRNA 干扰CCN5 基因的表达,采用MTT 法观察MCF-7 细胞增殖活性的变化,并采用荧光定量RT-PCR 和Western blotting 检测CCN5、Skp2 和P27Kip1 在mRNA 和蛋白水平的变化,探讨CCN5 基因调控乳腺癌细胞增殖和侵袭的分子机制。
首先,MTT细胞毒性实验表明:CCN5siRNA转染组细胞增殖抑制率显著升高,反证了CCN5对MCF-7细胞增殖有抑制作用。通过构建CCN5siRNA慢病毒载体,转染MCF-7 乳腺癌细胞,荧光定量RTPCR 实验结果表明:在mRNA 水平干扰CCN5基因表达,引起CCN5基因的mRNA 水平下调,并引起Skp2/P27Kip1通路基因水平的变化,例如:Skp2mRNA水平上调和P27Kip1mRNA水平下降,与空白对照组和阴性对照组相比有显著性差异(P<0.05)。而空白对照与阴性对照组织间无显著性差异(P< 0.05)。
其次,本研究还在蛋白水平对CCN5 与Skp2/P27Kip1 通路的相关性作了探索和研究。Western blot 结果表明:CCN5siRNA 组的Skp2 蛋白水平比空白对照组和阴性对照组均升高,提示CCN5 基因被“敲除”后,其相关调控蛋白Skp2 上调,与此同时,P27Kip1 蛋白和mRNA 水平下调,提示Skp2 水平受到上调后,抑制下游P27Kip1 蛋白和mRNA 水平。CCN5/Skp2/P27Kip1 通路在乳腺癌细胞增殖调控中具有微观抑制的作用,当CCN5 水平下降时,这种微观抑制被“解除”,细胞增殖、分裂无限循环,分化降低,非典型增生,乳腺癌发生。并且,MTT 细胞增殖能力实验结果也提示,CCN5siRNA组细胞增殖活性增强,高于空白对照组和阴性对照组(P< 0.05),而空白对照组与阴性对照组之间无显著差异(P> 0.05)。
既往有研究表明,CCN5 是一种抑癌基因,在侵袭力和转移力强的乳腺癌细胞株的表达水平较低,例如,CCN5mRNA 和蛋白表达水平在MDA-MB-231、MDA-MB-468 表达水平低于MCF-7 细胞[14-15],提示CCN5 基因与抑制乳腺癌细胞侵袭和转移相关。近年有研究表明:CCN5 对癌细胞增殖调控的作用取决于激素水平和微环境变化。例如:雌激素和孕激素可能通过WISP2/IGF1 信号通路刺激子宫蜕膜间质细胞的生长[16],而CCN5 能抑制血管平滑肌细胞以及三阴性乳腺癌细胞系MDA-MB-231 的增殖[17-18]。研究表明,CCN5 表达与乳腺癌、胰腺癌和结肠癌的侵袭性呈负相关,表明CCN5 具有抑制肿瘤侵袭和生长的活性[19-20],并且,CCN5在乳腺癌进展过程中显示升高的水平[21],这从一个侧面证实了CCN5 与乳腺癌进展的正相关。
CCN5 表达由雌激素以及雌激素受体阳性细胞中的表皮生长因子和胰岛素样生长因子诱导,CCN5 是雌激素诱导和胰岛素样生长因子诱导的增殖所必需的[22-23]。因此,CCN5 与激素受体相关的增殖调控将成为进一步关注的焦点。另外,CCN5 是否影响HER-2 阳性乳腺癌化疗后病理缓解因素是课题组感兴趣的研究热点[24-25]。
本研究通过反证法,即:采用CCN5siRNA 慢病毒体外转染MCF-7 细胞,实现敲降CCN5 基因的目的,随后观察乳腺癌细胞增殖能力变化,检测Skp2、P27Kip1 等下游被CCN5 调控基因的mRNA 和蛋白表达水平,探索CCN5 基因调控乳腺癌细胞MCF-7增殖能力的作用机制。研究结果说明:CCN5 基因通过下调Skp2 表达和上调P27Kip1 表达,抑制乳腺癌细胞增殖,提示CCN5 可能是抑制乳腺癌细胞增殖的靶点之一,所以,本研究为探索乳腺癌分子靶向治疗奠定了分子机制基础。
【Author contributions】LV Yan designed the study and wrote the article. GAO Shan , HAN Yan, ZHENG Xu and GENG Qiang performed the experiments. Li Chong reviewed the article. All authors read and approved the final manuscript as submitted.
