弥散峰度成像参数对阿尔兹海默病的诊断价值
2023-12-11徐玉华胡冰宇诸绍锋周杰
徐玉华,胡冰宇,诸绍锋,周杰
1.绍兴市第七人民医院放射科,浙江绍兴 312000;2.浙江省台州医院放射科,浙江临海 317000
阿尔兹海默病(Alzheimer’s disease,AD)是一种神经退行性疾病,其发病机制目前尚未明确,主要的临床症状是进行性认知能力下降、记忆损害等疾病,使患者基本丧失了独立生活的能力,影响老年人健康生活质量,带来严重的社会卫生问题[1-2]。弥散峰度成像(diffusion peak imaging,DKI)作为扩散加权成像(diffusion-weighted imaging,DWI)技术的延伸,能够更准确、真实地反映组织的细微结构变化[3]。到目前为止,临床上有较多研究证实DKI技术的临床可行性,因此其被广泛应用于临床针对各种疾病的研究中[4]。国内应用DKI技术对AD患者的脑细微结构进行研究的鲜有报道,因此,本研究旨在探讨DKI参数对AD的诊断价值。
1 对象与方法
1.1 研究对象
选取2019年4月至2020年12月绍兴市第七人民医院诊治的AD患者50例为观察组,另外选取50例健康体检的人员为对照组。观察组,男27例(54%),女23例(46%);平均年龄(59.97±6.23)岁,体质量指数(body mass index,BMI)(23.68±1.28)kg/m2,教育程度(9.89±1.25)年。对照组,男30例(60%),女20例(40%);平均年龄(60.29±6.10)岁,BMI(23.54±1.26)kg/m2,教育程度(10.06±1.23)年。两组患者年龄、性别、BMI、教育程度等基线信息对比(P>0.05),具有可比性。本研究经绍兴市第七人民医院伦理委员会审核批准(伦理审批号:2022-003-01号)。
1.2 纳入与排除标准
纳入标准:①AD患者符合美国精神病学会制订的《精神障碍诊断与统计手册》[5]诊断标准;②均为首次发病;③无颅脑外伤、肿瘤、炎症、手术史。
排除标准:①合并严重影响中枢神经系统的疾病;②存在严重精神障碍患者,不能正常配合研究;③合并恶性肿瘤者;④严重免疫系统疾病者。
1.3 检查方法
采用1.5T磁共振仪(明峰医疗系统股份有限公司生产,型号:Scintcare1.5)行头部扫描。扫描范围包括:海马、顶叶白质、额叶白质;扫描序列包括:弥散张量成像、DKI扫描:采用GRE-EPI序列,层厚:5mm,间隔:0.5mm,单个弛豫时间(relaxation time,TR)4500 ms,回波时间(echo time,TE)98.6ms,FOV 240mm×240mm,矩阵128×128,体素为2mm×2mm×3mm;进行DKI扫描,扫描层数18层,激励次数(number of incentives,NEX)为1,扫描时间3min 5s,扩散敏感梯度场施加的方向为15个,每个方向的b值均有3个值(0、1000、2000s/mm2),扩散敏感梯度场施加的方向为30个。T2WI上选择尾状核头、壳核、苍白球、丘脑、红核、黑质、齿状核部位确定感兴趣区,行双侧对称测量,要注意避开对脑脊液、血管的影响。
1.4 图像处理及数据测量
运用迭代重建参数图生成一系列平均弥散率(average diffusion rate,MD)、平均峰度(meankurtosis,MK)、参数各向异性分数(fraction of the parameter anisotropy,FA)参数图,针对MD、MK、FA参数进行3次测量并取平均值,根据平均值进行差异性检验,分别得出MD、MK、FA在海马、顶叶白质、额叶白质中的值。ROI的放置统一由同一位放射科医生完成。
1.5 认知功能评分
根据简易精神状况量表(summary mental status scale,MMSE)[6]评估AD患者认知功能,总分为30分。分数越高代表认知功能较好。
1.6 统计学方法
采用SPSS19.0统计学软件对数据进行处理分析。计量资料符合正态分布采用均数±标准差(±s)表示,组间差异比较采用独立样本t检验,多组差异比较采用单因素方差分析,进一步两两比较采用LSD-t检验;计数资料差异比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 正常大脑与AD患者大脑相关DKI图像
确诊为AD患者部分脑区出现了较为明显的萎缩情况,AD患者脑室系统也呈现扩大现象,见图1。
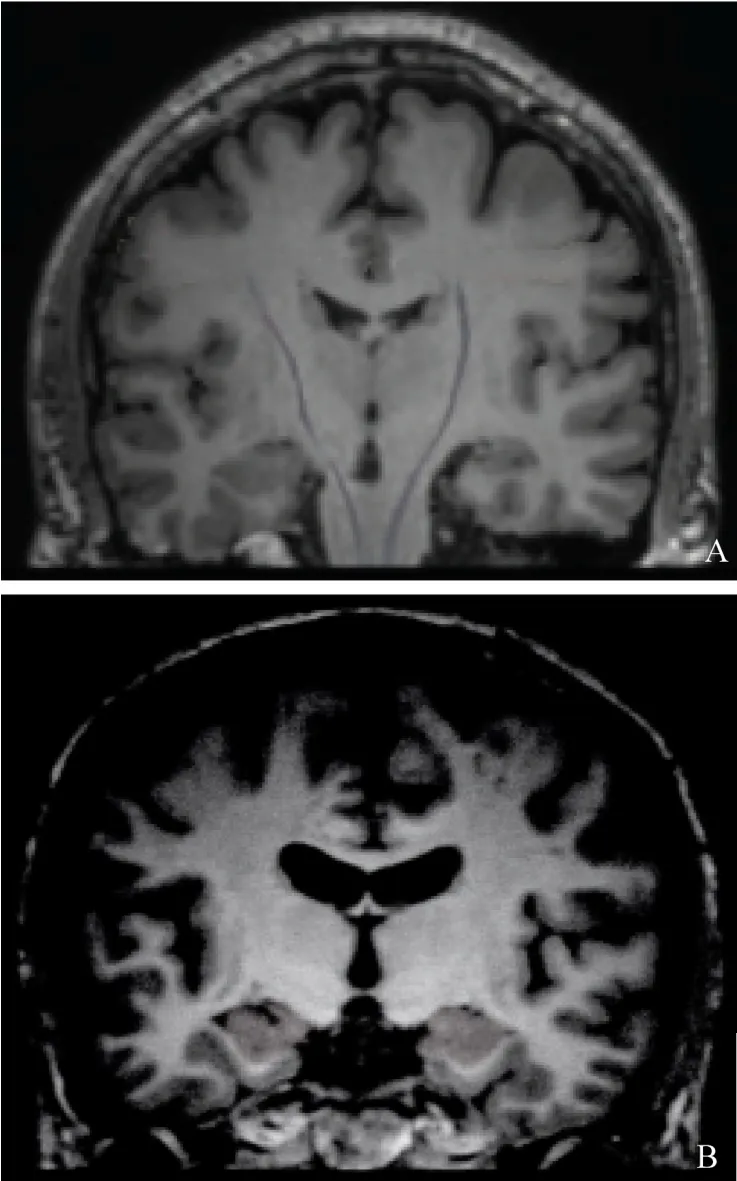
图1 大脑相关DKI图像
2.2 两组患者DKI参数变化
观察组海马、顶叶白质、额叶白质中MK、FA均低于对照组,海马、顶叶白质、额叶白质中MD均高于对照组,差异有统计学意义(P<0.05),见表1。
表1 两组患者DKI参数变化(±s)
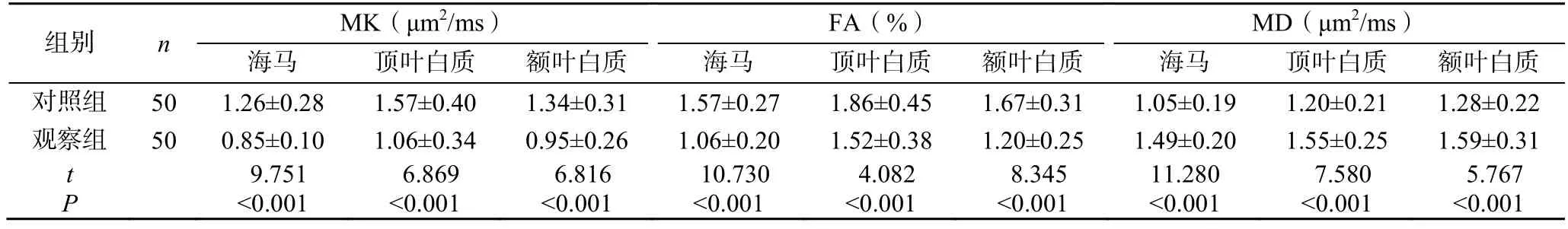
表1 两组患者DKI参数变化(±s)
组别 n MK(μm2/ms) FA(%) MD(μm2/ms)海马 顶叶白质 额叶白质海马 顶叶白质 额叶白质海马 顶叶白质 额叶白质对照组 50 1.26±0.28 1.57±0.40 1.34±0.311.57±0.271.86±0.451.67±0.311.05±0.19 1.20±0.21 1.28±0.22观察组 50 0.85±0.10 1.06±0.34 0.95±0.261.06±0.201.52±0.381.20±0.251.49±0.20 1.55±0.25 1.59±0.31 t 9.751 6.869 6.816 10.730 4.082 8.345 11.280 7.580 5.767 P <0.001 <0.001 <0.001 <0.001 <0.001 <0.001 <0.001 <0.001 <0.001
2.3 阿尔兹海默病不同部位DKI参数比较
不同部位的DKI参数比较,差异有统计学意义(P<0.05),见表2。
表2 AD不同部位DKI参数比较(±s)
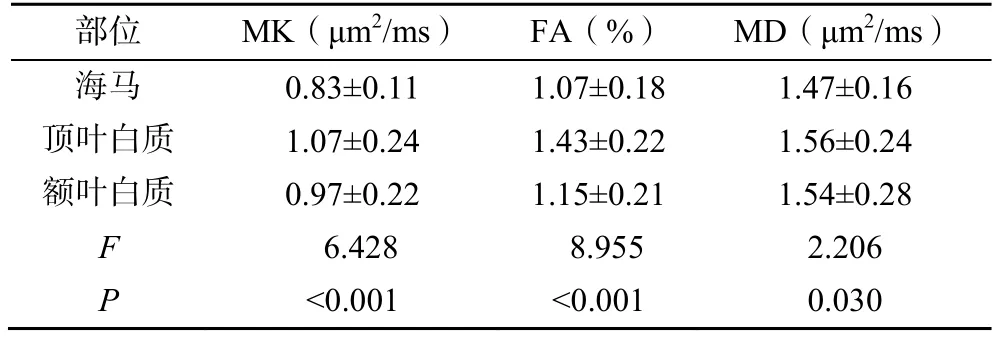
表2 AD不同部位DKI参数比较(±s)
部位 MK(μm2/ms) FA(%) MD(μm2/ms)海马 0.83±0.11 1.07±0.18 1.47±0.16顶叶白质 1.07±0.24 1.43±0.22 1.56±0.24额叶白质 0.97±0.22 1.15±0.21 1.54±0.28 F 6.428 8.955 2.206 P <0.001 <0.001 0.030
2.4 两组患者认知功能比较
相比于对照组,观察组MMSE评分较低(27.51±2.56分vs.10.26±1.14分,P<0.001)。
3 讨论
AD的病因及发病机制尚不明确,病理学特征为脑内大量的β-淀粉样蛋白和Tau蛋白沉积,神经细胞丧失,主要发生于老年群体中,是一种中枢神经系统退化所导致[7-9]。该病一旦发病,几乎没有治愈的可能,只能通过综合治疗延缓病情,对于患者的家庭幸福感及正常横祸均造成了严重的影响,因此,对于AD进行及早的诊断具有重要意义[10-11]。
目前,MR用于诊断AD的主要技术为弥散张量成像、扩散加权成像等,虽然可以直观的观察患者脑内白质纤维异常,但是存在于脑内微观环境的神经元组织观察不到,神经元组织在脑内水分子的主要扩散方式为非高斯分布,而弥散张量成像、扩散加权成像无法准确描述水分子的非高斯分布状态[12-13]。本研究结果显示,在AD患者中MK、FA较低,MD较高,与严重程度具有一定的相关性,表明DKI参数与AD患者的疾病严重程度有一定的关系,对疾病有诊断价值。在DKI参数中包括FA值用于评估白质纤维走向及完整程度,而髓鞘密度、纤维直径、密度、细胞外水分子扩散能力、髓鞘内空间大小,决定了扩散各向异性的程度,MK值用于反映的是轴突鞘、细胞膜、髓鞘层等组织微观结构的复杂度。MD值不会受纤维走向的影响,代表区域内的水分子弥散水平和弥散阻力的整体情况,是不具有方向的一个平均值。三者分别用于检测不同位置,可以准确的诊断出AD患者[14-15]。
研究显示,AD患者在脑白质改变时发现,AD患者的FA值在海马、顶叶白质、额叶白质表现为降低,提示,AD患者的脑白质微结构变化主要集中在脑后部及中部,很大程度上与AD患者病理传播特点及特定区域有关[16-17]。本研究结果显示,AD患者中海马、顶叶白质、额叶白质中MK、FA值较低;MD值较高,且与DKI参数均呈正相关。分析原因,海马、顶叶白质、额叶白质脑弥散峰度值的改变与神经元的损伤有关。DKI参数包括评估白质纤维走向、完整程度等,可以影响海马、顶叶白质、额叶白质[18-19]。
综上所述,DKI参数与疾病严重程度具有相关性,且其在海马、顶叶白质、额叶白质中均存在不同表达,对AD患者具有一定的诊断价值,具有临床应用价值。
