结直肠混合性腺-神经内分泌癌的临床病理特征与诊疗分析
2023-12-11杜立陈子华
杜立,陈子华
(中南大学湘雅医院 普通外科,湖南 长沙 410008)
1987年Lewin[1]首次对混合性腺癌-内分泌癌做出分类:这些混合肿瘤的两种成分可以表现出不同的形态特征(也取决于起源部位)以及分化程度,并且以复合、碰撞、两性肿瘤等不同的模式组合,2010 版WHO 消化系统肿瘤分类将其归类为神经内分泌肿瘤(neuroendocrine neoplasm,NEN),并采用“ 混合性腺- 神经内分泌癌(mixed adeno-neuroendocrine carcinoma,MANEC) ”命名,其生物学行为及预后是两种肿瘤成分的总和,各成分都能独立进展及转移[2-4]。随后,2019年WHO将胃肠道内分泌肿瘤根据形态、核分裂计数及Ki-67阳性指数分为 G1~G3 级神经内分泌瘤(neuroendocrine tumor,NET)、大细胞型和小细胞型神经内分泌癌(neuroendocrine carcinoma,NEC)、混合性神经内分泌-非神经内分泌肿瘤(mixed neuroendocrine-nonneuroendocrine neoplasm,MiNEN)(表1)。MiNEN 为一类疾病,MiNEN 亚型之间的预后无显著差异[5],MANEC 被包括于其中,它要求非神经内分泌成分为癌,但不限于腺癌;神经内分泌成分也可以包括分化较好的NEC,且两种成分要求不少于30%[6],但30%的限制临床实践中有一定局限性,因为小灶(<30%) 分化差的癌(如NEC、印戒细胞癌) 也具有重要临床意义[4]。结直肠MANEC 为极为罕见的疾病,2016年统计显示发病率大概为1.16 例/1 000 000 人[7]。目前普遍认可的MANEC 发生机制为单克隆起源,即腺癌和NEC 由单个突变细胞增殖而成,可能的共享突变为TP53、APC、KRAS、BRAF 突变[8]。对于该病的诊断主要依靠手术标本的病理检查及免疫组织化学检测,即MANEC 的两种成分需形态上明确可区分,其中神经内分泌成分应经免疫组织化学染色证实。对于结直肠MANEC 的治疗应采用综合全面的治疗方案,手术能改善患者的生存期[7],化疗可选用针对NEC 的顺铂+依托泊苷或者针对腺癌的以奥沙利铂和氟尿嘧啶为基础的化疗方案[9]。本研究总结了近10 余年来收治的结直肠MANEC 病例的临床病理资料及诊疗经过,以期提高对该病的认识,从而规范其治疗及管理。
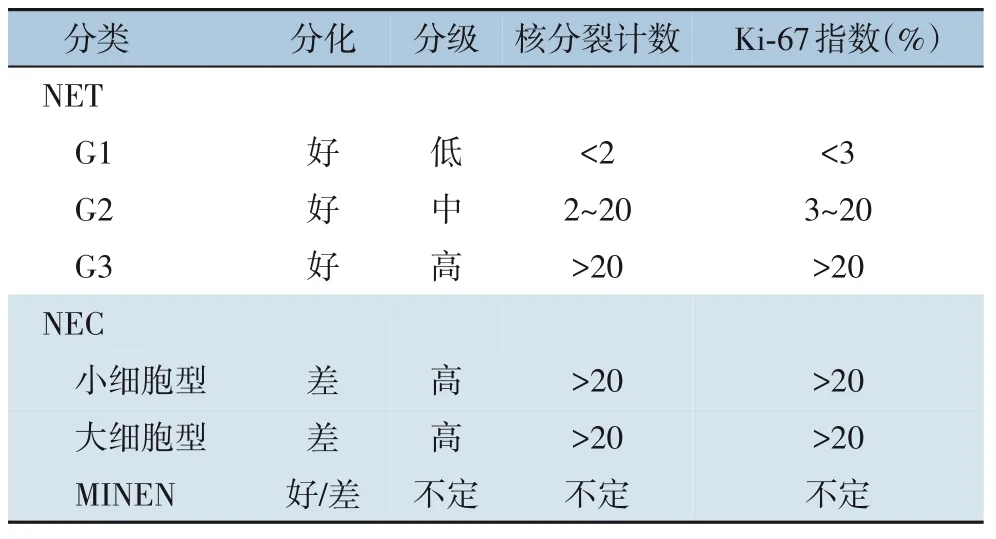
表1 WHO 2019年消化系统NEN的分类和分级标准Table 1 WHO 2019 classification and grading criteria for gastrointestinal NENs
1 资料与方法
1.1 病例来源
对中南大学湘雅医院13年(2010年1月—2023年3月)的病理档案进行回顾,通过合并检索“神经内分泌癌”“腺癌”“肠”确定了54 例消化道腺癌合并神经内分泌病变的病例。并从中筛选出了13 例通过手术标本确诊的结直肠MANEC 病例。
1.2 研究方法
通过病案信息科查阅其临床资料,记录患者的性别和年龄、肿瘤位置、转移部位、放射学检查报告、血清肿瘤标志物,及术前、术后的详细病理信息,并进行随访了解对于手术及化疗等治疗的效果。腺体和神经内分泌成分的形态分型和分级遵循WHO 2019年的分类。结直肠癌的病理及临床分级遵循AJCC 第8 版。神经内分泌成分用神经内分泌免疫组织化学标志物进行鉴定。
2 结果
2.1 患者术前临床资料
13 例MANEC 患者中,男性10 例(76.9%),女性3例(23.1%),男女之比3.3∶1。患者年龄49~93岁,平均年龄为65.1 岁。最常见的症状是便血(出现频率为61.5%),其次是大便性状改变(46.1%),腹痛腹胀(38.4%),体质量减轻(30.7%),腹泻(23%)。在体格检查中有61%的患者出现阳性体征,在6 例直肠病变中有5 例直肠指检可触及肿物;7 例结肠病变中有3 例可触及腹部肿块。血清相关肿瘤标志物检测结果显示,13 例中有8 例化疗前或术前所测血清CEA 升高,平均23.3 ng/mL(正常值<5 ng/mL),13 例中仅有2 例CA19-9 升高,值为432.7 ng/mL 和45.3 ng/mL(正常值为<35 U/mL),2 例CA242 升高,值分别为37.73 kU/L 和>200 kU/L(正常值为<20 kU/L)。影像学检查结果显示,13 例患者全腹部增强CT 或MR 均发现了肠壁增厚,且原发肿瘤部位均为结直肠,临床和放射学标准排除了其他解剖来源的转移性疾病,并根据生长方式和周围淋巴结侵犯情况给予结直肠癌的影像学诊断;13 例患者肠镜检查均发现肠腔内肿物并取少量组织送病例检查,术前病理报告显示,其中7 例仅检测出腺癌成分,2 例为高级别上皮内瘤变,1 例为绒毛-管状腺瘤,1 例为低分化腺癌组织并存在神经内分泌分化,1 例为腺癌并G3-NET,1 例因既往行肛周肿块部分切除,所取标本病理回报为低分化腺癌合并NEC。针对上述2 例根据术前病理考虑存在神经内分泌病变的患者进一步完善了以18F-奥曲肽(18F-OC)为显像剂的PET/CT 全身断层显像,均提示肠壁增厚处及周围淋巴结存在生长抑素受体(SSTR)表达增高(2/2)(图1)。术前转移情况:肠旁淋巴结是最常见的转移部位(9 例,69.2%),其次是肝脏(1 例,7.6%)、肺(1 例,7.6%),有1 例的肝脏肿块在经放射科会诊后考虑为良性病变。
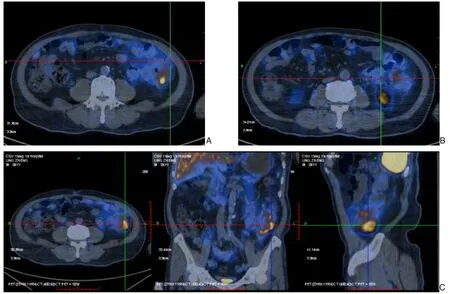
图1 以18F-OC为显像剂的PET/CT全身断层显像 A-B:病灶周围多发淋巴结影伴显像剂分布浓聚(SUⅤmax5.8);C:降结肠壁局限性增厚,较厚处约29 mm,显像剂浓聚(SUⅤmax12.5)Figure 1 PET/CT whole-body tomographic imaging with 18F-OC as the imaging agent A-B:Multiple lymph nodes with concentrated radiotracer distribution(SUⅤmax 5.8)around the lesions;C:Localized thickening of the descending colon wall,measuring approximately 29 mm at the thickest point,with radiotracer concentration(SUⅤmax 12.5)
2.2 术后临床病理资料
所有病例均呈现晚期临床分期,显示广泛的局部扩展和(或) 远处转移,其中大多数为Ⅲ期(9 例),其余Ⅱ、Ⅳ期各2 例。手术标本病理报告显示:肿块的平均大小为4 cm×3.4 cm×2.6 cm;84.6%(11/13)为溃疡型肿块;8 例(61.5%)为低分化腺癌,4 例(30.7%)为中分化腺癌,1 例(7.8%)为高分化腺癌。免疫组织化学中染色结果显示,肿瘤细胞表达神经内分泌标记物,例如嗜铬粒蛋白A(CgA)、突触素(Syn)、长抑素受体2(SSTR2)和(或)CD56。其中Syn 的阳性率为100%(13/13),CgA 的阳性率为61.5% (8/13),CD56 的阳性率为85.7%(6/7),SSTR2 的阳性率为66.6%(2/3),手术标本的部分免疫组化结果见图2。Ki-67 指数在增殖最高的区域进行计数。其中5 例患者的Ki-67指数在20%~50%之间,8 例Ki-67 指数>50%。术后复查发现的转移:泌尿系统(2 例)、肝脏(2 例)、腹膜(2 例)。
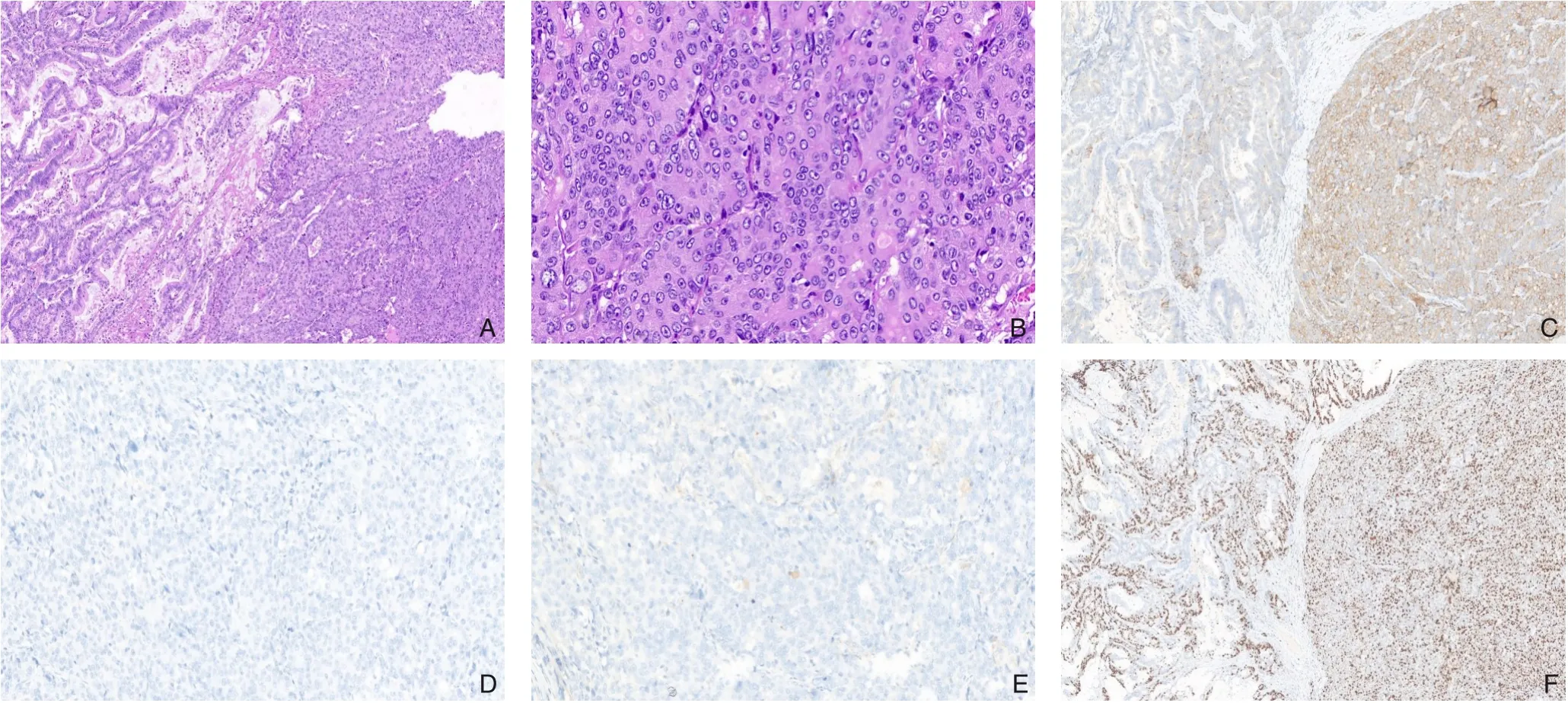
图2 组织病理学结果 A:左边为腺癌成分,右边为神经内分泌癌成分(HE×100);B:大细胞神经内分泌癌由核仁明显、胞质少、核分裂象易见的大型肿瘤细胞组成(HE×400);C:Syn染色结果,左边腺癌组织阴性,左边神经内分泌成分阳性(×100);D:CgA染色阴性(×200);E:SSTR2染色结果为阴性(×200);F:热点区Ki-67阳性指数:左侧腺癌区为60%,右侧NEC区为80%Figure 2 Histopathological findings A:Adenocarcinoma component on the left,and neuroendocrine carcinoma component on the right(HE ×100);B:Large-cell neuroendocrine carcinoma composed of large tumor cells with prominent nucleoli,scant cytoplasm,and easily visible mitotic figures(HE ×400);C:Negative staining in the left adenocarcinoma tissue and positive staining in the right neuroendocrine component for Syn(×100);D:Negative staining for CgA(×200);E:Negative staining for SSTR2(×200);F:Hotspot Ki-67 positive index:60% on the adenocarcinoma area,and 80% on the NEC area on the right
2.3 治疗方法
13 例患者均行手术治疗,其中3 例行术前新辅助治疗。术后随访中了解到9 例的后续治疗情况,其中2 例因年龄较高或个人意愿未行后续药物治疗,剩余7 例中有4 例使用了以奥沙利铂为基础针对以腺癌为主的化疗方案(如FOLFOX4)、2 例针对NEC 为主,使用了EP 方案(顺铂+依托泊苷)、1 例仅使用了免疫治疗(信迪利单抗)。2 例联合使用了靶向治疗(贝伐珠单抗)、1 例联合序贯使用了EP 和FOLFIRI 及贝伐珠单抗。
2.4 随访情况
在13 例病例中,有2 例失访。剩余11 例患者中8 例死亡,3 例存活。了解到8 例患者的具体生存期(1、3年生存率分别为37.5%、25%),平均生存期为20.6 个月,中位生存期为13.5 个月。
3 讨论
MANEC 属于罕见病例,据报道:肠道MANEC的发病率从2000—2016年呈持续增长。2000年胃肠道MANEC 的发病率为0.23 例/1 000 000 人,2016年为1.16 例/1 000 000 人。在此期间,APC(即发病率增加的斜率或程度)为8.0%(95%CI=5.7%~10.3%,P<0.05),男性的发病率略高于女性[7]。Frizziero 等[8]在汇总77 项研究中得出MINEN的发患者群中,65.6%为男性,34.4%为女性,并在每个原发部位的亚组中,男性都占大多数。在本研究中,男女比3.3∶1,与既往研究基本一致。研究显示,60.3%的MANEC 位于阑尾,29.3%位于结肠,10.4%位于肛门直肠[10],肿瘤位置对MANEC具有重要的预后意义,位于阑尾的MANEC 预后较位于结直肠的好[11]。
MANEC 的诊断主要依靠病理和免疫组织化学。NEC 根据细胞形态分为小细胞型和大细胞型[12-13]。有研究[14]报道,在胃肠NEC 中大细胞癌和小细胞癌的发病率分别为61%和39%,且分型不影响生存,也暂无根据该分型而不同的治理方案。对于病理诊断MANEC 大致有以下三点原则:⑴ 在HE 染色的背景下观察到同时存在NEC 和非NEC 等两种成分,这是诊断的基石;⑵ 当神经内分泌成分不存在时,即使最特异和最敏感的神经内分泌标志物免疫染色呈阳性(如CgA 和Syn),也不能考虑该诊断;⑶ 至少存在2 个及以上的神经内分泌标志物染色阳性(最好是CgA、Syn、CD56、SSTR2 和INSM-1)[15-16]。在本研究中,13 例患者都完成了CgA、Syn 的检测,部分完善了CD56、SSTR2 的免疫染色,结果显示,Syn 的阳性率为100% (13/13),CgA 的阳性率为61.5% (8/13),CD56 的阳性率为85.7%(6/7),SSTR2 的阳性率为66.6%(2/3),该结果印证了即使观察到了神经内分泌成分,神经内分泌成分标志物也并非一定为阳性,因此需要上述所提到的多种要求来明确诊断;且CgA 相较于其他标志物阳性率偏低,也验证了Rindi 等[17]的观点:CgA 在NET 中的表达趋于强烈且呈弥散分布;但在NEC 中表达微弱或根本不表达。免疫组织化学对于非神经内分泌成分的精准识别有助于患者的管理及治疗,对于转移性MINEN,使用特异性标志物(转录因子、细胞角蛋白)可以提示原发部位[16],本研究中共有7 例患者完善了消化道上皮细胞的转录因子CDX-2 染色,结果均为阳性,并在肝转移组织染色中也为阳性,因此可以提示该病变可能原发病灶为肠道。术前病理检出神经内分泌病变的比例并不高,可能与内镜下所取标本量少,取材表浅相关,建议采用内镜下肿块多点取样法,或针对存在如脏器转移且具备穿刺条件情况下可行B 超引导下肿块穿刺以获得充足的标本量。
在术前病理提示存在神经内分泌分化或NEN存在的情况下,完善了以18F-OC 为显像剂的PET/CT,均提示局部肠壁及肠旁淋巴结存在SSTR 表达增高的结果。大部分NEN 会表达生SSTR,其中主要表达的亚型为SSTR2,目前已人工合成稳定性高的生长抑素类似物,并将其与放射性物质(最常使用的为68GA)结合,可以结合SSTR 通过PET/CT检查显示肿瘤分布及转移部位,指导临床分期及后续治疗管理,该特异性结合不仅可以用于诊断还发展为一种治疗手段,即肽受体放射性核素治疗(PRRT)[18]。除了生SSTR 激动剂外,目前也有相关生长抑素抑制剂对NEN 诊断和治疗的研究,这些研究提示:拮抗剂比激动剂更有效地结合肿瘤中SSTR 位点,包括如乳腺癌、肾细胞癌等SSTR2 密度较低的肿瘤;更高的肿瘤摄取率和更好的肿瘤与背景的对比度,可改善图像质量和检出率;更长的半衰期和更多的DNA 双链的断裂率[19]。在本研究中,选用的显像剂为18F-OC,因为通过前瞻性对比研究发现,18F-OC 显示出良好的生物分布[20]。
MANEC 的治疗应采用综合治疗,包括手术、术前及术后化疗。一项回顾性研究[21]表明,病变部位在胃的MANEC 和NEC,在新辅助化疗后可显著延长其总生存(OS)期,新辅助化疗组患者的OS 优于手术组的患者(P=0.032)。具体而言,新辅助化疗组的3年OS 率为68.8%,手术组为43.8%;新辅助化疗组的5年OS 率为57.4%,手术组为28.5%。本研究中仅3 例行新辅助化疗,其预后较同临床分期的患者生存期长。根据文献报道,手术治疗的患者的预后优于采取保守治疗的患者(中位生存期:15 个月vs.86 个月,P<0.001)[7],对早期病变实行手术治疗,能改善患者的生存期,Ⅰ、Ⅱ期5年生存率分别为100.0%、72.7%[2],即使存在远处转移的患者,也应参照腺癌或NEC 通过转化治疗提高MANEC 患者的手术实行率[14]。本研究中所有患者均接受了手术治疗。MANEC 是一种恶性肿瘤,发现时常已存在转移。对于该种预后差、复发率和转移率高的疾病即使在R0切除术后仍需要系统的化疗方案,但是目前针对于MANEC的化疗方案暂无具体的指南及方案,因此有文章[14]提出可以根据术后标本中的主导成分选择化疗方案。对于以NEC 占比成分较多的患者,可选用顺铂+依托泊苷,该方案被认为是治疗神经内分泌癌的一线化疗方案,卡铂+依托泊苷、FOLFOX方案、顺铂+伊利替康等可作为备选方案[22-23];对于以腺癌成分为主的患者,可使用目前已经建立并且较完善的对于结直肠腺癌的化疗方案,比如基于奥沙利铂和氟尿嘧啶的化疗[9,24],另外研究[25]表明联合贝伐珠单抗可延长无进展生存(PFS)期和OS 期。本研究术后随访了解到9 例的后续治疗,其中2 例因年龄较高或个人意愿未行化疗,2 例使用了以奥沙利铂和氟尿嘧啶为基础的化疗方案,如FOLFOX4 (其中2 例联合使用了贝伐珠单抗,1 例使用过顺铂+依托泊苷),2 例使用以奥沙利铂为基础的化疗方案,如XELOX,1 例使用以氟尿嘧啶为基础的化疗方案,如FORFIRI,1 例仅使用信迪利单抗,1 例仅使用顺铂+依托泊苷。我院的治疗方案大致符合目前文献所报道的内容。不过仅1 例最近于2021年诊断的患者联合序贯使用了EP、FOLFIRI 及贝伐珠单抗,且在术后12 个月仍处于稳定状态,推测联合针对神经内分泌成分EP 方案和针对腺癌成分的奥沙利铂为基础的方案及贝伐珠单抗可能存在优势,有待进一步的前瞻性研究验证,对于单独使用信迪利单抗的患者,他的生存期仅为6 个月,因为术后反复出现双下肢水肿,使用利尿剂对症治疗,身体状况难以耐受化疗,并在术后复查中发现肝脏多发转移,才选择了姑息性免疫治疗。关于信迪利单抗,它主要同其他药物一起联用,用于治疗霍奇金淋巴瘤、非小细胞肺癌[26]、不可切除性肝癌[27]。虽然有研究[28]表明在二线治疗无效的NEN 中,信迪利单抗在对于神经内分泌癌治疗存在意义,但是仍需要后续研究验证免疫治疗对于MANEC 的有效性。
胃肠道MANEC 患者的中位生存期为75 个月(95%CI=60~128 个月),1、5、10年OS 率分别为83.6%、54.9%、44.9%;局部疾病患者的预后和中位生存期最好,远处疾病患者的生存时间比区域疾病患者短(18 个月vs.87 个月,P<0.001)。高分化肿瘤患者的中位生存期显著高于低分化和未分化肿瘤患者;接受手术的患者比接受保守治疗的患者预后更好(中位生存期:15 个月vs.86 个月,P<0.001);在区域淋巴结阴性和肿瘤>2 cm 的患者中也观察到有统计学意义的生存改善;诊断年龄(>60 岁),SEER 分期(区域和远距离),肿瘤分级(低分化和未分化),区域淋巴结阳性,手术,肿瘤大小(>2 cm) 和盲肠肿瘤部位都与胃肠道MANEC 病死率独立相关[7]。La Rosa 等[29]在分析了27 例NEC 和12 例MANEC 的临床病理学资料,单变量分析显示,只有显著的瘤周淋巴反应、CD117 免疫反应、血管侵犯和MSI/CIMP+状态与预后显著相关;多变量分析显示,血管侵犯和CD117 免疫反应性是独立预后标志物。Li 等[30]对8 005 例结直肠癌患者的生存期进行统计分析后表明,腺癌、黏液腺癌和印戒细胞癌的中位生存期分别为23.6、26.9、26.9 个月。本研究中,8 例患者的具体生存期(1、3年生存率分别为37.5%、25%),平均生存期为20.6 个月,中位生存期为13.5 个月,因此推测结直肠MANEC 预后较单纯腺癌差。本研究中的预后要差于前文总结所得出的结论,可能因为本研究包含的病例中92.3%(12/13)存在淋巴结或远处转移,且平均年龄>60 岁,肿块平均大小>2 cm,92.3%(12/13)腺癌为中低分化。本研究中2 例生存期超过3年的患者的病理及临床分期分别为ypT3N0M0、pT2N1M0 和Ⅱ、Ⅲa 期,浸润深度及淋巴结转移情况均良好;另有1 例病理分级为pT3N0M0,临床分期为Ⅱ期的患者在术后复查中发现存在肝转移,最后的生存期仅为6 个月,因此推测生存期可能与临床病理分期及有无远处转移相关。
总之,诊断主要依据病理以及CgA、Syn、CD56、SSTR2 和INSM-1 等免疫组化染色,以奥曲肽为显像剂的PET/CT 可增加该类疾病的检出率,以改善结直肠MANEC 的治疗管理方案及患者预后。治疗原则为手术治疗为主,化疗为辅,化疗方案联合针对神经内分泌成分EP 方案和针对腺癌成分的奥沙利铂为基础的方案更可能有优势,PDL1 免疫治疗对于晚期神经内分泌癌及MANEC 的疗效有待进一步临床试验验证。
利益冲突:所有作者均声明不存在利益冲突。
作者贡献声明:杜立主要负责资料收集和论文的撰写;陈子华主要负责对论文内容修改和审校。
