高通量测序法分析贮藏期甜瓜果实中真菌群落结构组成及动态变化
2023-12-11郑贺云朱丽霞张翠环汪志伟耿新丽
郑贺云,朱丽霞,姚 军,李 超,张翠环,汪志伟,耿新丽,*
(1.新疆维吾尔自治区葡萄瓜果研究所,新疆 鄯善 838200;2.塔里木大学食品科学与工程学院,新疆 阿拉尔 843300)
甜瓜是世界上最受欢迎的水果之一,富含糖、维生素、抗坏血酸、胡萝卜素、叶酸、钙、磷、钾等营养物质[1],备受广大消费者的青睐。甜瓜在我国栽培历史悠久,随着产业的可持续发展,其栽培面积不断扩大,联合国粮食及农业组织统计数据库(http://fao.org)显示,2020年,我国甜瓜栽培面积和产量均居世界前列,种植面积为38.78万 hm2,产量为138.65万 t。甜瓜果实糖和水分含量较高,生理代谢旺盛,后熟衰老速度较快,采收、运输和贮藏期间水分散失和呼吸蒸腾作用会导致果实萎蔫、软化等品质劣变,而病原菌侵染致果实腐烂现象更为普遍,造成了巨大的经济损失。
近年来,诸多研究已将采后甜瓜腐烂与真菌侵染紧密联系起来,从采后甜瓜中鉴定出的致病菌主要包括链格孢、镰刀菌、粉红单端孢、青霉等[2]。然而,采后果实中微生物群落系统复杂,其相互作用直接影响果实的品质和贮藏性能。内生真菌通常不会引发植物病害,其可以通过与病原体直接相互作用或诱导宿主产生激素促进植物生长来提高寄主植物的抗性,但是其与寄主的共生平衡被打破后有可能转变为病原物潜伏在植物体内,最终引起病害症状[3]。
传统的微生物培养分离技术可以量化可培养的微生物,并能将它们鉴定到属、种,但只有极少部分微生物能够实现分离与培养,绝大多数微生物不能获得纯培养物,而且其操作费时费力,结果会因操作误差而产生偏差[4]。2006年,有研究者通过高通量测序技术对深海微生物群落进行了分析[5],目前该技术已被广泛用于研究不同基质微生物群落的动态变化和多样性。有研究者利用该技术分析不同时期柑橘果实中的真菌种类,发现不同生长阶段的柑橘果皮和果肉组织中优势菌群差异显著[6];Qiu Wanwei等[7]评价冬菇冷藏过程中微生物多样性变化,结果表明冷藏条件下蘑菇贮藏后期假单胞菌、绿杆菌和金杆菌丰度较高;Li Meng等[8]分析了板栗贮藏过程中真菌群落组成的变化,建立了真菌介导的腐烂与板栗贮藏期品质之间的相互关系;Dai Kun等[9]通过高通量测序分析真菌群落的变化,从而监测贮藏过程中杨梅的腐烂程度和果实品质,为杨梅采后贮藏过程中腐烂和品质变化的监测提供了新的思路。目前,高通量测序技术已成功地应用于黄瓜[10]、花生[11]、菠菜[12]、菜心菜[13]、番茄[14]等果蔬贮藏过程中微生物群落变化的解析。上述研究证实利用高通量测序技术可以对果蔬中微生物群落之间的相互关系进行深入的解析。
为了解贮藏期甜瓜果实中真菌群落的变化,本研究利用Illumina MiSeq高通量测序平台对‘西州密25号’甜瓜不同贮藏期的果皮和果肉中真菌群落进行内部转录间隔区(internal transcribed spacer,ITS)测序,以期对贮藏期甜瓜果皮和果肉组织中真菌群落组成和动态变化进行解析,为采后病害的发生规律及后续甜瓜保鲜、内生生防菌的开发提供理论依据。
1 材料与方法
1.1 材料与试剂
‘西州密25号’由新疆维吾尔自治区葡萄瓜果研究所育成,于2021年4月18日播种在新疆维吾尔自治区葡萄瓜果研究所甜瓜贮藏与运输课题试验基地,行距3 m,株距45 cm,施行膜下滴管栽培模式和田间常规管理。2021年7月9日采收,选择大小及成熟度一致、无病虫害、无机械损伤的果实置于温度为(23.0±0.5)℃、相对湿度为70%~80%的环境下贮藏。
DNA提取试剂盒购自天根生化科技(北京)有限公司。
1.2 仪器与设备
3K15高速冷冻离心机 德国Sigma公司;Scientz-48高通量组织研磨器 宁波新芝生物科技股份有限公司;DYY-11型电泳仪 北京市六一仪器厂;移液枪 德国Eppendorf公司;IE412-L电子天平 德国Sartorius公司;凝胶成像系统 美国Bio-Rad公司;HYSW-10A超纯水机 南京恒裕仪器设备制造有限公司;MLS-3750蒸汽灭菌锅 日本三洋公司。
1.3 方法
1.3.1 样品采集
取样时间分别为0 d(甜瓜果实采收的当天,果实新鲜)、7 d(甜瓜果实果皮转黄,步入衰老阶段)、14 d(甜瓜果实表面开始出现轻微的腐烂)、21 d(甜瓜果实开始大面积腐烂)。每次随机选取9 个果实,每3 个一组,进行3 次重复,分别取果皮和果肉组织。果皮样品由随机选取3 个果实的全果皮混合而成,果肉样品由距离果皮2.5 cm处一圈果肉混合而成,取样后置于-80 ℃保存备用。贮藏0 d果皮、果肉分别记为P4、R4,贮藏7 d果皮和果肉分别记为P5、R5;贮藏14 d果皮和果肉分别记为P6、R6;贮藏21 d的果皮和果肉分别记为P7、R7。
1.3.2 甜瓜样品ITS序列测定
以样品的基因组DNA为模板,文库的建立和基于Illumina测序平台对甜瓜样品中真菌群落DNA片段进行的双端测序均由上海派森诺生物科技股份有限公司完成。ITS测序引物为F:5’-CTTGGTCATTTAGAGGAAGTAA-3’;R:5’-GCTGCGTTCTTCATCGATGC-3’。
1.3.3 测序数据分析
利用QIIME2软件对原始数据进行分析,首先调用qiime cutadapt trim-paired切除序列的引物片段,弃去未匹配引物的序列;然后通过qiime dada2 denoise-paired调用DADA2进行质控、去噪、拼接、去嵌合体获得扩增子序列变体(amplicon sequence variants,ASVs)。序列长度分布统计使用R语言脚本,对全部样本中所包含的高质量序列长度分布进行统计。
1.4 数据统计与分析
使用上海派森诺生物科技股份有限公司的生信云平台(https://www.zcygov.cn/)对真菌群落组成、群落多样性、种群差异等进行分析。
2 结果与分析
2.1 序列有效性分析
贮藏期果肉和果皮组织共24 个样品,通过Illumina MiSeq平台测序,最终共计获得1 937 667 对双端序列,经过质控、去嵌合体后获得1 638 150 条高质量序列,序列长度范围为155~369 bp,平均长度为230 bp。
2.2 不同贮藏期甜瓜真菌群落组成分析
2.2.1 甜瓜样品中ASV分析和物种注释
分类学分析结果表明,在贮藏期果皮和果肉组织24 个样品中共鉴定出真菌3 个门、23 个纲、54 个目、106 个科、123 个属。
2.2.2 基于门水平贮藏期甜瓜真菌组成结构分析
如图1所示,在门水平上子囊菌门(Ascomycota)和担子菌门(Basidiomycota)是甜瓜贮藏期果皮和果肉24 个样品中的优势菌群,相对丰度分别为69.65%和29.68%,毛霉门(Mucoromycota)的相对丰度为0.67%。贮藏期内(0~21 d),果皮中子囊菌门的相对丰度呈先上升后下降的趋势,且其在贮藏14 d时占绝对优势,相对丰度达99.06%,而担子菌门的相对丰度呈先下降后上升的趋势;果肉中子囊菌门的相对丰度呈先下降后上升的趋势,而担子菌门的相对丰度则呈先上升后下降的趋势,并在贮藏14 d时占绝对优势,相对丰度高达66.46%。毛霉门只在贮藏0 d的果皮和和果肉组织中检出,其相对丰度分别只有2.17%和3.14%。
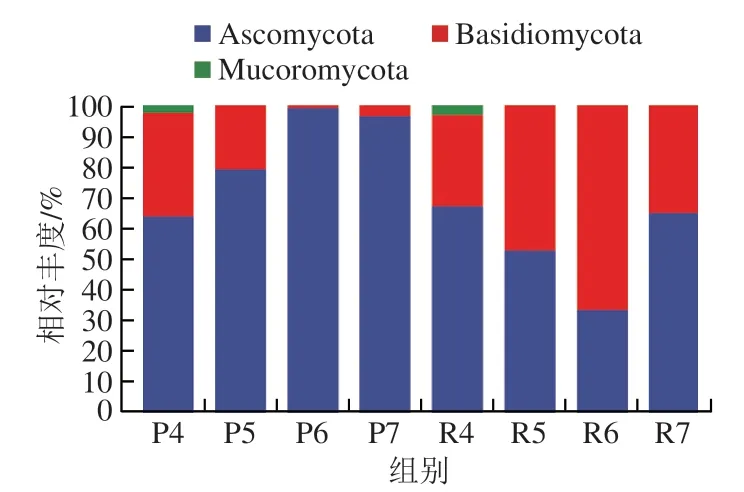
图1 基于门水平甜瓜样品中真菌群落组成Fig. 1 Fungal community composition in melon samples at the phylum level
2.2.3 基于目水平贮藏期甜瓜果皮和果肉组织中真菌结构分析
如图2所示,甜瓜贮藏期果皮和果肉24 个样品在目水平共注释到10 个相对丰度大于1%的真菌微生物群落,分别是散囊菌目(Eurotiales)(相对丰度28.55%)、格孢腔菌目(Pleosporales)(相对丰度17.12%)、银耳目(Tremellales)(相对丰度16.55%)、肉座菌目(Hypocreales)(相对丰度12.50%)、线黑粉菌目(Filobasidiales)(相对丰度3.42%)、酵母菌目(Saccharomycetales)(相对丰度2.60%)、马拉色菌目(Malasseziales)(相对丰度2.48%)、小囊菌目(Microascales)(相对丰度2.02%)、煤炱目(Capnodiales)(相对丰度1.66%)和叶黑粉菌目(Entylomatales)(相对丰度1.41%)。

图2 基于目水平甜瓜样品中真菌群落组成Fig. 2 Fungal community composition in melon samples at the order level
整个贮藏期内(0~21 d),果皮与果肉中优势菌群差异较为明显,新鲜果实(0 d)的果皮中格孢腔菌目、银耳目、肉座菌目占据优势,而果肉中优势菌群为格孢腔菌目、银耳目和小囊菌目。随着贮藏时间的延长,贮藏21 d时果皮中检测到的优势菌群以散囊菌目为主,肉座菌目次之,贮藏14 d时散囊菌目占绝对优势,相对丰度高达87.36%;贮藏21 d时果肉中的优势菌群除格孢腔菌目、银耳目和小囊菌目外,还包括为肉座菌目、酵母菌目和叶黑粉菌目。综上,贮藏21 d时果皮中的优势菌群为散囊菌目和肉座菌目,而果肉中格孢腔菌目、银耳目和肉座菌目占优势。
2.2.4 基于属水平贮藏期甜瓜果皮和果肉组织中真菌结构分析
如图3所示,在属水平上,甜瓜贮藏期果皮和果肉24 个样品中相对丰度排名前10 位的优势菌群分别为曲霉属(Aspergillus)、维什尼亚科齐马菌属(Vishniacozyma)、链格孢属(Alternaria)、单端孢属(Trichothecium)、Papiliotrema、青霉属(Penicillium)、黑粉酵母属(Filobasidium)、附球菌属(Epicoccum)、绿僵菌属(Metarhizium)、毕赤酵母属(Pichia)。
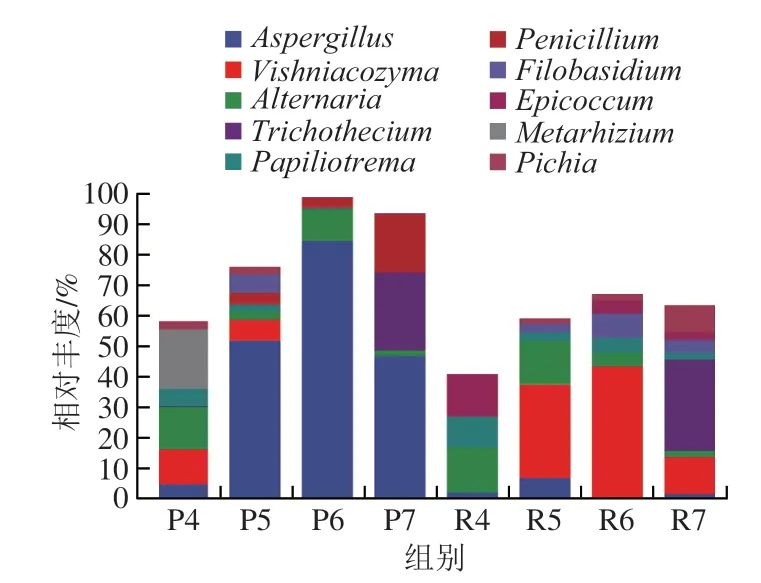
图3 基于属水平甜瓜样品中真菌群落组成Fig. 3 Fungal community composition in melon samples at the genus level
从图3和表1可以看出,贮藏0 d时果实较新鲜,果皮中菌群相对均衡,优势菌为绿僵菌属、维什尼亚科齐马菌属和链格孢属,曲霉属和Papiliotrema相对丰度较低;贮藏7~14 d时优势菌群转变成曲霉属,链格孢属次之,在第14天时曲霉属相对丰度达到峰值(84.06%),这个时期部分果实表面开始出现黑色斑块,斑块上出现黑色颗粒状物,形成黑色霉斑,依据形态学分析鉴定为典型的黑曲霉[15];贮藏21 d时曲霉属、单端孢属和Penicillium占主要地位,果实表面部分病斑布满浅粉红色霉层,边缘霉层为白色,病斑周围有水渍状,而软化腐烂为粉红单端孢的典型特征[16],还有部分病斑为青绿色,病斑上有青绿色霉状物,与青霉菌引起的症状相符[17]。贮藏0 d时,果肉中链格孢属、Papiliotrema和附球菌属的相对丰度较高,随着贮藏时间的推移,维什尼亚科齐马菌属、链格孢属和单端孢属转变成优势菌群。贮藏7~14 d果实进入衰老期,但果实无腐烂症状,维什尼亚科齐马菌属占据绝对优势,相对丰度分别为30.29%(7 d)和42.83%(14 d);贮藏后期(21 d)单端孢属相对丰度较高(29.64%),维什尼亚科齐马菌属和毕赤酵母属次之,相对丰度分别为11.87%和8.97%。综上,甜瓜贮藏期果皮和果肉中的优势菌属存在较大差异,贮藏21 d时果皮中曲霉属、链格孢属、单端孢属为优势菌属,而果肉中的优势菌属则为单端孢属、维什尼亚科齐马菌属和毕赤酵母属。

表1 甜瓜果实组织中真菌ASVs优势菌群相对丰度分析Table 1 Relative abundance analysis of dominant groups of fungal ASVs in melon fruit tissues %
2.2.5 基于种水平贮藏期甜瓜果皮和果肉组织中真菌结构分析
如图4所示,甜瓜贮藏期果皮和果肉24 个样品中在种水平上注释到相对丰度排名前10 位的优势菌群分别Vishniacozyma tephrensis(相对丰度8.21%)、粉红单端孢(Trichothecium roseum)(相对丰度6.94%)、卡恩斯维希尼克氏酵母(Vishniacozyma carnescens)(相对丰度3.42%)、Filobasidium magnum(相对丰度2.59%)、金龟子绿僵菌(Metarhizium anisopliae)(相对丰度2.42%)、产黄青霉菌(Penicillium chrysogenum)(相对丰度2.29%)、浅黄隐球酵母菌(Papiliotrema flavescens)(相对丰度2.11%)、黑附球菌(Epicoccum nigrum)(相对丰度1.85%)、杂色曲霉(Aspergillus versicolor)(相对丰度1.73%)、限制马拉色菌(Malassezia restricta)(相对丰度1.46%)和其他(相对丰度66.98%)。
贮藏0 d时,果皮中主要优势菌种为M. anisopliae、V. tephrensis、P. flavescens,随着贮藏时间的延长,这些具有生防效果的菌群相对丰度大幅下降,并在贮藏14 d时基本消失,导致贮藏后期(21 d)T. roseum、P. chrysogenum、A. versicolor等致病菌迅速生长繁殖,促使甜瓜产生严重的粉霉病。果肉中真菌群落组成随着贮藏时间的延长差异明显,V. tephrensis、V. carnescens、F. magnum和P. flavescens相对丰度先上升后下降,贮藏21 d时T. roseum占绝对优势,因此,T. roseum是甜瓜采后不可忽视的病菌。
2.3 果实组织间显著差异性群落和种群分析
使用ASV丰度特征表制作的维恩图可以用来统计样本之间共有和独有的物种数目,从而直观地显示样本在ASV水平上组成的相似性及重叠性。如图5所示,由维恩图解析不同贮藏期甜瓜果皮和果肉样品及不同时期果实中真菌群落的异同,发现果皮中的ASV有57 个,果肉中的ASV有47 个,两者共有的ASV有11 个,占ASV总数的10.75%,贮藏期果皮中的ASV多于果肉,由此可知,贮藏期果皮的真菌群落丰富度高于果肉。从贮藏0、7、14、21 d果实组织中检测到的ASV分别为42、35、24、27 个,其特有的ASV分别为33、20、8、11 个,这4 个时期检测出共有的ASV为4 个,贮藏期内ASV数量呈先下降后上升的趋势(图6)。综上,可通过高通量测序技术获得较多真菌群落种类和丰富度方面的信息,在本研究贮藏条件下,只有一部分真菌进一步生长,进而在一定条件下导致甜瓜果实腐烂。

图5 贮藏期甜瓜果皮和果肉样品ASVs分布维恩图Fig. 5 Venn diagram of ASV distribution in melon peel and pulp during storage

图6 不同贮藏时期果实中真菌群落ASVs分布花瓣图Fig. 6 Petal diagram of ASVs distribution of fungal communities in melon fruit at different storage periods
根据属水平ASV平均丰度排名前20 位的菌群数据绘制热图,将不同的ASV根据操作分类单元丰度分布或样本间的相似度加以聚类,热图中不同颜色可反映出不同时期甜瓜果实组织中真菌群落的相似性、差异性及物种聚类关系。如图7所示,贮藏0 d时,刚采摘成熟的果实较新鲜,营养较丰富,附球菌属(Epicoccum)、Papiliotrema、被孢霉属(Mortierella)、马拉色氏霉菌属(Malassezia)、光黑壳属(Preussia)、绿僵菌属(Metarhizium)、阿德利长西氏酵母属(Naganishia)是果实中积累的特异性真菌群落。附球菌属能够抵御细菌,也能引起甜瓜病害,王郅媛等[18]在华莱士甜瓜上分离得到黑附球菌并确定其为甜瓜的病原菌;Papiliotrema为一种酵母属真菌;被孢霉属在生物技术和生物转化应用方面具有重要的价值,同时还可以引起动植物病害[19];马拉色氏霉菌属是一种致病菌;绿僵菌属为昆虫病原菌;光黑壳属是一种植物内生菌[20]。
贮藏期内甜瓜果实中积累的特异性真菌包括单端孢菌属(Trichothecium)、毕赤酵母属(Pichia)、叶黑粉菌属(Entyloma)、青霉属(Penicillium)、曲霉属(Aspergillus)、节担菌属(Wallemia)、Gibellulopsis、维什尼亚科齐马菌属(Vishniacozyma)、线黑粉酵母属(Filobasidium)、帚枝霉属(Sarocladium)。单端孢属、青霉属、曲霉属是甜瓜采后致腐的主要病原菌;叶黑粉菌属、节担菌属、帚枝霉属和Gibellulopsis都是植物病原菌。叶黑粉菌属能够引起向日葵黑粉病[21],节担菌属为煤污病病原菌[22],帚枝霉属可引起水稻鞘腐病[23];毕赤酵母属、维什尼亚科齐马菌属、线黑粉酵母属为生防菌。综上,随着甜瓜果实的衰老,果实中积累的致病菌种类增多,同时也积累了大量的生防酵母菌,这为拮抗菌的分离提供了理论依据。
2.4 果实组织中真菌多样性分析
Alpha多样性是评价微生物群落丰度和多样性的重要指标,包括Chao1指数和Shannon指数。Chao1指数反映样品中菌群的丰富度,其数值越大表明样品中菌群越丰富。Shannon指数反映样品中菌群的多样性,其数值越大表明样品中菌群的多样性越高[24]。
由图8可知,贮藏0~21 d的甜瓜样品果皮Chao1指数和Shannon指数均在贮藏7 d时升高,14 d时下降,贮藏21 d时再次升高;而果肉中Chao1指数呈上升趋势,Shannon指数呈先上升后下降的趋势。由此可知,贮藏期甜瓜果皮和果肉中真菌群落的丰度和多样性存在差异,且果皮中的真菌群落丰度和多样性都高于果肉。

图8 甜瓜不同贮藏期果实组织中真菌Alpha多样性Fig. 8 Fungal alpha diversity in melon fruit tissues at different storage periods
3 讨 论
本研究以不同贮藏期的甜瓜为对象,利用高通量测序技术探究了甜瓜贮藏期果皮和果肉中真菌的群落结构组成和相对丰度的变化趋势,测序数据经过去噪、质控处理后,24 个样品共得到1 638 150 条高质量序列片段,平均长度为230 bp,同时共得到570 个ASV,共鉴定出真菌3 个门、23 个纲、54 个目、106 个科、123 个属。ASV注释结果表明,甜瓜贮藏期果皮和果肉24 个样品中,子囊菌门和担子菌门是门水平的优势菌群;在目水平,果皮中优势菌群为散囊菌目,而果肉中格孢腔菌目和银耳目占优势;在属水平,果皮中优势菌群从维什尼亚科齐马菌属、Papiliotrema和绿僵菌属(贮藏0 d)变为曲霉属、单端孢属和青霉属(贮藏21 d),果肉中的优势菌群也随着贮藏期的延长而改变,贮藏21 d时优势菌群为维什尼亚科齐马菌属、单端孢属和毕赤酵母属。由此可知,贮藏期甜瓜果实组织中真菌群落的丰度和多样性存在差异,引起贮藏期甜瓜品质劣变的真菌包括曲霉属、单端孢属、青霉属、链格孢菌属、镰刀菌属等,本研究结果与使用传统方法对甜瓜果实进行研究的结果相似,如利用纯培养方法也得到了相同的纯培养物[25-26]。
甜瓜目前面临的主要保鲜问题仍是衰老引起的果实品质劣变和微生物大量滋生繁殖导致的腐败。随着贮藏期的延长,甜瓜果实衰老逐渐加重,导致果实生理失调严重、抗性降低,同时也对果实中微生物群落的变化和动态平衡产生极大的影响。本研究选取不同贮藏期甜瓜果皮和果肉组织,通过高通量测序分析其真菌群落结构的变化,研究发现从新鲜甜瓜果皮中检测出的优势菌群有维什尼亚科齐马菌属、链格孢属、绿僵菌属,此外还检测到曲霉属和单端孢菌属,但相对丰度较低;而果肉中则以链格孢属、Papiliotrema和附球菌属为主。链格孢菌属、曲霉属和单端孢菌属是甜瓜采后常见致病菌,由此推断,病原菌在甜瓜果实生长发育过程中已潜伏侵染,这与马文平等[27]的研究结果一致,即在甜瓜生长发育过程中,从开花至成熟期均可受到链格孢的侵染,且侵染率较高,粉红单端孢主要侵染成熟的甜瓜果实。这一结果提示甜瓜采后黑斑病和粉霉病的发生也有可能源于生长期间即在果实中潜伏的链格孢属和单端孢属,因此生产中在采前进行对采后病菌的防治可能会得到较好的效果,并有效保持采后果实品质。
随着贮藏时间的延长,果皮和果肉组织中的优势菌群都发生了显著变化,贮藏中后期(14~21 d)果皮中维什尼亚科齐马菌属、毕赤酵母属和Papiliotrema的相对丰度为0,说明该物种几乎消失;而果肉中维什尼亚科齐马菌属的相对丰度在贮藏期先升高后降低,与其在菜心切口处的变化趋势一致[13],说明贮藏时间可影响其生长繁殖。果实组织中主要致病菌链格孢属、单端孢属、青霉属、曲霉属的相对丰度随酵母菌相对丰度的变化呈先下降后升高的趋势,最终大量生长繁殖并占据优势,导致果实腐烂。通常认为维什尼亚科齐马菌属、Papiliotrema和毕赤酵母属均为有益菌,研究表明维什尼亚科齐马菌属能够有效抑制贮藏期扩展青霉、Botrytis cinerea和枝孢霉对有机梨的侵染[28-29];P. flavescen对小麦苗期茎基腐病有一定防治效果[30];毕赤酵母可以有效延缓樱桃番茄黑斑病的发展[31]。由贮藏期果实组织中优势菌群的改变可以推断,酵母菌在贮藏前期可能通过营养竞争抑制了链格孢和单端孢属等致病菌的生长,而后期由于大量消亡其竞争能力减弱,由于缺少了拮抗菌的防御,最终致使致病菌迅速生长繁殖并占据优势,从而致使果实腐烂严重。
本研究贮藏后期果实组织中真菌丰度整体下降,这与猕猴桃软腐病发病过程中内生真菌多样性的研究结果[32]一致。出现这一结果可能是由于随着贮藏时间的延长果实成熟衰老严重,果实中的营养流失较多,无法满足微生物的正常营养代谢需求,导致大量微生物死亡,且病原微生物侵染果实后进行代谢,释放出有毒的代谢产物,使得微生物不能正常生长繁殖;同时,果实在受到病原物侵染后释放出抑制微生物生长的挥发性物质,最终使得果实在贮藏后期真菌群落不断减少。
随着贮藏时间的延长及果实的成熟与衰老,甜瓜采后病害逐渐加重,其生理变化导致营养流失,同时对果实中微生物群落的种类及动态平衡均有很大影响,促使果实抗性降低,导致病害发生。本实验研究果实内微生物群落的动态变化和相互关系,可为甜瓜采后病害的发生规律、病害防治以及拮抗菌的筛选提供理论依据。
