青头菌多酚的提取及体外抗氧化活性的研究
2023-12-09赵红艳张鸭关
赵红艳,张鸭关
(曲靖师范学院 化学与环境科学学院,云南 曲靖 655011)
0 引 言
云南得天独厚的地理条件,孕育着口感细腻、味道鲜美、营养价值极高的各类野生菌[1].大量研究表明,野生菌具有很高的营养价值与药用价值,多食食用菌不仅可以增强机体免疫功能、降低癌症诱发率,还能降血脂、降血压.因此,野生菌也越来越受人们的喜爱.近年来,随着人们对野生菌研究的不断深入,野生菌在医学领域的应用也愈加广泛.青头菌[Russulavirescens(Schaeff.)Fr.]是一种常见食药用菌,又称绿菇或青杆菌等[2],隶属伞菌目、红菇科、红菇属,味道鲜美,营养丰富,具有较好的保健与药用价值[3].早在明代中医药学著作《滇南本草》中,就有对“青头菌”药用功效“气味甘淡,微酸,无毒,主治眼目不明,能泻肝经之火,散热舒气,妇人气郁,服之最良”的记载[2],近年来研究表明,“青头菌”有抑制肿瘤、消炎、抑菌、抗氧化和调节血脂等功效[4].
酚类化合物是指带有一个或者多个羟基芳环,多酚是一类含有特定倍数苯酚单元化合物的总称[5],主要分布于植物细胞的液泡内,一般以糖苷形式广泛存在[6].多酚类物质具有延缓衰老、降血压、降血脂、预防癌症和抑菌抗炎功能[7],这也使得多酚的研究越来越受人们的关注.
1 实验材料与方法
1.1 主要材料与仪器
数显恒温水浴锅金坛区西城新瑞仪器厂;TDL-5-A飞鸽牌系列离心机上海安亭科学仪器厂;紫外分光光度计TU-1810北京普析通用仪器有限责任公司;SK2200H超声波清洗器上海科导超声仪器有限责任公司;DHG-9053A电热鼓风干燥箱上海一恒科学仪器有限责任公司;DFY-800C高速粉碎机温岭市林大机械有限公司;AL204-IC电子天平梅特勒-拖利多仪器上海有限责任公司.
没食子酸;无水乙醇;无水碳酸钠;磷酸二氢钠;磷酸氢二钠;硫酸亚铁;铁氰化钾;三氯化铁;30%过氧化氢;DPPH(1,1-二苯基-2-三硝基苯肼);水杨酸;福林酚;三氯乙酸.以上试剂都为分析纯,生产厂家为天津市风帆化学试剂科技有限责任公司.
1.2 原料处理
青头菌,采自曲靖市附近山上(见图1),由曲靖师范学院生物资源与食品工程学院韩丽红教授鉴定为青头菌(Russulavirescens).将青头菌根部去除,用蒸馏水清洗干净后,切片,低温烘干、粉碎,密封备用.

图1 采自野外的青头菌
1.3 实验方法
1.3.1 多酚标准曲线的绘制
参考唐婷范等人[8]方法并加以调整:准确称取0.01g的没食子酸,加水溶解,转移到100 mL的容量瓶中定容,可得0.1mg/mL的没食子酸溶液.在五支洁净的25 mL棕色容量瓶中分别移入0.4、0.6、0.8、1.0、1.2 mL的没食子酸标准溶液,然后补水至总体积为6.0 mL,再分别加0.5 mL的福林酚,混匀后再加1.5 mL 20%Na2CO3,摇匀.用未加没事子酸的溶液作为空白对照.将六支容量瓶放到暗处放置30 min.在760 nm处测定六支容量瓶中溶液的吸光度,绘制标准曲线.
1.3.2 青头菌中多酚的提取及含量的测定
参照张晓婷等人[9]提取多酚的方法并加以调整:称取1g青头菌粉末,按照一定的料液比加入一定量的一定浓度的乙醇溶液,保持超声仪器的温度为30℃,将离心管放到超声仪器中提取一定时间后离心5 min,然后将上清液定容到50 mL的容量瓶中,得到多酚提取液.移取1 mL多酚提取液于25 mL的棕色容量瓶中,然后按照标准曲线方法显色.放置30 min测定多酚浓度.计算多酚含量.
式中:Y(mg/g)是青头菌多酚提取率;C是待测液浓度(mg/mL);V是样品溶液的体积(mL);N是稀释倍数;m是青头菌干粉的质量(g).
1.3.3 单因素实验
分别选取不同提取时间(20 min、30 min、40 min、50 min、60 min)、料液比(1∶20、1∶30、1∶40、1∶50、1∶60),乙醇体积分数(20%、30%、40%、50%、60%),进行单因素实验
1.3.4 正交实验设计
根据单因素实验结果,选择超声时间、料液比、乙醇体积分数三个水平进行正交实验,见表1.

表1 正交试验因素水平表
1.3.5 青头菌多酚抗氧化活性实验
(1)青头菌多酚对羟基自由基的清除
参考李晓强等人[10]的水杨酸法,取9 mmol/L的水杨酸和9 mmol/L的FeSO4各1mL于试管中,再加入2 mL样品和1 mL 9.8 mmol/L的H2O2进行显色反应,摇匀后于37℃水浴反应30 min,在510 nm波长下测定混合液的吸光值A1.用超纯水代替H2O2溶液测得对照吸光值A2.用乙醇溶液代替样品测吸光值A0.·OH清除率的计算公式如下:
清除率(%)=[1-(A1-A2)/A0]×100
式中:A1-加样之后所测的吸光度;
A2-纯水代替H2O2溶液所测的吸光度;
A0-乙醇溶液代替样品液所测的吸光度.
(2)青头菌多酚对DPPH自由基的清除
参考郭翎菲[11]的方法稍作调整,取2.0 mL DPPH溶液和2.0 mL不同浓度的多糖样品溶液于10 mL比色管中,摇匀放置30 min,在517 nm处测定其吸光度A0,按照同样的方法测定2.0 mL 80%乙醇溶液和不同浓度多糖样品溶液2.0 mL的吸光度A1,2.0 mL 80%乙醇溶液和2.0 mL DPPH溶液的吸光度A2.以维生素C为对照品,按下式计算DPPH清除率:
清除率(%)=[1-(A0-A1)/A2]×100
式中:A0-DPPH加多糖之后所测的吸光度;
A1-乙醇代替DPPH之后所测的吸光度;
A2-乙醇代替多糖溶液所测的吸光度.
(3)青头菌多酚对总还原能力的测定
参照张芳铭等人[12]的实验方法稍作修改,量取0.1mL且依次增加0.1mL的多酚稀释液于八支洁净的离心管中,再分别补水至总体积为1 mL,然后加入2.5 mL 0.2 mol/L磷酸缓冲溶液和2.5 mL 1%铁氰化钾溶液,摇匀后放入50℃恒温水浴锅反应20 min.取出加入2.5 mL 10%三氯乙酸溶液,然后以3 000 r/min转速离心5 min.取上清液2.5 mL,加入2.5 mL蒸馏水和0.5 mL的三氯化铁溶液,摇匀后静置10 min.以试剂空白为参比液,在700 nm波长处测定该溶液的吸光度为A.以吸光度值反映总还原能力,吸光度值越大说明还原能力越强.
2 结果与讨论
2.1 多酚标准曲线
以浓度为横坐标,吸光度为纵坐标做标准曲线,得回归方程为Y=0.08708X+0.0177,R2=0.9996,线性较好.
2.2 单因素实验
2.2.1 乙醇体积分数对青头菌多酚提取的影响结果
由图2可以看出,随乙醇体积分数增加,多酚得率先上升后下降.乙醇比例较高时,色素等脂溶性成分大量溶出,阻碍了多酚的溶出,且高浓度的乙醇更容易挥发,与张砚垒等人[13]探究乙醇体积分数对圆铃1号枣多酚的提取影响得出的结论大体一致.因此最佳的乙醇体积分数为30%.

图2 乙醇体积分数对青头菌多酚提取的影响
2.2.2 料液比对青头菌多酚提取的影响结果
由图3可以看出,当料液比增加时,多酚的提取率呈上升趋势,当料液比为1∶30时,多酚得率上升较明显,最后趋于平稳.可能是料液比较低时,青头菌中的多酚不能完全被提取出来,增加提取剂乙醇的用量,未被提取的多酚向提取剂乙醇中转移,溶剂与原料的比值越大,浓度梯度越大,有效成分的扩散速率也越大,与林锦铭等人[14]探究料液比对美藤果壳多酚的提取影响得出的结论一致.因此最佳料液比为1∶50.

图3 料液比对青头菌多酚提取的影响
2.2.3 超声时间对青头菌多酚提取的影响结果
由图4可以看出,在20 min~40 min间,青头菌多酚得率随时间的增加而升高,最大值为8.29 mg/g.延长时间,多酚得率先降低后又稍微升高,但均小于40 min的得率.多酚得率降低可能是由于提取时间过长,导致部分多酚被分解或过程中发生了氧化分解,与张砚垒等人[13]探究超声时间对圆1号枣多酚的提取影响得出的结论大体一致.因此最佳提取时间为40 min.
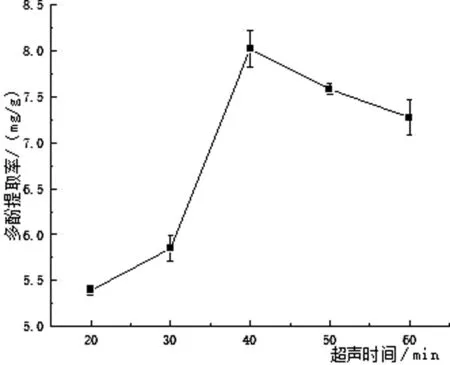
图4 超声时间对青头菌多酚提取的影响
2.3 正交实验设计结果
由表2中的数据可以得出,三个因素对青头菌多酚提取的影响大小为C(超声时间)>A(乙醇体积分数)>B(料液比).其中超声时间的影响最大,青头菌多酚提取的最好组合为A1B1C1,即青头菌多酚的最佳提取方案为乙醇体积分数30%,料液比1∶30,超声时间40 min.对此方案进行验证,称取1g青头菌粉末,按最佳组合A1B1C1重复三次实验,多酚提取率分别为9.76 mg/g、9.79 mg/g、9.82 mg/g,于正交实验结果相符合,因此最佳组合是合理的.

表2 正交实验设计结果
2.4 抗氧化活性实验
2.4.1 青头菌多酚对·OH的清除结果
由图5可知,青头菌多酚和Vc的质量浓度越大,对·OH的清除率越大,即清除能力越强.当质量浓度为80 μg/mL时,青头菌多酚和Vc对·OH的清除率分别为63.32%、96.32%.在胡新颖等人[7]的大麦多酚对·OH的清除能力的实验中,50 μg/mL的大麦多酚对·OH的清除率为18.78%,本实验中50 μg/mL的青头菌多酚对·OH的清除率可达47.32%.相比,青头菌多酚对·OH的清除率要高很多,说明青头菌多酚对·OH具有良好的清除效果.
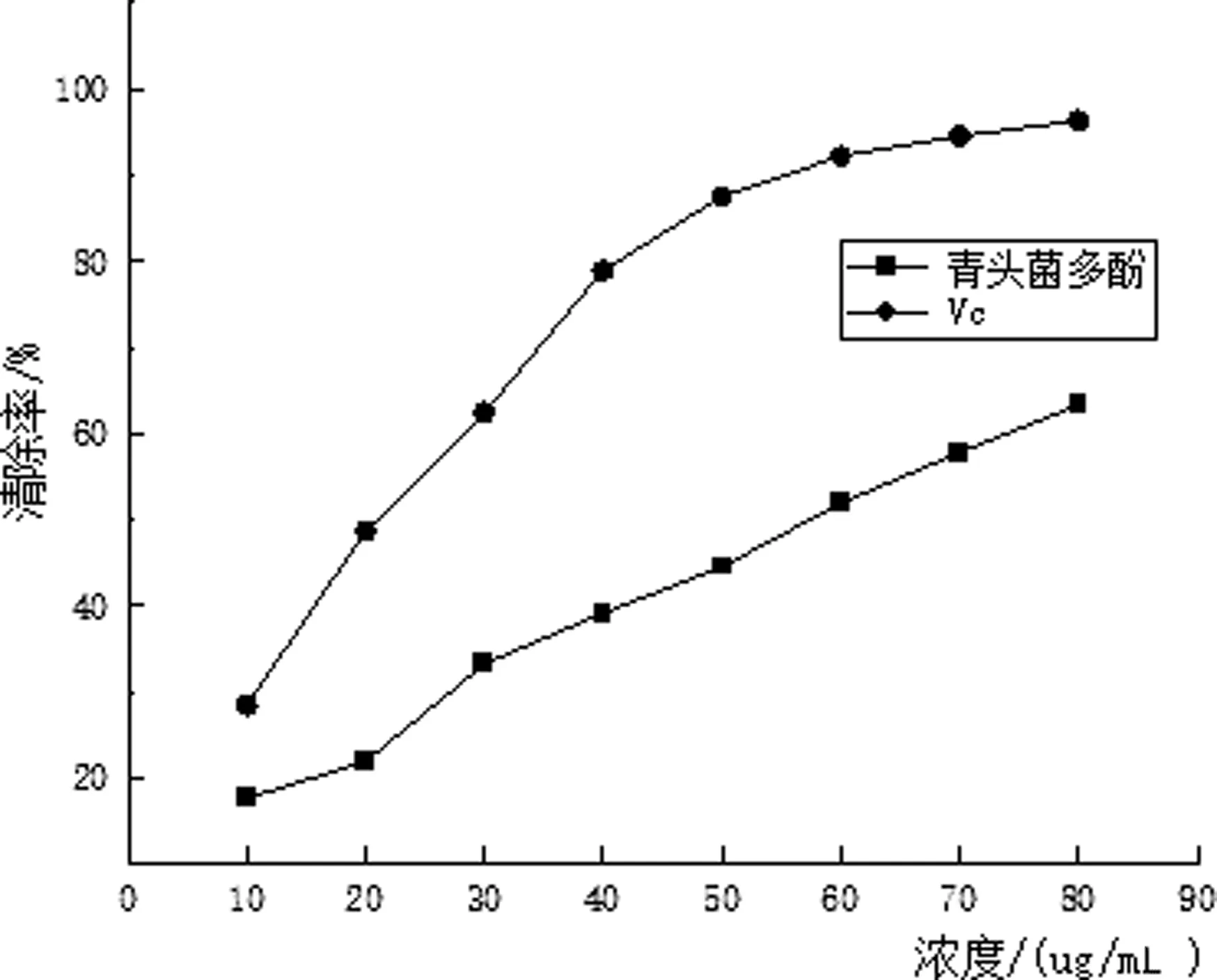
图5 羟基自由基清除率测定结果
2.4.2 青头菌多酚对DPPH自由基的清除率测定结果
由图6可知,青头菌多酚和Vc的质量浓度越大,对DPPH的清除率越大,即清除能力越强.当质量浓度为20.36 μg/mL时,青头菌多酚和Vc对DPPH自由基的清除率达到最大值,分别为61.11%、95.32%,Vc对DPPH自由基的清除率明显高于青头菌多酚对DPPH自由基的清除率.在汪群等人[15]的海带多酚对DPPH自由基的清除能力的实验中,2.0 mg/mL的海带游离多酚、结合多酚对DPPH自由基的清除率分别为41.72%、19.37%,本实验中的0.02 mg/mL的青头菌多酚对DPPH自由基的清除率为61.11%.相比较,青头菌多酚对DPPH自由基的清除率要高很多,说明青头菌多酚对DPPH自由基具有良好的清除效果.

图6 DPPH自由基清除率测定结果
2.4.3 青头菌多酚对总还原能力的测定结果
由图7可知,青头菌多酚溶液和Vc溶液的质量浓度增加,吸光度也增加,即青头菌多酚提取液和Vc溶液的总还原能力是增强的,青头菌多酚提取液的总还原能力略低于Vc溶液.
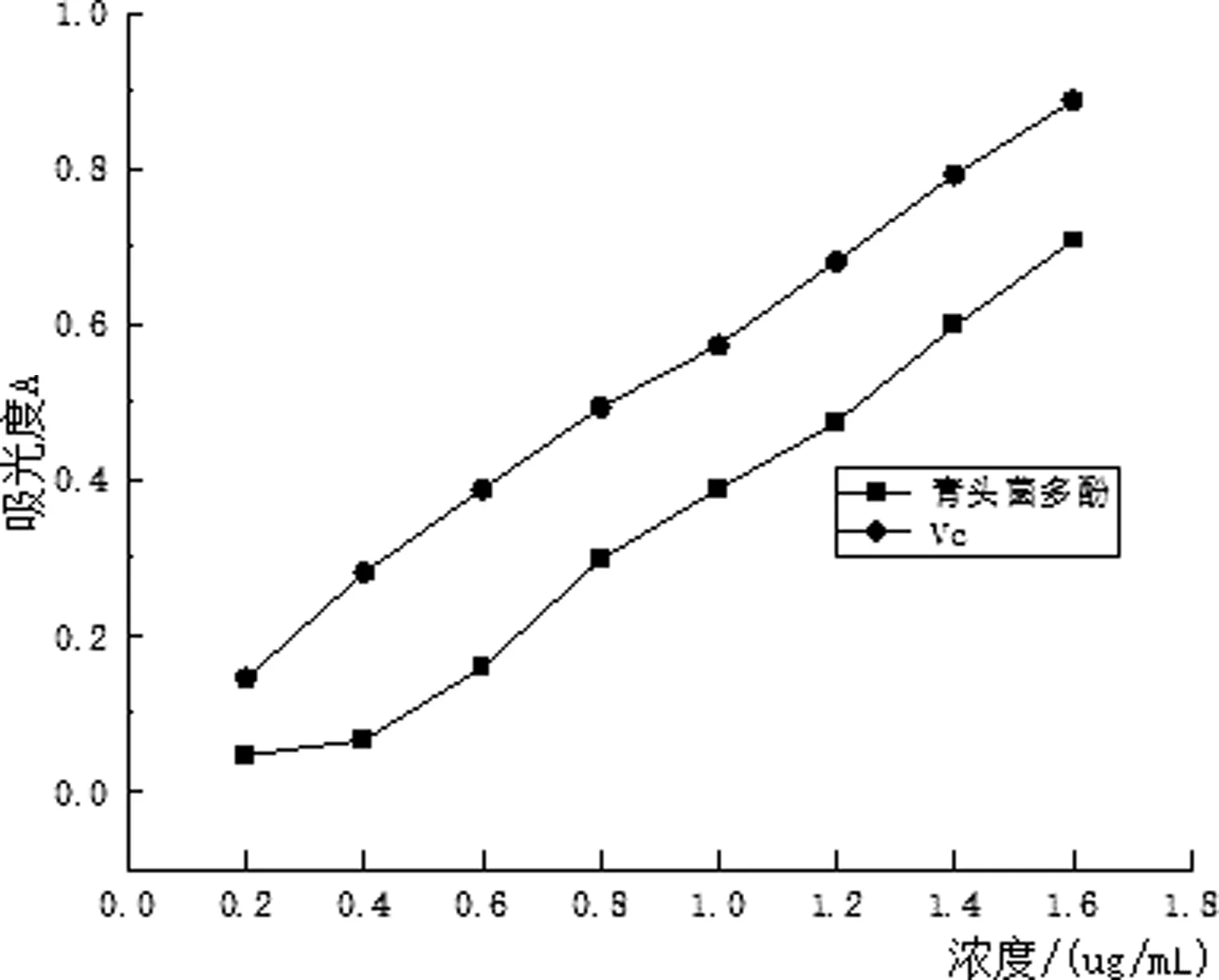
图7 总还原能力测定结果
3 结 论
本实验采用不同体积分数的乙醇提取青头菌多酚.通过单因素和正交实验优化提取方案,青头菌多酚的最佳的提取方案为:乙醇体积分数30%,料液比1∶30,超声时间40 min.在此方案下青头菌多酚的提取率为9.81mg/g.通过进行·OH和DPPH自由基的清除以及总还原能力的实验来研究青头菌多酚的抗氧化活性.抗氧化实验中,·OH和DPPH自由基的清除率与青头菌多酚的质量浓度的相关性较好,质量浓度增加,清除率增加.在总还原能力的实验中,青头菌多酚的总还原能力与青头菌多酚的质量浓度的相关性好,浓度增加,吸光度增加,还原能力增强.
