TRPV1、TRPV4在光生物调节中的作用机制研究进展
2023-12-09李美润刘海亮宋武琦
王 菲,李美润,刘海亮,宋武琦
(哈尔滨医科大学微生物学教研室,人体自身免疫病诊疗技术国家地方联合工程研究中心,黑龙江 哈尔滨 150081)
引言
瞬时受体电位通道(Transient Receptor Potential,TRP)家族是一种非选择性的阳离子通道,并且对各种物理及化学刺激高度敏感,包括磷酸化、机械力和渗透压[1]。光生物调节法(Photobiomodulation,PBM)也被称为低水平激光治疗(Low-level Laser Therapy,LLLT),与传统激光疗法相比,其优点是具有非侵入性,可以将光的能量密度降低到对机体不会产生任何损伤。低水平激光疗法已被证实有抗炎、促进细胞凋亡、伤口愈合与骨的再生等功效[2],但PBM的机制还不明确,它涉及的通路也并不完善。目前有研究表明,TRP家族中一些蛋白如TRPV可以在PBM过程中发挥作用,本文通过对TRPV1和TRPV4的功能和研究进展进行整理,初步分析TRPV在PBM中的作用机制。
1 TRPV蛋白结构及其功能
TRP最初是在果蝇的光感受器中发现的,并在哺乳动物中拥有六种亚型:TRPV、TRPM、TRPA、TRPC、TRPP和TRPML[3,4]。和所有TRP通道一样,TRPV有六个跨膜域组成四聚体离子通道,每个亚基具有一个影响阳离子特别是钙离子的孔环[5]。TRPV每个亚基的N-端和C-端位于细胞内。N-端包含6个锚蛋白重复序列以及一个钙调素(CaM)结合位点;C-端包含TRP盒和一个与稳定性和功能有关的CaM结合位点[6,7]。当受到刺激时,通道打开,允许离子进入到细胞内。TRPV1 (Transient Receptor Potential Vanilloid 1,TRPV1)离子通道自20世纪晚期被克隆以来,人们对该蛋白的结构和功能进行了广泛的研究[8]。因此,它是目前研究最深入的哺乳动物TRP通道。TRPV4于2000年被首次报道,是TRPV的一种亚型[9,10]。尽管TRPV4的研究只有数十年,但通过激动剂、阻断剂、敲除小鼠等手段,TRPV4的作用也不断被阐明[11,12]。TRPV的结构如图1所示。
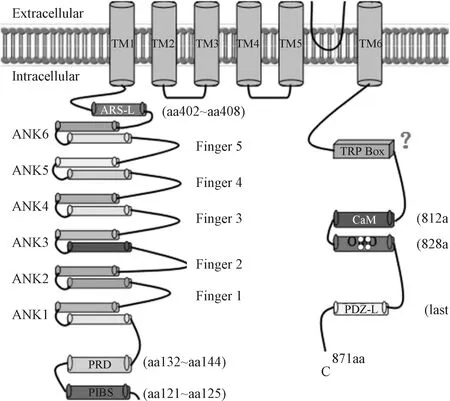
图1 TRPV的结构[13]Fig.1 Structure of TRPV
TRPV可被多种刺激因素激活,包括温度、渗透压、化学刺激[14-16]等。作为一种膜上的钙离子渗透性阳离子通道,TRPV1已被研究出多种激动剂与阻断剂,例如激动剂辣椒素、RTX和珠卡赛辛等;阻断剂辣椒平、A-425619和AMG8163等[17-20]。TRPV4目前已被研究出多种激动剂与阻断剂,例如激动剂4α-PDD、GSK-1016790A、5,6-EET;阻断剂钌红、辣椒平、GSK2193874等[21-25]。TRPV4也被证明具有抑制炎症、调节纤维化和血管生成等作用,作为多种疾病的治疗靶点[13,26-30]。
2 TRPV1、TRPV4的功能
TRPV1在关节组织内传导机械、疼痛和炎症信号方面发挥关键作用,通过药物或基因手段敲除TRPV1通道实际上可能会加重炎症症状[31]。由于TRPV1是配体门控的阳离子通道,TRPV1对Ca2+的亲和力大于Na+,而钙离子内流恰恰是凋亡的关键因素[32]。
TRPV4目前的研究主要是通过TGF-β通路和Ca2+信号参与各个组织器官发挥相应的功能。在心血管系统中,TRPV4通过整合TGF-β1和机械因子的信号,调节心肌成纤维细胞向肌成纤维细胞分化[33]。在内皮和血管平滑肌细胞中,TRPV4调节血流介导的血管的收缩和舒张、内皮的完整性和通透性以及血管修复与重塑[34,35]。TRPV4在神经元和神经胶质细胞中表达时,可调节神经系统的兴奋性、活力、伤害感受,参与神经细胞发生[36,37];在皮肤中,TRPV4通道被认为是外周瘙痒的重要介质并维持皮肤的稳态[38]。在肾血管中,TRPV4介导的细胞内钙离子内流并降低TGF-β1和细胞外蛋白的表达,更进一步激活AMPK/SIRT1通路在高血压肾纤维化中的作用[39]。
TRPV1、TRPV4在关节组织内传导机械、疼痛和炎症信号方面发挥关键作用,是调节关节疾病疗效的一个有吸引力的治疗靶点,也是呼吸系统疾病潜在的治疗靶点[40]。TRPV4可能是缓解胰腺炎疼痛的治疗干预的合适靶点[41]。
3 光生物调节中TRPV的功能
在果蝇等无脊椎动物的光传输过程中,光可通过改变蛋白质的构型来激活视紫红质蛋白,从而激活TRP通道。而视紫红质蛋白和TRP蛋白通过与PLC-β和PKC结合参与INAD支架蛋白的构成,并与肌动蛋白结合以调节光信号传导的速度和灵敏度[42]。在LLLT中,低能量激光作用于细胞的分子机制通常被认为是“光生物调节作用”或“光生物刺激作用”,通过加速DNA和RNA的合成来促进细胞增殖,具体原理包括改善细胞退行信号、调节激酶活性、调节细胞内阳离子浓度等分子生物学效应[43]。在细胞线粒体内,红光会把一氧化氮(Nitric Oxide,NO)从细胞色素C氧化酶(Cytochrome C Oxidase,CCO)释放出来,CCO的氧化还原反应会制造更多的能量分子三磷酸腺苷(ATP),产生更多的活性氧(Reactive Oxygen Species,ROS),从而激活NF-κB、HIF-1等DNA转录因子[43]。
研究表明,TRP通道也参与感知“氧化还原状态”[44]。最近的研究表明,瞬态受体电位(TRP)受体是一种可透过钙离子通道的阳离子通道,它参与了蓝色和绿色波长激光和635 nm二极管激光器对LLLI的光生物调节作用[45,46]。其中,405 nm UHF-USP蓝光激光的LLLI通过上调TRPV1的增殖和分化,促进了成骨细胞的细胞外钙化[47]。在类风湿关节炎中,630 nm LED照射促进了TRPV1表达诱导成纤维样滑膜细胞凋亡[48]。
在研究激光对肥大细胞的影响时,Yang等[49]发现530 nm激光可通过激活TRPV4通道提高细胞内Ca2+水平,从而促进组胺释放。TRPV4作为TRP通道超家族的亚家族成员,是细胞内外Na+和Ca2+等阳离子的非选择性离子通道,其中GPCR可通过激活PLC来继发激活TRPV4通道[50,51]。在探讨TRPV4在关节炎致病作用的研究中,相关报道表明TRPV4是关节炎症和疼痛的重要参与者,是关节疾病的理想治疗靶点[29,52,53]。TRPV4通道可参与介导炎症因子(如IL-1β和TNF-α)在滑膜成纤维细胞中的信号传导,其激活后可减少炎症状态下IL-1α诱导的IL-8的产生[26]。TRPV4通道在滑膜细胞中的表达和调控在维持关节健康中起重要作用。UVB辐射通过激活表皮TRPV4离子通道和触发内皮素-1信号传导而产生晒伤痛并影响皮肤[54]。630 nm LED光生物调节可能通过TRPV4/PI3K/AKT/mTOR信号通路抑制人滑膜细胞MH7A细胞的增殖[55]。光激活TRP通道作为PBM机制的证据目前较少,但正在缓慢增加。
4 结论
综上所述,TRPV通道在细胞和机体生理中发挥着重要的作用。TRPV1、TRPV4是钙离子渗透性的非选择性阳离子通道,并可以被一系列的不同刺激激活。在过去的十几年中,有越来越多的研究证据表明这种蛋白质在疾病中的作用。TRPV1、TRPV4的显著特征是其在全身的广泛分布及其与其他蛋白质相互作用的能力,这再次表明TRPV对生理功能具有广泛而多样的影响。
光生物调节的研究证据表明,TRPV1、TRPV4广泛地参与了PBM的作用过程,并且与不同波段的光疗作用均有联系,利用TRPV和PBM的作用机制,进一步研究离子通道在预防和治疗人类疾病中的作用。对于TRPV的研究,有望进一步阐明PBM的分子生物学机制,完善光调节生物过程的理论基础,为进一步设计、测试和开发光生物调节的治疗手段提供帮助。
