FNA-Tg、Tg对术前甲状腺乳头状癌淋巴结转移的诊断价值及相关性分析
2023-12-08林珍珍张钱磊李泽霖高海霞王维娜单美慧
杨 波, 林珍珍, 张钱磊, 李泽霖, 高海霞, 王维娜, 单美慧
(新疆医科大学附属肿瘤医院1病理科, 2乳腺甲状腺外科, 3新疆乳腺甲状腺肿瘤临床医学研究中心, 乌鲁木齐 830011)
甲状腺乳头状癌(papillary thyroid carcinoma,PTC) 患者的淋巴结转移与否,决定术中是否对其进行颈部淋巴结清扫,并可预测患者预后[1]。超声检查和细针穿刺细胞学(fine-needle aspiration cytology,FNAC)检查是评估淋巴结转移最重要的方法[2]。FNAC诊断高度特异,但对淋巴结转移性甲状腺癌诊断的敏感性仅为71%~87%[3-4]。甲状腺球蛋白(thyroglobulin,Tg)具有高度的组织特异性,并且几乎分化型甲状腺癌都会分泌Tg。1992年,Pacini等[3]最先提出对PTC患者可疑转移淋巴结的穿刺洗脱液甲状腺球蛋白(fine-needle aspiration cytology with needle-wash thyroglobulin,FNA-Tg) 进行检测,随后一些研究相继报道,其敏感度高于FNAC。目前指南推荐在对可疑淋巴结转移性甲状腺癌进行FNAC时,应联合FNA-Tg检测[5],但由于缺少标准检测方法,FNA-Tg检测的最佳诊断阈值差异很大[6-8]。本研究旨在探讨FNA-Tg、Tg对术前PTC淋巴结转移的辅助诊断价值,确定本中心FNA-Tg的最佳诊断阈值,为临床提供诊断和治疗依据。
1 材料和方法
1.1 研究对象收集2022年3月至2023年4月期间在新疆医科大学附属肿瘤医院就诊并经病理证实为PTC,且行颈部淋巴结清扫术的初治患者98例(经典型67例,滤泡亚型15例,高细胞亚型8例,弥漫硬化型5例,包裹型3例)共164个淋巴结。男性28例,女性70例,年龄26~67岁,平均年龄(41.58±9.42) 岁。本研究经医院伦理委员会批准(K-2021063)。
1.2 方法
1.2.1 FNAC检查 对超声检查可疑转移的淋巴结(钙化、液化、高回声团、血流信号增多丰富、淋巴结呈球形、淋巴门结构破坏)进行细针穿刺抽吸,尽量避免穿刺到血管。穿刺所用注射器规格是10 mL,连接0.8 mm 针头。首先对可疑转移淋巴结反复抽吸5 次,将抽吸物涂片1张,立即置于95% 乙醇溶液固定后进行HE染色;然后将注射器内穿刺物打入5 mL细胞保存液(碧迪医疗)中,进行薄层液基细胞学制片,巴氏染色;将保存液中剩余细胞制成细胞蜡块或涂片,进行免疫细胞化学Tg染色。最后将注射器内剩余穿刺物反复冲洗至生理盐水中,制成0.5 mL洗脱液,进行Tg检测。将穿刺的淋巴结在超声引导定位下用医用美蓝染料标记,所有行超声引导下穿刺的淋巴结均行手术切除,并进行组织病理学检查。
1.2.2 FNA-Tg、血清Tg和促甲状腺激素(TSH)检测 FNA洗脱液、血清Tg及TSH均采用全自动电化学发光法进行检测(Roche公司,型号:COBAS 602)。本实验室FNA-Tg和血清Tg最低检测浓度为0.04 ng/mL,最高检测浓度为500 ng/mL,如果检测值<0.04 ng/mL,按照0.04 ng/mL计算。如果检测值>500 ng/mL,稀释后重新检测,Tg的阈值会远低于最大值[8]。因此,不再重新检测,直接按照500+ ng/mL计算。血清Tg的正常值范围为3.5~77 ng/mL。血清TSH的正常值范围为0.270~4.200 μIU/mL。所有患者术前5 d内均测定血清Tg、TSH水平。
1.2.3 免疫细胞化学染色 将细胞蜡块或涂片进行Tg免疫细胞化学染色(Tg,即用型,中杉金桥),免疫细胞化学染色采用DAKO自动免疫组化机染色。
1.3 结果判定结果判定以组织病理学为金标准,根据淋巴结有无PTC转移,分为转移组和非转移组。细胞病理学判读分为2类:阳性(有PTC细胞转移)和阴性(未见明确PTC细胞转移或细胞量不足),涂片与液基制片有1张阳性,即判读细胞学为阳性。Tg阳性为细胞质见黄褐色颗粒且阳性细胞大于10%。细胞病理学和组织病理学结果均由工作10年以上的病理学医师进行判读。
1.4 统计学方法应用SPSS 26.0统计学软件对数据进行分析,计量资料呈非正态分布,选用中位数和四分位数进行描述,计数资料用频数描述。关联性分析采用Spearman相关性分析,以“PTC淋巴结是否转移”为因变量,单因素分析用卡方检验,多因素分析构建二元逻辑回归模型,探讨PTC淋巴结转移的影响因素。采用ROC分析,绘制ROC曲线后计算AUC,根据约登指数最高的临界点确定最佳诊断阈值,P<0.05为差异有统计学意义。
2 结果
2.1 PTC患者淋巴结特征164个淋巴结中转移性淋巴结103 个(Ⅵ区51 例,Ⅱ区29 例,Ⅲ区15 例,Ⅳ区8例),未转移61 个。转移组淋巴结FNA-Tg中位数是500+,非转移组FNA-Tg中位数是24.70,差异有统计学意义(P<0.001)。转移组中,血清Tg水平高于非转移组,差异有统计学意义(P<0.05)。转移组与非转移组血清TSH水平差异无统计学意义(P>0.05)(表1)。

表1 164个淋巴结临床特征
2.2 FNA-Tg、血清Tg、TSH对术前PTC淋巴结转移的诊断价值以PTC淋巴结是否转移(二分类)为因变量,FNA-Tg、血清Tg、TSH为自变量。共线性检验显示各指标方差膨胀系数均小于10,指标间不存在多重共线性,符合二元逻辑回归模型构建要求。结果显示,FNA-Tg是术前PTC淋巴结转移诊断的影响因素(χ2=34.202,P<0.001)、血清TSH是术前PTC淋巴结转移诊断的提示因素(χ2=2.810,P=0.094)。
2.3 FNA-Tg测量的最佳诊断阈值构建ROC曲线评估FNA-Tg检测术前淋巴结转移性PTC的最佳诊断阈值为98.605 ng/mL,AUC为0.866(95%CI:0.805~0.926),FNA-Tg、联合诊断的AUC、约登指数分别是0.866(95%CI:0.805~0.926)、0.714与0.947(95%CI:0.912~0.982)、0.834。见图1。

图1 FNAC、FNA-Tg、联合诊断ROC曲线图
2.4 FNAC、FNA-Tg及联合检测的诊断效能比较103个转移性淋巴结中FNAC正确诊断79个,假阴性24个,61个非转移性淋巴结全部正确诊断(图2)。FNAC诊断的敏感性、特异性、准确性分别是76.7%、100.0%、85.4%。FNA-Tg正确诊断140个,假阴性16个,假阳性8个。在FNAC误诊的24例中,14例囊性,FNA-Tg检测均提示有PTC转移(图3)。12 例FNAC与FNA-Tg联合检测均为假阴性,8例FNA-Tg假阳性。联合诊断的敏感性是88.3%,准确性是90.9%,敏感性和准确性均较单独检测高。AUC比较结果显示,联合检测AUC(0.834)>FNACAUC(0.767)>FNA-TgAUC(0.714)。以FNA-Tg>98.605 ng/mL为阳性诊断标准时,联合检测与组织病理学的一致性是0.909,约登指数是0.834,优于单一检测。但FNAC、FNA-Tg及联合检测,各诊断方法检测术前PTC患者淋巴结转移无统计学差异(P>0.05)。结果见表2及图1。
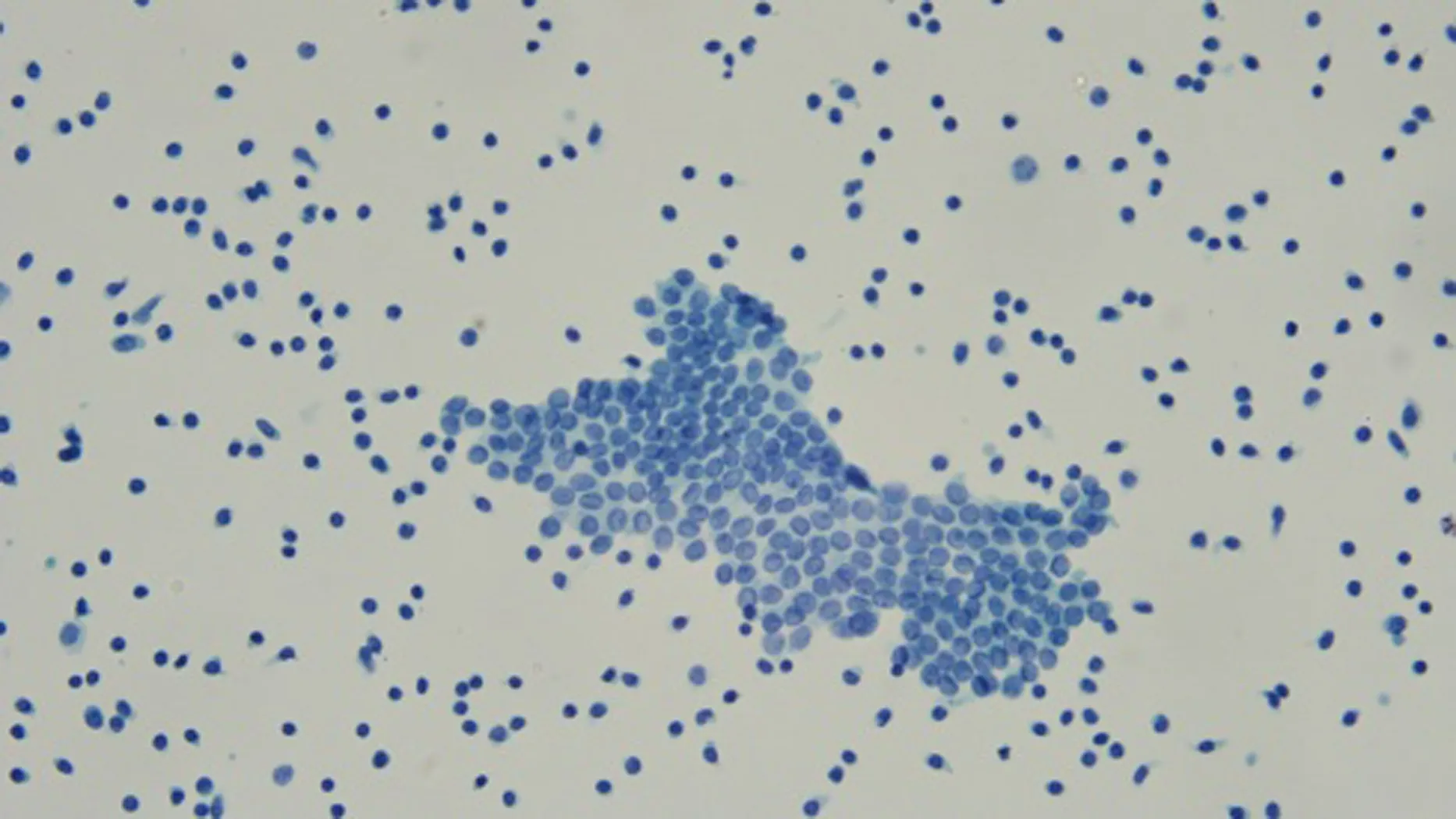
注: 淋巴结内有甲状腺乳头状癌转移

注: 淋巴结囊性变,可见组织细胞

表2 不同检测方法的诊断效能比较
2.5 Tg免疫细胞化学染色对组织学确定转移的33个淋巴结进行Tg免疫细胞化学染色,其中FNAC确定淋巴结转移27个,假阴性6个。33个淋巴结Tg均阳性(图4、5)。

注: 组织细胞中夹杂缺乏乳头状癌特征的肿瘤细胞

注: 肿瘤细胞Tg阳性,周围见组织细胞
2.6 血清Tg、TSH与FNA-Tg的关系采用Spearman相关分析对血清Tg、TSH 与FNA-Tg 之间的相关关系进行分析,结果显示,血清Tg与FNA-Tg 呈正相关(r=0.287,P<0.01);根据淋巴结是否有转移进行分组分析后发现,转移组中血清Tg与FNA-Tg 呈正相关(r=0.213,P<0.05);血清TSH与FNA-Tg的相关性不显著。
3 讨论
在PTC术前和术后监测随访中,FNA-Tg检测由于具有较高的敏感性和特异性,因此被认为是一种有效的检测方法。但是由于研究人群不同,检测方法各异,阈值设置不统一等,导致各研究结果存在明显差异。本研究对象均为初治PTC患者,避免了研究人群的差异性。
在一项关于PTC患者准确性诊断的Meta分析中,FNA-Tg的敏感性和特异性分别为86.2%和90.2%[9]。本研究以手术切除的组织病理学作为PTC患者淋巴结转移判定的金标准,单因素分析提示FNA-Tg在转移组中的水平高于非转移组(P<0.05);多因素二元逻辑回归分析显示,FNA-Tg是PTC患者淋巴结转移诊断的影响因素(P<0.001)。检测FNA-Tg可提高评估术前PTC患者淋巴结转移的准确性。
虽然已有较多关于FNA-Tg的研究,但其诊断阈值差异很大,范围为1~300 ng/mL[1,7,10-11],而且确定阈值的方法也不同。目前主要的观点是构建ROC曲线分析得出最佳诊断阈值,但不同研究者提出的阈值范围不同[12-14],可能与研究人群、“金标准”的定义、测定FNA-Tg的方法学等不同有关[5]。本研究中,生理盐水为洗脱液,量为0.5 mL时,通过构建ROC曲线分析得出PTC术前FNA-Tg的最佳诊断阈值是98.605 ng/mL。与Wang等[15]研究结果相似,但与其最佳诊断阈值147.5 ng/mL的结果存在差距,可能是由于洗脱液的剂量不同所致。提示FNATg需标准化的样本处理流程和阈值判断标准,以期能为诊断PTC颈部淋巴结转移提供更准确的信息。
在本研究中有24例FNAC是假阴性结果。其中14例为囊性淋巴结,穿刺细胞学检查镜下为组织细胞和淋巴细胞,但FNA-Tg结果提示阳性。淋巴结囊性变是超声诊断转移性分化型甲状腺癌的一个特征性表现。囊性转移的淋巴结在FNAC中的假阴性率较高,因此可以通过检测FNA-Tg降低假阴性率。联合检测有12例假阴性,其中3例仅累及淋巴结中央极少区域,5例在淋巴结边缘窦见少许癌细胞,可能是因为癌组织仅累及小部分淋巴结,穿刺未抽吸到肿瘤细胞所致;4例淋巴结最大直径≤3 mm,可能是由于淋巴结体积太小,未穿刺到淋巴结所致。8例FNA-Tg是假阳性结果,可能是基质效应导致正常淋巴结中Tg水平升高。研究结果表明,联合检测与组织病理学的一致性、AUC均优于单一检测,这与Xu等[16]研究结果一致。联合检测提高了FNAC对淋巴结转移的诊断效能,有利于临床更好地确定手术方案,也可避免因复发导致的再手术并发症风险和再手术费用。
FNAC诊断特异性较高,但有时穿刺的肿瘤细胞只具有部分PTC细胞核的特征,或淋巴结囊性变,形态类似组织细胞时,导致诊断不确定而易误诊。Tg免疫细胞化学染色对PTC具有高度特异性。本研究中33个淋巴结Tg均阳性,其中包括6个FNAC诊断的假阴性。本研究结果提示,在细胞学特征不明显的病例中,Tg增加了FNAC诊断的敏感性和特异性。但只有在肿瘤细胞数量足够时,才适用于Tg免疫细胞化学染色。
近年来,更多研究开始关注血清Tg、TSH是否会影响FNA-Tg。有些研究中,血清Tg水平被作为诊断阈值[17]。然而,对患者血清Tg和FNA-Tg的取样如果不在同一时间,而是间隔一段时间取样,血清Tg可能会出现激素诱导的变化,从而可能会造成数据偏差。此时使用血清Tg水平作为检测阈值或许并不可靠。在本研究中,从血清Tg、TSH取样到FNAC的时间间隔为0~5 d。Blažekovic等[18]报道血清Tg与FNA-Tg呈正相关,Duval等[19]的研究结果显示,血清Tg、TSH与FNA-Tg无相关性。本研究根据Spearman相关分析表明,总病例、转移组、非转移组患者术前血清Tg、TSH分别与FNA-Tg呈弱相关,与Sun等[20]的研究结果类似。
本研究存在一定的局限性,样本量较小,今后将扩大样本量,进一步研究PTC术后患者的诊断阈值,并将术前与术后进行比较研究,探讨FNA-Tg检测是否可用于评估131I治疗效果的研究。
