产细菌素乳酸菌的筛选及其益生性能评价
2023-12-08张乐丁一珍潘媛娜李科耿燕周娟许泓瑜李恒许正宏史劲松
张乐,丁一珍,潘媛娜,李科,耿燕,周娟,许泓瑜,李恒*,许正宏,史劲松
1(江南大学 生命科学与健康工程学院,江苏 无锡,214112) 2(粮食发酵与食品生物制造国家工程研究中心,江苏 无锡,214112)
乳酸菌(lactic acid bacteria, LAB)是一类公认的重要肠道益生菌,具有维持胃肠道菌群平衡、促进消化吸收、增强免疫功能、降低胆固醇等多方面生理功能[1]。乳酸菌肠道益生作用的发挥,与其代谢产生的多种有益代谢物密不可分[2]。部分乳酸菌在代谢过程中所产生的细菌素,又称抗菌肽,是一种生物活性多肽,能在靶细菌细胞膜上形成通道或直接抑制某些细胞功能而发挥高效抑菌或杀菌作用,在肠道健康中受到广泛关注[3]。
研究表明,产细菌素的乳酸菌可通过抑制病原微生物生长、竞争排斥或竞争黏附等方式促进自身及其他益生菌在肠道内的定植[4-5],从而调节紊乱的肠道菌群结构,稳定肠内微生态系统。NAIMI等[6]在模拟猪近端结肠的体外发酵模型上证明了细菌素MccJ25对纽波特沙门氏菌的抑制活性,并在肠道炎症小鼠模型[7]中发现给予MccJ25可减少肠道病原体定植,保护宿主免受肠毒性大肠杆菌的感染。一些乳酸菌产生的细菌素结合了抗菌特性和宿主导向活性[8],通过免疫调节或者诱导宿主肠道抗菌肽的表达[9],进一步促进病原体的排除,如加氏乳杆菌产生的环状细菌素加氏菌素A调节肠上皮细胞的液体吸收和分泌能力,促进了导致早期断奶仔猪腹泻的微生物的消除[10]。此外,产细菌素乳酸菌还具有缓解慢性感染、炎症性肠病和肥胖等疾病的能力,如从母乳中分离的产细菌素干酪乳酸菌可与肠道病原体竞争,减少结直肠腺癌细胞系和胆固醇水平,并改善小鼠模型中的炎症性肠病[11];植物乳杆菌NCMIB8826产生的植物乳杆菌素EF能有效改善在饮食诱导的肥胖小鼠模型中显示出有益的作用[12]。因此,进一步挖掘具有高效抑菌作用的产细菌素乳酸菌,并分析评价其肠道益生活性,对推进乳酸菌通过调节肠道微生态干预或治疗疾病等应用具有重要的作用。
本研究以大肠杆菌(Escherichiacoli)ATCC 25922为指示菌,通过有机酸和过氧化氢排除试验、蛋白酶敏感试验,筛选得到一株抑菌能力较强、产细菌素的哈尔滨乳杆菌(Lactobacillusharbinensis)P1-1,并对其益生性能进行评价,同时通过共培养的方式评价其与特定微生物之间的相互作用,为进一步丰富对产细菌素乳酸菌的了解和拓展应用提供参考。
1 材料与方法
1.1 材料与设备
1.1.1 实验材料
指示菌株E.coliNissle1917、L.plantarumCGMCC No.18389、E.coliATCC 25922、StaphylococcussepidermidisATCC 12228均保藏于本实验室。
蛋白胨、酵母粉,OXOID公司;牛肉膏、葡萄糖、CH3COONa、柠檬酸氢二铵、K2HPO4·3H2O、MgSO4·7H2O、MnSO4·4H2O、胰蛋白胨、NaCl、蔗糖、胆盐、吐温80、酵母膏、鱼粉蛋白胨、大豆蛋白胨、琼脂粉、琼脂糖、无水乙醇、卡那霉素、胃蛋白酶、胰蛋白酶、过氧化氢酶,国药集团化学试剂有限公司。
1.1.2 培养基
MRS培养基(g/L):牛肉膏10.0,酵母粉5.0,蛋白胨10.0,葡萄糖20.0,CH3COONa 5.0,柠檬酸氢二铵2.0,K2HPO4·3H2O 2.0,MnSO4·4H2O 0.05,MgSO4·7H2O 0.2,吐温80 1.0。115 ℃,灭菌20 min后备用。
LB培养基(g/L):蛋白胨10.0, 酵母粉5.0, NaCl 10.0,121 ℃,灭菌150 min后备用。
1.1.3 溶液配制
人工胃液:取0.1 mol/L HCl用蒸馏水调节pH值至2.0,加入胃蛋白酶0.01 g/mL,溶解均匀后微孔滤膜除菌备用。
人工肠液:取KH2PO42.04 g,加蒸馏水150 mL溶解,用4 g/L NaOH调节pH值至6.8,加入胰蛋白酶0.01 g/mL,溶解均匀后微孔滤膜除菌备用。
1.1.4 仪器与设备
小型低温离心机,德国Eppendorf公司;酶标仪,Molecular Devices公司;PCR仪、实时荧光定量PCR仪,BIO-RAD公司;超净工作台,苏州安泰空气技术有限公司;电热鼓风干燥箱,上海实验仪器厂有限公司;高压蒸汽灭菌锅,美国AUTOCLAVE Engineers公司。
1.2 实验方法
1.2.1 抑菌活性评价
采用牛津杯法进行抑菌活性评价实验。抑菌乳酸菌的筛选以E.coliATCC 25922为指示菌。取100 μL 稀释至107CFU/mL的指示菌培养液于提前准备好的LB平板上,涂布均匀后晾干,用无菌镊子夹取灭菌后的牛津杯于平板上。供试乳酸菌在37 ℃静置培养24 h后,测定发酵液OD600值,并将发酵液分别于4 500 r/min离心10 min,取200 μL上清液加入牛津杯中,之后在指示菌最适生长温度37 ℃下培养24 h,测定各乳酸菌抑菌圈直径,计算抑菌圈直径与OD600比值,以单位菌体对应的抑菌圈大小作为抑菌效果评价依据。选定乳酸菌的抑菌活性以E.coliATCC 25922和S.epidermidisATCC 12228为指示菌株再次评价,目标菌株于37 ℃培养箱中静置培养,取4、8、12、16、20、24 h的发酵上清液进行评价。
1.2.2 产细菌素乳酸菌的筛选与确定
1.2.2.1 乳酸菌的筛选与鉴定
分别取酸乳和酵素样本10 g加至90 mL生理盐水中,振荡使之充分混匀,梯度稀释后取10-5、10-6、10-7菌液分别均匀涂布于MRS平板中,置于厌氧培养箱中37 ℃恒温培养,24 h后通过菌落形态初步鉴定,从中挑选出符合菌种特征的菌株进行划线分离,挑选单菌落在液体MRS培养基中进行纯化培养,培养24 h取样进行菌种鉴定。
1.2.2.2 排除有机酸的干扰
测定各供试乳酸菌发酵液上清的pH,用2 mol/L NaOH溶液调节pH值至5.0,之后进行抑菌实验。以利用1 mol/L乳酸、乙酸调节成相同pH且未接种的MRS培养基作为空白对照。
1.2.2.3 排除过氧化氢的干扰
将过氧化氢酶加入到各供试乳酸菌发酵上清液中,使过氧化氢酶的终质量浓度为1 mg/mL。以不使用过氧化氢酶处理的各供试菌发酵上清液为空白对照,评价处理后发酵上清液抑菌活性的变化。
1.2.2.4 蛋白类抑菌物质的确定
用1 mol/L HCl调节各供试乳酸菌发酵上清液至胃蛋白酶最适作用pH 2.0,加入胃蛋白酶使其终质量浓度为1 mg/mL,37 ℃水浴2 h后煮沸灭酶,之后将pH值调节到5.0并加入终质量浓度为1 mg/mL的过氧化氢酶进行抑菌活性测定。
1.2.3 16S rDNA序列同源性分析
用细菌基因组提取试剂盒提取筛选得到的乳酸菌总DNA,以菌株基因组为模板,通过PCR扩增16S rDNA基因片段。上游引物27F:5′-AGAGTTTGATCMTGGCTCAG-3′;下游引物1492R:5′-GGTTACCTTGTTACGACTT-3′。PCR扩增体系与条件包括:反应体系30 μL,DNA模板2 μL,上游引物1 μL,下游引物1 μL,2×Phanta Max Master Mix (Dye Plus) 15 μL,ddH2O 11 μL。PCR扩增程序:95 ℃预变性10 min,95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸60 s,循环34次,72 ℃延伸5 min,4 ℃保存。凝胶电泳检验合格后送生工生物工程(上海)股份有限公司进行测序。将测序结果拼接后在NCBI中数据库利用BLAST进行同源性比对,选取序列一致性在98%以上的部分序列进行比对并构建系统发育树。
1.2.4 乳酸菌益生性能评价
1.2.4.1 胃肠液耐受性评价
将筛选所得菌株的24 h发酵液按体积比1∶10接种至人工胃液中,37 ℃恒温静置培养,分别在0、1、2、3 h取样,对人工胃液中的活菌进行稀释和涂布计数;将接入人工胃液中作用3 h的悬浊液进一步以体积比1∶10加至人工肠液中,分别在4、5、6、7 h取样计数获得活菌数,存活率的计算如公式(1)所示,公式(1)评价了菌株对模拟胃肠液的耐受能力。
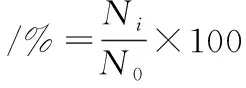
(1)
式中:Ni为不同时间对应的活菌数;N0为初始活菌数。
1.2.4.2 胆盐耐受性评价
向MRS培养基中分别添加0.3、0.6、0.9、1.2 g/L的胆盐,灭菌备用。将筛选所得菌株分别接种到上述培养基中,以MRS培养基为对照,37 ℃静置培养24 h,取样进行活菌计数,并按照公式(1)求出其存活率。
1.2.5 共培养体系构建及RT-qPCR检测
以筛选所得菌株为研究对象,分别选择2株益生菌E.coliNissle 1917和L.plantarumCGMCC No.18389,以及2株条件致病菌E.coliATCC 25922和S.epidermidisATCC 12228作为共培养菌株,并按最优接种比(10∶3)接种,于37 ℃培养箱中静置培养。以筛选菌株、E.coliNissle 1917、L.plantarumCGMCC No.18389、E.coliATCC 25922和S.epidermidisATCC 12228 5株菌的纯培养体系为对照,在0、4、8、12、16、20、24 h分别进行取样,测量OD600值、pH值及抑菌活性。
采用RT-qPCR对共培养时体系中的不同微生物拷贝数进行测定。提取共培养发酵液的总RNA作为模板,以表1所示序列作为引物。RT-qPCR反应体系扩增体系及条件为:反应体系25 μL,DNA模板1 μL,上游引物1 μL,下游引物1 μL,SYBR Green Master Mix 12 μL,ddH2O 10 μL。RT-qPCR扩增程序:95 ℃预变性3 min,95 ℃变性10 s,54 ℃退火10 s,72 ℃延伸10 s,循环40次,65 ℃梯度升温至95 ℃,4 ℃保存。

表1 引物序列Table 1 Primer sequence
1.2.6 数据分析
所有实验均重复3次,实验结果以平均值±标准偏差来表示,使用Graphpad Prism软件绘图与分析,使用MEGA-X软件构建系统发育树。
2 结果与分析
2.1 产细菌素菌株的筛选
细菌素是益生菌发挥抑菌作用的重要代谢产物,可以通过抑制致病菌,促进有益菌的定殖来调节肠道菌群从而发挥肠道益生功能[13]。益生性乳酸菌通过代谢产生有机酸、细菌素、过氧化氢等多种物质发挥抑菌作用和调节肠道生态[14]。其中,以细菌素作为抑菌物在复杂肠道菌群调节中具有更高的稳定性[15]。本研究根据菌落形态特征进行初步鉴定,从酸乳和酵素样本中共筛选到20株稳定生长的微生物。经16S rDNA序列同源比对,鉴定得到乳杆菌属15株(L.paracaseiJN-1、L.paracaseiJN-2、L.paracaseiJN-3、L.brevisJN-6、L.fermentumJN-7、L.fermentumJN-8、L.fermentumJN-9、L.fermentumJN-10、L.harbinensisP1-1、L.helveticusP1-2、L.brucelliP1-3、L.plantarumP1-7、L.plantarumP1-8、L.plantarumP1-9、L.plantarumP1-10),片球菌属2株(PediococcuspentosaceusJN-4、P.lactisJN-5),肠球菌属2株(EnterococcusfaecalisP1-4、E.faeciumP1-5),链球菌属1株(StreptococcusthermophilusP1-6)。为筛选高产细菌素的野生型乳酸菌,进一步以E.coliATCC 25922作为指示菌,对这20株乳酸菌进行进一步筛选,通过排除有机酸干扰试验、过氧化氢酶试验、蛋白酶敏感试验,评估并获得具有较强抑菌活性的产细菌素乳酸菌。首先,通过未排除酸与过氧化氢干扰的抑菌结果分析,E.faeciumP1-4、L.paracaseiJN-1、L.paracaseiJN-2和L.harbinensisP1-1单位菌体密度的抑菌活性较高,抑菌圈直径与OD600的比值超过6,S.thermophilusP1-6和L.plantarumP1-7的比值<3,抑菌活性较低(图1-a)。为排除有机酸对抑菌活性的干扰,统一调节发酵上清液pH值为5.0再测试乳酸菌抑菌性能。如图1-b所示,大部分乳酸菌的抑菌活性均有所下降,但仍保留有较强的抑菌活性,其中L.brucellaP1-3、L.harbinensisP1-1和L.plantarumP1-10单位菌体密度的抑菌活性>4,表明这些乳酸菌发酵液中除有机酸外还有其他物质发挥抑菌作用。进一步排除过氧化氢干扰。如图1-c所示,经过氧化氢酶处理后,大部分乳酸菌抑菌活性几乎没有下降,说明过氧化氢在其发酵上清中占比较低,对整体抑菌活性的贡献不高。由于乳酸菌产生的细菌素易被蛋白酶分解,故最后利用蛋白酶处理验证乳酸菌产细菌素的能力,结果如图1-d所示。部分乳酸菌对大肠杆菌的抑菌活性显著下降,甚至趋于丧失。其中,抑菌能力下降最为显著的是L.harbinensisP1-1,其抑菌圈直径/OD600值仅为1.18,远小于其他菌株,说明其发酵上清液中的抑菌物质主要为细菌素。因而选定筛得的L.harbinensisP1-1作为研究对象详细开展评价。
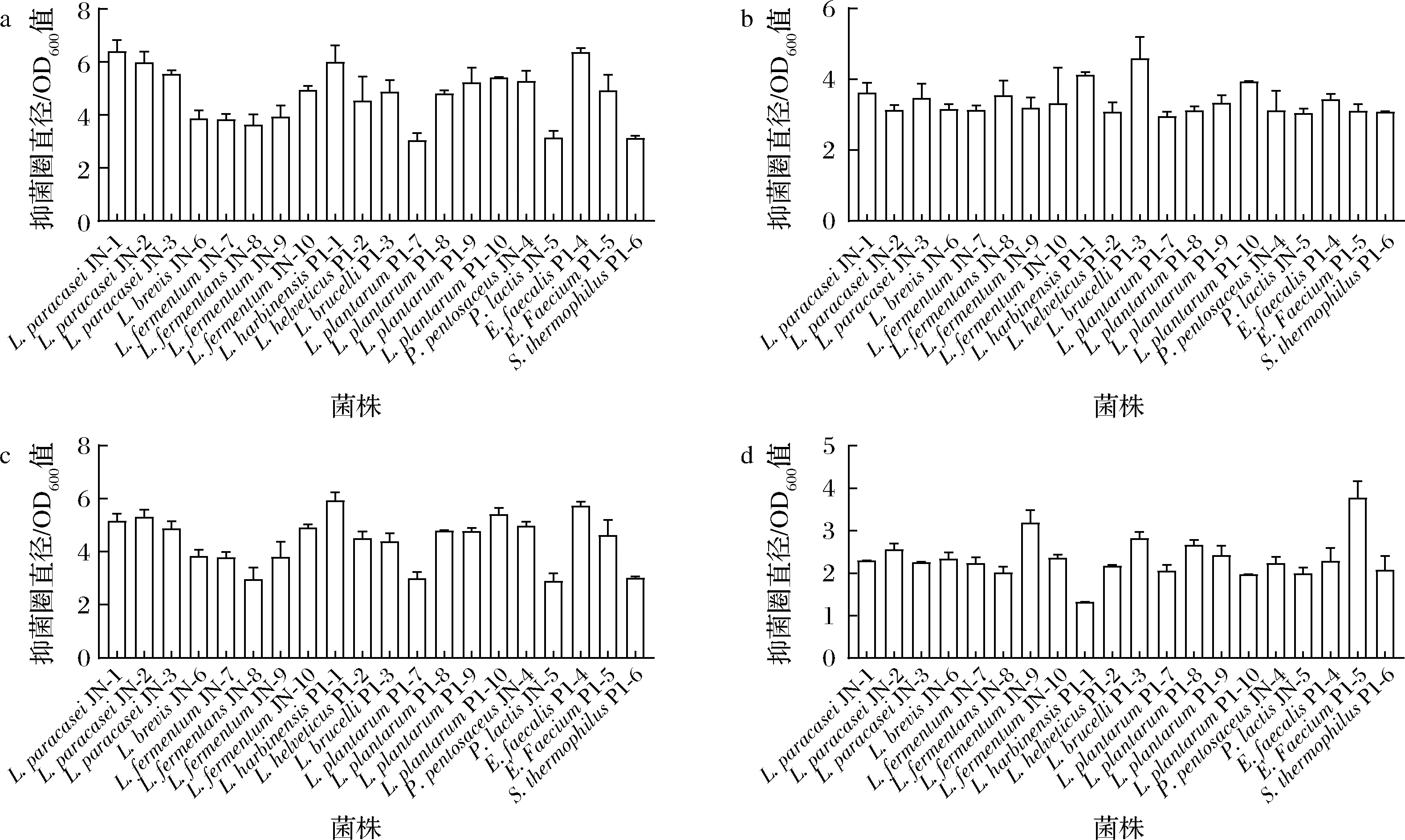
a-未排除干扰实验;b-排除有机酸干扰实验;c-排除过氧化氢干扰实验;d-蛋白酶敏感实验图1 二十株乳酸菌的抑菌活性Fig.1 Antibacterial activity of 20 lactic acid bacteria
2.2 菌株L.harbinensis P1-1的同源分析及益生性能评价
通过16S rDNA基因序列测定及同源性比对分析,选取序列一致性在98%以上的部分序列构建系统发育树。如图2所示,L.harbinensisP1-1与L.harbinensisM1亲缘关系最为接近,该菌是从天然发酵豆腐乳清中分离得到的一株益生性乳酸菌,能够抑制单增李斯特菌、鼠伤寒沙门氏菌等的生长,具有胃肠液耐受和胆盐耐受等益生特性[16]。
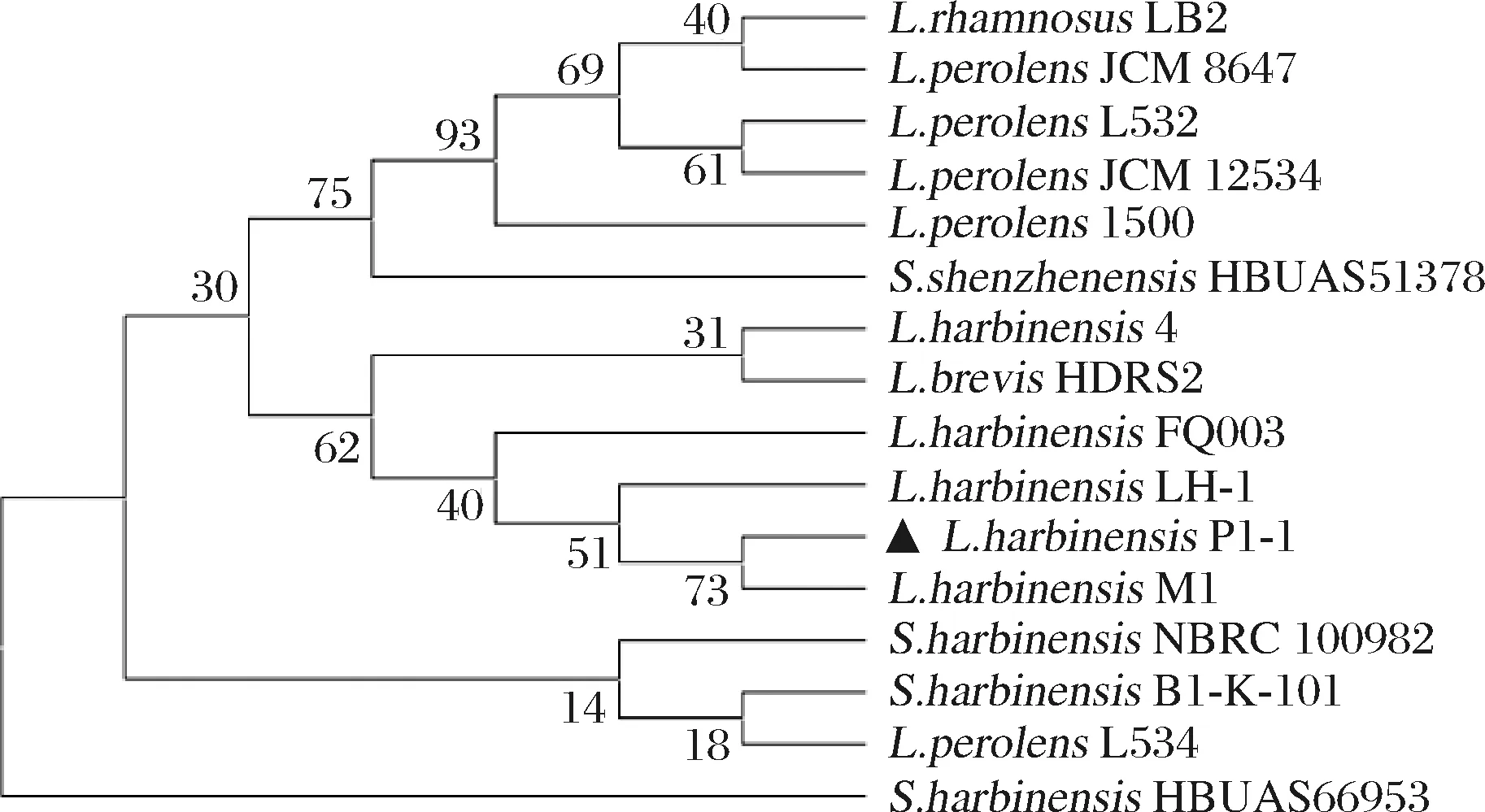
图2 L.harbinensis P1-1的16 s rDNA系统发育树Fig.2 Phylogenetic tree based on 16S rDNA sequence of L.harbinensis P1-1
乳酸菌作为一种益生菌,对胃肠液及胆盐的耐受性是菌株在宿主体内存活、生长并发挥肠道益生功能的前提[17]。采用模拟胃肠液及胆盐环境评价L.harbinensisP1-1的消化液耐受性。如图3和表2所示,L.harbinensisP1-1在人工胃液中3 h仍具有90%以上的存活率;在人工肠液中4 h,存活率仍接近90%。在不同浓度胆盐的培养基中,L.harbinensisP1-1均能良好生长,在0.3 g/L的胆盐中存活率为72.4%,在1.2 g/L的胆盐中存活率仍达到56.2%,表明L.harbinensisP1-1具有优良的消化道环境耐受性和适应性,与文献报道的L.harbinensisXC-3耐受结果相近[18]。

图3 人工胃肠液的耐受性Fig.3 Tolerance of artificial gastrointestinal fluid
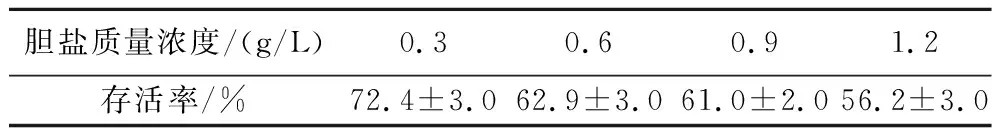
表2 胆盐耐受性Table 2 Bile salt tolerance
进一步评价所获菌株L.harbinensisP1-1的抑菌活性。分别以革兰氏阳性菌E.coliATCC 25922和革兰氏阴性菌S.epidermidisATCC 12228为指示菌,评价结果如图4所示。以E.coliATCC 25922为指示菌时,L.harbinensisP1-1抑菌活性随培养时间延长而逐渐增强,24 h时抑菌圈直径达到约23 mm,远大于文献报道中的L.harbinensisB22[19]和L.harbinensisM1[16],与文献报道的其他乳杆菌的抑菌能力相当,如L.salivarius1[20]、L.rhamnosusyoba 2012[21]和E.mundtiiCECT972T[22]。以S.epidermidisATCC 12228为指示菌时,L.harbinensisP1-1抑菌活性随时间变化趋势与E.coliATCC 25922相似,但抑菌活性略低,24 h 抑菌圈直径为21 mm。目前,对于L.harbinensis产细菌素能力及抑菌活性的研究并不多,且已报道的L.harbinensis的抑菌能力均不显著,如从母羊奶酪中分离的一株L.harbinensis对E.coli、Klebsiellapneumoniae、Pseudomonasaeruginosa等不同指示菌的抑菌圈直径仅约4 mm[23];从四川泡菜样品中分离得到的L.harbinensisB22对E.coli、Listeriainnocua、Listeriainnocua等不同指示菌的抑菌圈直径约13 mm[19]。比较分析可知,L.harbinensisP1-1具有显著且稳定的抑菌能力。

a-目标菌株在不同时间段对S.epidermidis ATCC 12228和 E.coli ATCC 25922的抑菌直径;b-以E.coli ATCC 25922 为指示菌平板图;c-以S.epidermidis ATCC 12228为指示菌平板图图4 L.harbinensis P1-1的抑菌活性评价Fig.4 Evaluation of antibacterial activity of L.harbinensis P1-1
2.3 L.harbinensis P1-1对共培养微生物的影响
益生菌在维护肠道健康时,往往表现为同时促进其他益生菌的增殖并抑制病原菌的生长[24-25]。为进一步了解L.harbinensisP1-1的益生特性,将L.harbinensisP1-1分别与2株益生菌及2株条件致病菌共培养,考查体系pH、菌体密度以及各微生物的生长变化情况。其中,L.plantarumCGMCC No.18389是实验前期从酸菜中筛选得到的一株益生菌[26],E.coliNissle 1917是公认的益生菌,E.coliATCC 25922和S.epidermidisATCC 12228是标准菌株。
共培养对总酸产量的影响如图5-a所示,L.harbinensisP1-1与益生菌L.plantarumCGMCC No.18389协同产酸,使得共培养体系在不同时间点的pH均低于L.harbinensisP1-1纯培养体系,且pH下降速率更快;而E.coliNissle 1917、E.coliATCC 25922和S.epidermidisATCC 12228均削弱了L.harbinensisP1-1的产酸能力,表现为共培养体系在发酵过程中的pH均高于L.harbinensisP1-1纯培养。
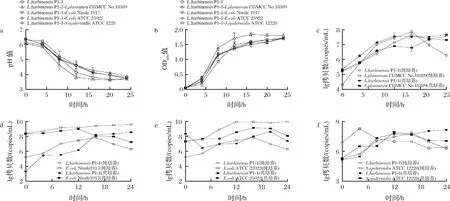
a-pH值;b-OD600值;c-与L.plantarum CGMCC No.18389共培养体系;d-与E.coli Nissle 1917共培养体系; e-与E.coli ATCC 25922共培养体系;f-与S.epidermidis ATCC 12228共培养体系图5 L.harbinensis P1-1共培养体系pH值、OD600值和生物量的变化Fig.5 Changes of pH, OD600, and biomass in L.harbinensis P1-1 co-culture system
共培养对菌体密度的影响如图5-b所示,各体系菌体生长速率大致相同,均在4 h左右进入对数生长期,15 h到达稳定期,OD600值达到1.6左右。0~8 h,共培养体系的OD600值均高于L.harbinensisP1-1纯培养,其中以L.harbinensisP1-1与L.plantarumCGMCC No.18389共培养体系菌体生长速率最快,OD600值在8 h 时就达到了1.6;8 h后,L.harbinensisP1-1与L.plantarumCGMCC No.18389共培养体系持续稳定增殖,其他体系种间竞争抑制趋于明显,菌体密度增长缓慢,且体系间无显著差异。
进一步分析共培养体系中各微生物的生物量变化。整体比较L.harbinensisP1-1与这4株菌共培养过程中菌体生长的变化趋势发现(图5-c~图5-f),发酵初期,共培养体系中微生物生物量变化较为复杂,但在发酵中后期,尤其是共培养16 h后,菌体生长趋势相对明朗,L.harbinensisP1-1的益生特性更为明显,且自身生长增殖情况比纯培养时更稳定。具体分析来看,L.harbinensisP1-1完全不抑制L.plantarumCGMCC No.18389的生长,L.plantarumCGMCC No.18389在24 h的生物量约为7.2 copies/mL,与L.plantarumCGMCC No.18389纯培养体系生物量相当;对E.coliNissle 1917的生物量无显著影响,其生物量与纯培养相当,在12 h后才略呈下降趋势,E.coliNissle 1917的存活率高于95%;显著抑制了致病菌E.coliATCC 25922和S.epidermidisATCC 12228的生长,共培养8 h后两株菌的存活率均低于90%,E.coliATCC 25922的生物量显著低于纯培养,存活率下降了15.9%。共培养对抑菌活性的影响如表3所示,与L.harbinensisP1-1纯培养时比较,当L.harbinensisP1-1与2株益生菌共培养时,抑菌圈直径均大于26 mm,抑菌活性增强了约20%;与2株条件致病菌共培养在一定程度上促进了L.harbinensisP1-1的抑菌活性,推测原因可能是共培养条件进一步诱导了L.harbinensisP1-1细菌素的产生,已报道文献中,WU等[27]的研究也发现L.plantarumRUB1与ListeriamonocytogenesATCC 19111和StaphylococcusaureusATCC 6538共培养时可增强抑菌活性和细菌素相关基因的表达。

表3 L.harbinensis P1-1对共培养菌株的抑制情况及 不同体系的抑菌活性Table 3 Inhibition of L.harbinensis P1-1 on co-cultured strains and antibacterial activity of different systems
3 结论
本研究从发酵食品中分离筛选得到20株乳酸菌,通过排除有机酸、过氧化氢等的干扰以及蛋白酶敏感试验,获得了一株抑菌能力较强的产细菌素哈尔滨乳杆菌L.harbinensisP1-1。益生活性评价表明,L.harbinensisP1-1具有良好的胃肠液及胆盐耐受性能,在人工胃液中的存活率高达91.1%,在人工肠液中的存活率超过70%,在1.2 g/L的胆盐中存活率高达56.2%。分别以E.coliATCC 25922和S.epidermidisATCC 12228为指示菌,L.harbinensisP1-1抑菌活性均随培养时间延长而逐渐增强,培养24 h后对E.coliATCC 25922的抑菌圈直径达到23 mm,对S.epidermidisATCC 12228的抑菌活性略低。共培养结果表明,L.harbinensisP1-1与益生菌L.plantarumCGMCC No.18389互利共生,二者生长及增殖更为稳定,共培养发酵液pH下降加快,且抑菌效果增强,抑菌圈直径提高了约20%;与E.coliNissle 1917共培养时,其生物量约为7 copies/mL,与纯培养相比相差不大,共培养发酵液抑菌圈直径增加到25 mm左右;L.harbinensisP1-1可显著抑制E.coliATCC 25922和S.epidermidisATCC 12228的生长,2株条件致病菌的存活率均低于90%,L.harbinensisP1-1的抑菌活性同时增强,推测条件致病菌促进了L.harbinensisP1-1细菌素的产生。综上所述,L.harbinensisP1-1是一株抑菌能力较强的产细菌素乳酸菌,且具有良好的肠道益生能力,在食品、医药等行业中具有较高的应用价值。
