木质纤维素丁酸预处理及其高效合成丁醇的调控
2023-12-05周泰然侍永江桂铮王诗洁曹瑾时号罗洪镇
周泰然,侍永江,桂铮,王诗洁,曹瑾,时号,2,罗洪镇,2*
(1. 淮阴工学院生命科学与食品工程学院,淮安 223003;2. 江苏省生物质转化与过程集成工程实验室,淮安 223003)
由于化石能源日益枯竭和温室气体的过量排放,人类面临着资源短缺和全球变暖等问题[1]。利用可再生的农林废弃物生产液态燃料是解决上述问题的有效方法。丁醇是一种高效的液态燃料,其能量密度和燃烧性能突出[2]。丁醇的生产方法包括化学法和发酵法。发酵法是通过微生物将底物转化为丁醇等产物,简称为丁醇发酵。传统丁醇发酵的原料主要是玉米,该模式存在成本高、与人争粮等问题。因此,利用廉价的玉米秸秆、水稻秸秆等木质纤维素资源作为原料,是降低生物丁醇生产成本的有效方案[3-4]。
木质纤维素是一种非均质聚合物,主要由纤维素、半纤维素和木质素构成,是地球上储量最丰富的生物炼制原料[5-7]。然而,木质纤维素固有的抗降解特性导致难以对其直接利用,建立可用于生物质拆分并高效制取可发酵糖的预处理工艺,是目前该领域需要解决的关键问题[8]。近年来,研究人员建立了化学法、生物法和物理法等多种预处理方法[9-10]。这些预处理可有效攻克木质纤维素的抗降解屏障,显著提高纤维素组分占比,有利于可发酵糖生产。在上述预处理方法中,酸预处理是一种高效拆解各组分的工艺[11]。传统的酸预处理一般使用无机酸作为预处理剂,这些试剂对设备腐蚀性强且各组分易过度降解成酚类、糠醛类等副产物,对微生物发酵不利[12]。有机酸具有反应温和、不易腐蚀设备等特点,是生物质预处理剂的重要选择。丁酸是丁醇发酵的代谢中间产物和丁醇合成前体物质,利用其进行木质纤维素预处理,可以避免外源预处理剂对发酵的影响。研究表明,在丁醇发酵过程中,添加丁酸可以有效提高丁醇产量[13-14]。然而,木质纤维素在丁酸预处理中的酶解底物用于丁醇合成的研究鲜见报道。
基于此,笔者以典型农林废弃物玉米秸秆为研究对象,选用丁酸溶液预处理玉米秸秆,确定最优预处理条件并分析其酶解性能;将秸秆酶解液和残余丁酸作为补料碳源,通过丁醇发酵动力学特征确定最优过程调控策略,实现农林废弃物高效转化生物燃料的目标。
1 材料与方法
1.1 试验材料
玉米秸秆购自江苏省连云港市,搅碎后置于烘箱中60 ℃烘至质量恒定,过40目筛(粒径约0.4 mm);纤维素酶Cellic CTec2购自诺维信(中国)生物技术有限公司;其他试剂均购自国药集团化学试剂有限公司。
1.2 微生物与培养基
丙酮丁醇梭菌(ClostridiumacetobutylicumATCC 824),本实验室保藏。
种子培养基(CGM培养基):KH2PO40.75 g/L、K2HPO40.75 g/L、NaCl 1.00 g/L、MnSO4·5H2O 0.017 g/L、MgSO4·7H2O 0.70 g/L、FeSO4·7H2O 0.01 g/L、L-天冬酰胺2.00 g/L、酵母抽提物5.00 g/L、(NH4)2SO42.00 g/L和葡萄糖30.00 g/L,pH自然。
发酵培养基共2种:第1种发酵培养基与CGM培养基配方一致;第2种发酵培养基在CGM培养基的配料基础上,将葡萄糖质量浓度改为20.00 g/L。
1.3 试验方法
1.3.1 丁酸预处理
在250 mL高压反应釜中加入10 g玉米秸秆,与100 mL不同质量浓度(50,100,150和200 g/L)丁酸溶液混合,在不同温度(160,180和200 ℃)下反应0.5 h,结束后用自来水将体系降至室温,抽滤分离收集固体组分和上清液组分,用蒸馏水将固体组分冲洗至pH 7.0,置于烘箱60 ℃烘干12 h。烘至质量恒定的样品用于化学组分分析。
1.3.2 菌种活化及丁醇发酵
将保藏于孢子管的丙酮丁醇梭菌孢子悬浮液以10%接种量转入装有50 mL CGM的100 mL厌氧瓶中,使用真空泵将厌氧瓶内抽至真空,保证种子培养的厌氧环境。将厌氧瓶沸水浴2 min,随后置于0 ℃冷激2 min,最后置于水浴锅中37 ℃静态培养24 h,即活化种子液。
将上述活化种子液以10%接种量接入装有50 mL发酵培养基的100 mL厌氧瓶中,置于37 ℃水浴锅中静置培养72 h,定时取样分析细胞代谢及产物合成情况。
1.3.3 用于流加的葡萄糖和预处理残余丁酸
用作补料碳源的酶解液:由玉米秸秆酶解液添加营养物质组成,其中营养物质为无葡萄糖的CGM。
进行实验设计是开展科学探究的重要组成部分,实验设计是围绕所提出的问题进行实验方案设计的思维过程,有助于培养学生的探究能力和科学思维,促进其学科核心素养的养成。实验设计的关键在于变量的确定及控制。在生物学教学中,学生常因为不能正确地分析变量,所以难以设计出比较完整的实验方案,进而影响其实验设计能力的发展。因此加强变量分析教学,帮助学生掌握实验设计的各种变量及其控制方法,是提高学生实验设计能力发展的有效途径。
玉米秸秆酶解液制备方法:丁酸预处理后的固体残渣与pH 4.8、50 mmol/L柠檬酸钠缓冲液以固液比1∶5(g∶mL)混合,以5~10 FPU/g底物添加纤维素酶Cellic CTec2,置于50 ℃下150 r/min酶解反应72 h,即得到富含葡萄糖的玉米秸秆酶解液。
预处理残余丁酸:将预处理后的残余丁酸上清液进行脱毒操作,即添加5%(质量分数)活性炭后置于60 ℃下150 r/min摇床中脱毒12 h,随后经过抽滤收集脱毒后的丁酸溶液。
1.3.4 丁醇发酵的间歇流加策略
流加秸秆酶解液的调控策略:初始葡萄糖质量浓度为20.00 g/L,发酵12 h后流加秸秆酶解液,共3个批次。批次a为未流加秸秆酶解液;批次b为发酵12 h后,一次性向发酵液中流加秸秆酶解液,使得葡萄糖总质量浓度为30 g/L;批次c为发酵12 h后一次性向发酵液中流加秸秆酶解液,使得葡萄糖总质量浓度为40 g/L。上述批次72 h发酵结束。
流加丁酸和秸秆酶解液的调控策略:初始葡萄糖质量浓度为20.00 g/L,共3个批次。批次d为培养12 h后,一次性流加秸秆酶解液使得葡萄糖总质量浓度为30.00 g/L,丁酸流加时间为12~24 h,每12 h流加1 g/L丁酸,共流加2 g/L;批次e为培养12 h后,一次性流加秸秆酶解液使得葡萄糖总质量浓度为30.00 g/L,丁酸流加时间为12~36 h,每8 h流加0.5 g/L丁酸,共计2 g/L;批次f为培养12 h后,一次性流加秸秆酶解液使得葡萄糖总质量浓度为40.00 g/L,丁酸流加时间为12~36 h,每8 h流加0.5 g/L丁酸,共计流加2 g/L。上述批次72 h发酵结束。
1.4 分析方法
纤维素、半纤维素和木质素含量参照美国国家可再生能源实验室NREL/TP-510-42618方法进行测定[15]。
采用GC1290型气相色谱仪系统(GC,上海舜宇恒平科学仪器有限公司)分析预处理后液体组分中的丁酸及发酵过程中代谢产物丙酮、丁醇、乙醇和丁酸的浓度,以异丁醇为内标,用0.3 mol/L HCl酸化后进行气相色谱分析;检测器为氢火焰离子化检测器(FID),色谱柱为FFAP毛细管柱(长×内径×填料粒径为30 m × 0.32 mm × 0.5 μm,大连中汇达科学仪器有限公司)。丁醇发酵中总溶剂产量是丙酮、丁醇和乙醇的产量之和。各实验组均设定3个平行批次,实验结果以平均值±标准偏差展示在图表中。
2 结果与分析
2.1 丁酸预处理对玉米秸秆组分的影响
有机酸(如甲酸、乙酸等)已被用于木质纤维素预处理过程[11]。相较于其他有机酸,丁酸可以避免外源预处理剂对丁醇发酵的影响。选用不同浓度的丁酸分别预处理玉米秸秆,预处理后的原料组分变化结果如表1所示。

表1 丁酸预处理后玉米秸秆的化学组分变化Table 1 The chemical composition of the corn stover solid residue after butyric acid (BA) pretreatments
未经预处理的玉米秸秆葡聚糖含量为30.70%、木聚糖含量为21.17%,经过预处理后的葡聚糖含量均大幅提升,同时木聚糖组分也有不同程度的脱除,结果表明丁酸预处理对玉米秸秆组分的解聚效果比较显著。利用50 g/L丁酸预处理时,在180 ℃条件下反应0.5 h后的残渣葡聚糖含量达47.25%,固体质量回收率为57.52%,同时葡聚糖回收率达到了88.53%,且该批次的木聚糖脱除率为82.88%。利用高于100 g/L丁酸进行预处理时,原料的固体回收率和葡聚糖含量维持在49.03%~58.82% 和44.89%~49.66%。虽然上述预处理条件可以保证与50 g/L丁酸预处理的化学组分相似,但是高浓度丁酸存在腐蚀性高、成本高等缺点,且高浓度丁酸会增加后续处理难度。因此,综合不同预处理条件下的固体组成及葡聚糖回收率结果,确定50 g/L丁酸、180 ℃条件下维持0.5 h作为玉米秸秆最优预处理工艺,并以此为基础探究其酶解液用于丁醇发酵的效果。
2.2 流加玉米秸秆酶解液对丁醇发酵的影响
经过丁酸预处理后的玉米秸秆需要经过酶解来获得丁醇发酵所需的葡萄糖,分析了不同纤维素酶添加量对预处理后秸秆的酶解效果(固液比均为1∶5),结果如图1所示。酶解72 h后,在5 FPU/g纤维素酶添加量下,葡萄糖质量浓度为53.3 g/L;当将纤维素酶添加量提高至10 FPU/g时,葡萄糖质量浓度达到70.8 g/L。为减少后续补料对发酵体积的影响,故选择10 FPU/g条件下的酶解液进行丁醇发酵。本研究在预实验中将其作为碳源直接替换CGM中的葡萄糖,丙酮丁醇梭菌未生长且几乎没有溶剂合成。这主要是由于秸秆预处理后的预处理液和酶解液中仍含有多种发酵抑制物。为降低抑制组分对丁醇发酵的毒性,选择在细胞对数生长期以间歇流加的方式补充碳源,避免菌种生长初期接触酶解液组分中的抑制物,提高产溶剂梭菌对玉米秸秆酶解液的利用率。

图1 不同纤维素酶添加量对丁酸预处理玉米秸秆酶解的影响Fig. 1 Effects of cellulase dosage on enzymatic hydrolysis of cornstover after butyric acid pretreatment
批次a的发酵动力学曲线如图2A所示,培养基中的初始葡萄糖在36 h即被全部消耗,此时发酵液中含有2.00 g/L丁酸和4.15 g/L丁醇。发酵72 h时,发酵液中含有0.36 g/L丁酸和4.89 g/L丁醇。丁醇和总溶剂产量分别比36 h时的产量提升了17.83%和15.30%,这说明丁酸可以被丙酮丁醇梭菌吸收并用于产物合成。批次b的发酵动力学曲线如图2B所示,在发酵12 h后,向发酵液中一次性流加秸秆酶解液使得葡萄糖总质量浓度为30.00 g/L,该批次进行至60 h时葡萄糖消耗殆尽。发酵终了的丁醇和总溶剂产量分别为7.05和9.99 g/L,比批次a分别提升了44.17%和36.66%,这表明流加的酶解液可作为碳源用于产物合成。进一步提升秸秆酶解液流加量至葡萄糖总体系为40.00 g/L(批次c),其发酵动力学曲线如图2C所示。葡萄糖在12 h时降至8.80 g/L,补料的葡萄糖至发酵60 h被完全消耗,葡萄糖消耗曲线趋势与批次b一致。批次c产生了9.34 g/L丁醇和13.31 g/L总溶剂,这表明流加碳源被丙酮丁醇梭菌转化为4.45 g/L丁醇和6.00 g/L总溶剂。

A) 批次a;B) 批次b;C) 批次c;D) 批次a~c的丁醇/丙酮质量比和溶剂生产效率。
2.3 玉米秸秆酶解液/残余丁酸协同流加策略提高丁醇发酵性能
为构建绿色高效的生物丁醇转化工艺,Luo等[14,16]已经验证了在丁醇发酵过程中添加丁酸或预处理残余丁酸可以提高丁醇产量。同时,本研究表明适量补料秸秆酶解液能够有效提高丁醇产量。利用50 g/L丁酸预处理玉米秸秆后得到的液体组分中仍含有49.40 g/L丁酸,该预处理残余丁酸和秸秆酶解液协同流加对丁醇发酵的影响还不清楚。因此,进一步探究秸秆酶解液/残余丁酸协同流加策略对丁醇发酵的影响,结果如图3所示。批次d(图3A)协同流加玉米秸秆酶解液和残余丁酸后,丙酮丁醇梭菌生长代谢仍正常进行,葡萄糖于48 h时完全消耗;丁酸于12 h浓度达到最大值,随着丁酸的间歇流加和菌种生理代谢的影响,其浓度上下波动。发酵72 h后的丁醇和总溶剂质量浓度分别达到 8.15 和11.15 g/L,分别比批次b提升了15.60%和 11.61%,这表明秸秆酶解液/残余丁酸协同流加策略对丁醇高效合成的可行性。批次d最终丁酸为2.03 g/L,这可能是流加丁酸质量浓度较高,对发酵环境造成冲击影响了丙酮丁醇梭菌代谢所致[17]。随后优化了丁酸流加量及流加次数,分4次流加2 g/L残余丁酸,发酵动力学如图3B所示。批次e发酵72 h后的丁酸质量浓度为0.87 g/L,丁醇和总溶剂产量分别为8.39和11.86 g/L。这表明大部分丁酸在发酵产溶剂过程中被重吸收,并有效提高了丁醇和溶剂产量。此外,将玉米秸秆酶解液补料量至葡萄糖总质量浓度为40 g/L,并通过4次流加2 g/L丁酸,发酵动力学结果如图3C所示(批次f)。该批次发酵72 h后的丁醇和总溶剂产量为10.58和14.85 g/L,丁酸质量浓度为0.85 g/L。相比于批次c,丁醇产量提升13.28%。这表明在高浓度葡萄糖补料情况下,丁酸仍能有效提升溶剂产量。
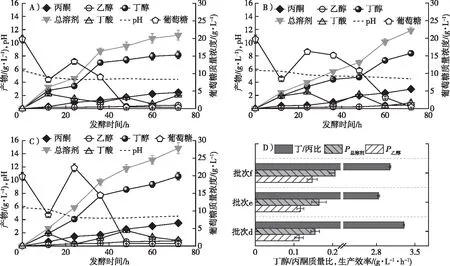
A) 批次d;B) 批次e;C) 批次f;D) 批次d~f的丁醇/丙酮质量比和溶剂生产效率。
对上述批次的丁醇发酵综合性能进行比较(图3D),批次d的丁醇和总溶剂生产效率分别为0.113和0.155 g/(L·h),丁醇/丙酮质量比达到3.3∶1.0。研究表明,丁醇占总产物的比例越大,越利于降低后续产物的分离纯化成本;当丁醇质量浓度从12 g/L提高至20 g/L时,溶剂的分离纯化成本将降低50%[18]。虽然批次e有更高的溶剂产量,但对比批次d的丁醇/丙酮质量比降低了16.2%。这是因为丁酸单次流加量较大对丁醇发酵菌代谢生长产生影响,从而降低了丙酮产量。当葡萄糖体系为40.00 g/L时,批次f的丁醇和总溶剂生产效率分别提升至0.147和0.206 g/(L·h),比批次c分别提升了13.08%和11.35%。由此可知,通过间歇补料方式可以高效利用木质纤维素衍生葡萄糖及预处理残余丁酸合成丁醇,该工艺不仅解决了传统酸预处理剂环境污染大、腐蚀性高的问题,还为生物炼制过程的优化调控提供技术支撑。
2.4 不同底物补料策略强化丁醇合成的代谢机理
预处理后含丁酸的液体组分通过补料方式可以提高丁醇合成能力,同时秸秆酶解液也可作为发酵碳源用于丁醇合成。从丙酮丁醇梭菌代谢通路(图4)可知,在丁醇发酵过程中添加的丁酸可以进入胞内,通过丁酸环的再吸收能力将其转化为丁酰辅酶A,随后在辅因子还原型辅酶I(NADH)作用下合成终产物丁醇(图4A)。相较于单一的丁酸补料条件,在丁醇发酵过程中同时流加丁酸和葡萄糖,丙酮丁醇梭菌可以将葡萄糖通过糖酵解途径转化为溶剂合成前体乙酰辅酶A,并产生辅因子和能量物质腺嘌呤核苷三磷酸(ATP),保证了细胞正常代谢;添加的丁酸则通过丁酸环的再吸收作用还原转化为丁醇(图4B),进而实现丁醇发酵性能的提升。

A)残余丁酸补料;B)残余丁酸和酶解液协同补料。
此外,改善生物炼制过程的经济性能是该领域未来需要关注的重要问题之一[19]。本研究利用的丁酸是化学合成丁酸,仍然存在成本较高的缺点,如何降低该工艺的预处理成本是未来需要进一步解决的问题。由于丁酸可以通过生物质衍生的可发酵糖发酵制备,目前丁酸发酵的产量可以达到50~90 g/L,这为生物质预处理提供了可靠的技术基础[20]。因此,未来可以尝试将丁酸发酵与生物质预处理相结合,进而实现低成本的木质纤维素预处理和生物燃料的高效生产。
3 结 论
本研究首先分析了丁酸作为有机酸预处理玉米秸秆的效果,同时利用丙酮丁醇梭菌作为丁醇发酵菌株,探究了预处理残余丁酸和秸秆酶解液作为共底物进行丁醇生产的可行性,具体结论如下:
1)50 g/L丁酸、180 ℃反应0.5 h条件下玉米秸秆的预处理效果最优。
2)当利用玉米秸秆酶解产生的葡萄糖作为补料碳源时,丁醇产量从4.89 g/L提高到9.34 g/L。将玉米秸秆酶解液和残余丁酸作为共底物补料时,发酵结束的丁醇产量和生产效率分别达到10.58 g/L和0.147 g/(L·h),比无补料批次提高了116%。
3)该工艺既可以将木质纤维素转化的葡萄糖用于丁醇合成,还能够将预处理残余丁酸高效转化,实现了木质纤维素高效转化生物丁醇的目标,为廉价生物质原料精炼提供借鉴。
