新麦草细胞分裂素调控基因CKX4克隆及表达分析
2023-12-04任晓敏石凤翎
任晓敏, 云 岚,2*, 李 珍, 艾 芊, 赵 乔, 石凤翎
(1.内蒙古农业大学草原与资源环境学院, 内蒙古 呼和浩特 010018; 2.草地资源教育部重点实验室,内蒙古 呼和浩特 010011; 3.中国科学院深圳先进技术研究院, 广东 深圳 518055)
细胞分裂素(Cytokinin,CK)是植物生长发育及环境应答的重要调节因子,通过信号转导的分子机制发挥作用[1]。细胞分裂素氧化酶/脱氢酶(Cytokinin oxidase/dehydrogenase,CKX)通过断裂细胞分裂素N6位置上的不饱和异戊烯类侧链,生成腺嘌呤和不饱和醛,降解细胞分裂素,进而对植物的生长发育起到调控作用。大部分CKX的N端和C端分别有黄素腺嘌呤二核苷酸(Flavin adenine dinucleotide,FAD)-binding保守结构域和cytokinine-binding保守结构域,保持其基因成员之间功能的相似性[2-3]。CKX4是CKX基因家族成员之一,和植物籽实产量等调控相关[4]。水稻(OryzasativaL.)中的OsCKX4基因主要在根部和叶片中表达,该基因在ATG翻译启动子区域内有七个细胞分裂素应答元件和一个生长素应答元件[5],在水稻中参与生长素及细胞分裂素的信号通路来调控根冠的发育,根特异性表达CKX4可以提高水稻的锌含量和籽实产量[6-7]。小麦(TriticumaestivumL.)中的TaCKX4基因在各个器官中均有表达,对一些性状如分蘖数、籽粒数、籽粒产量和穗数有很强的调节作用[8-9]。
新麦草[Psathyrostachysjuncea(Fisch.) Nevski]为禾本科(Poaceae)小麦族多年生禾草[10],是新麦草属唯一具有饲用价值的物种[11],该种原产于中亚和西伯利亚,在我国主要分布在新疆和内蒙古等地,具有抗寒、抗旱、耐牧、返青早、耐盐碱等优良特性,并在北方寒旱区生态治理方面发挥着重要作用[10-12]。近年来,随着生态修复工程对优质高产草种的需求不断增加,改良产量性状成为当下草育种需要解决的关键问题。
新麦草是下繁型禾草,分蘖数量是影响此类禾草饲草和种子产量的关键因素之一。前期研究发现并筛选到CKX4等与新麦草分蘖相关的候选基因[13]。在新麦草中,CKX4基因功能研究还很不充分,未见CKX4基因克隆、蛋白亚细胞定位及表达鉴定分析的报道。因此,本研究以新麦草分蘖节为材料,克隆CKX4基因,并利用生物信息学分析新麦草及其近缘物种之间的亲缘关系,预测新麦草CKX4基因编码蛋白二级结构、三级结构及功能位点等,通过定量实时PCR(qRT-PCR)对CKX4基因在不同分蘖类型种质中的相对表达量进行验证,利用烟草瞬时转染法和蛋白质印迹法(Western blot)分析CKX4定位及表达情况,为深入了解CKX4基因在多年生禾草生长发育中的作用机制及新麦草CKX4基因功能进一步验证提供参考和理论依据。
1 材料与方法
1.1 试验材料
本研究选取内蒙古呼和浩特市内蒙古农业大学牧草资源圃的30株疏蘖型(ST)和30株密蘖型(DT)的新麦草为材料,提取分蘖节组织总RNA,疏蘖型和密蘖型新麦草的总RNA分别重复3次,共6个样品,由北京百迈克生物科技有限公司进行无参转录组测序,并以相同株数的多分蘖和少分蘖新麦草不同组织为材料提取总RNA,进行qRT-PCR验证,以1个月龄的烟草为材料进行瞬时转染。试验所用过表达载体为p1300-cYFP、转化菌株为感受态DH5α、农杆菌菌株为GV3101感受态、利福平(Rif)和卡那霉素(Kan),均由中国科学院深圳先进技术研究院合成所实验室保存。
1.2 试验方法
1.2.1总RNA提取和cDNA合成 用Primer Premier 5.0软件设计引物(表1),按照总RNA提取试剂盒(DP432,天根,北京)提取新麦草分蘖节的总RNA,微量核酸检测仪(Implen NP80 Mobile)测定浓度及RNA提取质量,通过一步法去除gDNA及cDNA合成试剂盒(AW311-02,全式金,北京)反转录合成cDNA并于—20℃保存。

表1 引物序列Table 1 Primer sequence
1.2.2新麦草CKX4基因克隆 以新麦草植株分蘖节为材料,按照总RNA提取试剂盒(DP432,天根,北京)的方法提取总RNA,反转录成cDNA,通过SnapGene 6.0.2设计PCR引物(表1)。以2 μL新麦草分蘖节cDNA为模板,加25 μL 2×Phanta Max Master Mix,各2 μL上下游引物,19 μL ddH2O,总反应体系50 μL,进行PCR反应。反应程序为:95℃ 3 min ×1;95℃ 15 s,61℃ 15 s,72℃ 2 min共35个循环;72℃延伸5 min。反应结束后进行聚丙烯酰胺凝胶电泳,按照胶回收试剂盒(DP209,天根,北京)说明回收目的条带,利用克隆试剂盒(CB501-01,全式金,北京)连接Blunt和胶回收产物并转化摇菌,按照质粒小提试剂盒(DP105,天根,北京)说明提取质粒,由广州睿博兴科公司进行测序。
1.2.3近缘物种CKX4基因编码区同源性分析 新麦草CKX4基因的CDS序列通过克隆并由广州睿博兴科公司测序获得。利用NCBI数据库中的BLAST工具(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行同源序列比对,下载小麦等10个物种CKX4基因编码区的氨基酸序列。通过DNAMAN软件对以上物种的CKX4基因编码区氨基酸序列进行比对。利用MEGA 11软件对不同物种的CKX4基因进行系统发育进化树绘制。用ExPASy(https://web.expasy.org/protparam/)分别预测不同物种的等电点(Isoelectric point)、氨基酸数量(Number of amino acids)、分子量(Molecular weight)、亲水系数及不稳定系数。通过NCBI中的Structure(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)分析不同物种的蛋白保守结构域。
1.2.4新麦草CKX4基因编码蛋白结构分析 利用PRABI中的SOPMA(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)进行新麦草CKX4蛋白质二级结构预测。通过SWISS-MODEL(https://swissmodel.expasy.org/)预测蛋白质的三级结构,并用SAVESv 6.0(https://saves.mbi.ucla.edu/)进行蛋白质三级结构模型质量评估;预测好的模型用i-TASSER(https://zhanggroup.org/I-TASSER/registration.html)的ModRefiner进行蛋白质功能位点预测,利用软件Pymol对功能位点进行三维立体结构绘制。
1.2.5新麦草CKX4基因相对表达分析 基于RNA-Seq结果,利用Ge Norm,Norm Finder和Best Keeper 3种内参基因稳定性评价软件筛选出表达稳定的CKX4基因;利用IBM SPSS Statistics 23软件分析CKX4基因分别在30株DT和30株ST新麦草中的相对表达量。以不同分蘖类型新麦草不同组织的cDNA为模板,进行qRT-PCR验证,cDNA模板加1 μL,正反向引物各0.6 μL,2×Talent qPCR Pre Mix加10 μL,最后补加RNase-free ddH2O,总反应体系为20 μL;用qRT-PCR标准曲线评估CKX4基因的扩增效率,最后通过2-ΔΔCt法计算CKX4基因分别在DT和ST中的相对表达量。
1.2.61300-cYFP-CKX4农杆菌转化烟草及亚细胞定位 以0.5 μL克隆质粒为模板,p1300上下游连接引物各2 μL,其余同1.2.2方法中PCR反应;单酶切p1300-cYFP载体反应体系为:20 μL p1300-cYFP载体质粒,1.5 μL SpeI酶和5 μL Cut Smart,总反应体系50 μL,将目的基因与载体进行连接转化。反应体系为:1 μL E×naseⅡ,2 μL 5×CEⅡ buffer,目的基因与载体共7 μL,总体系10 μL。PCR中37℃温控30 min;进行菌液阳性PCR后提质粒测序。将GV3101感受态菌株与CKX4-YFP连接产物连接后涂在含卡那霉素和利福平的抗性板上,30℃培养2 d,挑取菌落于含Kan和Rif的25 mL 1×LB中,30℃振荡培养12 h,4 000 r·min-1离心30 min;倒净上清后加入侵染液把菌液的OD600调为0.5~0.6,50 mL侵染液由500 μL 1 mol·L-1MgCl2,500 μL 1 mol·L-1MES,50 μL 200 mmol·L-1AS和超纯水组成,用1 mL的注射器将调好的菌液注射到烟草叶片中,培养2 d后于尼康共聚焦显微镜下拍照分析。
1.2.7蛋白质印迹 将上述转化烟草叶片于液氮中磨成粉末置于离心管中并加入等量的2×SDS loading buffer,混匀后于沸水浴中加热10 min,12 000 r·min-1离心5 min,取上清。将预制胶安装在电泳槽中,加入1×SDS-PAGE电泳缓冲液,向胶孔中点入蛋白上清和全新预染彩色蛋白Marker,120 V电压下电泳1 h。PVDF膜于甲醇中浸泡,将滤纸浸泡于转膜液中,转膜液由2.9 g甘氨酸、5.8 g Tris、200 mL甲醇、0.37 g SDS和ddH2O配制而成,总体系为1 L。电泳结束后,将凝胶反向置于PVDF膜下,覆盖滤纸和海绵后于4℃下恒压100 V转膜60 min。转膜后将PVDF膜置于孵育盒中,用1×TBST(20×TBST、Tween-20和ddH2O组成)稍微洗涤后加入封闭液(含5%脱脂奶粉的1×TBST),室温40 r·min-1转速下摇1 h,倒掉封闭液,加入含GFP抗性的封闭液摇1 h,1×TBST洗涤30 min,加入含HRP标记山羊抗小鼠lgG(H+L)的封闭液,40 r·min-1摇1 h,1×TBST洗涤10 min,将PVDF膜置于成像板上,滴加混合等量BeyoECL Moon A液和B液的ECL工作液,于WB曝光仪下拍照。
2 结果与分析
2.1 新麦草CKX4基因克隆
以新麦草分蘖节cDNA为模板,克隆CKX4基因全长(图1),测序结果目的片段大小为1 596 bp,编码531个氨基酸。
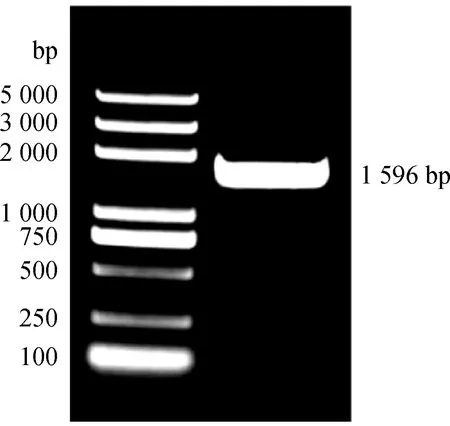
图1 新麦草CKX4基因克隆Fig.1 Cloning of CKX4 gene in Psathyrostachys juncea
2.2 近缘物种CKX4蛋白理化性质分析
蛋白理化性质分析显示(表2),新麦草等11个物种的CKX4基因CDS序列长度最短为1 569 bp,最长为1 596 bp;蛋白质序列最短的含有523个氨基酸,最长则为531个,蛋白质分子量为57.52~58.44 KD。新麦草、野生稻(OryzabrachyanthaA.Chev. & Roehr.)和大麦亚种(Hordeumvulgaresubsp.VulgareSpenn.)的等电点分别为7.33,7.09和7.32,为碱性蛋白,其余物种CKX4蛋白的等电点在6.47~6.66之间,均为酸性蛋白。各物种CKX4蛋白亲水系数均为负值,表明11个物种的CKX4蛋白均为亲水蛋白。新麦草CKX4蛋白的不稳定系数大于40,小麦和二粒小麦[Triticumdicoccoides(Koern. ex Asch. &Graebn.) Schweinf.]的不稳定系数也均大于40,均为不稳定蛋白,新麦草与小麦和二粒小麦的CKX4蛋白在理化性质方面较相似。
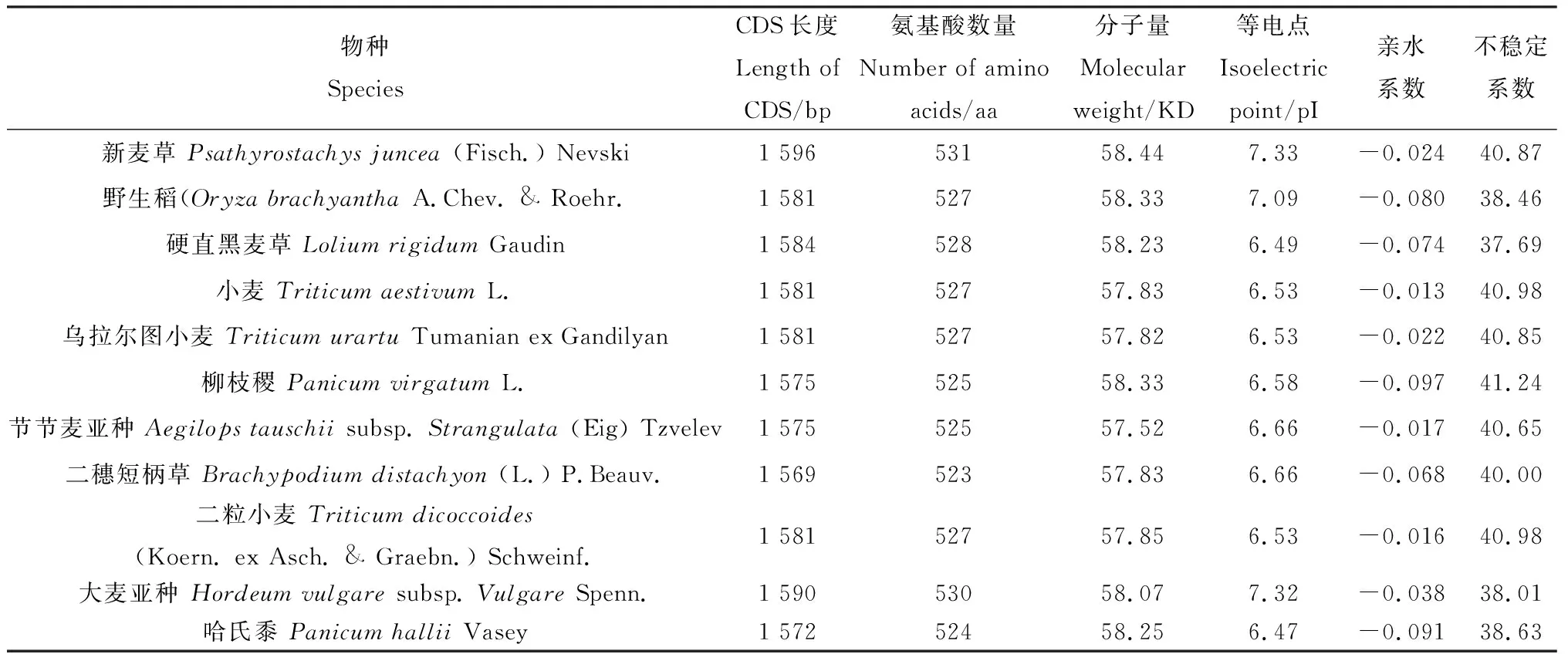
表2 各物种CKX4蛋白理化性质分析Table 2 Analysis of physicochemical properties of CKX4 protein in individual species
2.3 CKX4基因编码区同源序列分析
2.3.1多序列比对及保守结构域分析 将新麦草及10个近缘物种的CKX4基因编码区的氨基酸序列进行多序列比对分析,结果显示(图2),新麦草等9个物种的FAD辅因子在CKX4蛋白中与GHS基序相关联,二穗短柄草(Brachypodiumdistachyon(L.) P.Beauv.)CKX4在相同的位置则为AHS基序。11个物种存在相同的保守结构域,说明该基因在物种间比较保守可能具有相似功能,其中细胞素结合(Cytokin-bind)结构域范围相同,细胞分裂素脱氢酶结构域(PLN02441)的起始位置有一定差异,野生稻开始于第6位氨基酸,节节麦亚种(Aegilopstauschiisubsp.Strangulata(Eig) Tzvelev)开始于第30位氨基酸,新麦草及其余物种均从第25位V残基开始。

图2 新麦草与其近缘物种CKX4蛋白序列比对Fig.2 Alignment of CKX4 protein sequences of P. juncea with those of its relatives注:倒三角之间代表细胞素结合结构域(Cytokin-bind);矩形框与红色圆形之间代表细胞分裂素脱氢酶结构域(PLN02441)Note:Between the inverted triangles represents the cytotin binding domain(Cytokin-bind);Between the rectangular box and the red circle represents the cytokinin dehydrogenase domain(PLN02441)
2.3.2同源蛋白系统发育树分析 采用MEGA 11软件对CKX4基因编码区进行分析(图3),CKX4基因编码蛋白聚类分析将所有材料初步分为两类,野生稻、柳枝稷(PanicumvirgatumL.)及哈氏黍(PanicumhalliiVasey)为一类,其余物种聚成的一类可进一步分为两个亚类,其中一个亚类仅包含硬直黑麦草(LoliumrigidumGaudin)和二穗短柄草两个物种,新麦草与小麦等麦类植物划分为同一亚类,进一步表明在考察的10个禾本科近缘物种中,节节麦、小麦类及大麦亚种与新麦草亲缘关系最近,具有高度同源性。

图3 基于CKX4氨基酸序列的系统发育进化树Fig.3 Phylogenetic tree of P. juncea based on CKX4 amino acid sequence
2.3.3新麦草CKX4蛋白结构预测 新麦草CKX4蛋白二级结构预测结果显示(图4),该蛋白中有186个氨基酸形成α-螺旋,占比35.03%;延伸链占比18.46%,由98个氨基酸形成;β-转角占6.59%,由35个氨基酸形成;不规则卷曲占39.92%,由212个氨基酸形成,表明α-螺旋和不规则卷曲是新麦草CKX4蛋白的主要二级结构。新麦草CKX4蛋白质三级结构主要由不同数量的α-螺旋和β片层折叠构成(图5),通过预测其功能位点显示,该蛋白存在和FAD相关的GHS基序的组氨酸残基位点和Leu(亮氨酸)残基位点(L223)。

图4 新麦草CKX4蛋白二级结构预测Fig.4 Secondary structure prediction of CKX4 protein in P. juncea
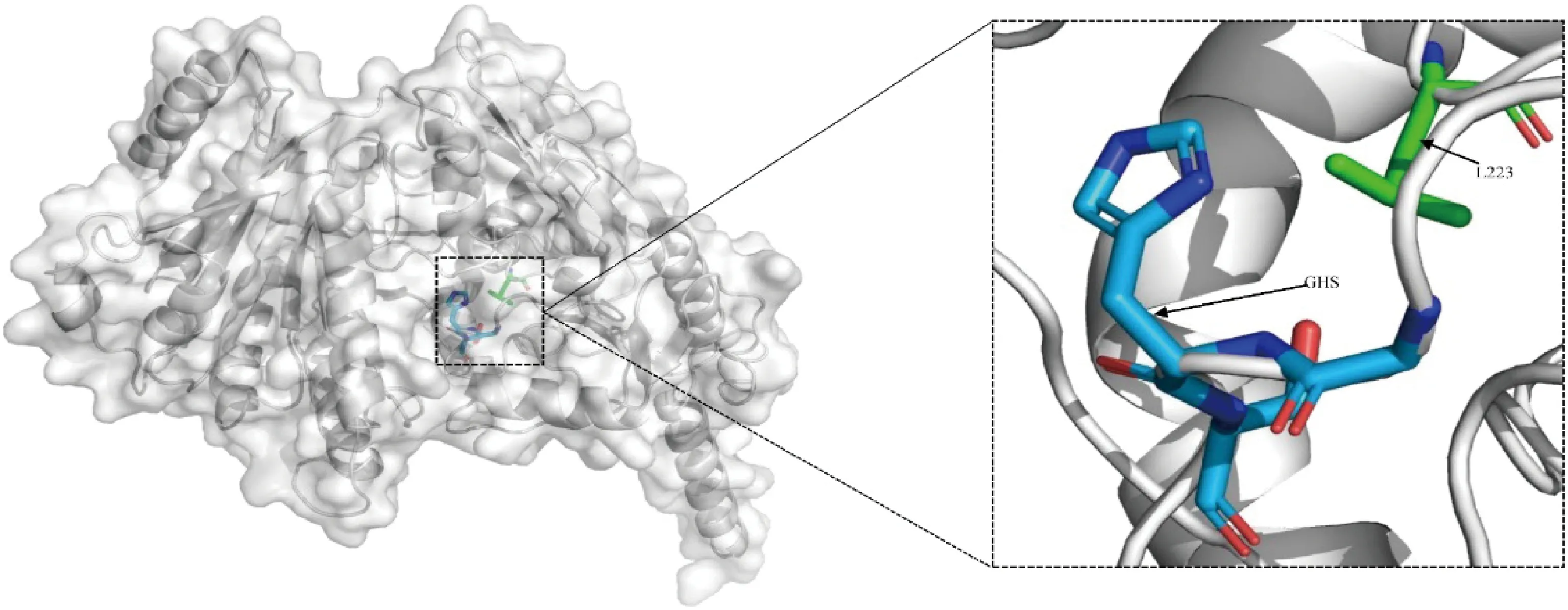
图5 新麦草CKX4蛋白三级结构及配体结合位点预测Fig.5 Prediction of tertiary structure and ligand binding sites of CKX4 protein in P. juncea
2.4 新麦草CKX4基因相对表达量分析
RNA-Seq结果显示(图6A),新麦草CKX4基因在DT中的相对表达量为3.677,而ST中相对表达量为8.160,ST中相对表达量显著高于DT中的相对表达量(P<0.05);用相同生育期材料进行qRT-PCR验证,结果显示DT中的CKX4基因相对表达量为27.723,而ST中的该基因相对表达量为72.011,该基因在ST类型新麦草材料中相对表达量极显著上调(P<0.01),表明CKX4基因与新麦草分蘖过程相关,且在该过程中起到降低分蘖数的作用。进一步对不同分蘖类型新麦草不同组织中的CKX4基因的相对表达量进行分析,结果显示(图6B),CKX4基因在不同分蘖类型的新麦草中,根和叶中的基因相对表达量无显著差异,分蘖节中ST型新麦草中CKX4基因相对表达量极显著上调(P<0.01),且表达量高于其他组织。
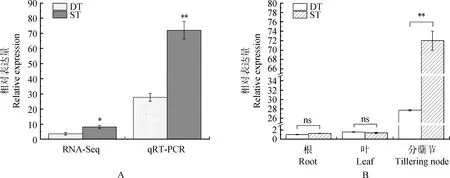
图6 新麦草CKX4基因表达量分析Fig.6 Analysis of CKX4 gene expression in P. juncea注:图上标* 表示CKX4基因不同分蘖型新麦草相比差异显著(P<0.05),标**表示差异极显著(P<0.01),ns表示无显著差异,DT表示多分蘖型新麦草,ST表示少分蘖型新麦草Note:The marker * in the figure indicates that there was a significant difference in CKX4 gene expression between different tillering types of P. juncea (P<0.05),and the marker ** that the difference was extremely significant (P<0.01);ns denotes that there was no significant difference;DT stands for the multi-tillering type of P. juncea, ST the less tillering type
2.5 新麦草CKX4亚细胞定位及蛋白质印记分析
将CKX4克隆质粒与单酶切后的p1300-cYFP载体进行连接,构建CKX4-YFP过表达载体,转化农杆菌后侵染烟草,分析CKX4蛋白亚细胞定位及表达情况,结果显示(图7),p1300-cYFP载体可以正常表达,新麦草CKX4蛋白定位于细胞内,推测可能定位于高尔基体中。利用蛋白质印迹法分析新麦草CKX4蛋白在烟草中的表达情况,结果(图8)显示,CKX4-YFP表达位置在85.48 kDa。
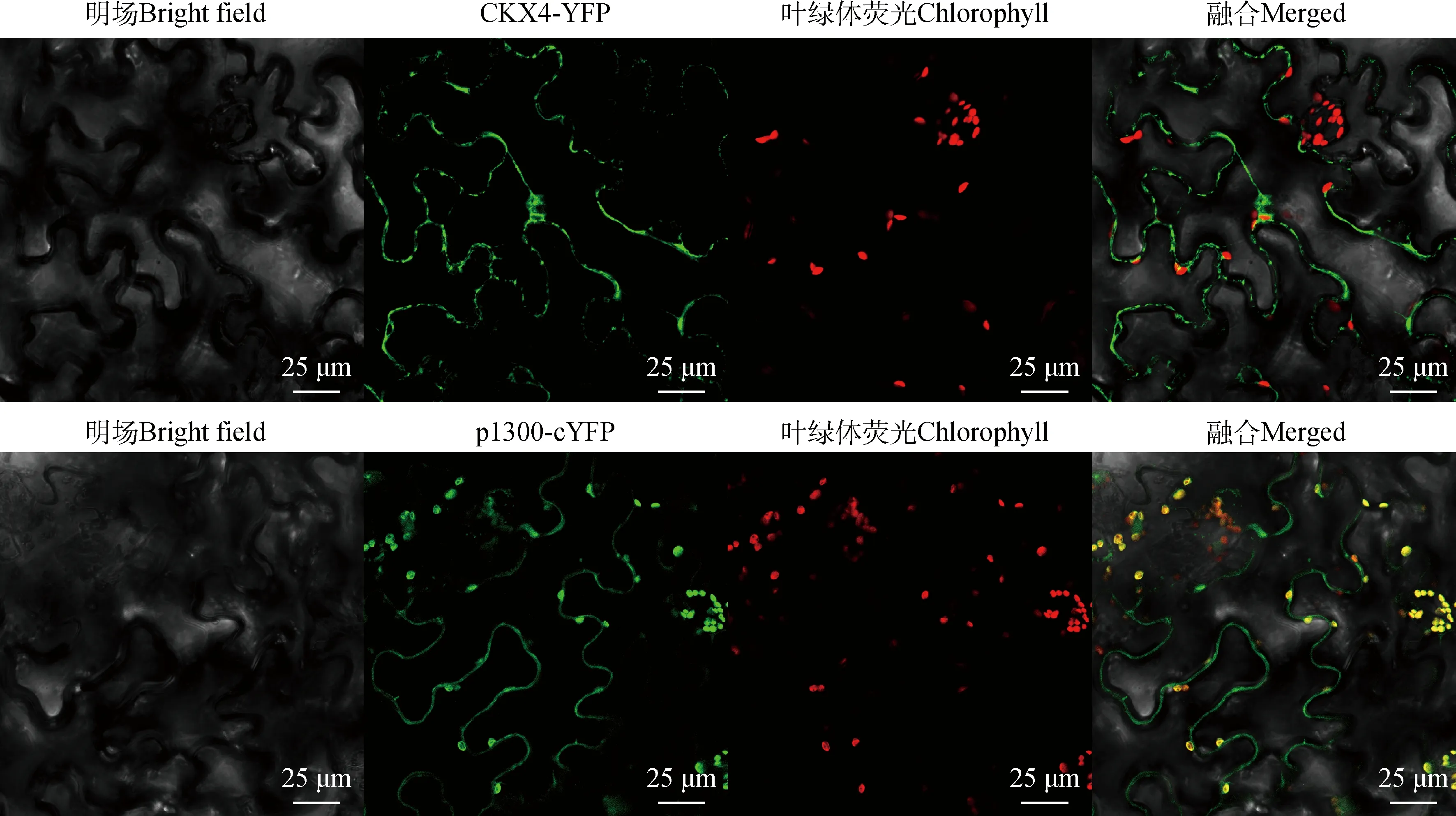
图7 CKX4的亚细胞定位Fig.7 Subcellular localization of CKX4
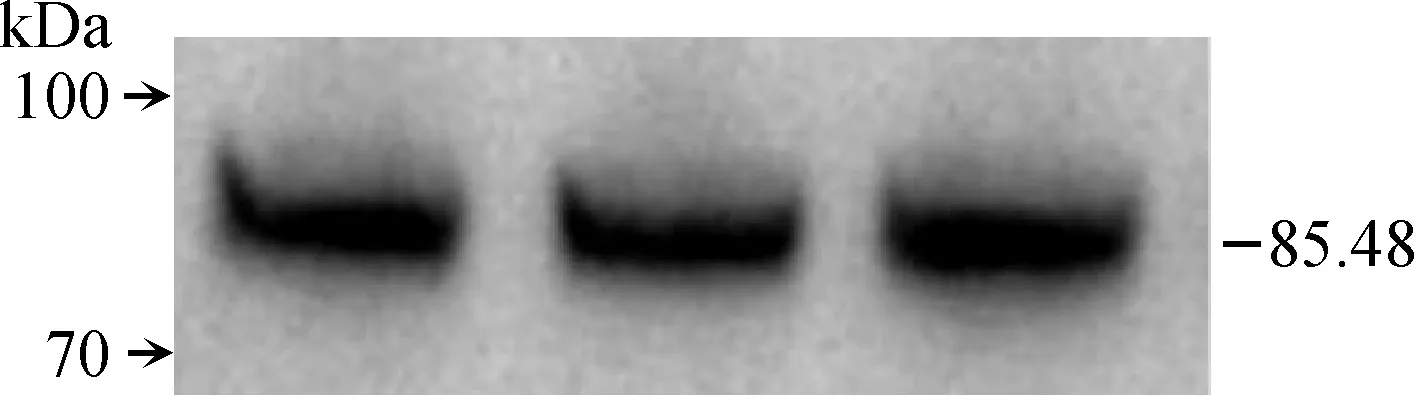
图8 新麦草CKX4-YFP蛋白质印迹分析Fig.8 Western blot analysis of CKX4-YFP in P. juncea
3 讨论
细胞分裂素与植物的各种生理活动密切相关,如营养转移、细胞分裂和叶片衰老等[14-15]。CKX是专一催化且不可逆降解细胞分裂素的黄素酶,通过各种化学和分子方法抑制CKX会导致不同组织中的细胞分裂素聚集,进而提高谷物产量和非生物胁迫耐受性,并延缓衰老[6]。
本研究通过PCR的方法成功克隆了新麦草CKX4基因序列,经测序后进行同源序列比对及保守结构域分析,结果表明11个近缘物种均存在FAD-binding保守结构域、细胞素结合(Cytokin-bind)结构域和细胞分裂素脱氢酶结构域(PLN02441),说明新麦草与10个近缘物种的CKX4编码蛋白有功能相似的部分,细胞素结合结构域是细胞分裂素脱氢酶1、FAD和细胞分裂素结合区域,主要存在于细胞分裂素脱氢酶1中,能够结合FAD和细胞分裂素底物[16]。在不同物种的系统发育树及理化性质分析中,新麦草与小麦等麦类作物的亲缘关系最近,CKX4编码蛋白也有相似的理化性质,表明其具有高度的同源性,蛋白功能相似。有研究表明,小麦CKX基因对小麦的生长发育及产量形成有明显的影响[17-18],TaCKX3 基因在‘豫麦 8679’/‘红芒春 31’ 重组自交系(RILs)群体中有较好的多态性,与小麦的穗粒数相关[19],除此之外,TaCKX2-1和TaCKX2-2基因与小麦穗粒数呈正相关关系,且在幼穗和茎中高表达,说明两个基因可能对穗分化发育起重要作用,从而对小麦产量形成影响[20]。小麦TaNAC1基因通过下调TaCKX4基因的表达量,促进细胞分裂素的产生和积累,从而抑制小麦的根系生长,TaCKX4基因在整个调控过程中对小麦锌含量和产量也有一定的影响,该基因通过调节小麦籽粒数、穗数和分蘖数等性状,进而影响小麦产量,但这种调节依赖于田间环境[8-9]。Chang等人[21]研究发现小麦中TaCKX4携带A型基因的叶绿素含量和粒重显著高于B型基因的个体,对小麦的产量有一定影响。以上说明CKX4基因不仅通过调控新麦草的分蘖数对新麦草产量产生影响,也可能通过调控穗分化影响种子产量。
蛋白质的二级结构存在折叠结构,骨架的原子之间存在相互作用,形成多肽,决定蛋白质结构,进而决定生化功能,二级结构的预测对于识别蛋白质三级结构及其折叠也有重要意义[22-23]。新麦草CKX4蛋白的二级结构主要由α-螺旋和不规则卷曲组成,探究其结构对揭示该蛋白功能有重要作用。FAD辅因子在活性CKX蛋白中与保守GHS基序的组氨酸残基共价结合[16],H是植物CKX中的结合残基[1],但二穗短柄草CKX4在相同的位置为AHS基序,该突变可能会影响FAD的结合[24],有研究推测降解CK的主要反应机制与FAD结构域相关[16,25-26]。新麦草CKX4编码蛋白的三级结构主要由α-螺旋和β片层折叠构成,该模型已通过SAVESv6.0软件的质量评估,在其功能位点预测中,新麦草CKX4蛋白存在Leu(亮氨酸)残基和组氨酸残基位点,GHS基序的存在可能在降解CK的反应机制中发挥作用,从而影响CKX4基因调控新麦草的相关表型。新麦草中Leu(亮氨酸)残基位点主要为L223,杨树(PopulusL.)CKX中存在高度保守的L492残基,用于构建对顺式玉米素(cZ)类CK具有修饰特异性的细胞分裂素脱氢酶变体,因为cZ衍生物与生长受限的发育阶段相关,过表达这些变体的植物可用于揭示cZ衍生物在植物生长中的作用,所以该残基可能是分子操作的潜在目标,推测新麦草该类残基对其生长特性有一定的作用[27]。此外,亮氨酸残基在CKX中主要影响催化降解细胞分裂素过程中的氧化反应速率[24,27],新麦草CKX4中Leu残基的存在可能是影响催化降解细胞分裂素过程氧化反应速率的主要因素,进而也是影响CKX4蛋白功能的重要结构。
RNA-Seq数据分析发现DT型的新麦草中CKX4基因相对表达量显著偏低,与qRT-PCR结果相符,该研究方式同紫花苜蓿(MedicagosativaL.)[28]、草地早熟禾(PoapratensisL.)[29]及狗尾草(Setariaviridis)[30]等物种相关基因表达分析方式相同,通过对不同分蘖型新麦草不同组织中的CKX4基因相对表达量分析显示,分蘖节中CKX4基因相对表达量高于其他组织,这可能由于CKX4基因下调表达导致了细胞分裂素脱氢酶活性下降,从而降低CKX4对细胞分裂素的降解作用,促进新麦草产生更多分蘖。这与石斛兰(Dendrobium)[31]DSCKX1基因研究相似,在过量表达DSCKX1基因的石斛兰和拟南芥(Arabidopsisthaliana)中,细胞分裂素含量会随着细胞分裂素氧化酶活性水平的升高而降低,从而会产生细胞分裂素缺失的植株表型。植物不同器官中的细胞分裂素脱氢酶活性不同[32],CKX的活性调节与其在细胞中的浓度相关[33]。有研究表明CKX在参与植物胁迫反应时,细胞分裂素脱氢酶活性在胁迫植物的叶和根中受到强烈刺激而增强,并与细胞分裂激素的负调节相吻合[34],说明新麦草的CKX4蛋白可能通过参与细胞分裂素脱氢酶反应的过程进而影响新麦草的生长发育。
新麦草CKX4亚细胞定位于细胞内,与水稻(OryzasativaL.)[35]OsCKX3定位一致,OsCKX3推测定位于高尔基体,欧李(Cerasushumilis)[36]ChCKX4定位于质膜中,ChCKX4基因家族中部分成员定位于细胞质中,蒺藜苜蓿(Medicagotruncatula)[37]MtCKX定位于细胞膜和细胞核上。综上所述,新麦草CKX4定位与禾本科植物水稻定位图相似,故推测新麦草CKX4可能也定位于高尔基体中。蛋白质印迹结果显示CKX4-YFP能在烟草中正常表达,说明CKX4于目的植物中可正常转化表达,为CKX4基因调控改进新麦草分蘖数和产量提供了理论基础和参考依据。
4 结论
研究通过PCR方法成功克隆了新麦草CKX4基因;新麦草与小麦等麦类作物具有高度同源性;新麦草CKX4蛋白存在FAD相关的GHS基序的组氨酸残基和Leu(亮氨酸)残基位点;通过RNA-Seq分析及qRT-PCR验证均发现在疏蘖型新麦草中CKX4基因表达量相对更高,说明该蛋白在调控新麦草生长发育中起关键作用。烟草瞬时转染与蛋白质印记分析均显示CKX4-YFP可在烟草中正常表达,亚细胞定位于细胞内。本研究将为新麦草产量性状精准改良提供理论依据和参考。
