PD-1抑制剂治疗广泛期小细胞肺癌患者的疗效及安全性
2023-12-04李亚伟韩正全张竞竞
李亚伟 韩正全 张竞竞 苏 方
(蚌埠医学院第一附属医院肿瘤内科,安徽 蚌埠 233004)
小细胞肺癌(small cell lung cancer,SCLC)在肺癌中约占14%,与吸烟密切相关[1]。因其具有增殖迅速、早期转移及获得性化疗耐药的特点,所以预后很差[2]。按照由退伍军人管理局肺研究小组(VALSG)分期系统,SCLC分为局限期(limited-stage small cell lung cancer,LS-SCLC)和广泛期(extensive-stage small cell lung cancer,ES-SCLC)。目前一线标准化疗方案仍是依托泊苷和顺铂/卡铂(EP/C)的联合化疗[3],临床上60%以上新诊断的SCLC患者为ESSCLC,一线化疗后的中位总生存期为10个月[4]。目前,免疫检查点抑制剂联合标准化疗是一线治疗ESSCLC的新标准[5],现有循证医学证据多以程序性死亡受体-配体1(programmed cell death-ligand 1,PD-L1)抑制剂为主。目前PD-L1抑制剂阿替利珠单抗[6]、度伐利尤单抗[7]获批ES-SCLC的一线治疗,纳武利尤单抗[8]及帕博利珠单抗[9]在三线治疗中显示出一定的临床获益。临床中,由于PD-L1抑制剂价格昂贵,只有小部分SCLC治疗应用了PD-1抑制剂,本研究回顾性分析真实事件中以国产PD-1抑制剂(信迪利单抗、替雷利珠单抗、卡瑞利珠单抗)为主联合化疗一线治疗ES-SCLC的疗效和安全性,以期为临床治疗选择提供一定的参考依据。
1 对象与方法
1.1 研究对象 回顾性筛选2020年1月至2022年1月蚌埠医学院第一附属医院肿瘤内科收治的ES-SCLC患者,整理病案资料后随机分为两组对比研究。
纳入标准:①按照VALSG分期系统经组织学或病理学确诊的ES-SCLC患者。②既往未接受任何PD-1/PD-L1抑制剂等免疫治疗。③≥18周岁的男性或女性。④美国东部肿瘤协作组ECOG评分0或1分。⑤具有足够的器官功能,根据实体瘤疗效评价标准RECIST v1.1有≥1个客观可测量或评价的肿瘤病灶。⑥至少完成4周期治疗。排除标准:①需要使用大剂量糖皮质激素或其他免疫抑制剂或合并需系统性治疗的自身免疫性疾病。②有严重的心脑血管疾病。③有间质性肺炎或放射性肺炎病史。④有严重血栓栓塞病史。⑤活动性乙型肝炎、丙型肝炎,治疗期间未使用抗病毒治疗。⑥合并HIV感染或活动性结核。
1.2 治疗方法 对照组:依托泊苷联合顺铂/卡铂(EP/C)方案,具体用法:依托泊苷(齐鲁制药有限公司,国药准字H37023183)60~100 mg/m2,静脉滴注,第1~4天;顺铂(江苏豪森药业集团有限公司,国药准字H20040813),25 mg/m2,静脉滴注第1~4天;或卡铂(鲁制药有限公司,国药准字H20020181),药-时曲线下面积(AUC)=5,静脉滴注,第1天,每21天为1周期。
试验组:EP/C方案基础上联合PD-1单抗,具体用法:化疗方案同上。PD-1单抗:信迪利单抗(信达生物制药有限公司,国药准字 S20180016)、替雷利珠单抗(生物科技有限公司,国药准字S20190045)或卡瑞丽珠单抗(苏州盛迪亚生物医院有限公司,国药准字S20190027)200 mg,静脉滴注,第1天,每21天为1周期,4~6周期后PD-1单药维持治疗。
1.3 疗效和安全性评估 依据世界卫生组织实体瘤疗效评价标准RECIST v1.1进行客观疗效评价,每2周期进行一次疗效评估。疗效评估分为完全缓解、部分缓解、疾病稳定和疾病进展4个等级,得出客观有效率和疾病控制率。
血清学肿瘤标志物:收集治疗前和4个周期治疗后患者血清神神经元特异烯醇化酶(neuron specific enolase,NSE)和胃泌素释放肽前体(pro-gastrinreleasing peptide,ProGRP)的水平。
观察患者无进展生存期(progression free survival,PFS),根据常见的治疗相关不良反应(NCI-CTC)4.0版标准进行不良反应发生率评价。
1.4 统计学方法 本研究采用SPSS 27.0进行统计分析,计量资料符合正态分布的用±s表示,两组间比较采用t检验;计数资料用n(%)表示,两组间比较采用χ2检验;Kaplan-Meier生存曲线采用GraphPad 5.0软件绘制,P<0.05为差异有统计学意义。
2 结果
2.1 两组基线临床资料比较 共纳入符合标准的患者64例,对照组和试验组分别有41例和23例,试验组应用PD-1抑制剂,其中替雷利珠单抗9例,信迪利单抗7例,卡瑞利珠单抗7例。两组患者一般临床资料差异无统计学意义(P>0.05)。见表1。

表1 两组基线临床资料比较[例(%)]
2.2 两组治疗效果比较 试验组客观有效率为82.60%,明显高于对照组的51.22%(P<0.05)。试验组和对照组疾病控制率分别为91.30%和68.29%(P>0.05),见表2。在64例患者中,到数据截止日期时,试验组中位PFS为8.9个月,对照组中位PFS为6.6个月,试验组较对照组高(P=0.014)。见图1。
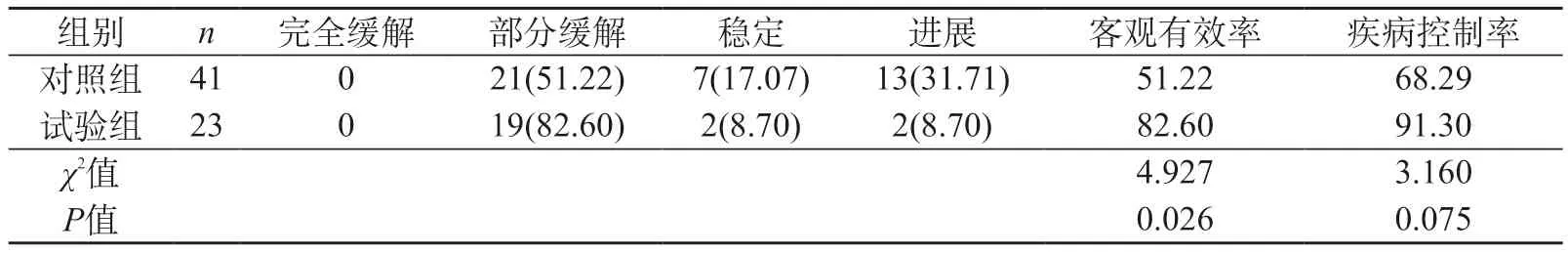
表2 两组治疗效果比较[例(%)]

图1 64例ES-SCLC接受化疗联合PD-1抑制剂的PFS的对比
2.3 两组治疗前后肿瘤标志物比较 两组患者治疗前和在4周期治疗后,两组的NSE、ProGRP水平均无差异(均P>0.05)。见表3。

表3 两组治疗前后肿瘤标志物比较(ng/ml)
2.4 两组不良反应发生率比较 两组均出现不同程度的不良反应,常见的为乏力、骨髓抑制(多见于白细胞减低、血小板减少或贫血)、恶心呕吐,试验组和对照组3级及以上不良反应发生率分别为10例(43.47%)和19例(46.34%),差别无统计学意义(χ2=0.049,P=0.825)。见表4。

表4 两组不良反应发生率比较[例(%)]
3 讨论
SCLC发病率相对较低,但总体预后不佳,近几十年来,SCLC的治疗进展非常缓慢。最近,免疫治疗改变了SCLC的标准治疗方法,在SCLC的治疗中引入免疫疗法取得了一些进展[10]。尽管阿替利珠单抗一线治疗ES-SCLC给患者带来了益处,但高昂的治疗成本以及缺乏预测疗效和毒性的生物标志物使其在临床应用时有一定的局限。而PD-1抑制剂在SCLC治疗中也有一些进展,最新报道一例进展的SCLC患者在应用信迪利单抗后肺内病灶得到控制,PFS为9.7个月[11]。2023年1月17日,由上海复宏汉霖自主研发的国产PD-1免疫治疗药斯鲁利单抗,在国内获批一线治疗ES-SCLC[12]。
近期研究显示,免疫治疗联合化疗的增效与SCLC的高突变率有关,具有免疫原性的SCLC类型对免疫治疗有反应。肿瘤的异质性包括肿瘤间或肿瘤内的异质性,Gay等人[13]报告了SCLC中四个不同转录亚群(SCLC-A,SCLC-N,SCLC-P和SCLC-I),其中第四组SCLC-I肿瘤倾向于优先对联合免疫治疗有反应。另一方面,SCLC中效应性CD8+淋巴细胞的数量相比腺癌和鳞状细胞癌分别要低5.4倍和6倍[14]。
本研究回顾分析了PD-1抑制剂联合标准化疗对ES-SCLC一线治疗的疗效及安全性,联合PD-1抑制剂后较标准化疗组能够显著延长PFS,而不良反应未见明显增加。肿瘤标志物水平与肿瘤分期相关[15],该研究中发现NSE或ProGRP标志物水平与病情变化并非总是保持一致,如部分患者疾病进展时NSE或ProGRP水平并未同步明显增加,但出现其他肿瘤标志物的变化,如CEA或CA199的明显升高。两组在NSE或ProGRP的变化水平并无显著性差别,目前SCLC治疗仍缺乏预测疗效和毒性的生物标志物[16]。在不良反应方面,对照组和试验组均可出现不同程度的恶心、呕吐或骨髓抑制,分析出现合并3级及以上电解质紊乱可能与SCLC本身的特点相关[17],另外,试验组1例患者出现严重皮疹但PFS为14.3个月,明显长于中位FPS,免疫治疗时皮疹的发生是否与药物作用有关尚待进一步的研究。
对于LS-SCLC患者早期加入免疫治疗是否延长患者的PFS,既往研究报道显示LS-SCLC在一线联合应用阿替利珠单抗时并未观察到有显著的生存时间延长[6]。本研究未计入各患者的总生存时间,后续待进一步统计与完善。该研究系回顾性分析,较前瞻性研究有一定的缺陷,加上样本量的局限,该研究结果仅具有一定的参考意义。
其他不足的是,尽管免疫治疗联合化疗治疗ESSCLC具有不可否认的优势,但本研究显示的PFS获益的幅度仍然不大。考虑到SCLC中四个不同转录亚群,试验组病例中第四组SCLC-I肿瘤的比例可能对研究结果造成影响,然而目前相应基因检测在临床工作中无法进行。
总之,未来需更好地了解SCLC的精确分子机制以及从根本上降低该病的发病率,如鼓励民众戒烟、定期体检及早期发现和积极治疗,这些需要国家、社会和家庭的共同努力。
