骨髓骨片法体外培养大鼠骨髓间充质干细胞和PKH26 标记
2023-12-04爽谢燕燕徐菊菊闫振宇
陈 爽谢燕燕徐菊菊闫振宇*
(1.华北理工大学,河北 唐山 063000;2.华北理工大学附属医院,河北 唐山 063000)
骨再生是各种类型的骨创伤研究的难点问题,因为外伤、车祸等外力难以抵抗的因素造成骨损伤、骨缺损,手术治疗是临床唯一有效的彻底治愈手段。 但是,由于身体不能耐受手术、置换材料发生排斥反应、手术费用昂贵等因素使其在临床应用上受到一定限制,部分患者常因无法行走而产生心理抑郁。 有研究证实,向牵张成骨模型注射自体骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)可以对矿化区形成骨再生[1],并且能够分化为成骨细胞,再通过旁分泌发挥作用,此细胞易分离、扩增、免疫原性低,间充质干细胞提供了骨再生的新方向之一[2]。 BMSCs 属于修复机体某些特定组织的一类干细胞,是一种能够自我复制和分化为多种细胞类型的祖细胞。 另外,多项试验的研究结果证实了BMSCs 与生物材料具有很好的相容性,形成复合支架促进骨缺损修复、骨组织再生的优势[3-4]。 近年来,BMSCs 已经成为理想的骨组织工程种子细胞。 有实验研究表明,骨髓的收集技术会影响BMSCs 的异质性,最后影响软骨细胞分化,而对成骨或成肪潜力方面无明显影响[5]。 本实验中,研究者通过5 d 大鼠乳鼠骨髓骨片法对BMSCs 进行分离培养,并作出鉴定。 然后应用PKH26 程序性标记,观察对细胞形态、增殖、诱导分化的影响,为BMSCs 体内移植到软骨的进一步研究提供了实验依据。
1 材料和方法
1.1 实验动物
SPF 级SD 雄性大鼠5 d 乳鼠和3 ~4 周SD 雄性大鼠分别2 只,前者体重11~13 g,后者体重80 ~90 g,实验动物均购买于北京华阜康生物科技股份动物公司[SCXK(京)2019-0008]。 动物均饲养在华北理工大学医学实验动物中心SPF 级屏障实验室环境内[SYXK(冀)2020-007],饲养条件:室温18~26℃,相对湿度40%~70%。 实验动物福利伦理审查获得华北理工大学伦理委员会批准(2022-SY-012),所有实验动物在实验过程中均遵守3R 原则。
1.2 主要试剂与仪器
α-MEM 培养基、0.25% EDTA 胰酶、双抗(青链霉素)均购买于Hyclone 公司,货号SH30265.01、SH30042.01、SV30010;胎牛血清购买于Gibco 公司,货号10099-141;PKH26 试剂盒购买于贝博生物科技有限公司,货号BB-441125;CCK-8 试剂盒购买于北京聚合美生物科技有限公司,货号MF128-01;油红O 染色试剂盒、茜素红S 染色液(0.2%)购买于北京索莱宝科技有限公司,货号为G1262、G1450;Anti Rat FITC-CD29、Anti Rat FITC-CD90、Anti Rat FITC-CD45 均购买于美国BD 公司。 细胞培养箱购买于美国Termo 公司;流式细胞仪购买于美国Becton Dickinson 公司;荧光倒置相差电子显微镜购买于日本Nikon 公司;酶标仪购买于美国Biotek 公司;生物安全柜购买于美国Farma 公司,型号为HR60-IIA2;微量电子天平购买于德国Satorius 公司,型号为TE601-L。
1.3 实验方法
1.3.1 大鼠BMSCs 提取与培养
采用大鼠5 d 乳鼠骨髓骨片法分离培养大鼠BMSCs,具体方法为:取SD 雄性大鼠5 d 乳鼠2 只,颈椎脱臼法处死后,用无菌镊子、眼科剪轻轻将其后肢皮肤剥离掉,充分暴露双后肢,分离双侧完整的后肢,去除附着的肌肉和筋膜,用含有1%双抗的PBS 清洗2 次,并用眼科剪剪成体积小于3 mm3的小碎块转移至含10%血清的α-MEM 培养基中,混匀后接种在细胞培养瓶中,放置在37℃的5% CO2细胞培养箱中。 接种48 h 后,可观察到骨片周围爬出的是细长的梭形细胞,继续培养至细胞密度达80%左右,可进行1 ∶2 传代,倒置相差显微镜下观察细胞生长情况。
传统大鼠BMSCs 的分离培养方法是采用3 ~4周SD 雄性大鼠2 只,使用3%戊巴比妥钠腹腔麻醉,麻醉剂量2 mL/kg,然后用75%酒精浸泡10 min,传递至超净台内。 取仰卧位,充分暴露膝关节,将后肢皮肤剪开,小心分离股骨胫骨以及肌肉筋膜等,用无菌PBS 浸泡后,使用1 mL 注射器冲洗骨髓腔,直至无红色后,收集全部液体,离心,转移到含10%血清的α-MEM 培养基中,混匀后接种在细胞培养瓶中,放置在37℃的5% CO2细胞培养箱中。 48 h后首次换液,继续培养至细胞密度达80%左右,可进行1 ∶2 传代,倒置相差显微镜下观察细胞生长情况。
1.3.2 大鼠BMSCs 鉴定
取第3 代BMSCs,对其进行消化、离心、重悬后得到密度为1×106/mL 的单细胞悬液,分别加入抗大鼠单克隆抗体CD29、CD45、CD90,在4℃下进行30 min 避光孵育,最后加入PBS 重悬,上机检测,重复检测3 次。
1.3.3 PKH26 标记大鼠BMSCs
应用PKH26 对第3 代细胞进行染色,配制PKH26 染色工作液:用无血清α-MEM 培养基将PKH26 母液稀释250 倍后备用。 用100 μL 染色工作液将消化完成的细胞沉淀重悬,直至细胞浓度为107/mL,吹打混匀后加到用锡纸包裹的EP 管中,放入37℃的培养箱进行10 min 的孵育,4℃冰箱中孵育25 min,800 r/min 离心5 min,弃上清液,收集细胞,用PBS 清洗2 次细胞上未结合的PKH26 染色液,加入4 mL 完全培养基重悬细胞,充分吹打混匀,接种在细胞培养瓶中,注意避光,在培养箱内继续培养,传代扩增,随后可以直接在倒置荧光电子显微镜下观察到细胞标记的效果以及荧光的强弱。
1.3.4 CCK-8 法检测标记与未标记细胞增殖活力
取第3 代被PKH26 标记(实验)组和未被标记BMSCs(对照)组,制备成单细胞悬液,操作依据CCK-8 试剂盒检测细胞增殖能力,具体步骤:分别将实验组和对照组的细胞浓度调整为2×103/L,每孔100 μL,接种到96 孔培养板,设5 个复孔,在相同条件下培养,每24 h 分别取5 个实验组和对照组孔加入10 μL CCK-8 试剂,培养箱中孵育3 h,在酶标仪450 nm 参数下读取OD 值,连续检测10 d,以培养时间为横坐标,以吸光度为纵坐标,将PKH26 标记与未标记大鼠BMSCs 的生长曲线绘制出来。
1.3.5 PKH26 标记与未标记细胞成骨成脂诱导及鉴定
(1)细胞成骨诱导及鉴定:成骨诱导液配方为向含10%血清的α-MEM 培养基中加入10 mmol/L β-甘油磷酸钠、0.05 mmol/L Vc 和100 mmol/L 地塞米松。 取第3 代细胞调整密度为5×105/孔后,在6孔板中接种;当细胞达到70%的融合度时,再替换成骨诱导液,培养至第21 天用茜素红染色。
(2)细胞成脂诱导及鉴定:成脂诱导液配方为向含10%血清的α-MEM 培养基中加入10 μmol/L胰岛素、1 μmol/L 地塞米松、0.5 mmol/L 3-异丁基-卜甲基黄嘌呤和200 μmol/L 吲哚美辛。 取第3 代细胞调整密度为5×105/孔后接种于6 孔板培养;当细胞达到70%融合度时,再替换成脂诱导液,培养至第14 天用油红O 染色。
1.4 统计学方法
所有实验数据采用SPSS 19.0 软件进行统计分析,用GraphPad Prism 8 软件进行绘制统计图。 计量资料表示为平均数±标准差(±s),多组数据间差异比较采用单因素方差分析,两组数据之间差异比较采用独立样本t检验,以P<0.05 表示差异具有统计学意义。
2 结果
2.1 细胞的形态观察
将骨髓骨片接种于培养瓶,经过大鼠BMSCs 原代36 h 的培养,可见少量从骨片周围爬出,贴壁生长,有大量悬浮的细胞;培养到72 h,第一次半定量换液,悬浮细胞降低,贴壁细胞逐渐增加,大量细胞爬出,它是细长的梭形、三角形、纺锤形;继续培养到96 h 以后细胞密集生长,出现大片融合现象,呈漩涡状,可进行1 ∶2 传代培养。 传代到第3 代细胞均是呈长梭形,形态一致,具有较强的折光性,融合密度较高时可呈漩涡状、鱼群状(图1)。
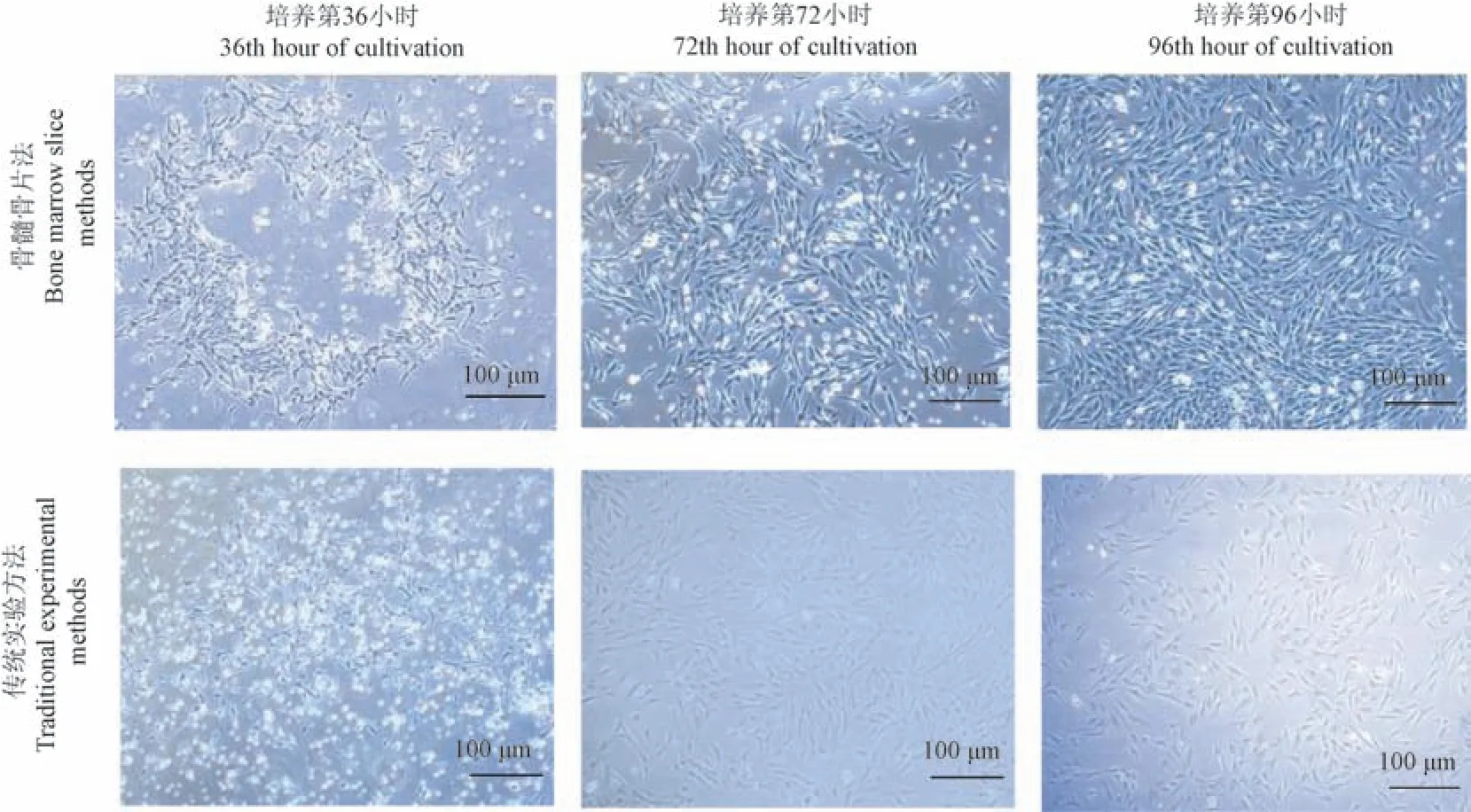
图1 原代BMSCs 细胞形态Figure 1 Morphology of primary BMSCs
传统方法培养的BMSCs 在36 h 仅观察到少量细胞贴壁,培养到48 h 进行首次换液,观察到细胞贴壁数量增加,继续培养到第72 h,观察到细胞尚未形成群落,排列分散,呈细长梭形;继续培养到96 h,细胞密度可达50%以上,但仍需继续培养,尚无法传代(图1)。
2.2 流式细胞鉴定
如图2 所示,经流式细胞仪对表面标志物进行检测,第3 代大鼠BMSCs 阴性对照为(0.55 ±0.73)%,高表达CD29、CD90,表达量分别为(91.18±1.29)%、(95.04±0.11)%,而低表达CD45,仅有(1.74±0.36)%,差异显著(P<0.001),证明分离培养的是大鼠BMSC(表1)。
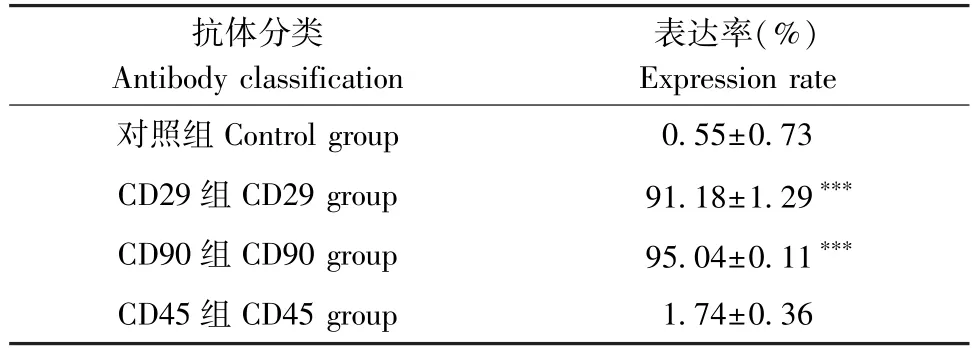
表1 第3 代大鼠BMSCs 表面抗原表达Table 1 Expression of BMSCs surface antigens in the 3rd generation rats
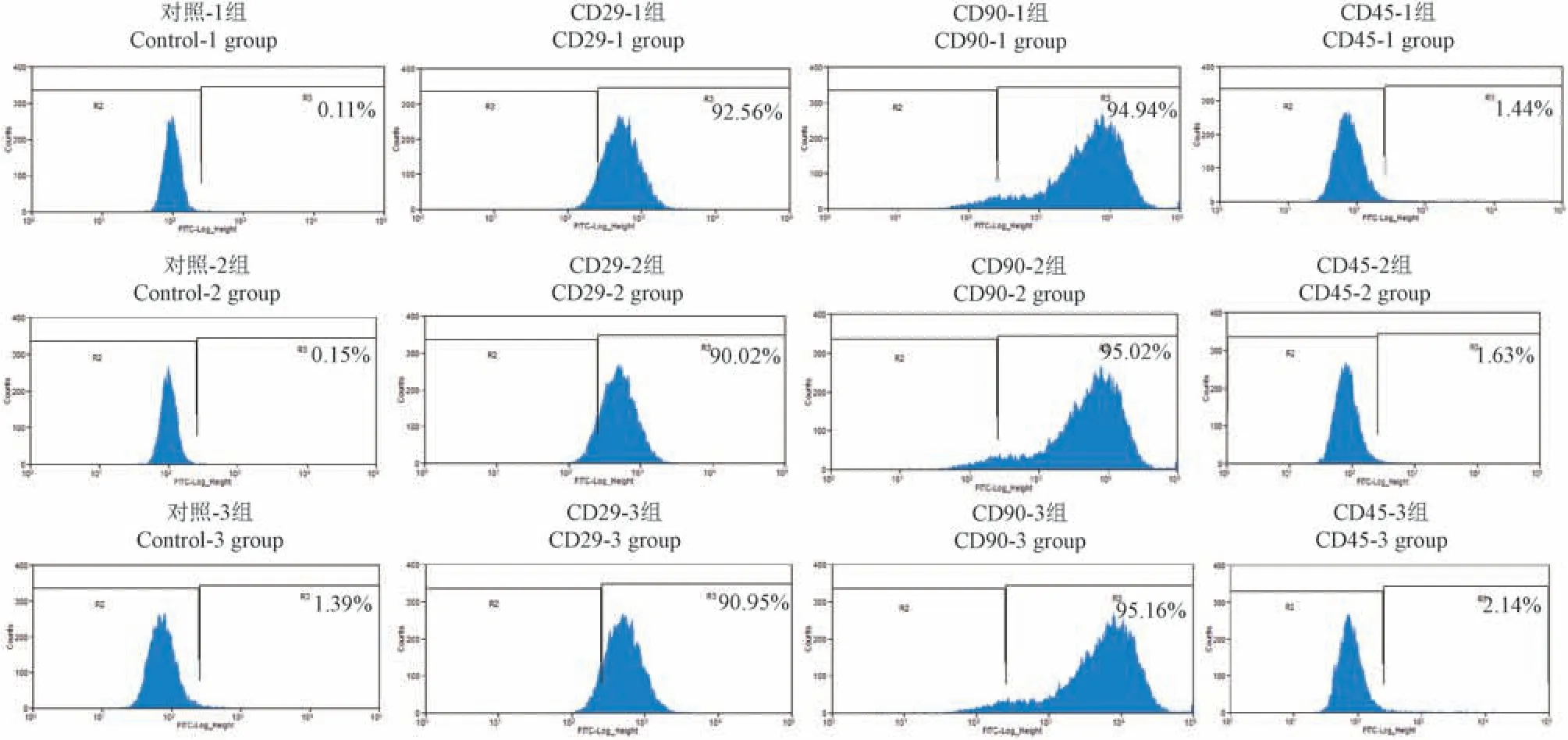
图2 流式细胞仪检测细胞表面抗原的表达Figure 2 Detection of cell surface antigen expression by flow cytometry
2.3 PKH26 标记结果
第3 代细胞经PKH26 染色24 h 后,在荧光显微镜下观察呈红色,荧光在细胞膜上分布均匀一致,标记率为98%,染色前后BMSCs 细胞形态没有变化(图3)。
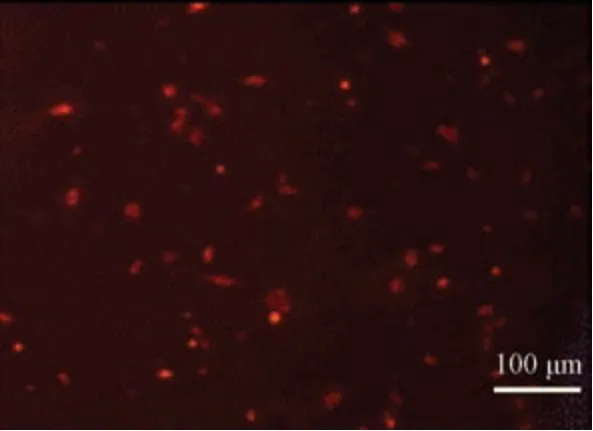
注:PKH26 标记BMSCS 24 h 后。图3 PKH26 标记结果Note.24th hour of PKH26 marking BMSCS.Figure 3 PKH26 Mark results
2.4 CCK-8 法测定细胞生长曲线
PKH26 标记组与未标记组大鼠BMSCs 第2 天缓慢生长,第3 天加快生长,到第7 天达到生长增殖高峰期,第8 天至第10 天生长进入平台期,大体生长曲线表现为倒“S”形。 两组细胞在460 nm 处的OD 值无显著差异(P>0.05),说明PKH26 标记BMSCs 对增殖无显著影响(图4)。
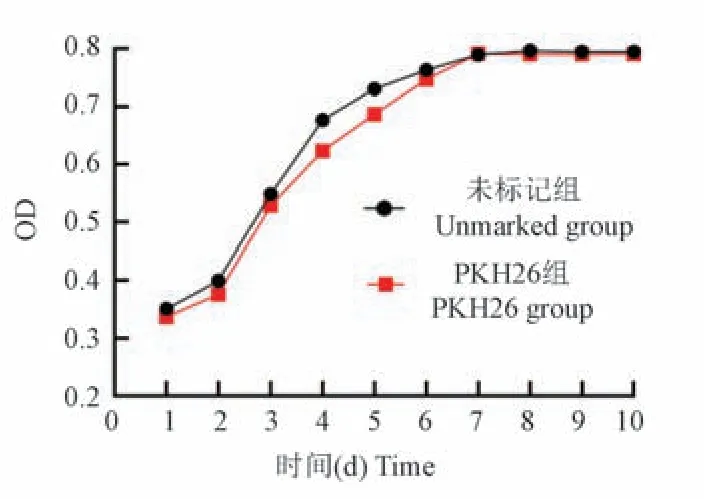
图4 PKH26 标记组与未标记组生长曲线的比较Figure 4 Comparison of growth curve between PKH26 labeled group and unlabeled group
2.5 成骨成脂诱导及染色结果
成骨诱导21 d 后观察到大量细胞呈絮状,结节状生长,茜素红染色呈红色结节,这种结节就是沉积下来的钙盐;成脂诱导14 d 后观察到大量细胞内含有空泡状透亮圈,具有强折光性,油红O 染色偏红,是脂滴的形成(图5)。
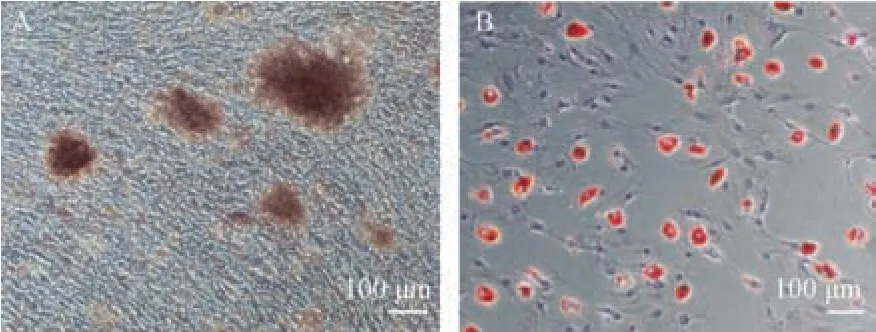
注:A:BMSCs 成骨诱导21 d 后茜素红染色;B:BMSCs 成脂诱导14 d 后油红O 染色。图5 BMSCs 成骨茜素红染色和成脂油红O 染色Note.A, Alizarin red staining 21 days after osteogenesis of BMSCs.B, Oil red O staining after 14 days of lipogenic induction of BMSCs.Figure 5 BMSCs Alizarin red staining and fatty oil red O staining
3 讨论
BMSCs 具有免疫调节、抗炎、抗纤维化等作用,在炎症环境下,关节腔内注射BMSCs 可能会增加骨异常增殖和异位钙化的风险[6]。 值得肯定的是,BMSCs 可以代替软骨细胞进行多次扩增,对最终形成的组织几乎没有影响,这使它们成为组织工程中移植细胞来源的主要细胞[7]。 传统的培养方法如胶原酶消法、贴壁法和差速离心法等可培养BMSCs[8-10],但短期内大量提取细胞具有一定困难,因此,寻找一种快速高效且稳定的分离纯化途径显得尤为重要。 本实验分离培养大鼠BMSCs 采用大鼠5 d 乳鼠骨髓骨片法,传代至第3 代,经流式细胞学鉴定高表达CD29、CD44、CD90,低表达CD45,并向成骨、成脂方向诱导,证明该方法可获得纯度较高的大鼠BMSCs。
近年来发现,BMSCs 已成为细胞移植、组织工程、基因治疗等领域的研究热点。 有实验结果证实BMSCs 移植作为治疗大鼠肺纤维化模型具有前景性的治疗策略,能明显缓解肺泡炎症及肺纤维化[11]。 同时,脑动脉栓塞大鼠模型进行BMSCs 移植的实验结果表明,BMSCs 可增加趋化因子和聚唾液酸化酶的表达,增加脑缺血条件下内源性神经元祖细胞的迁移,说明该机制可能有助于改善脑缺血[12]。 另外,间充质干细胞对关节炎的修复作用机制已逐渐变得成熟,有研究表明BMSCs 可促进软骨修复[13-14]。 以上这些治疗作用的关键在于移植过程中对细胞进行标记来观察其分化、存活及迁移。常用的标记细胞方法包括DAPI 标记、BrdU 标记、Dil 标记等,不过,这些荧光染料都有局限性,DAPI标记是一种标荧光染料,标记细胞核,当标记的细胞死亡后会释放出DAPI,不需要标记的细胞也会被标记出来,从而引起假阳性,且容易淬灭,不适合用于长期标记[15]。 BrdU 标记是通过免疫组化的方式进行间接观察,操作不方便,并且标记的细胞死亡后会释放出BrdU,与DAPI 类似,同样会造成较高假阳性率[16]。 Dil 标记细胞3 d 后会出现严重的细胞毒性反应,35 d 后能被检测到的标记细胞不足1/2,在体外细胞扩增过程中染色的稳定性低[17]。 因此,选择一种合适的染料,对大鼠BMSCs 进行标记、示踪尤为重要。
荧光染料PKH26 是一种新型染料,用于标记活细胞可以发出强烈稳定的红色荧光。 被标记的细胞与未被标记的细胞相比,形态良好,没有明显的区别,标记率为98%,这种方法能较好地检测出体外细胞诱导分化的情况,或将标记的细胞注射到动物体内,便于观察活体内移植细胞的迁移情况,从而达到示踪细胞的目的。 由于PKH26 染色方法简便、毒性小,不用放射性同位素,安全系数高。 因此,PKH26 是大鼠BMSCs 的理想标记方式,为大鼠BMSCs 在体内迁移分化实验的后续研究打下了坚实基础。
